
Los cuerpos en forma de hongo o corpora pedunculata son un par de estructuras en el cerebro de los artrópodos , incluidos insectos y crustáceos , [2] y algunos anélidos (notablemente el gusano Platynereis dumerilii ). [3] Se sabe que desempeñan un papel en el aprendizaje y la memoria olfativa . En la mayoría de los insectos, los cuerpos en forma de hongo y el cuerno lateral son las dos regiones cerebrales superiores que reciben información olfativa del lóbulo antenal a través de neuronas de proyección. [4] Fueron identificados y descritos por primera vez por el biólogo francés Félix Dujardin en 1850. [5] [6]
Los cuerpos de los hongos suelen describirse como neuropilos , es decir, como densas redes de procesos neuronales (terminales dendríticos y axónicos ) y glía . Reciben su nombre de su cáliz aproximadamente hemisférico , una protuberancia que está unida al resto del cerebro por un tracto nervioso central o pedúnculo .
La mayor parte de nuestro conocimiento actual sobre los cuerpos en forma de hongo proviene de estudios de unas pocas especies de insectos, especialmente la cucaracha Periplaneta americana , la abeja Apis mellifera , [7] la langosta y la mosca de la fruta Drosophila melanogaster . Los estudios sobre los cuerpos en forma de hongo de la mosca de la fruta han sido particularmente importantes para comprender la base genética del funcionamiento de los cuerpos en forma de hongo, ya que su genoma ha sido secuenciado y existe una gran cantidad de herramientas para manipular su expresión genética.
En el cerebro de los insectos , los pedúnculos de los cuerpos en forma de hongo se extienden a través del mesencéfalo . Están compuestos principalmente por las largas y densas fibras nerviosas de las células de Kenyon , las neuronas intrínsecas de los cuerpos en forma de hongo. Estas células se han encontrado en los cuerpos en forma de hongo de todas las especies que se han investigado, aunque su número varía. Las moscas de la fruta, por ejemplo, tienen alrededor de 2.500, mientras que las cucarachas tienen alrededor de 200.000.
Aquí se puede ver una disección del cerebro de una langosta para exponer el cerebro central y realizar registros electrofisiológicos. [8]
Históricamente, se creía que solo los insectos tenían cuerpos en forma de hongo, porque no estaban presentes en cangrejos y langostas. Sin embargo, su descubrimiento en el camarón mantis en 2017 condujo a la conclusión posterior [2] de que el cuerpo en forma de hongo es el estado ancestral de todos los artrópodos , y que esta característica se perdió más tarde en cangrejos y langostas. [2]
Los cuerpos de hongo son mejor conocidos por su papel en el aprendizaje asociativo olfativo . Estas señales olfativas se reciben de neuronas dopaminérgicas , octopaminérgicas , colinérgicas , serotoninérgicas y GABAérgicas fuera del MB. [9] Son más grandes en los himenópteros , que se sabe que tienen un control particularmente elaborado sobre los comportamientos olfativos. Sin embargo, dado que los cuerpos de hongo también se encuentran en insectos primitivos anósmicos , es probable que su papel se extienda más allá del procesamiento olfativo. Los estudios anatómicos sugieren un papel en el procesamiento de la entrada visual y mecanosensorial en algunas especies. [10] En los himenópteros en particular, las subregiones del neuropilo del cuerpo de hongo están especializadas para recibir entrada sensorial olfativa, visual o ambos tipos. [11] En los himenópteros, la entrada olfativa se encuentra en capas en el cáliz. En las hormigas se pueden discriminar varias capas, correspondientes a diferentes cúmulos de glomérulos en los lóbulos antenales , quizás para procesar diferentes clases de olores. [4] [12] Existen dos grupos principales de neuronas de proyección que dividen el lóbulo antenal en dos regiones principales, anterior y posterior. Los grupos de neuronas de proyección están segregados, inervando grupos glomerulares por separado y enviando axones por vías separadas, ya sea a través del tracto protocerebral medial-antenno (m-APT) o a través del tracto protocerebral lateral-antenno (l-APT), y conectando con dos capas en el cáliz de los cuerpos del hongo. En estas capas se representa topográficamente la organización de las dos regiones eferentes del lóbulo antenal, estableciendo un mapa odotópico burdo del lóbulo antenal en la región del labio de los cuerpos del hongo. [4] [12]
Se sabe que los cuerpos de los hongos están involucrados en el aprendizaje y la memoria , particularmente en el olfato , y por lo tanto son objeto de una intensa investigación actual. En insectos más grandes, los estudios sugieren que los cuerpos de los hongos tienen otras funciones de aprendizaje y memoria, como memoria asociativa , filtrado sensorial, control motor y memoria de lugares. La investigación implica que los cuerpos de los hongos generalmente actúan como una especie de detector de coincidencias , integrando entradas multimodales [4] y creando nuevas asociaciones, lo que sugiere su papel en el aprendizaje y la memoria. [13] Trabajos recientes también muestran evidencia de la participación del cuerpo de los hongos en comportamientos olfativos innatos a través de interacciones con el cuerno lateral, [14] [15] posiblemente haciendo uso de las respuestas sensoriales parcialmente estereotipadas de las neuronas de salida del cuerpo de los hongos (MBON) en todos los individuos. [16] Aunque las conexiones entre las neuronas de proyección y las células de Kenyon son aleatorias (es decir, no estereotipadas entre individuos), [17] la estereotipia en las respuestas MBON es posible gracias a la convergencia densa de muchas células de Kenyon en unas pocas MBON junto con otras propiedades de la red. [16]
La información sobre los olores puede estar codificada en el cuerpo del hongo por las identidades de las neuronas que responden, así como por el momento en que se activan sus picos. [18] Los experimentos en langostas han demostrado que las células de Kenyon tienen su actividad sincronizada con oscilaciones neuronales de 20 Hz y son particularmente sensibles a los picos de las neuronas de proyección en fases específicas del ciclo oscilatorio. [19]
Las neuronas que reciben señales de las neuronas serotoninérgicas y GABAérgicas fuera del MB producen vigilia, y la estimulación experimental de estas neuronas serotoninérgicas aguas arriba fuerza el sueño. Las neuronas diana en el MB son inhibidas por serotonina , GABA y la combinación de ambos. Por otro lado, la octopamina no parece afectar la función del sueño del MB. [9]

Sabemos que las estructuras del cuerpo del hongo son importantes para el aprendizaje olfativo y la memoria en Drosophila porque su ablación destruye esta función. [21] El cuerpo del hongo también puede combinar información del estado interno del cuerpo y la entrada olfativa para determinar el comportamiento innato. [22] Los roles exactos de las neuronas específicas que componen los cuerpos del hongo aún no están claros. Sin embargo, estas estructuras se estudian ampliamente porque se sabe mucho sobre su composición genética . Hay tres clases específicas de neuronas que componen los lóbulos del cuerpo del hongo: neuronas α/β, α'/β' y γ, que tienen todas una expresión genética distinta. Un tema de investigación actual es cuál de estas subestructuras en el cuerpo del hongo está involucrada en cada fase y proceso de aprendizaje y memoria. [23] Los cuerpos del hongo de Drosophila también se usan a menudo para estudiar el aprendizaje y la memoria y se manipulan debido a su naturaleza relativamente discreta. Por lo general, los ensayos de aprendizaje olfativo consisten en exponer a las moscas a dos olores por separado; Uno de ellos se combina con pulsos de descarga eléctrica (el estímulo condicionado o EC+) y el segundo no ( el estímulo incondicionado o EI). Después de este período de entrenamiento, las moscas se colocan en un laberinto en forma de T con los dos olores colocados individualmente en cada extremo de los brazos horizontales en forma de "T". Se calcula el porcentaje de moscas que evitan el EC+, y se considera que una evitación alta es evidencia de aprendizaje y memoria. [24]
Estudios recientes que combinan el condicionamiento del olor y la imagen celular han identificado seis rastros de memoria que coinciden con cambios moleculares en el sistema olfativo de Drosophila . Tres de estos rastros están asociados con la formación temprana de la memoria conductual. Uno de estos rastros fue visualizado en el lóbulo antenal (AL) por moléculas reporteras sinapto-pHluorina . Inmediatamente después del condicionamiento, un conjunto adicional de neuronas de proyección en un conjunto de ocho glomérulos en el AL se activa sinápticamente por el olor condicionado, y dura solo 7 minutos. [25] Un segundo rastro es detectable por la expresión de GCaMP , y por lo tanto un aumento en el influjo de Ca 2+ , en los axones α'/β' de las neuronas del cuerpo del hongo. [26] Este es un rastro más duradero, presente hasta una hora después del condicionamiento. El tercer rastro de memoria es la reducción de la actividad de la neurona lateral del par anterior, que actúa como un supresor de la formación de la memoria a través de uno de sus receptores GABAérgicos inhibidores . La disminución de la respuesta de calcio de las neuronas APL y la posterior disminución de la liberación de GABA en los cuerpos de los hongos persistieron hasta 5 minutos después del condicionamiento del olor. [27]
El rastro de memoria a medio plazo depende de la expresión del gen amn ubicado en las neuronas mediales pareadas dorsalmente. Un aumento en la entrada de calcio y la liberación sináptica que inerva los cuerpos en forma de hongo se vuelve detectable aproximadamente 30 minutos después del emparejamiento de la descarga eléctrica con un olor, y persiste durante al menos una hora. [28] Ambos rastros de memoria a largo plazo que se han mapeado dependen de la actividad y la síntesis proteica de CREB y CaMKII , y solo existen después del condicionamiento espaciado. El primer rastro se detecta en las neuronas α/β entre 9 y 24 horas después del condicionamiento, y se caracteriza por un aumento en la entrada de calcio en respuesta al olor condicionado. [29] El segundo rastro de memoria a largo plazo se forma en los cuerpos en forma de hongo γ y se detecta por el aumento de la entrada de calcio entre 18 y 24 horas después del condicionamiento [30]
El monofosfato de adenosina cíclico (AMPc o AMP cíclico) es un segundo mensajero que se ha visto implicado en la facilitación de la entrada de calcio del cuerpo en forma de hongo en las neuronas del cuerpo en forma de hongo de Drosophila melanogaster . La elevación del AMPc induce plasticidad presináptica en Drosophila. Los niveles de AMPc se ven afectados tanto por neurotransmisores , como la dopamina y la octopamina , como por los propios olores. La dopamina y la octopamina son liberadas por las interneuronas del cuerpo en forma de hongo , mientras que los olores activan directamente las neuronas en la vía olfativa, lo que provoca la entrada de calcio a través de los canales de calcio dependientes del voltaje . [31]
En un paradigma de condicionamiento clásico , la combinación de la despolarización neuronal (a través de la aplicación de acetilcolina para representar el olor o el EC ) con la posterior aplicación de dopamina (para representar el choque o el EI ), da como resultado un aumento sinérgico de AMPc en los lóbulos del cuerpo en forma de hongo. [31] Estos resultados sugieren que los lóbulos del cuerpo en forma de hongo son un sitio crítico de integración del EC/EI a través de la acción del AMPc. Este efecto sinérgico se observó originalmente en Aplysia , donde la combinación del influjo de calcio con la activación de la señalización de la proteína G por la serotonina genera un aumento sinérgico similar en AMPc. [32]
Además, este aumento sinérgico de AMPc está mediado y depende de la adenilato ciclasa del colinabo (RUT AC), que es sensible tanto al calcio (que resulta de la apertura del canal de calcio dependiente del voltaje por los olores) como a la estimulación de la proteína G (causada por la dopamina). [31] Mientras que un emparejamiento hacia adelante de despolarización neuronal y dopamina (acetilcolina seguida de dopamina) da como resultado un aumento sinérgico de AMPc, un emparejamiento hacia adelante de despolarización neuronal y octopamina produce un efecto subaditivo sobre el AMPc. [31] Más específicamente, esto significa que este emparejamiento produce significativamente menos AMPc que la suma de cada estímulo individualmente en los lóbulos. Por lo tanto, la rut AC en las neuronas del cuerpo del hongo funciona como un detector de coincidencia con la dopamina y la octopamina funcionando bidireccionalmente para afectar los niveles de AMPc. [31]
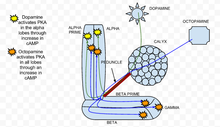
Se ha descubierto que la proteína quinasa A (PKA) desempeña un papel importante en el aprendizaje y la memoria en Drosophila . [33] Cuando el calcio entra en una célula y se une a la calmodulina , estimula la adenilato ciclasa (AC), que está codificada por el gen rutabaga ( rut ). [34] Esta activación de la AC aumenta la concentración de AMPc , que activa la PKA. [34] Cuando se aplica dopamina , un estimulante olfativo aversivo, activa la PKA específicamente en los lóbulos verticales del cuerpo del hongo. [34] Esta especificidad espacial está regulada por la PDE dunce ( dnc ), una fosfodiesterasa específica de AMPc . Si se elimina el gen dunce, como se encuentra en el mutante dnc , la especificidad espacial no se mantiene. Por el contrario, una estimulación apetitiva creada por una aplicación de octopamina aumenta la PKA en todos los lóbulos. [34] En el mutante rut , un genotipo en el que se elimina el colinabo, las respuestas tanto a la dopamina como a la octopamina se redujeron considerablemente y estuvieron cerca del ruido experimental.
La acetilcolina , que representa el estímulo condicionado , conduce a un fuerte aumento en la activación de PKA en comparación con la estimulación con dopamina u octopamina solas. [34] Esta reacción se elimina en mutantes rut , lo que demuestra que PKA es esencial para la integración sensorial. [34] La especificidad de la activación del lóbulo alfa en presencia de dopamina se mantiene cuando la dopamina está en combinación con acetilcolina. [34] Esencialmente, durante un paradigma de condicionamiento cuando un estímulo condicionado se empareja con un estímulo no condicionado, PKA exhibe una activación aumentada. Esto demuestra que PKA es necesaria para el aprendizaje condicionado en Drosophila melanogaster .
Las respuestas de estímulo → salida son el producto de pares de excitación e inhibición . Este es el mismo patrón de organización que en el cerebro de los mamíferos . Estos patrones pueden, como en el caso de los mamíferos, preceder a la acción. A partir de 2021, [actualizar]esta es un área que recién fue dilucidada por Zwaka et al 2018, Duer et al 2015 y Paffhausen et al 2020. [7]