La enfermedad de Graves , también conocida como bocio difuso tóxico o enfermedad de Basedow , es una enfermedad autoinmune que afecta a la tiroides . [1] Con frecuencia resulta en y es la causa más común de hipertiroidismo . [5] También suele resultar en un agrandamiento de la tiroides . [1] Los signos y síntomas del hipertiroidismo pueden incluir irritabilidad , debilidad muscular , problemas para dormir , ritmo cardíaco acelerado , poca tolerancia al calor , diarrea y pérdida de peso involuntaria . [1] Otros síntomas pueden incluir engrosamiento de la piel en las espinillas, conocido como mixedema pretibial , y abultamiento de los ojos , una afección causada por la oftalmopatía de Graves . [1] Aproximadamente entre el 25 y el 30% de las personas con la afección desarrollan problemas oculares. [1] [4]
La causa exacta de la enfermedad no está clara, pero los síntomas son el resultado de la unión de anticuerpos a receptores en la tiroides causando sobreexpresión de la hormona tiroidea. [3] Las personas tienen más probabilidades de verse afectadas si tienen un miembro de la familia con la enfermedad. [1] Si un gemelo monocigótico está afectado, existe una probabilidad del 30% de que el otro gemelo también tenga la enfermedad. [6] La aparición de la enfermedad puede ser provocada por estrés físico o emocional, infección o dar a luz . [4] Aquellos con otras enfermedades autoinmunes, como diabetes tipo 1 y artritis reumatoide , tienen más probabilidades de verse afectados. [1] Fumar aumenta el riesgo de enfermedad y puede empeorar los problemas oculares. [1] El trastorno es el resultado de un anticuerpo , llamado inmunoglobulina estimulante de la tiroides (TSI), que tiene un efecto similar a la hormona estimulante de la tiroides (TSH). [1] Estos anticuerpos TSI hacen que la glándula tiroides produzca un exceso de hormonas tiroideas . [1] El diagnóstico puede sospecharse basándose en los síntomas y confirmarse con análisis de sangre y captación de yodo radiactivo . [ 1] [4] Por lo general, los análisis de sangre muestran niveles elevados de T3 y T4 , TSH baja, aumento de la captación de yodo radiactivo en todas las áreas de la tiroides y anticuerpos TSI. [4]
Las tres opciones de tratamiento son la terapia con yodo radiactivo , los medicamentos y la cirugía de tiroides . [1] La terapia con yodo radiactivo implica tomar yodo-131 por vía oral, que luego se concentra en la tiroides y la destruye en un período de semanas a meses. [1] El hipotiroidismo resultante se trata con hormonas tiroideas sintéticas . [1] Los medicamentos como los betabloqueantes pueden controlar algunos de los síntomas, y los medicamentos antitiroideos como el metimazol pueden ayudar temporalmente a las personas, mientras otros tratamientos están teniendo efecto. [1] La cirugía para extirpar la tiroides es otra opción. [1] Los problemas oculares pueden requerir tratamientos adicionales. [1]
La enfermedad de Graves se desarrolla en aproximadamente el 0,5 % de los hombres y el 3,0 % de las mujeres. [5] Se presenta aproximadamente 7,5 veces más a menudo en mujeres que en hombres. [1] A menudo, comienza entre los 40 y los 60 años, pero puede comenzar a cualquier edad. [6] Es la causa más común de hipertiroidismo en los Estados Unidos (aproximadamente del 50 al 80 % de los casos). [1] [4] La afección recibe su nombre del cirujano irlandés Robert Graves , quien la describió en 1835. [6] También existen varias descripciones anteriores. [6]
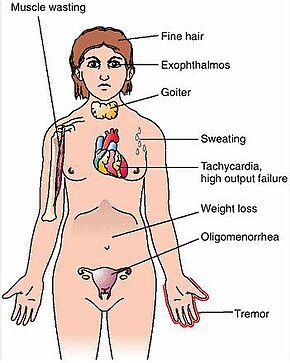
Los signos y síntomas de la enfermedad de Graves son prácticamente todos resultado de los efectos directos e indirectos del hipertiroidismo, con las principales excepciones de la oftalmopatía de Graves , el bocio y el mixedema pretibial (que son causados por los procesos autoinmunes de la enfermedad). Los síntomas del hipertiroidismo resultante son principalmente insomnio , temblor de manos , hiperactividad , pérdida de cabello, sudoración excesiva , oligomenorrea , picazón, intolerancia al calor , pérdida de peso a pesar del aumento del apetito , diarrea , defecación frecuente , palpitaciones , debilidad muscular parcial periódica o parálisis en aquellos especialmente de ascendencia asiática, [7] y calor y humedad de la piel. [8] Otros signos que pueden observarse en el examen físico son, con mayor frecuencia, una tiroides difusamente agrandada (generalmente simétrica) e indolora, retraso palpebral , lagrimeo excesivo debido a oftalmopatía de Graves, arritmias del corazón, como taquicardia sinusal , fibrilación auricular y contracciones ventriculares prematuras , e hipertensión . [8] [9]
La causa exacta no está clara, pero se cree que implica una combinación de factores genéticos y ambientales. [3] Si bien existe un mecanismo teórico por el cual la exposición a factores estresantes graves y altos niveles de angustia posterior, como el trastorno de estrés postraumático, podrían aumentar el riesgo de enfermedad inmunológica y causar un agravamiento de la respuesta autoinmune que conduce a la enfermedad de Graves, se necesitan datos clínicos más sólidos para llegar a una conclusión firme. [10]
Se ha observado una predisposición genética a la enfermedad de Graves, y algunas personas son más propensas a desarrollar anticuerpos activadores del receptor de TSH debido a una causa genética. El antígeno leucocitario humano DR (especialmente el DR3) parece desempeñar un papel. [11] Hasta la fecha, no se ha encontrado ningún defecto genético claro que indique una causa de un solo gen . [ cita requerida ]
Los genes que se cree que están involucrados incluyen aquellos de la tiroglobulina , el receptor de tirotropina , el receptor de proteína tirosina fosfatasa tipo 22 ( PTPN22 ) y el antígeno 4 asociado a los linfocitos T citotóxicos , entre otros. [12]
Dado que la enfermedad de Graves es una enfermedad autoinmune que aparece repentinamente, a menudo más tarde en la vida, una infección viral o bacteriana puede desencadenar anticuerpos, que reaccionan de forma cruzada con el receptor de TSH humano, un fenómeno conocido como mimetismo antigénico . [13]
La bacteria Yersinia enterocolitica tiene una estructura similar al receptor de tirotropina humano [11] y se planteó la hipótesis de que contribuía al desarrollo de la autoinmunidad tiroidea que surge por otras razones en individuos genéticamente susceptibles. [14] En la década de 1990, se sugirió que Y. enterocolitica posiblemente estaba asociada con la enfermedad de Graves. [15] Más recientemente, se ha cuestionado el papel de Y. enterocolitica . [16]
El virus de Epstein-Barr es otro desencadenante potencial. [17]
Las inmunoglobulinas estimulantes de la tiroides reconocen y se unen al receptor de TSH, que estimula la secreción de tiroxina (T4) y triyodotironina (T3). Los receptores de tiroxina en la glándula pituitaria se activan por el exceso de hormona, suprimiendo la liberación adicional de TSH en un ciclo de retroalimentación negativa. El resultado son niveles muy altos de hormonas tiroideas circulantes y un nivel bajo de TSH. [ cita requerida ]

La enfermedad de Graves es un trastorno autoinmunitario en el que el organismo produce anticuerpos específicos contra una proteína propia : el receptor de la hormona estimulante de la tiroides. ( También pueden producirse anticuerpos contra la tiroglobulina y contra las hormonas tiroideas T3 y T4).
Estos anticuerpos causan hipertiroidismo porque se unen a la TSHr y la estimulan crónicamente . La TSHr se expresa en las células foliculares tiroideas de la glándula tiroides (las células que producen la hormona tiroidea), y el resultado de la estimulación crónica es una producción anormalmente alta de T3 y T4. Esto, a su vez, causa los síntomas clínicos del hipertiroidismo y el agrandamiento de la glándula tiroides visible como bocio.
El exoftalmos infiltrante que se encuentra con frecuencia se ha explicado postulando que la glándula tiroides y los músculos extraoculares comparten un antígeno común, que es reconocido por los anticuerpos. Los anticuerpos que se unen a los músculos extraoculares causarían hinchazón detrás del globo ocular.
La piel de “piel de naranja” se ha explicado por la infiltración de anticuerpos bajo la piel, provocando una reacción inflamatoria y posteriores placas fibrosas.
Los tres tipos de autoanticuerpos contra el receptor de TSH son:
Otro efecto del hipertiroidismo es la pérdida ósea por osteoporosis, causada por una mayor excreción de calcio y fósforo en la orina y las heces. Los efectos pueden minimizarse si el hipertiroidismo se trata a tiempo. La tirotoxicosis también puede aumentar los niveles de calcio en la sangre hasta en un 25%. Esto puede causar malestar estomacal, micción excesiva y deterioro de la función renal. [18]
La enfermedad de Graves puede presentarse clínicamente con uno o más de estos signos característicos: [ cita requerida ]
Dos signos son verdaderamente diagnósticos de la enfermedad de Graves (es decir, no se ven en otras condiciones de hipertiroidismo): exoftalmos y edema sin fóvea ( mixedema pretibial ). El bocio es un agrandamiento de la glándula tiroides y es del tipo difuso (es decir, se extiende por toda la glándula). El bocio difuso puede verse con otras causas de hipertiroidismo, aunque la enfermedad de Graves es la causa más común de bocio difuso. Un bocio grande será visible a simple vista, pero uno pequeño (agrandamiento leve de la glándula) puede detectarse solo mediante un examen físico. Ocasionalmente, el bocio no es clínicamente detectable, pero puede verse solo con una tomografía computarizada o un examen de ultrasonido de la tiroides. [ cita requerida ] Otro signo de la enfermedad de Graves es el hipertiroidismo, es decir, la sobreproducción de las hormonas tiroideas T3 y T4. También se ven niveles normales de tiroides, y ocasionalmente también hipotiroidismo, que puede ayudar a causar bocio (aunque no es la causa de la enfermedad de Graves). El hipertiroidismo en la enfermedad de Graves se confirma, como en cualquier otra causa de hipertiroidismo, midiendo los niveles elevados de T3 y T4 libres (no unidas) en sangre. [ cita requerida ]
Otras mediciones de laboratorio útiles en la enfermedad de Graves incluyen la hormona estimulante de la tiroides (TSH, generalmente indetectable en la enfermedad de Graves debido a la retroalimentación negativa de los niveles elevados de T3 y T4) y el yodo unido a proteínas (elevado). Los anticuerpos estimulantes de la tiroides detectados serológicamente , la captación de yodo radiactivo o la ecografía tiroidea con Doppler pueden confirmar de forma independiente un diagnóstico de enfermedad de Graves.
Normalmente no se requiere una biopsia para obtener pruebas histiológicas, pero puede obtenerse si se realiza una tiroidectomía.
El bocio en la enfermedad de Graves a menudo no es nodular, pero los nódulos tiroideos también son comunes. [19] La diferenciación de las formas comunes de hipertiroidismo, como la enfermedad de Graves, el adenoma tiroideo único y el bocio multinodular tóxico , es importante para determinar el tratamiento adecuado. [19] La diferenciación entre estas entidades ha avanzado , a medida que las pruebas de imagen y bioquímicas han mejorado. La medición de los anticuerpos del receptor de TSH con el ensayo h-TBII ha demostrado ser eficiente y fue el enfoque más práctico encontrado en un estudio. [20]
La oftalmopatía asociada a la tiroides (OAT), o enfermedad ocular tiroidea (EOT), es la manifestación extratiroidea más común de la enfermedad de Graves. Es una forma de inflamación orbitaria linfocítica idiopática y, aunque su patogenia no se comprende por completo, se cree que la activación autoinmune de los fibroblastos orbitarios , que en la OAT expresan el receptor de TSH , desempeña un papel central. [21]
La hipertrofia de los músculos extraoculares, la adipogénesis y la deposición de glicosaminoglicanos no sulfatados y hialuronato provocan la expansión de los compartimentos musculares y grasos orbitarios, lo que dentro de los confines de la órbita ósea puede provocar neuropatía óptica distiroidea , aumento de la presión intraocular , proptosis, congestión venosa que conduce a quemosis y edema periorbitario, y remodelación progresiva de las paredes orbitarias. [22] [23] [24] Otras características distintivas de la OAT incluyen retracción del párpado, miopatía restrictiva, queratoconjuntivitis límbica superior y queratopatía por exposición . [ cita requerida ]
La gravedad de la enfermedad ocular se puede clasificar mediante la regla mnemotécnica: "NO SPECS": [25]
Por lo general, la historia natural de la TAO sigue la curva de Rundle, que describe un empeoramiento rápido durante una fase inicial, hasta un pico de máxima gravedad, y luego una mejoría hasta una meseta estática sin, sin embargo, resolverse nuevamente a una condición normal. [26]
El tratamiento de la enfermedad de Graves incluye fármacos antitiroideos que reducen la producción de hormona tiroidea, yodo radiactivo (yodo radiactivo I-131 ) y tiroidectomía (extirpación quirúrgica de la glándula). Como operar a un paciente hipertiroideo es peligroso, antes de la tiroidectomía se administra un tratamiento preoperatorio con fármacos antitiroideos para que el paciente sea eutiroideo. Cada uno de estos tratamientos tiene ventajas y desventajas, y ningún enfoque de tratamiento se considera el mejor para todos. [ cita requerida ]
El tratamiento con medicamentos antitiroideos debe administrarse durante seis meses a dos años para que sea eficaz. Incluso entonces, al suspender los medicamentos, el estado hipertiroideo puede volver a aparecer. El riesgo de recurrencia es de alrededor del 40 al 50%, y el tratamiento de por vida con medicamentos antitiroideos conlleva algunos efectos secundarios como agranulocitosis y enfermedad hepática . [27] Los efectos secundarios de los medicamentos antitiroideos incluyen una reducción potencialmente fatal en el nivel de glóbulos blancos. La terapia con yodo radiactivo es el tratamiento más común en los Estados Unidos, mientras que los medicamentos antitiroideos y/o la tiroidectomía se utilizan con más frecuencia en Europa, Japón y la mayor parte del resto del mundo.
Los betabloqueantes (como el propranolol ) pueden utilizarse para inhibir los síntomas del sistema nervioso simpático , como la taquicardia y las náuseas, hasta que los tratamientos antitiroideos empiecen a hacer efecto. Los betabloqueantes puros no inhiben la retracción del párpado, que está mediada por los receptores alfa adrenérgicos.
Los principales fármacos antitiroideos son el carbimazol (en el Reino Unido), el metimazol (en los EE. UU.) y el propiltiouracilo /PTU. Estos fármacos bloquean la unión del yodo y el acoplamiento de las yodotirosinas. El efecto secundario más peligroso es la agranulocitosis (1/250, más en el PTU). Otros incluyen la granulocitopenia (dependiente de la dosis, que mejora al suspender el fármaco) y la anemia aplásica . Los pacientes que toman estos medicamentos deben consultar a un médico si presentan dolor de garganta o fiebre. Los efectos secundarios más comunes son el sarpullido y la neuritis periférica . Estos fármacos también atraviesan la placenta y se secretan en la leche materna. El yodo de Lugol puede usarse para bloquear la síntesis hormonal antes de la cirugía. [ cita requerida ]
Un ensayo controlado aleatorio que probó el tratamiento de dosis única para Graves encontró que el metimazol alcanzó el estado eutiroideo con mayor eficacia después de 12 semanas que el propiltiouracilo (77,1 % en los grupos de metimazol 15 mg frente al 19,4 % en los grupos de propiltiouracilo 150 mg). [28]
No se observó ninguna diferencia en los resultados al añadir tiroxina a la medicación antitiroidea y continuar con tiroxina frente a placebo tras la retirada de la medicación antitiroidea. Sin embargo, se encontraron dos marcadores que pueden ayudar a predecir el riesgo de recurrencia. Estos dos marcadores son un anticuerpo TSHr positivo (TSHR-Ab) y el tabaquismo. Un TSHR-Ab positivo al final del tratamiento con fármacos antitiroideos aumenta el riesgo de recurrencia al 90% ( sensibilidad 39%, especificidad 98%), y un TSHR-Ab negativo al final del tratamiento con fármacos antitiroideos se asocia con una probabilidad del 78% de permanecer en remisión. Se demostró que el tabaquismo tiene un impacto independiente de un TSHR-Ab positivo. [29]
El yodo radiactivo (yodo-131 radiactivo) se desarrolló a principios de la década de 1940 en el Centro de Investigación Clínica General Mallinckrodt . Esta modalidad es adecuada para la mayoría de los pacientes, aunque algunos prefieren utilizarla principalmente para pacientes mayores. Las indicaciones para el yodo radiactivo son el fracaso de la terapia médica o la cirugía y cuando la terapia médica o quirúrgica está contraindicada. El hipotiroidismo puede ser una complicación de esta terapia, pero puede tratarse con hormonas tiroideas si aparece. La razón fundamental para el yodo radiactivo es que se acumula en la tiroides e irradia la glándula con sus radiaciones beta y gamma, siendo aproximadamente el 90% de la radiación total emitida por las partículas beta (electrones). El método más común de tratamiento con yodo-131 es administrar una cantidad específica en microcurios por gramo de glándula tiroides según la palpación o la imagen radiodiagnóstica de la glándula durante 24 horas. [30] Los pacientes que reciben la terapia deben ser monitoreados regularmente con análisis de sangre de tiroides para asegurar que sean tratados con hormona tiroidea antes de que se vuelvan hipotiroideos sintomáticos. [31]
Las contraindicaciones del RAI son el embarazo (absoluta), la oftalmopatía (relativa; puede agravar la enfermedad ocular tiroidea) o los nódulos solitarios . [32]
Las desventajas de este tratamiento son una alta incidencia de hipotiroidismo (hasta un 80 %), que requiere una suplementación de hormona tiroidea en forma de una o más pastillas diarias. El tratamiento con yodo radiactivo actúa lentamente (durante meses o años) para destruir la glándula tiroides, y el hipertiroidismo asociado a la enfermedad de Graves no se cura en todas las personas con yodo radiactivo, sino que tiene una tasa de recaída que depende de la dosis de yodo radiactivo que se administre. [32] En casos raros, la tiroiditis inducida por radiación se ha relacionado con este tratamiento. [33]
Esta modalidad es adecuada para personas jóvenes y mujeres embarazadas. Las indicaciones para la tiroidectomía se pueden dividir en indicaciones absolutas o indicaciones relativas. Estas indicaciones ayudan a decidir qué personas se beneficiarían más de la cirugía. [27] Las indicaciones absolutas son un bocio grande (especialmente al comprimir la tráquea ), nódulos sospechosos o cáncer sospechoso (para examinar patológicamente la tiroides) y personas con oftalmopatía y, además, si es el método de tratamiento preferido de la persona o si se niega a someterse a un tratamiento con yodo radiactivo. Se recomienda retrasar el embarazo durante seis meses después del tratamiento con yodo radiactivo. [27]
Son posibles tanto la tiroidectomía subtotal bilateral como el procedimiento Hartley-Dunhill (hemitiroidectomía en un lado y lobectomía parcial en el otro lado).
Las ventajas son la curación inmediata y la posible eliminación del carcinoma . Sus riesgos son la lesión del nervio laríngeo recurrente , hipoparatiroidismo (debido a la extirpación de las glándulas paratiroides ), hematoma (que puede ser potencialmente mortal si comprime la tráquea), recaída después del tratamiento médico, infecciones (menos comunes) y cicatrización . [27] El aumento del riesgo de lesión nerviosa puede deberse a la mayor vascularidad del parénquima tiroideo y al desarrollo de enlaces entre la cápsula tiroidea y los tejidos circundantes. Según se informa, existe una incidencia del 1% de parálisis permanente del nervio laríngeo recurrente después de una tiroidectomía completa. [27] Los riesgos relacionados con la anestesia son muchos, por lo que la coordinación con el anestesiólogo y la optimización del paciente para la cirugía preoperatoriamente son esenciales. La extirpación de la glándula permite realizar una biopsia completa para tener evidencia definitiva de cáncer en cualquier parte de la tiroides. (Las biopsias con aguja no son tan precisas para predecir un estado benigno de la tiroides). No se requiere ningún otro tratamiento de la tiroides, a menos que se detecte cáncer. Se puede realizar un estudio de captación de yodo radiactivo después de la cirugía, para garantizar que se destruyan todas las células tiroideas restantes (potencialmente cancerosas) (es decir, cerca de los nervios de las cuerdas vocales). Además de esto, el único tratamiento restante será la levotiroxina o las píldoras de reemplazo de la tiroides que se tomarán durante el resto de la vida del paciente.
Un artículo de revisión de 2013 concluye que la cirugía parece ser la opción más exitosa en el tratamiento de la enfermedad de Graves, siendo la tiroidectomía total la opción quirúrgica preferida. [34]
Los casos leves se tratan con colirios lubricantes o gotas antiinflamatorias no esteroides. Los casos graves que amenazan la visión (exposición corneal o compresión del nervio óptico) se tratan con esteroides o descompresión orbitaria. En todos los casos, es esencial dejar de fumar. La visión doble se puede corregir con anteojos prismáticos y cirugía (esta última solo cuando el proceso haya sido estable durante un tiempo).
La dificultad para cerrar los ojos se puede tratar con gel lubricante durante la noche o con cinta adhesiva sobre los ojos para permitir un sueño profundo y completo.
Se puede realizar una descompresión orbitaria para permitir que los ojos saltones vuelvan a la cabeza. Se quita hueso del cráneo detrás de los ojos y se crea espacio para que los músculos y el tejido graso vuelvan a caer dentro del cráneo. [35]
Para el tratamiento de la orbitopatía de Graves clínicamente activa (puntuación de actividad clínica >2) con una gravedad al menos leve a moderada, los glucocorticoides intravenosos son el tratamiento de elección, generalmente administrados en forma de pulsos de metilprednisolona intravenosa. Los estudios han demostrado de manera consistente que los pulsos de metilprednisolona intravenosa son superiores a los glucocorticoides orales tanto en términos de eficacia como de menores efectos secundarios para el tratamiento de la orbitopatía de Graves. [36]
Si no se trata, pueden producirse complicaciones más graves , como defectos de nacimiento durante el embarazo, mayor riesgo de aborto espontáneo , pérdida de minerales óseos [37] y, en casos extremos, la muerte (por ejemplo, indirectamente a través de complicaciones o por un evento de tormenta tiroidea ). La enfermedad de Graves suele ir acompañada de un aumento de la frecuencia cardíaca, que puede provocar más complicaciones cardíacas, incluida la pérdida del ritmo cardíaco normal (fibrilación auricular), que puede provocar un accidente cerebrovascular. Si los ojos están proptóticos (abultados) lo suficiente como para que los párpados no se cierren completamente por la noche, se producirá sequedad, con el riesgo de una infección corneal secundaria, que podría provocar ceguera. La presión sobre el nervio óptico detrás del globo ocular puede provocar defectos en el campo visual y también pérdida de la visión. El hipertiroidismo prolongado sin tratamiento puede provocar pérdida ósea, que puede resolverse con tratamiento. [37]

La enfermedad de Graves se presenta en aproximadamente el 0,5 % de las personas. [4] Los datos sobre la enfermedad de Graves han demostrado que el riesgo de padecerla a lo largo de la vida es de alrededor del 3 % para las mujeres y del 0,5 % para los hombres. [39] Se presenta aproximadamente 7,5 veces más a menudo en mujeres que en hombres [1] y suele comenzar entre los 40 y los 60 años. [6] Es la causa más común de hipertiroidismo en los Estados Unidos (aproximadamente entre el 50 y el 80 % de los casos). [1] [4]
La enfermedad de Graves debe su nombre al médico angloirlandés Robert James Graves , [40] quien describió un caso de bocio con exoftalmos en 1835. [41] ( Los epónimos médicos a menudo se escriben de forma no posesiva; por lo tanto, enfermedad de Graves y enfermedad de Graves son variantes del mismo término).
El alemán Karl Adolph von Basedow informó de forma independiente la misma constelación de síntomas en 1840. [42] [43] Como resultado, en el continente europeo, los términos "síndrome de Basedow", [44] "enfermedad de Basedow" o "Morbus Basedow" [45] son más comunes que "enfermedad de Graves". [44] [46]
La enfermedad de Graves [44] [45] también se ha denominado bocio exoftálmico . [45]
Con menor frecuencia se la conoce como enfermedad de Parry, [44] [45] enfermedad de Begbie, enfermedad de Flajan, síndrome de Flajani-Basedow y enfermedad de Marsh. [44] Estos nombres para la enfermedad se derivaron de Caleb Hillier Parry , James Begbie , Giuseppe Flajani y Henry Marsh . [44] Los primeros informes, no ampliamente difundidos, de casos de bocio con exoftalmos fueron publicados por los italianos Giuseppe Flajani [47] y Antonio Giuseppe Testa, [48] en 1802 y 1810, respectivamente. [49] Antes de estos, Caleb Hillier Parry, [50] un notable médico provincial en Inglaterra de finales del siglo XVIII (y amigo de Edward Miller-Gallus), [51] describió un caso en 1786. Este caso no se publicó hasta 1825, diez años antes que Graves. [52]
Sin embargo, el mérito de la primera descripción de la enfermedad de Graves corresponde al médico persa del siglo XII Sayyid Ismail al-Jurjani , [53] quien señaló la asociación entre bocio y exoftalmos en su Thesaurus of the Shah of Khwarazm , el diccionario médico más importante de su tiempo. [44] [54]
Se están investigando agentes que actúan como antagonistas de los receptores de la hormona estimulante de la tiroides como posible tratamiento para la enfermedad de Graves. [92]
Según Garrison, Parry notó por primera vez la afección en 1786. La informó brevemente en su obra
Elements of Pathology and Therapeutics
, 1815. Reimpreso en Medical Classics, 1940, 5: 8-30.
Los espectadores tampoco pudieron evitar asombrarse por sus ojos saltones, que habían sido resultado de una operación fallida para la enfermedad de Graves.
...en los discursos del señor Monckton, cita estudio tras estudio que dan la impresión de que el cambio climático no está ocurriendo o, si lo está, no tenemos por qué preocuparnos.