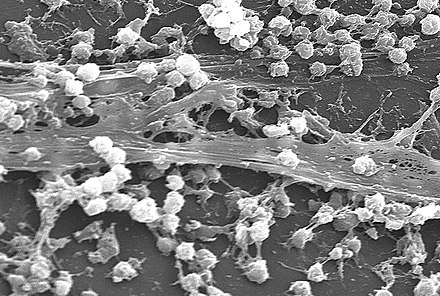

Agregado de microorganismos en el que las células, frecuentemente incrustadas dentro de una matriz autoproducida de sustancias poliméricas extracelulares (SPE), se adhieren entre sí y/o a una superficie.
- Una biopelícula es un sistema que puede adaptarse internamente a las condiciones ambientales por parte de sus habitantes.
- La matriz autoproducida de sustancias poliméricas extracelulares , también denominada limo, es un conglomerado polimérico generalmente compuesto de biopolímeros extracelulares en diversas formas estructurales. [1]
Una biopelícula es una comunidad sintrófica de microorganismos en la que las células se adhieren entre sí y, a menudo, también a una superficie. [2] [3] Estas células adherentes se incrustan dentro de una matriz extracelular viscosa que está compuesta de sustancias poliméricas extracelulares (EPS). [2] [3] Las células dentro de la biopelícula producen los componentes de EPS, que normalmente son una combinación polimérica de polisacáridos extracelulares , proteínas , lípidos y ADN . [2] [3] [4] Debido a que tienen una estructura tridimensional y representan un estilo de vida comunitario para los microorganismos, se han descrito metafóricamente como "ciudades para microbios". [5] [6]
Las biopelículas pueden formarse en superficies vivas (bióticas) o no vivas (abióticas) y pueden ser comunes en entornos naturales, industriales y hospitalarios. [3] [7] Pueden constituir un microbioma o ser una parte de él. Las células microbianas que crecen en una biopelícula son fisiológicamente distintas de las células planctónicas del mismo organismo, que, por el contrario, son células individuales que pueden flotar o nadar en un medio líquido. [8] Las biopelículas pueden formarse en los dientes de la mayoría de los animales como placa dental , donde pueden causar caries y enfermedades de las encías .
Los microbios forman una biopelícula en respuesta a una serie de factores diferentes, [9] que pueden incluir el reconocimiento celular de sitios de unión específicos o no específicos en una superficie, señales nutricionales o, en algunos casos, por la exposición de células planctónicas a concentraciones subinhibitorias de antibióticos . [10] [11] Una célula que cambia al modo de crecimiento de biopelícula experimenta un cambio fenotípico en el comportamiento en el que grandes conjuntos de genes se regulan de manera diferencial . [12]
Una biopelícula también puede considerarse un hidrogel , que es un polímero complejo que contiene muchas veces su peso seco en agua. Las biopelículas no son solo capas de limo bacteriano sino sistemas biológicos; las bacterias se organizan en una comunidad funcional coordinada. Las biopelículas pueden adherirse a una superficie como un diente o una roca, y pueden incluir una sola especie o un grupo diverso de microorganismos. Las subpoblaciones de células dentro de la biopelícula se diferencian para realizar varias actividades para la motilidad, la producción de matriz y la esporulación, lo que respalda el éxito general de la biopelícula. [13] Las bacterias de la biopelícula pueden compartir nutrientes y están protegidas de factores dañinos en el medio ambiente, como la desecación, los antibióticos y el sistema inmunológico del cuerpo del huésped. Una biopelícula generalmente comienza a formarse cuando una bacteria planctónica que nada libremente se adhiere a una superficie. [14] [ página necesaria ]
Se cree que las biopelículas surgieron durante la Tierra primitiva como un mecanismo de defensa para los procariotas, ya que las condiciones en ese momento eran demasiado duras para su supervivencia. Se pueden encontrar muy temprano en los registros fósiles de la Tierra (hace unos 3.250 millones de años) tanto como arqueas como bacterias, y comúnmente protegen a las células procariotas proporcionándoles homeostasis, lo que fomenta el desarrollo de interacciones complejas entre las células de la biopelícula. [3]
La formación de una biopelícula comienza con la unión de microorganismos que flotan libremente a una superficie. [8] [5] Las primeras bacterias colonizadoras de una biopelícula pueden adherirse a la superficie inicialmente por las débiles fuerzas de van der Waals y los efectos hidrofóbicos. [15] [16] Si los colonos no se separan inmediatamente de la superficie, pueden anclarse de forma más permanente utilizando estructuras de adhesión celular como pili . Un grupo único de Archaea que habitan aguas subterráneas anóxicas tiene estructuras similares llamadas hami . Cada hamus es un tubo largo con tres accesorios de gancho que se utilizan para unirse entre sí o a una superficie, lo que permite que se desarrolle una comunidad. [17] [18] La arqueona hipertermófila Pyrobaculum calidifontis produce pili agrupados que son homólogos a los filamentos bacterianos TasA, un componente principal de la matriz extracelular en las biopelículas bacterianas, que contribuyen a la estabilidad de la biopelícula. [19] Los homólogos de TasA están codificados por muchas otras arqueas, lo que sugiere similitudes mecanísticas y una conexión evolutiva entre las biopelículas bacterianas y arqueales. [19]

La hidrofobicidad también puede afectar la capacidad de las bacterias para formar biopelículas. Las bacterias con mayor hidrofobicidad tienen una repulsión reducida entre el sustrato y la bacteria. [21] Algunas especies de bacterias no pueden adherirse a una superficie por sí solas con éxito debido a su movilidad limitada, pero sí pueden anclarse a la matriz o directamente a otras bacterias colonizadoras anteriores. Las bacterias inmóviles no pueden reconocer superficies ni agregarse entre sí con tanta facilidad como las bacterias móviles. [21]
Durante la colonización de la superficie, las células bacterianas pueden comunicarse mediante productos de detección de quórum (QS), como la N-acil homoserina lactona (AHL). Una vez que ha comenzado la colonización, la biopelícula crece mediante una combinación de división celular y reclutamiento. Las matrices de polisacáridos suelen envolver las biopelículas bacterianas. Los exopolisacáridos de la matriz pueden atrapar autoinductores de QS dentro de la biopelícula para evitar la detección de depredadores y garantizar la supervivencia bacteriana. [22] Además de los polisacáridos, estas matrices también pueden contener material del entorno circundante, incluidos, entre otros, minerales, partículas de suelo y componentes sanguíneos, como eritrocitos y fibrina. [21] La etapa final de la formación de la biopelícula se conoce como desarrollo, y es la etapa en la que se establece la biopelícula y solo puede cambiar de forma y tamaño. [ cita requerida ]
El desarrollo de una biopelícula puede permitir que una colonia (o colonias) de células agregadas sean cada vez más tolerantes [23] o resistentes a los antibióticos . Se ha demostrado que la comunicación entre células o la detección de quórum intervienen en la formación de biopelículas en varias especies bacterianas. [24]

Las biopelículas son el producto de un proceso de desarrollo microbiano . [27] El proceso se resume en cinco etapas principales de desarrollo de la biopelícula, como se muestra en el diagrama siguiente: [28]

La dispersión de células de la colonia de biopelículas es una etapa esencial del ciclo de vida de la biopelícula. La dispersión permite que las biopelículas se propaguen y colonicen nuevas superficies. Las enzimas que degradan la matriz extracelular de la biopelícula, como la dispersina B y la desoxirribonucleasa , pueden contribuir a la dispersión de la biopelícula. [29] [30] Las enzimas que degradan la matriz de la biopelícula pueden ser útiles como agentes anti-biopelícula. [31] [32] La evidencia ha demostrado que un mensajero de ácidos grasos, el ácido cis -2-decenoico , es capaz de inducir la dispersión e inhibir el crecimiento de colonias de biopelículas. Secretado por Pseudomonas aeruginosa , este compuesto induce células cicloheteromórficas en varias especies de bacterias y la levadura Candida albicans . [33] También se ha demostrado que el óxido nítrico desencadena la dispersión de biopelículas de varias especies de bacterias [34] [35] en concentraciones subtóxicas. El óxido nítrico tiene potencial como tratamiento para pacientes que tienen infecciones crónicas causadas por biopelículas. [36]
En general, se suponía que las células dispersadas de las biopelículas pasaban inmediatamente a la fase de crecimiento planctónico. Sin embargo, los estudios han demostrado que la fisiología de las células dispersas de las biopelículas de Pseudomonas aeruginosa es muy diferente de la de las células planctónicas y de la biopelícula. [37] [38] Por lo tanto, el proceso de dispersión es una etapa única durante la transición de la biopelícula al estilo de vida planctónico en las bacterias. Se ha descubierto que las células dispersas son muy virulentas contra los macrófagos y Caenorhabditis elegans , pero muy sensibles al estrés por hierro, en comparación con las células planctónicas. [37]
Además, las biopelículas de Pseudomonas aeruginosa experimentan dinámicas espaciotemporales distintas durante la dispersión o desmontaje de la biopelícula, con consecuencias contrastantes en la recolonización y la diseminación de enfermedades. [39] La dispersión de la biopelícula indujo a las bacterias a activar genes de dispersión para salir activamente de las biopelículas como células individuales a velocidades constantes, pero no pudieron recolonizar superficies frescas. Por el contrario, el desmontaje de la biopelícula por degradación de un exopolisacárido de la biopelícula liberó agregados inmóviles a altas velocidades iniciales, lo que permitió a las bacterias recolonizar superficies frescas y causar infecciones en los huéspedes de manera eficiente. Por lo tanto, la dispersión de la biopelícula es más compleja de lo que se pensaba anteriormente, donde las poblaciones bacterianas que adoptan un comportamiento distinto después de la salida de la biopelícula pueden ser la clave para la supervivencia de las especies bacterianas y la diseminación de enfermedades.

Las biopelículas se encuentran generalmente en sustratos sólidos sumergidos o expuestos a una solución acuosa , aunque pueden formarse como esteras flotantes en superficies líquidas y también en la superficie de las hojas, particularmente en climas de alta humedad. Si se le proporcionan suficientes recursos para crecer, una biopelícula crecerá rápidamente hasta volverse macroscópica (visible a simple vista). Las biopelículas pueden contener muchos tipos diferentes de microorganismos, por ejemplo, bacterias, arqueas , protozoos , hongos y algas ; cada grupo realiza funciones metabólicas especializadas . Sin embargo, algunos organismos formarán películas de una sola especie en determinadas condiciones. La estructura social (cooperación/competencia) dentro de una biopelícula depende en gran medida de las diferentes especies presentes. [40]

La matriz EPS está formada por exopolisacáridos , proteínas y ácidos nucleicos. [41] [42] [43] Una gran proporción de los EPS está más o menos fuertemente hidratada, sin embargo, también se producen EPS hidrófobos; un ejemplo es la celulosa [44] que es producida por una variedad de microorganismos. Esta matriz encierra las células en su interior y facilita la comunicación entre ellas a través de señales bioquímicas, así como el intercambio de genes. La matriz EPS también atrapa enzimas extracelulares y las mantiene cerca de las células. Por lo tanto, la matriz representa un sistema de digestión externo y permite microconsorcios sinérgicos estables de diferentes especies. [45] Se ha descubierto que algunas biopelículas contienen canales de agua que ayudan a distribuir nutrientes y moléculas de señalización. [46] Esta matriz es lo suficientemente fuerte como para que, en determinadas condiciones, las biopelículas puedan fosilizarse ( estromatolitos ).
Las bacterias que viven en una biopelícula suelen tener propiedades significativamente diferentes de las bacterias que flotan libremente de la misma especie, ya que el entorno denso y protegido de la película les permite cooperar e interactuar de diversas formas. [47] Un beneficio de este entorno es una mayor resistencia a los detergentes y antibióticos , ya que la densa matriz extracelular y la capa exterior de células protegen el interior de la comunidad. [48] [49] En algunos casos, la resistencia a los antibióticos puede aumentar hasta 5000 veces. [50] La transferencia lateral de genes a menudo se facilita dentro de biopelículas bacterianas y arqueales [51] y puede conducir a una estructura de biopelícula más estable. [52] El ADN extracelular es un componente estructural importante de muchas biopelículas microbianas diferentes. [53] La degradación enzimática del ADN extracelular puede debilitar la estructura de la biopelícula y liberar células microbianas de la superficie.
Sin embargo, las biopelículas no siempre son menos susceptibles a los antibióticos. Por ejemplo, la forma de biopelícula de Pseudomonas aeruginosa no tiene mayor resistencia a los antimicrobianos que las células planctónicas en fase estacionaria, aunque cuando la biopelícula se compara con las células planctónicas en fase logarítmica, la biopelícula sí tiene mayor resistencia a los antimicrobianos. Esta resistencia a los antibióticos tanto en las células en fase estacionaria como en las biopelículas puede deberse a la presencia de células persistentes . [54]


Las biopelículas son omnipresentes en la vida orgánica. Casi todas las especies de microorganismos tienen mecanismos por los cuales pueden adherirse a superficies y entre sí. Las biopelículas se forman en prácticamente cualquier superficie que no se desprenda en ambientes acuosos o húmedos no estériles . Las biopelículas pueden crecer en los ambientes más extremos: desde, por ejemplo, las aguas extremadamente calientes y salobres de fuentes termales que van desde muy ácidas a muy alcalinas, hasta los glaciares congelados .
Las biopelículas se pueden encontrar en rocas y guijarros en el fondo de la mayoría de los arroyos o ríos y, a menudo, se forman en las superficies de charcos de agua estancada . Las biopelículas son componentes importantes de las cadenas alimentarias en ríos y arroyos y son pastadas por los invertebrados acuáticos de los que se alimentan muchos peces. Las biopelículas se encuentran en la superficie y en el interior de las plantas. Pueden contribuir a la enfermedad de los cultivos o, como en el caso de los rizobios fijadores de nitrógeno en los nódulos de las raíces , existir simbióticamente con la planta . [55] Los ejemplos de enfermedades de los cultivos relacionadas con las biopelículas incluyen el cancro de los cítricos, la enfermedad de Pierce de las uvas y la mancha bacteriana de plantas como los pimientos y los tomates. [56]
Los filtros de percolación en las plantas de tratamiento de aguas residuales son eliminadores muy eficaces de contaminantes del licor de depuración sedimentado. Funcionan haciendo que el líquido gotee sobre un lecho de material duro que está diseñado para tener una superficie muy grande. En la superficie del medio se desarrolla una biopelícula compleja que absorbe, adsorbe y metaboliza los contaminantes. La biopelícula crece rápidamente y cuando se vuelve demasiado espesa para retener su adherencia al medio, se lava y es reemplazada por una película recién formada. La película lavada ("desprendida") se sedimenta fuera de la corriente de líquido para dejar un efluente altamente purificado. [57]
Los filtros de arena lentos se utilizan en la purificación del agua para tratar el agua cruda y producir un producto potable. Funcionan mediante la formación de una biopelícula llamada capa hipogea o Schmutzdecke en los primeros milímetros de la capa de arena fina. La Schmutzdecke se forma en los primeros 10 a 20 días de funcionamiento [58] y está compuesta por bacterias , hongos, protozoos , rotíferos y una variedad de larvas de insectos acuáticos. A medida que una biopelícula epigea envejece, tienden a desarrollarse más algas y pueden estar presentes organismos acuáticos más grandes, incluidos algunos briozoos , caracoles y gusanos anélidos . La biopelícula superficial es la capa que proporciona la purificación efectiva en el tratamiento del agua potable, y la arena subyacente proporciona el medio de soporte para esta capa de tratamiento biológico. A medida que el agua pasa a través de la capa hipogea, las partículas de materia extraña quedan atrapadas en la matriz mucilaginosa y se adsorbe material orgánico soluble . Los contaminantes son metabolizados por las bacterias, hongos y protozoos. El agua producida a partir de un filtro de arena lento ejemplar es de excelente calidad, con una reducción del recuento de células bacterianas del 90 al 99 %. [59]
Los microbios beneficiosos para las plantas se pueden clasificar como rizobacterias promotoras del crecimiento de las plantas . [60] Estos promotores del crecimiento de las plantas colonizan las raíces de las plantas y proporcionan una amplia gama de funciones beneficiosas para su huésped, incluyendo la fijación de nitrógeno, la supresión de patógenos, propiedades antifúngicas y la descomposición de materiales orgánicos. [61] Una de estas funciones es la defensa contra bacterias y hongos patógenos transmitidos por el suelo mediante resistencia sistémica inducida (ISR) [62] o respuestas sistémicas inducidas desencadenadas por microbios patógenos (resistencia sistémica adquirida inducida por patógenos). [63] Los exudados de las plantas actúan como señales químicas para que las bacterias específicas del huésped colonicen. [64] Los pasos de colonización de las rizobacterias incluyen atracciones, reconocimiento , adherencia, colonización y crecimiento. [61] Las bacterias que han demostrado ser beneficiosas y forman biopelículas incluyen Bacillus , Pseudomonas y Azospirillum . [65] [66] Las biopelículas en la rizosfera a menudo resultan en resistencias sistémicas inducidas por patógenos o plantas. Las propiedades moleculares en la superficie de la bacteria causan una respuesta inmune en la planta huésped. [64] Estas moléculas asociadas a microbios interactúan con receptores en la superficie de las células vegetales y activan una respuesta bioquímica que se cree que incluye varios genes diferentes en varios loci. [64] Varias otras moléculas de señalización se han relacionado tanto con respuestas sistémicas inducidas como con respuestas sistémicas inducidas por patógenos, como el ácido jasmónico y el etileno. [61] Componentes de la envoltura celular como los flagelos bacterianos y los lipopolisacáridos, que son reconocidos por las células vegetales como componentes de patógenos. [67] También se ha demostrado que ciertos metabolitos de hierro producidos por Pseudomonas crean una respuesta sistémica inducida. [64] Esta función de la biopelícula ayuda a las plantas a desarrollar una resistencia más fuerte a los patógenos.
Las plantas que han sido colonizadas por PGPR formando una biopelícula han adquirido resistencias sistémicas y están preparadas para la defensa contra los patógenos. Esto significa que se han expresado los genes necesarios para la producción de proteínas que trabajan para defender a la planta contra los patógenos, y la planta tiene una "reserva" de compuestos para liberar para luchar contra los patógenos. [64] Un sistema de defensa preparado responde mucho más rápido a la infección inducida por patógenos y puede ser capaz de desviar a los patógenos antes de que puedan establecerse. [68] Las plantas aumentan la producción de lignina, reforzando las paredes celulares y dificultando la penetración de los patógenos en la célula, al mismo tiempo que cortan los nutrientes a las células ya infectadas, deteniendo eficazmente la invasión. [61] Producen compuestos antimicrobianos como fitoalexinas, quitinasas e inhibidores de proteinasas, que previenen el crecimiento de patógenos. [63] Estas funciones de supresión de enfermedades y resistencia a patógenos conducen en última instancia a un aumento de la producción agrícola y a una disminución del uso de pesticidas, herbicidas y fungicidas químicos porque hay una menor cantidad de pérdidas de cultivos debido a enfermedades. [69] La resistencia sistémica inducida y la resistencia sistémica adquirida inducida por patógenos son funciones potenciales de las biopelículas en la rizosfera y deben tenerse en cuenta cuando se aplican a las prácticas agrícolas de la nueva era debido a su efecto en la supresión de enfermedades sin el uso de productos químicos peligrosos.
Estudios realizados en 2003 descubrieron que el sistema inmunológico favorece el desarrollo de biopelículas en el intestino grueso. Esto se vio respaldado principalmente por el hecho de que las dos moléculas producidas con mayor abundancia por el sistema inmunológico también favorecen la producción de biopelículas y están asociadas con las biopelículas desarrolladas en el intestino. Esto es especialmente importante porque el apéndice contiene una gran cantidad de estas biopelículas bacterianas. [70] Este descubrimiento ayuda a distinguir la posible función del apéndice y la idea de que el apéndice puede ayudar a reinocular el intestino con una buena flora intestinal. Sin embargo, los estados modificados o alterados de las biopelículas en el intestino se han relacionado con enfermedades como la enfermedad inflamatoria intestinal y el cáncer colorrectal . [71]
En el entorno humano, las biopelículas pueden crecer en las duchas muy fácilmente, ya que proporcionan un entorno húmedo y cálido para que prosperen. Pueden formarse dentro de las tuberías de agua y alcantarillado y causar obstrucciones y corrosión . En pisos y mostradores, pueden dificultar la higiene en las áreas de preparación de alimentos. En el suelo, pueden causar bioobstrucciones . En los sistemas de agua de enfriamiento o calentamiento, se sabe que reducen la transferencia de calor. [72] Las biopelículas en los sistemas de ingeniería marina, como las tuberías de la industria del petróleo y el gas en alta mar, [73] pueden provocar problemas de corrosión importantes. La corrosión se debe principalmente a factores abióticos; sin embargo, al menos el 20% de la corrosión es causada por microorganismos que están adheridos a la subsuperficie del metal (es decir, corrosión influenciada por microbios ).
La adhesión bacteriana a los cascos de los barcos sirve como base para la bioincrustación de los buques de navegación marítima. Una vez que se forma una película de bacterias, es más fácil que otros organismos marinos, como los percebes, se adhieran a ella. Esta incrustación puede reducir la velocidad máxima del buque hasta en un 20%, prolongando los viajes y consumiendo combustible. El tiempo que pasan en dique seco para reacondicionamiento y repintado reduce la productividad de los activos de transporte marítimo, y la vida útil de los buques también se reduce debido a la corrosión y la eliminación mecánica (raspado) de los organismos marinos de los cascos de los barcos.
Los estromatolitos son estructuras de acreción en capas que se forman en aguas poco profundas mediante la captura, unión y cementación de granos sedimentarios por biopelículas microbianas, especialmente de cianobacterias . Los estromatolitos incluyen algunos de los registros más antiguos de vida en la Tierra y todavía se están formando en la actualidad.
En el cuerpo humano, las biopelículas están presentes en los dientes en forma de placa dental , donde pueden causar caries y enfermedades de las encías . Estas biopelículas pueden estar en un estado no calcificado que se puede eliminar con instrumentos dentales, o en un estado calcificado que es más difícil de eliminar. Las técnicas de eliminación también pueden incluir antimicrobianos . [74]
La placa dental es una biopelícula oral que se adhiere a los dientes y está formada por muchas especies de bacterias y hongos (como Streptococcus mutans y Candida albicans ), incrustadas en polímeros salivales y productos extracelulares microbianos. La acumulación de microorganismos somete a los dientes y tejidos gingivales a altas concentraciones de metabolitos bacterianos que dan lugar a enfermedades dentales. [75] La biopelícula en la superficie de los dientes está frecuentemente sujeta a estrés oxidativo [76] y estrés ácido. [77] Los carbohidratos de la dieta pueden causar una disminución drástica del pH en las biopelículas orales a valores de 4 y menores (estrés ácido). [77] Un pH de 4 a una temperatura corporal de 37 °C provoca la despurinización del ADN, dejando sitios apurínicos (AP) en el ADN, [78] especialmente pérdida de guanina. [79]
La biopelícula de placa dental puede provocar caries dentales si se permite que se desarrolle con el tiempo. Un cambio ecológico que se aleje de las poblaciones equilibradas dentro de la biopelícula dental es impulsado por ciertas poblaciones microbiológicas (cariogénicas) que comienzan a dominar cuando el entorno las favorece. El cambio a una población microbiológica acidogénica , acidúrica y cariogénica se desarrolla y se mantiene mediante el consumo frecuente de carbohidratos dietéticos fermentables . El cambio de actividad resultante en la biopelícula (y la producción de ácido resultante dentro de la biopelícula, en la superficie del diente) se asocia con un desequilibrio de desmineralización sobre remineralización, lo que lleva a una pérdida neta de minerales dentro de los tejidos duros dentales ( esmalte y luego dentina ), siendo el síntoma una lesión cariosa o cavidad. Al evitar que la biopelícula de placa dental madure o al devolverla a un estado no cariogénico, se pueden prevenir y detener las caries dentales. [80] [81] Esto se puede lograr a través del paso conductual de reducir el suministro de carbohidratos fermentables (es decir, la ingesta de azúcar) y la eliminación frecuente de la biopelícula (es decir, el cepillado de dientes ). [80]
Un sistema de señalización de detección de quórum de feromonas peptídicas en S. mutans incluye el péptido estimulante de la competencia (CSP) que controla la competencia genética. [82] [83] La competencia genética es la capacidad de una célula de absorber el ADN liberado por otra célula. La competencia puede conducir a la transformación genética, una forma de interacción sexual, favorecida en condiciones de alta densidad celular y/o estrés donde hay una oportunidad máxima de interacción entre la célula competente y el ADN liberado de las células donantes cercanas. Este sistema se expresa de manera óptima cuando las células de S. mutans residen en una biopelícula en crecimiento activo. Las células de S. mutans cultivadas en biopelícula se transforman genéticamente a una tasa de 10 a 600 veces mayor que las S. mutans que crecen como células planctónicas que flotan libremente suspendidas en líquido. [82]
Cuando la biopelícula que contiene S. mutans y estreptococos orales relacionados se somete a estrés ácido, se induce el regulón de competencia, lo que genera resistencia a ser destruido por el ácido. [77] Como señalaron Michod et al., la transformación en patógenos bacterianos probablemente proporciona una reparación recombinatoria eficaz y eficiente de los daños en el ADN. [84] Parece que S. mutans puede sobrevivir al estrés ácido frecuente en las biopelículas orales, en parte, a través de la reparación recombinatoria proporcionada por la competencia y la transformación.
Interacciones depredador-presa
Las interacciones depredador - presa entre biopelículas y bacterívoros, como el nematodo que habita en el suelo Caenorhabditis elegans , se han estudiado ampliamente. A través de la producción de una matriz pegajosa y la formación de agregados, las biopelículas de Yersinia pestis pueden impedir la alimentación al obstruir la boca de C. elegans . [85] Además, las biopelículas de Pseudomonas aeruginosa pueden impedir la movilidad deslizante de C. elegans , denominada "fenotipo de pantano", lo que da como resultado el atrapamiento de C. elegans dentro de las biopelículas y evita la exploración de los nematodos para alimentarse de biopelículas susceptibles. [86] Esto redujo significativamente la capacidad del depredador para alimentarse y reproducirse, promoviendo así la supervivencia de las biopelículas. Las biopelículas de Pseudomonas aeruginosa también pueden enmascarar sus firmas químicas, donde redujeron la difusión de moléculas de detección de quórum en el medio ambiente y evitaron la detección de C. elegans . [87]
Muchas bacterias diferentes forman biopelículas, incluidas las grampositivas (por ejemplo, Bacillus spp., Listeria monocytogenes , Staphylococcus spp. y bacterias de ácido láctico , incluidas Lactobacillus plantarum y Lactococcus lactis ) y las gramnegativas (por ejemplo, Escherichia coli o Pseudomonas aeruginosa ). [88] Las cianobacterias también forman biopelículas en entornos acuáticos. [89]
Las biopelículas están formadas por bacterias que colonizan las plantas, por ejemplo, Pseudomonas putida , Pseudomonas fluorescens y pseudomonas relacionadas, que son bacterias comunes asociadas a las plantas que se encuentran en las hojas, las raíces y en el suelo, y la mayoría de sus aislamientos naturales forman biopelículas. [90] Varios simbiontes fijadores de nitrógeno de las legumbres, como Rhizobium leguminosarum y Sinorhizobium meliloti, forman biopelículas en las raíces de las legumbres y otras superficies inertes. [90]
Además de las bacterias, las biopelículas también son generadas por arqueas [51] y por una variedad de organismos eucariotas , incluidos hongos, por ejemplo, Cryptococcus laurentii [91] y microalgas . Entre las microalgas, uno de los principales progenitores de las biopelículas son las diatomeas , que colonizan ambientes tanto dulces como marinos en todo el mundo. [92] [93]
Para otras especies en biopelículas asociadas a enfermedades y biopelículas que surgen de eucariotas , consulte a continuación.
Se ha descubierto que las biopelículas están implicadas en una amplia variedad de infecciones microbianas en el cuerpo, según una estimación del 80% de todas las infecciones. [94] Los procesos infecciosos en los que se han implicado las biopelículas incluyen problemas comunes como vaginosis bacteriana , infecciones del tracto urinario , infecciones del catéter , infecciones del oído medio , formación de placa dental , [95] gingivitis , recubrimiento de lentes de contacto , [96] y procesos menos comunes pero más letales como endocarditis , infecciones en fibrosis quística e infecciones de dispositivos permanentes como prótesis articulares , válvulas cardíacas y disco intervertebral. [97] [98] [99] La primera evidencia visual de una biopelícula se registró después de una cirugía de columna. [100] Se encontró que en ausencia de presentación clínica de infección, las bacterias impregnadas podrían formar una biopelícula alrededor de un implante, y esta biopelícula puede permanecer sin detectar a través de métodos de diagnóstico contemporáneos, incluido el hisopado. La biopelícula de implantes se encuentra frecuentemente presente en casos de pseudoartrosis "aséptica". [100] [101] [102] Además, se ha observado que las biopelículas bacterianas pueden perjudicar la cicatrización de heridas cutáneas y reducir la eficacia de los antibacterianos tópicos para curar o tratar heridas cutáneas infectadas. [103] Se cree que la diversidad de células de P. aeruginosa dentro de una biopelícula dificulta el tratamiento de los pulmones infectados de personas con fibrosis quística. [13] La detección temprana de biopelículas en heridas es crucial para el manejo exitoso de heridas crónicas. Aunque se han desarrollado muchas técnicas para identificar bacterias planctónicas en heridas viables, pocas han podido identificar biopelículas bacterianas de manera rápida y precisa. Se necesitan estudios futuros para encontrar medios de identificar y monitorear la colonización de biopelículas en la cama del paciente para permitir el inicio oportuno del tratamiento. [104]
Se ha demostrado que las biopelículas están presentes en el tejido extirpado del 80% de los pacientes sometidos a cirugía por sinusitis crónica . Se demostró que los pacientes con biopelículas habían sido despojados de cilios y células caliciformes , a diferencia de los controles sin biopelículas que tenían morfología normal de cilios y células caliciformes. [105] También se encontraron biopelículas en muestras de dos de los 10 controles sanos mencionados. Las especies de bacterias de los cultivos intraoperatorios no correspondían a las especies de bacterias en la biopelícula en el tejido del paciente respectivo. En otras palabras, los cultivos fueron negativos aunque las bacterias estaban presentes. [106] Se están desarrollando nuevas técnicas de tinción para diferenciar las células bacterianas que crecen en animales vivos, por ejemplo, de tejidos con inflamaciones alérgicas. [107]
Las investigaciones han demostrado que los niveles subterapéuticos de antibióticos β-lactámicos inducen la formación de biopelículas en Staphylococcus aureus . Este nivel subterapéutico de antibiótico puede ser resultado del uso de antibióticos como promotores del crecimiento en la agricultura o durante el curso normal de la terapia con antibióticos. La formación de biopelículas inducida por meticilina de bajo nivel fue inhibida por la DNasa, lo que sugiere que los niveles subterapéuticos de antibiótico también inducen la liberación de ADN extracelular. [108] Además, desde un punto de vista evolutivo, la creación de la tragedia de los comunes en microbios patógenos puede proporcionar formas terapéuticas avanzadas para infecciones crónicas causadas por biopelículas a través de tramposos invasores modificados genéticamente que pueden invadir "cooperadores" de tipo salvaje de bacterias patógenas hasta que las poblaciones de cooperadores se extingan o la población general de "cooperadores y tramposos" se extinga. [109]
P. aeruginosa representa un organismo modelo de biopelícula de uso común , ya que está involucrado en diferentes tipos de infecciones crónicas asociadas a biopelículas. [41] Los ejemplos de tales infecciones incluyen heridas crónicas, otitis media crónica, prostatitis crónica e infecciones pulmonares crónicas en pacientes con fibrosis quística (FQ). Alrededor del 80% de los pacientes con FQ tienen infección pulmonar crónica, causada principalmente por P. aeruginosa que crece en biopelículas no adheridas a la superficie rodeadas de PMN . [110] La infección permanece presente a pesar de la terapia antibiótica agresiva y es una causa común de muerte en pacientes con FQ debido al daño inflamatorio constante a los pulmones. [41] En pacientes con FQ, una terapia para tratar el desarrollo temprano de biopelículas es emplear DNasa para debilitar estructuralmente la biopelícula. [4] [111]
La formación de biopelículas de P. aeruginosa , junto con otras bacterias, se encuentra en el 90% de las infecciones de heridas crónicas, lo que conduce a una mala cicatrización y a un alto costo del tratamiento estimado en más de US$25 mil millones cada año en los Estados Unidos . [112] Para minimizar la infección por P. aeruginosa , las células epiteliales del huésped secretan péptidos antimicrobianos , como la lactoferrina , para prevenir la formación de biopelículas. [113]
Streptococcus pneumoniae es la principal causa de neumonía y meningitis adquiridas en la comunidad en niños y ancianos, y de sepsis en personas infectadas por el VIH. Cuando S. pneumoniae crece en biopelículas, se expresan genes específicos que responden al estrés oxidativo e inducen competencia. [114] La formación de una biopelícula depende del péptido estimulante de la competencia (CSP). El CSP también funciona como un péptido de detección de quórum. No solo induce la formación de biopelículas, sino que también aumenta la virulencia en la neumonía y la meningitis.
Se ha propuesto que el desarrollo de la competencia y la formación de biopelículas es una adaptación de S. pneumoniae para sobrevivir a las defensas del huésped. [84] En particular, los leucocitos polimorfonucleares del huésped producen una explosión oxidativa para defenderse de las bacterias invasoras, y esta respuesta puede matar a las bacterias dañando su ADN. Las S. pneumoniae competentes en una biopelícula tienen la ventaja de supervivencia de que pueden absorber más fácilmente el ADN transformante de las células cercanas en la biopelícula para usarlo en la reparación recombinatoria de los daños oxidativos en su ADN. Las S. pneumoniae competentes también pueden secretar una enzima (mureína hidrolasa) que destruye las células no competentes (fratricida) haciendo que el ADN se libere al medio circundante para su posible uso por parte de las células competentes. [115]
El péptido antimicrobiano de insectos cecropina A puede destruir células de E. coli uropatógenas formadoras de biopelículas planctónicas y sésiles , ya sea solo o cuando se combina con el antibiótico ácido nalidíxico , eliminando sinérgicamente la infección in vivo (en el insecto huésped Galleria mellonella ) sin citotoxicidad fuera del objetivo. El mecanismo de acción multiobjetivo implica la permeabilización de la membrana externa seguida de la disrupción de la biopelícula desencadenada por la inhibición de la actividad de la bomba de eflujo e interacciones con ácidos nucleicos extracelulares e intracelulares. [116]
Las biopelículas de Escherichia coli son responsables de muchas enfermedades infecciosas intestinales. [117] El grupo extraintestinal de E. coli (ExPEC) es el grupo bacteriano dominante que ataca el sistema urinario , lo que conduce a infecciones del tracto urinario . [118] La formación de biopelículas de estas E. coli patógenas es difícil de erradicar debido a la complejidad de su estructura de agregación, y tiene una contribución significativa al desarrollo de complicaciones médicas agresivas, aumento en la tasa de hospitalización y costo del tratamiento. [119] [120] El desarrollo de biopelículas de E. coli es una causa principal común de infecciones del tracto urinario (ITU) en los hospitales a través de su contribución al desarrollo de infecciones asociadas a dispositivos médicos . Las infecciones del tracto urinario asociadas a catéteres (CAUTI) representan la infección adquirida en el hospital más comúndebido a la formación de la biopelícula patógena de E. coli dentro de los catéteres. [121]
El patógeno Staphylococcus aureus puede atacar la piel y los pulmones, lo que provoca infecciones cutáneas y neumonía . [122] [123] Además, la red de infecciones por biopelículas de S. aureus desempeña un papel fundamental a la hora de impedir que las células inmunitarias, como los macrófagos , eliminen y destruyan las células bacterianas. [124] Además, la formación de biopelículas por bacterias, como S. aureus , no solo desarrolla resistencia a los antibióticos , sino que también desarrolla resistencia interna a los péptidos antimicrobianos (AMP) , lo que impide la inhibición del patógeno y mantiene su supervivencia. [125]
Serratia marcescens es un patógeno oportunista bastante común que puede formar biopelículas en diversas superficies, incluidos dispositivos médicos como catéteres e implantes, así como entornos naturales como el suelo y el agua. La formación de biopelículas por parte de S. marcescens es una preocupación grave debido a su capacidad de adherirse a las superficies y colonizarlas, protegiéndose de las respuestas inmunitarias del huésped y de los agentes antimicrobianos. Esta fortaleza hace que las infecciones causadas por S. marcescens sean difíciles de tratar, especialmente en hospitales donde la bacteria puede causar infecciones graves y específicas.
Las investigaciones sugieren que la formación de biopelículas por S. marcescens es un proceso controlado tanto por señales de nutrientes como por el sistema de detección de quórum. [126] La detección de quórum influye en la capacidad de la bacteria para adherirse a superficies y establecer biopelículas maduras, mientras que la disponibilidad de nutrientes específicos puede mejorar o inhibir el desarrollo de la biopelícula.
S. marcescens crea biopelículas que finalmente se convierten en una estructura altamente porosa y similar a un filamento compuesta de cadenas de células, filamentos y grupos de células. Las investigaciones han demostrado que las biopelículas de S. marcescens presentan una organización estructural compleja, incluida la formación de microcolonias y canales que facilitan el intercambio de nutrientes y desechos. La producción de sustancias poliméricas extracelulares (SPE) es un factor clave en el desarrollo de biopelículas, que contribuye a la adhesión y resistencia de la bacteria a los agentes antimicrobianos. Además de su papel en las infecciones asociadas a la atención médica, las biopelículas de S. marcescens se han relacionado con el deterioro de los equipos y procesos industriales. Por ejemplo, el crecimiento de biopelículas en torres de enfriamiento puede provocar bioincrustaciones y reducir la eficiencia.
Los esfuerzos para controlar y prevenir la formación de biopelículas por S. marcescens implican el uso de recubrimientos antimicrobianos en dispositivos médicos, el desarrollo de disruptores de biopelículas específicos y protocolos de esterilización mejorados. Es fundamental realizar más investigaciones sobre los mecanismos moleculares que rigen la formación y la persistencia de biopelículas de S. marcescens para desarrollar estrategias efectivas para combatir sus riesgos asociados. Se ha estudiado el uso de compuestos de indol para su uso como protección contra la formación de biopelículas. [127]
Se sugiere que alrededor de dos tercios de las infecciones bacterianas en humanos involucran biopelículas. [50] [128] Las infecciones asociadas con el crecimiento de biopelículas generalmente son difíciles de erradicar. [129] Esto se debe principalmente al hecho de que las biopelículas maduras muestran tolerancia a los antimicrobianos y evasiones de la respuesta inmune. [130] [41] Las biopelículas a menudo se forman en las superficies inertes de dispositivos implantados como catéteres, válvulas cardíacas protésicas y dispositivos intrauterinos. [131] Algunas de las infecciones más difíciles de tratar son las asociadas con el uso de dispositivos médicos. [50] [101]
La industria de dispositivos biomédicos y productos relacionados con la ingeniería de tejidos, que se encuentra en rápida expansión a nivel mundial, ya genera 180 mil millones de dólares por año, pero sigue sufriendo la colonización microbiana. Independientemente de la sofisticación, las infecciones microbianas pueden desarrollarse en todos los dispositivos médicos y construcciones de ingeniería de tejidos. [130] Entre el 60 y el 70 % de las infecciones adquiridas en el hospital están asociadas con la implantación de un dispositivo biomédico. [130] Esto da lugar a 2 millones de casos al año en los EE. UU., lo que le cuesta al sistema de salud más de 5 mil millones de dólares en gastos de atención médica adicionales. [130]
El nivel de resistencia a los antibióticos en una biopelícula es mucho mayor que el de las bacterias que no forman parte de ella, y puede ser hasta 5.000 veces mayor. [50] La matriz extracelular de la biopelícula se considera uno de los principales factores que pueden reducir la penetración de antibióticos en la estructura de una biopelícula y contribuye a la resistencia a los antibióticos. [132] Además, se ha demostrado que la evolución de la resistencia a los antibióticos puede verse afectada por el estilo de vida de la biopelícula. [133] La terapia con bacteriófagos puede dispersar la biopelícula generada por bacterias resistentes a los antibióticos. [134]
Se ha demostrado que la introducción de una pequeña corriente eléctrica en el líquido que rodea una biopelícula, junto con pequeñas cantidades de antibiótico, puede reducir el nivel de resistencia a los antibióticos en comparación con los niveles de bacterias que no forman parte de la biopelícula. Esto se denomina efecto bioeléctrico . [50] [135] La aplicación de una pequeña corriente continua por sí sola puede hacer que una biopelícula se desprenda de su superficie. [50] Un estudio demostró que el tipo de corriente utilizada no afectaba al efecto bioeléctrico. [135]
Las biopelículas también se pueden aprovechar con fines constructivos. Por ejemplo, muchas plantas de tratamiento de aguas residuales incluyen una etapa de tratamiento secundario en la que las aguas residuales pasan sobre biopelículas cultivadas en filtros, que extraen y digieren compuestos orgánicos. En dichas biopelículas, las bacterias son las principales responsables de la eliminación de materia orgánica ( DBO ), mientras que los protozoos y rotíferos son los principales responsables de la eliminación de sólidos suspendidos (SS), incluidos patógenos y otros microorganismos. Los filtros de arena lentos dependen del desarrollo de biopelículas de la misma manera para filtrar el agua superficial de fuentes de lagos, manantiales o ríos para beber. Lo que se considera agua limpia es efectivamente un material de desecho para estos organismos microcelulares. Las biopelículas pueden ayudar a eliminar el petróleo de los océanos o sistemas marinos contaminados. El petróleo se elimina mediante las actividades de degradación de hidrocarburos de las comunidades de bacterias hidrocarbonoclásticas (HCB). [136] Las biopelículas se utilizan en celdas de combustible microbianas (MFC) para generar electricidad a partir de una variedad de materiales de partida, incluidos desechos orgánicos complejos y biomasa renovable. [7] [137] [138] Las biopelículas también son relevantes para la mejora de la disolución de metales en la industria de biolixiviación , [139] y la agregación de contaminantes microplásticos para su eliminación conveniente del medio ambiente. [140] [141]
Las biopelículas se han vuelto problemáticas en varias industrias alimentarias debido a su capacidad de formarse en plantas y durante procesos industriales. [142] Las bacterias pueden sobrevivir largos periodos de tiempo en el agua, el estiércol animal y el suelo, provocando la formación de biopelículas en las plantas o en el equipo de procesamiento. [143] La acumulación de biopelículas puede afectar el flujo de calor a través de una superficie y aumentar la corrosión superficial y la resistencia a la fricción de los fluidos. [144] Estos pueden provocar una pérdida de energía en un sistema y una pérdida general de productos. [144] Junto con los problemas económicos, la formación de biopelículas en los alimentos plantea un riesgo para la salud de los consumidores debido a la capacidad de hacer que los alimentos sean más resistentes a los desinfectantes. [142] Como resultado, de 1996 a 2010 los Centros para el Control y la Prevención de Enfermedades estimaron 48 millones de enfermedades transmitidas por alimentos por año. [142] Las biopelículas se han relacionado con aproximadamente el 80% de las infecciones bacterianas en los Estados Unidos. [142]
En los productos , los microorganismos se adhieren a las superficies y se desarrollan biopelículas internamente. [142] Durante el proceso de lavado, las biopelículas resisten la higienización y permiten que las bacterias se propaguen por los productos, [142] especialmente a través de los utensilios de cocina. [145] Este problema también se encuentra en los alimentos listos para comer, porque los alimentos pasan por procedimientos de limpieza limitados antes del consumo [142] Debido a la perecibilidad de los productos lácteos y las limitaciones en los procedimientos de limpieza, que resultan en la acumulación de bacterias, los productos lácteos son susceptibles a la formación de biopelículas y contaminación. [142] [144] Las bacterias pueden estropear los productos más fácilmente y los productos contaminados plantean un riesgo para la salud de los consumidores. Una especie de bacteria que se puede encontrar en varias industrias y es una de las principales causas de enfermedades transmitidas por los alimentos es la Salmonella . [146] Se pueden encontrar grandes cantidades de contaminación por Salmonella en la industria de procesamiento de aves de corral, ya que aproximadamente el 50% de las cepas de Salmonella pueden producir biopelículas en las granjas avícolas. [142] La salmonela aumenta el riesgo de enfermedades transmitidas por los alimentos cuando los productos avícolas no se limpian y cocinan correctamente. La salmonela también se encuentra en la industria de los mariscos, donde se forman biopelículas a partir de patógenos transmitidos por los mariscos en los propios mariscos, así como en el agua. [146] Los productos de camarón se ven comúnmente afectados por la salmonela debido a técnicas de procesamiento y manipulación antihigiénicas. [146] Las prácticas de preparación de camarones y otros productos del mar pueden permitir la acumulación de bacterias en los productos. [146]
Se están probando nuevas formas de procedimientos de limpieza para reducir la formación de biopelículas en estos procesos, lo que conducirá a industrias de procesamiento de alimentos más seguras y productivas. Estas nuevas formas de procedimientos de limpieza también tienen un profundo efecto sobre el medio ambiente, a menudo liberando gases tóxicos en los depósitos de agua subterránea. [144] Como respuesta a los métodos agresivos empleados para controlar la formación de biopelículas, hay una serie de nuevas tecnologías y productos químicos bajo investigación que pueden prevenir la proliferación o la adhesión de microbios secretores de biopelículas. Las últimas biomoléculas propuestas que presentan una marcada actividad anti-biopelícula incluyen una gama de metabolitos como los ramnolípidos bacterianos [147] e incluso alcaloides derivados de plantas [148] y animales . [149]

En la acuicultura de mariscos y algas , las especies microbianas bioincrustantes tienden a bloquear redes y jaulas y, en última instancia, compiten con las especies cultivadas por el espacio y el alimento. [150] Las biopelículas bacterianas inician el proceso de colonización creando microambientes que son más favorables para las especies bioincrustantes. En el entorno marino, las biopelículas podrían reducir la eficiencia hidrodinámica de los barcos y las hélices, provocar bloqueos en las tuberías y el mal funcionamiento de los sensores, y aumentar el peso de los aparatos desplegados en agua de mar. [151] Numerosos estudios han demostrado que la biopelícula puede ser un reservorio de bacterias potencialmente patógenas en la acuicultura de agua dulce. [152] [153] [154] [155] Además, las biopelículas son importantes para establecer infecciones en los peces. [156] Como se mencionó anteriormente, las biopelículas pueden ser difíciles de eliminar incluso cuando se utilizan antibióticos o productos químicos en dosis altas. [157] [158] El papel que desempeña la biopelícula como reservorio de patógenos bacterianos de peces no se ha explorado en detalle, pero sin duda merece ser estudiado.
Junto con las bacterias, las biopelículas suelen ser iniciadas y producidas por microbios eucariotas. Las biopelículas producidas por eucariotas suelen estar ocupadas por bacterias y otros eucariotas por igual, sin embargo, la superficie se cultiva y el EPS es secretado inicialmente por el eucariota. [91] [92] [159] Se sabe que tanto los hongos como las microalgas forman biopelículas de esta manera. Las biopelículas de origen fúngico son aspectos importantes de la infección humana y la patogenicidad fúngica, ya que la infección fúngica es más resistente a los antimicóticos. [160] [161]
En el medio ambiente, las biopelículas fúngicas son un área de investigación en curso. Un área clave de investigación son las biopelículas fúngicas en las plantas. Por ejemplo, en el suelo, se ha demostrado que los hongos asociados a las plantas, incluidas las micorrizas, descomponen la materia orgánica y protegen a las plantas de los patógenos bacterianos. [162]
Las biopelículas en ambientes acuáticos suelen estar formadas por diatomeas . Se desconoce el propósito exacto de estas biopelículas, sin embargo, hay evidencia de que los EPS producidos por las diatomeas facilitan tanto el estrés por frío como por salinidad. [93] [163] Estos eucariotas interactúan con una amplia gama de otros organismos dentro de una región conocida como la ficosfera , pero lo más importante son las bacterias asociadas con las diatomeas, ya que se ha demostrado que, aunque las diatomeas excretan EPS, solo lo hacen cuando interactúan con ciertas especies de bacterias. [164] [165]
La transferencia horizontal de genes es la transferencia lateral de material genético entre organismos celulares. Ocurre con frecuencia en procariotas y con menor frecuencia en eucariotas. En las bacterias, la transferencia horizontal de genes puede ocurrir a través de la transformación (captación de ADN que flota libremente en el ambiente), la transducción (captación de ADN mediada por virus) o la conjugación (transferencia de ADN entre estructuras de pili de dos bacterias adyacentes). [166] Estudios recientes también han descubierto otros mecanismos, como la transmisión por vesículas de membrana o agentes de transferencia de genes. [167] Las biopelículas promueven la transferencia horizontal de genes de diversas formas.

Se ha demostrado que la conjugación bacteriana acelera la formación de biopelículas en entornos difíciles debido a las conexiones robustas establecidas por los pili conjugativos . [168] Estas conexiones a menudo pueden fomentar eventos de transferencia entre especies debido a la heterogeneidad diversa de muchas biopelículas. Además, las biopelículas están confinadas estructuralmente por una matriz de polisacáridos, lo que proporciona los requisitos espaciales cercanos para la conjugación. La transformación también se observa con frecuencia en biopelículas. La autólisis bacteriana es un mecanismo clave en la regulación estructural de la biopelícula, que proporciona una fuente abundante de ADN competente preparado para la absorción transformativa. [169] [167] En algunos casos, la detección de quórum entre biopelículas puede mejorar la competencia del eADN flotante libre, lo que promueve aún más la transformación. [167] La transferencia de genes Stx a través de portadores de bacteriófagos se ha observado dentro de biopelículas, lo que sugiere que las biopelículas también son un entorno adecuado para la transducción. [167] La HGT de vesículas de membrana ocurre cuando vesículas de membrana liberadas (que contienen información genética) se fusionan con una bacteria receptora y liberan material genético en el citoplasma de la bacteria. [167] Investigaciones recientes han revelado que la HGT de vesículas de membrana puede promover la formación de biopelículas de una sola cepa, aunque aún se desconoce el papel que desempeña la HGT de vesículas de membrana en la formación de biopelículas de múltiples cepas. [167] Los GTA, o agentes de transferencia genética, son partículas similares a fagos producidas por la bacteria huésped y contienen fragmentos de ADN aleatorios del genoma de la bacteria huésped. [167] La HGT dentro de las biopelículas puede conferir resistencia a los antibióticos o mayor patogenicidad en la población de las biopelículas, promoviendo la homeostasis de la biopelícula. [167]
Los plásmidos conjugativos pueden codificar proteínas asociadas a la biopelícula, como PtgA, PrgB o PrgC, que promueven la adhesión celular (necesaria para la formación temprana de la biopelícula). [170] Los genes que codifican fimbrias de tipo III se encuentran en pOLA52 ( plásmido de Klebsiella pneumoniae ) que promueven la formación de biopelículas dependientes del pilus conjugativo. [170]
La transformación ocurre comúnmente dentro de las biopelículas. Un fenómeno llamado fratricidio se puede observar entre las especies de estreptococos en el que se liberan enzimas que degradan la pared celular, lisando las bacterias vecinas y liberando su ADN. Este ADN puede luego ser absorbido por las bacterias supervivientes (transformación). [170] Los péptidos estimulantes de la competencia también pueden desempeñar un papel importante en la formación de biopelículas entre S. pneumoniae y S. mutans . [170] Entre V. cholerae , el propio pilus de competencia promueve la agregación celular a través de interacciones pilus-pilus al comienzo de la formación de la biopelícula. [170]
La invasión de fagos puede desempeñar un papel en los ciclos de vida de las biopelículas, lisando las bacterias y liberando su eADN, que fortalece las estructuras de la biopelícula y puede ser absorbido por las bacterias vecinas en la transformación. [170] La destrucción de la biopelícula causada por el fago Rac de E. coli y el profago Pf4 de P. aeruginosa provoca el desprendimiento de células de la biopelícula. [170] El desprendimiento es un fenómeno de la biopelícula que requiere más estudio, pero se plantea la hipótesis de que prolifera las especies bacterianas que componen la biopelícula.
Se ha observado que la HGT de vesículas de membrana ocurre en ambientes marinos, entre Neisseria gonorrhoeae , Pseudomonas aeruginosa , Helicobacter pylori y entre muchas otras especies bacterianas. [170] Aunque se ha demostrado que la HGT de vesículas de membrana es un factor que contribuye a la formación de biopelículas, aún se requiere investigación para demostrar que la HGT mediada por vesículas de membrana ocurre dentro de las biopelículas. [167] [170] También se ha demostrado que la HGT de vesículas de membrana modula las interacciones fago-bacteria en células resistentes a fagos SPP1 de Bacillus subtilis (que carecen de la proteína receptora SPP1). Tras la exposición a vesículas que contienen receptores, se produce la transducción de pBT163 (un plásmido que codifica cat), lo que da como resultado la expresión de la proteína receptora SPP1, abriendo las bacterias receptivas a una futura infección por fagos. [170]
Investigaciones recientes han demostrado que la especie arqueal H. volcanii tiene algunos fenotipos de biopelículas similares a las biopelículas bacterianas, como la diferenciación y la HGT, que requieren contacto célula-célula e involucran la formación de puentes citosólicos y eventos de fusión celular. [171]
Existe una amplia variedad de dispositivos de cultivo de biopelículas para imitar entornos naturales o industriales. Si bien es importante considerar que la plataforma experimental particular para la investigación de biopelículas determina qué tipo de biopelícula se cultiva y los datos que se pueden extraer. Estos dispositivos se pueden agrupar en los siguientes: [172]