
La visión es el sentido más importante para las aves , ya que una buena vista es esencial para un vuelo seguro. Las aves tienen una serie de adaptaciones que les dan una agudeza visual superior a la de otros grupos de vertebrados ; una paloma ha sido descrita como "dos ojos con alas". [1] Las aves son terópodos , [2] [3] y el ojo aviar se parece al de otros saurópsidos , con músculos ciliares que pueden cambiar la forma del cristalino rápidamente y en mayor medida que en los mamíferos . [ cita requerida ] Las aves tienen los ojos más grandes en relación con su tamaño en el reino animal, y en consecuencia el movimiento está limitado dentro de la cuenca ósea del ojo. [1] Además de los dos párpados que se encuentran habitualmente en los vertebrados, los ojos de las aves están protegidos por una tercera membrana transparente móvil. La anatomía interna del ojo es similar a la de otros vertebrados, pero tiene una estructura, el pecten oculi , exclusiva de las aves.
Algunos grupos de aves presentan modificaciones específicas en su sistema visual vinculadas a su forma de vida. Las aves rapaces tienen una densidad muy alta de receptores y otras adaptaciones que maximizan la agudeza visual. La colocación de sus ojos les proporciona una buena visión binocular que les permite calcular con precisión las distancias. Las especies nocturnas tienen ojos tubulares, un número reducido de detectores de color, pero una alta densidad de células bastón que funcionan bien con poca luz. Los charranes , las gaviotas y los albatros se encuentran entre las aves marinas que tienen gotitas de aceite rojas o amarillas en los receptores de color para mejorar la visión a distancia, especialmente en condiciones de niebla.
El ojo de un ave se parece mucho al de otros reptiles. A diferencia del ojo de los mamíferos , no es esférico y su forma más plana permite enfocar una mayor parte de su campo visual. Un círculo de placas óseas, el anillo esclerótico , rodea el ojo y lo mantiene rígido, pero una mejora con respecto al ojo de los reptiles, también presente en los mamíferos, es que el cristalino está más adelantado, lo que aumenta el tamaño de la imagen en la retina. [4]

Los ojos de la mayoría de las aves son grandes, no muy redondos y capaces de un movimiento limitado en las órbitas, [5] típicamente de 10° a 20° (pero en algunos paseriformes, >80°) en sentido horizontal. Es por eso que los movimientos de la cabeza en las aves juegan un papel más importante que los movimientos de los ojos. [6] Los dos ojos suelen moverse de forma independiente, [6] [7] y en algunas especies pueden moverse coordinadamente en direcciones opuestas. [8]
Las aves con ojos a los lados de la cabeza tienen un amplio campo de visión , útil para detectar depredadores, mientras que las que tienen los ojos en la parte delantera de la cabeza, como los búhos, tienen visión binocular y pueden estimar distancias cuando cazan. [9] [10] La becada americana probablemente tiene el campo de visión más grande de todas las aves, 360° en el plano horizontal y 180° en el plano vertical. [11]
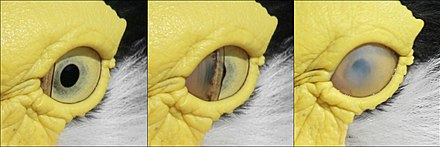
Los párpados de un pájaro no se utilizan para parpadear. En cambio, el ojo está lubricado por la membrana nictitante , un tercer párpado oculto que recorre el ojo horizontalmente como un limpiaparabrisas. [12] La membrana nictitante también cubre el ojo y actúa como una lente de contacto en muchas aves acuáticas cuando están bajo el agua. [5] Cuando duermen, el párpado inferior se levanta para cubrir el ojo en la mayoría de las aves, con la excepción de los búhos cornudos, donde el párpado superior es móvil. [13]
El ojo también se limpia con las secreciones lagrimales de la glándula lagrimal y está protegido por una sustancia aceitosa de las glándulas de Harder que recubre la córnea y evita la sequedad. El ojo de un ave es más grande en comparación con el tamaño del animal que el de cualquier otro grupo de animales, aunque gran parte de él está oculto en su cráneo. El avestruz tiene el ojo más grande de todos los vertebrados terrestres, con una longitud axial de 50 mm (2,0 pulgadas), el doble de la del ojo humano. [1]
El tamaño de los ojos de las aves está ampliamente relacionado con la masa corporal. Un estudio de cinco órdenes (loros, palomas, petreles, aves rapaces y búhos) mostró que la masa ocular es proporcional a la masa corporal, pero como se esperaba a partir de sus hábitos y ecología visual, las aves rapaces y los búhos tienen ojos relativamente grandes para su masa corporal. [14]
Los estudios de comportamiento muestran que muchas especies de aves se centran en objetos distantes preferentemente con su campo de visión lateral y monocular, y las aves se orientan lateralmente para maximizar la resolución visual. En el caso de una paloma, la resolución es el doble de buena con la visión monocular lateral que con la visión binocular frontal, mientras que en el caso de los humanos ocurre lo contrario. [1]

El rendimiento del ojo en condiciones de poca luz depende de la distancia entre el cristalino y la retina, y las aves pequeñas se ven obligadas a ser diurnas porque sus ojos no son lo suficientemente grandes como para ofrecer una visión nocturna adecuada. Aunque muchas especies migran de noche, a menudo chocan incluso con objetos muy iluminados, como faros o plataformas petrolíferas. Las aves rapaces son diurnas porque, aunque sus ojos son grandes, están optimizados para ofrecer la máxima resolución espacial en lugar de captar luz, por lo que tampoco funcionan bien con poca luz. [15] Muchas aves tienen una asimetría en la estructura del ojo que les permite mantener el horizonte y una parte importante del suelo enfocados simultáneamente. El coste de esta adaptación es que tienen miopía en la parte inferior de su campo visual. [1]
Las aves con ojos relativamente grandes en comparación con su masa corporal, como los colirrojos reales y los petirrojos europeos , cantan más temprano al amanecer que las aves de la misma masa con ojos más pequeños; de la misma manera, si las aves tienen el mismo tamaño de ojos pero diferentes masas corporales, la especie más grande canta más tarde que la más pequeña. Esto puede deberse a que el ave más pequeña tiene que comenzar el día más temprano debido a la pérdida de peso durante la noche. [16] La pérdida de peso durante la noche para las aves pequeñas es típicamente del 5 al 10% y puede ser superior al 15% en las noches frías de invierno. [16] En un estudio, los petirrojos aumentaron más masa en su alimentación al anochecer cuando las noches eran frías. [17]
Las aves nocturnas tienen ojos optimizados para la sensibilidad visual, con córneas grandes en relación con la longitud del ojo, mientras que las aves diurnas tienen ojos más largos en relación con el diámetro de la córnea para proporcionar una mayor agudeza visual. La información sobre las actividades de las especies extintas se puede deducir a partir de mediciones del anillo esclerótico y la profundidad de la órbita. Para que se pueda realizar esta última medición, el fósil debe haber conservado su forma tridimensional, por lo que el patrón de actividad no se puede determinar con confianza a partir de especímenes aplanados como Archaeopteryx , que tiene un anillo esclerótico completo pero no una medición de la profundidad de la órbita. [18]

Las estructuras principales del ojo de las aves son similares a las de otros vertebrados . La capa externa del ojo está formada por la córnea transparente en la parte delantera y dos capas de esclerótica , una capa de fibras de colágeno blancas y resistentes que rodea el resto del ojo y sostiene y protege el ojo en su conjunto. El ojo está dividido internamente por el cristalino en dos segmentos principales: el segmento anterior y el segmento posterior . El segmento anterior está lleno de un líquido acuoso llamado humor acuoso, y el segmento posterior contiene el humor vítreo, una sustancia gelatinosa transparente.
El cristalino es un cuerpo transparente, convexo o con forma de "lente", con una capa exterior más dura y una capa interior más blanda. Enfoca la luz sobre la retina. La forma del cristalino puede ser alterada por los músculos ciliares que están directamente unidos a la cápsula del cristalino por medio de las fibras zonulares. Además de estos músculos, algunas aves también tienen un segundo conjunto, los músculos de Crampton, que pueden cambiar la forma de la córnea, lo que proporciona a las aves un mayor rango de acomodación que el que es posible para los mamíferos. Esta acomodación puede ser rápida en algunas aves acuáticas buceadoras, como en los serretas. El iris es un diafragma coloreado operado muscularmente en frente del cristalino que controla la cantidad de luz que entra en el ojo. En el centro del iris se encuentra la pupila, el área circular variable a través de la cual la luz pasa al ojo. [4] [19]

La retina es una estructura multicapa relativamente lisa y curva que contiene las células fotosensibles (conos y bastones ) con las neuronas y vasos sanguíneos asociados. La densidad de los fotorreceptores es fundamental para determinar la agudeza visual máxima alcanzable. Los humanos tenemos unos 200.000 receptores por mm2 , pero el gorrión común tiene 400.000 y el busardo ratonero 1.000.000. Los fotorreceptores no están todos conectados individualmente al nervio óptico, y la relación entre ganglios nerviosos y receptores es importante para determinar la resolución. Esta es muy alta en el caso de las aves; la lavandera blanca tiene 100.000 células ganglionares por cada 120.000 fotorreceptores. [4]
Los bastones son más sensibles a la luz, pero no proporcionan información sobre el color, mientras que los conos, menos sensibles, permiten la visión en color. En las aves diurnas , el 80% de los receptores pueden ser conos (el 90% en algunos vencejos ), mientras que los búhos nocturnos tienen casi todos bastones. Al igual que en otros vertebrados, excepto los mamíferos placentarios , algunos de los conos pueden ser conos dobles . Estos pueden llegar a representar el 50% de todos los conos en algunas especies. [20]
Hacia el centro de la retina se encuentra la fóvea (o área central, menos especializada), que tiene una mayor densidad de receptores y es el área de mayor agudeza visual frontal, es decir, la detección más nítida y clara de los objetos. En el 54% de las aves, incluidas las aves rapaces , los martines pescadores , los colibríes y las golondrinas , existe una segunda fóvea para mejorar la visión lateral. El nervio óptico es un haz de fibras nerviosas que llevan mensajes desde el ojo a las partes relevantes del cerebro. Al igual que los mamíferos, las aves tienen un pequeño punto ciego sin fotorreceptores en el disco óptico, debajo del cual el nervio óptico y los vasos sanguíneos se unen al ojo. [4]
El pecten es un cuerpo poco conocido que consiste en tejido plegado que se proyecta desde la retina. Está bien provisto de vasos sanguíneos y parece mantener la retina provista de nutrientes, [1] y también puede proteger la retina de la luz deslumbrante o ayudar a detectar objetos en movimiento. [4] El pecten oculi está abundantemente lleno de gránulos de melanina que se ha propuesto que absorben la luz difusa que entra en el ojo del ave para reducir el resplandor de fondo. Se ha propuesto que el ligero calentamiento del pecten oculi debido a la absorción de luz por los gránulos de melanina mejora la tasa metabólica del pecten. Se sugiere que esto ayuda a aumentar la secreción de nutrientes en el cuerpo vítreo, para finalmente ser absorbidos por la retina avascular de las aves para mejorar la nutrición. [21] Se ha propuesto que la actividad enzimática extraalta de la fosfatasa alcalina en el pecten oculi respalda la alta actividad secretora del pecten para complementar la nutrición de la retina. [22]
La coroides es una capa situada detrás de la retina que contiene muchas arterias y venas pequeñas . Estas proporcionan sangre arterial a la retina y drenan sangre venosa. La coroides contiene melanina , un pigmento que le da al interior del ojo su color oscuro, lo que ayuda a evitar los molestos reflejos.

En el ojo de las aves hay dos tipos de receptores de luz: los bastones y los conos . Los bastones, que contienen el pigmento visual rodopsina, son mejores para la visión nocturna porque son sensibles a pequeñas cantidades de luz. Los conos detectan colores específicos (o longitudes de onda) de la luz, por lo que son más importantes para los animales orientados al color, como las aves. [25] La mayoría de las aves son tetracromáticas y poseen cuatro tipos de células cónicas, cada una con un pico de absorción máxima distintivo. En algunas aves, el pico de absorción máxima de la célula cónica responsable de la longitud de onda más corta se extiende hasta el rango ultravioleta (UV), lo que las hace sensibles a los rayos UV. [26] Además de eso, los conos en la retina de las aves están dispuestos en una forma característica de distribución espacial, conocida como distribución hiperuniforme, que maximiza su absorción de luz y color. Esta forma de distribución espacial solo se observa como resultado de algún proceso de optimización, que en este caso se puede describir en términos de la historia evolutiva de las aves. [27]
Los cuatro pigmentos cónicos, espectralmente distintos, se derivan de la proteína opsina , unida a una pequeña molécula llamada retinal , que está estrechamente relacionada con la vitamina A. Cuando el pigmento absorbe luz, el retinal cambia de forma y altera el potencial de membrana de la célula cónica, lo que afecta a las neuronas de la capa ganglionar de la retina. Cada neurona de la capa ganglionar puede procesar información de varias células fotorreceptoras y, a su vez, puede desencadenar un impulso nervioso para transmitir información a lo largo del nervio óptico para su posterior procesamiento en centros visuales especializados del cerebro. Cuanto más intensa sea la luz, más fotones absorberán los pigmentos visuales; cuanto mayor sea la excitación de cada cono, más brillante parecerá la luz. [25]
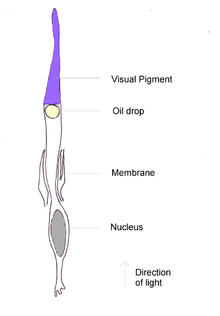
El pigmento cónico más abundante en todas las especies de aves examinadas es la forma de longitud de onda larga de la yodopsina , que absorbe en longitudes de onda cercanas a los 570 nm. Esta es aproximadamente la región espectral ocupada por los pigmentos sensibles al rojo y al verde en la retina de los primates, y este pigmento visual domina la sensibilidad al color de las aves. [28] En los pingüinos , este pigmento parece haber desplazado su pico de absorción a 543 nm, presumiblemente una adaptación a un entorno acuático azul. [29]
La información que transmite un único cono es limitada: por sí sola, la célula no puede decir al cerebro qué longitud de onda de luz provocó su excitación. Un pigmento visual puede absorber dos longitudes de onda por igual, pero aunque sus fotones sean de energías diferentes, el cono no puede distinguirlos, porque ambos hacen que la retina cambie de forma y, por lo tanto, desencadene el mismo impulso. Para que el cerebro vea el color, debe comparar las respuestas de dos o más clases de conos que contienen diferentes pigmentos visuales, por lo que los cuatro pigmentos en las aves proporcionan una mayor discriminación. [25]
Cada cono de un ave o reptil contiene una gotita de aceite coloreada ; estas ya no existen en los mamíferos. Las gotitas, que contienen altas concentraciones de carotenoides , se colocan de manera que la luz pase a través de ellas antes de alcanzar el pigmento visual. Actúan como filtros, eliminando algunas longitudes de onda y estrechando los espectros de absorción de los pigmentos. Esto reduce la superposición de respuestas entre pigmentos y aumenta la cantidad de colores que un ave puede discernir. [25] Se han identificado seis tipos de gotitas de aceite de cono; cinco de ellas tienen mezclas de carotenoides que absorben a diferentes longitudes de onda e intensidades, y el sexto tipo no tiene pigmentos. [30] Los pigmentos de cono con el pico de absorción máxima más bajo, incluidos los que son sensibles a los rayos UV, poseen el tipo de gotitas de aceite "claras" o "transparentes" con poco efecto de ajuste espectral. [31]
Los colores y la distribución de las gotitas de aceite de la retina varían considerablemente entre especies y dependen más del nicho ecológico utilizado (cazador, pescador, herbívoro) que de las relaciones genéticas . Por ejemplo, los cazadores diurnos, como la golondrina común y las aves rapaces, tienen pocas gotitas de color, mientras que el charrán común , que pesca en la superficie , tiene una gran cantidad de gotitas rojas y amarillas en la retina dorsal. La evidencia sugiere que las gotitas de aceite responden a la selección natural más rápidamente que los pigmentos visuales del cono. [28] Incluso dentro del rango de longitudes de onda que son visibles para los humanos, las aves paseriformes pueden detectar diferencias de color que los humanos no registran. Esta discriminación más fina, junto con la capacidad de ver la luz ultravioleta, significa que muchas especies muestran dicromatismo sexual que es visible para las aves, pero no para los humanos. [32]
Las aves cantoras migratorias utilizan el campo magnético de la Tierra, las estrellas, el Sol y otras señales desconocidas para determinar su dirección migratoria. Un estudio estadounidense sugirió que los gorriones sabaneros migratorios utilizaban la luz polarizada de una zona del cielo cercana al horizonte para recalibrar su sistema de navegación magnética tanto al amanecer como al atardecer. Esto sugirió que los patrones de polarización de la luz del cielo son la referencia de calibración principal para todas las aves cantoras migratorias. [33] Sin embargo, parece que las aves pueden estar respondiendo a indicadores secundarios del ángulo de polarización y pueden no ser capaces de detectar directamente la dirección de polarización en ausencia de estas señales. [34]

Muchas especies de aves son tetracromáticas , con células cónicas dedicadas a percibir longitudes de onda en las regiones ultravioleta y violeta del espectro de luz. Estas células contienen una combinación de opsinas sensibles a las ondas cortas (SWS1), opsinas similares a SWS1 (SWS2) y pigmentos carotenoides filtrantes de onda larga [35] para filtrar y recibir selectivamente luz entre 300 y 400 nm. Hay dos tipos de visión del color de onda corta en las aves: sensible al violeta (VS) y sensible al ultravioleta (UVS). [36] Las sustituciones de un solo nucleótido en la secuencia de la opsina SWS1 son responsables del desplazamiento hacia el azul de la sensibilidad espectral de la opsina de sensible al violeta (λ max = 400) a sensible al ultravioleta (λ max = 310–360). [37] Este es el mecanismo evolutivo propuesto por el cual surgió originalmente la visión ultravioleta. Los principales clados de aves que tienen visión UVS son Palaeognathae (ratites y tinamús), Charadriiformes (aves playeras, gaviotas y álcidos), Trogoniformes (trogones), Psittaciformes (loros) y Passeriformes (aves posadas, que representan más de la mitad de todas las especies de aves). [38]
La visión ultravioleta puede ser útil para el cortejo. Las aves que no muestran dicromatismo sexual en longitudes de onda visibles para los humanos a veces se distinguen por la presencia de manchas reflectantes ultravioleta en sus plumas. [39] [40] Los herrerillos azules machos tienen una mancha reflectante ultravioleta en la coronilla que muestran durante el cortejo al adoptar posturas y levantar las plumas de la nuca. [41] Los picogordos azules machos con el azul más brillante y con mayor desplazamiento de la radiación ultravioleta en su plumaje son más grandes, ocupan los territorios más extensos con abundantes presas y alimentan a sus crías con más frecuencia que otros machos. [25] Los paíños mediterráneos no muestran dimorfismo sexual en los patrones de radiación ultravioleta, pero la correlación entre la reflectancia de la radiación ultravioleta y la condición corporal de los machos sugiere un posible papel en la selección sexual. [42]
La apariencia del pico es importante en las interacciones del mirlo . Aunque el componente UV parece no ser importante en las interacciones entre machos que mantienen un territorio, donde el grado de naranja es el factor principal, la hembra responde con mayor fuerza a los machos con picos que reflejan bien los rayos UV. [43]
También se ha demostrado que la luz ultravioleta tiene funciones en la búsqueda de alimento, [44] la identificación de presas, [45] y la frugivoría. En general, se considera que las aves tienen ventajas similares a las que tienen los primates tricromáticos sobre los primates dicromáticos en la frugivoría [46] . Las superficies cerosas de muchas frutas y bayas pueden reflejar la luz ultravioleta que anuncia su presencia a las aves que utilizan la luz ultravioleta. [25] Sin embargo, la evidencia generalizada que apoya la frugivoría mediada por el color es equívoca y puede depender de la escala. [47] Los cernícalos comunes pueden localizar los rastros de los ratones de campo con la visión; estos pequeños roedores dejan rastros de olor de orina y heces que reflejan la luz ultravioleta, lo que los hace visibles para los cernícalos. [45] Sin embargo, esta visión ha sido cuestionada por el hallazgo de una baja sensibilidad a la luz ultravioleta en las aves rapaces y una débil reflexión de la luz ultravioleta en la orina de los mamíferos. [48]
Si bien la visión tetracromática no es exclusiva de las aves (los insectos, reptiles y crustáceos también son sensibles a las longitudes de onda cortas), algunos depredadores de las aves que perciben la luz ultravioleta no pueden verla. Esto plantea la posibilidad de que la visión ultravioleta proporcione a las aves un canal a través del cual puedan enviar señales de forma privada, permaneciendo así inadvertidas para los depredadores. [49] Sin embargo, la evidencia reciente no parece respaldar esta hipótesis. [50]
Las aves también pueden utilizar pistas ultravioleta para distinguir entre cuerpos de agua limpios y contaminados. El principal producto de desecho del metabolismo del nitrógeno de las aves es el ácido úrico , que absorbe la luz ultravioleta y permanece casi sin disolverse en el agua, mientras que la carbamida presente en la orina de los mamíferos refleja la luz ultravioleta. [45] Sin embargo, los experimentos de doble elección realizados con palomas no pudieron mostrar preferencias detectables hacia el agua limpia. [51]
El contraste (o más precisamente, el contraste de Michelson) se define como la diferencia de luminancia entre dos áreas de estímulo, dividida por la suma de la luminancia de las dos. La sensibilidad al contraste es la inversa del contraste más pequeño que se puede detectar; una sensibilidad al contraste de 100 significa que el contraste (de Michelson) más pequeño que se puede detectar es del 1%. Las aves tienen una sensibilidad al contraste comparativamente menor que los mamíferos. Se ha demostrado que los humanos detectan contrastes tan bajos como 0,5-1% [52], mientras que la mayoría de las aves evaluadas requieren aproximadamente un 10% de contraste para mostrar una respuesta conductual. [53] [54] [55] Una función de sensibilidad al contraste describe la capacidad de un animal para detectar el contraste de patrones de rejilla de diferentes frecuencias espaciales (es decir, diferentes detalles). Para experimentos de visualización estacionaria, la sensibilidad al contraste es más alta en una frecuencia espacial media y más baja para frecuencias espaciales más altas y más bajas. [56]

Las aves pueden distinguir mejor los movimientos rápidos que los humanos, para quienes un parpadeo a una velocidad superior a 50 ciclos de pulsos de luz por segundo parece un movimiento continuo. Por lo tanto, los humanos no pueden distinguir los destellos individuales de una bombilla fluorescente que oscila a 60 ciclos de pulsos de luz por segundo, pero los periquitos y los pollos tienen umbrales de parpadeo o de ciclos de pulsos de luz por segundo de más de 100 ciclos de pulsos de luz por segundo. [ cita requerida ] Un gavilán de Cooper puede perseguir presas ágiles a través del bosque y evitar ramas y otros objetos a gran velocidad; para los humanos, una persecución de este tipo parecería borrosa. [11]
Las aves también pueden detectar objetos que se mueven lentamente. El movimiento del sol y de las constelaciones en el cielo es imperceptible para los humanos, pero detectado por las aves. La capacidad de detectar estos movimientos permite a las aves migratorias orientarse adecuadamente. [11]
Para obtener imágenes estables mientras vuelan o cuando están posados en una rama que se balancea, los pájaros mantienen la cabeza lo más firme posible con reflejos compensatorios. Mantener una imagen estable es especialmente importante para las aves rapaces. [11] Debido a que la imagen puede centrarse en la fóvea profunda de un solo ojo a la vez, la mayoría de los halcones, cuando se lanzan en picado, utilizan una trayectoria en espiral para acercarse a su presa después de haber fijado su atención en un individuo objetivo. La alternativa de girar la cabeza para obtener una mejor vista ralentiza la caída en picado al aumentar la resistencia, mientras que la espiral no reduce la velocidad de manera significativa. [57] [58]
Cuando un objeto está parcialmente bloqueado por otro, los humanos inconscientemente tienden a compensarlo y completar las formas (ver Percepción amodal ). Sin embargo, se ha demostrado que las palomas no completan las formas ocluidas. [59] Un estudio basado en la alteración del nivel de gris de una percha que tenía un color diferente al del fondo mostró que los periquitos no detectan los bordes en función de los colores. [60]
Se ha sugerido que la percepción de los campos magnéticos por parte de las aves migratorias depende de la luz. [61] Las aves mueven la cabeza para detectar la orientación del campo magnético, [62] y los estudios sobre las vías neuronales han sugerido que las aves pueden ser capaces de "ver" los campos magnéticos. [63] El ojo derecho de un ave migratoria contiene proteínas fotorreceptoras llamadas criptocromos . La luz excita estas moléculas para producir electrones desapareados que interactúan con el campo magnético de la Tierra, proporcionando así información direccional. [64] [65]

La capacidad visual de las aves rapaces es legendaria, y la agudeza de su vista se debe a una variedad de factores. Las aves rapaces tienen ojos grandes para su tamaño, 1,4 veces mayores que la media de las aves del mismo peso, [14] y el ojo tiene forma de tubo para producir una imagen retiniana más grande. El poder de resolución de un ojo depende tanto de la óptica (los ojos grandes con grandes aperturas sufren menos difracción y pueden tener imágenes retinianas más grandes debido a una distancia focal larga) como de la densidad del espaciamiento de los receptores. La retina tiene una gran cantidad de receptores por milímetro cuadrado, lo que determina el grado de agudeza visual. Cuantos más receptores tenga un animal, mayor será su capacidad para distinguir objetos individuales a distancia, especialmente cuando, como en las aves rapaces, cada receptor suele estar unido a un solo ganglio. [1] Muchas aves rapaces tienen fóveas con muchos más bastones y conos que la fóvea humana (65.000/mm2 en el cernícalo americano, 38.000 en los humanos) y esto proporciona a estas aves una espectacular visión a larga distancia. [ cita requerida ] Se propone que la forma de la fóvea central profunda de las aves rapaces puede crear un sistema óptico de telefoto, [66] aumentando el tamaño de la imagen retiniana en la fóvea y, por lo tanto, aumentando la resolución espacial. Los estudios de comportamiento muestran que algunas aves rapaces de ojos grandes (águila de cola de cuña, buitres del Viejo Mundo) tienen una resolución espacial dos veces mayor que los humanos, pero muchas aves rapaces de tamaño mediano y pequeño tienen una resolución espacial comparable o inferior. [67] [68] [69] [70] [71] [72]
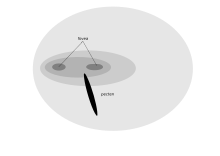
Los ojos frontales de un ave rapaz proporcionan una visión binocular, que es asistida por una fóvea doble. [4] Las adaptaciones de las aves rapaces para una resolución visual óptima (un cernícalo americano puede ver un insecto de 2 mm desde la copa de un árbol de 18 m) tienen la desventaja de que su visión es pobre en niveles bajos de luz, y debe posarse por la noche. [1] Las aves rapaces pueden tener que perseguir presas móviles en la parte inferior de su campo visual y, por lo tanto, no tienen la adaptación a la miopía de campo inferior demostrada por muchas otras aves. [1] Las aves carroñeras como los buitres no necesitan una visión tan nítida, por lo que un cóndor tiene una sola fóvea con unos 35.000 receptores mm 2 . Los buitres, sin embargo, tienen una alta actividad fisiológica de muchas enzimas importantes para adaptarse a su claridad de visión lejana. [74] [ cita requerida ] El caracara crestado también tiene una sola fóvea, ya que esta especie busca carroña e insectos en el suelo. Sin embargo, tienen un mayor grado de superposición binocular que otros halcones, lo que potencialmente les permite manipular objetos, como rocas, mientras buscan alimento. [75]
Al igual que otras aves investigadas, las aves rapaces también tienen gotitas de aceite de colores en sus conos. [69] [70] [76] El plumaje generalmente marrón, gris y blanco de este grupo, y la ausencia de exhibiciones de color en el cortejo, sugiere que el color es relativamente poco importante para estas aves. [4]
En la mayoría de las aves rapaces, una prominente cresta ocular y sus plumas se extienden por encima y por delante del ojo. Esta "ceja" le da a las aves rapaces su mirada distintiva. La cresta protege físicamente el ojo del viento, el polvo y los residuos y lo protege del deslumbramiento excesivo. El águila pescadora carece de esta cresta, aunque la disposición de las plumas sobre sus ojos cumple una función similar; también posee plumas oscuras delante del ojo que probablemente sirven para reducir el deslumbramiento de la superficie del agua cuando el ave está cazando su dieta básica de peces. [11]

Los búhos tienen ojos muy grandes para su tamaño, 2,2 veces más grandes que el promedio de las aves del mismo peso, [14] y ubicados en la parte delantera de la cabeza. Los ojos tienen una superposición de campo de 50-70%, lo que proporciona una mejor visión binocular que para las aves rapaces diurnas (superposición de 30-50%). [77] La retina del cárabo tiene alrededor de 56.000 bastones sensibles a la luz por milímetro cuadrado (36 millones por pulgada cuadrada); aunque las afirmaciones anteriores de que podía ver en la parte infrarroja del espectro han sido descartadas. [78]

Las adaptaciones a la visión nocturna incluyen el gran tamaño del ojo, su forma tubular, un gran número de bastones retinianos muy juntos y la ausencia de conos, ya que las células de los conos no son lo suficientemente sensibles para un entorno nocturno de baja emisión de fotones. Hay pocas gotas de aceite coloreadas, lo que reduciría la intensidad de la luz, pero la retina contiene una capa reflectante, el tapetum lucidum . Esto aumenta la cantidad de luz que recibe cada célula fotosensible, lo que permite al ave ver mejor en condiciones de poca luz. [4] Los búhos normalmente tienen una sola fóvea, y está poco desarrollada, excepto en los cazadores diurnos como el búho campestre . [77]
Además de los búhos, los gavilanes murciélagos , los sapos y los chotacabras también muestran una buena visión nocturna. Algunas especies de aves anidan en lo profundo de sistemas de cuevas que son demasiado oscuros para la visión, y encuentran su camino al nido con una forma simple de ecolocalización . El guácharo es el único pájaro nocturno que ecolocaliza, [79] pero varias salanganas Aerodramus también utilizan esta técnica, con una especie, la salangana Atiu , que también usa la ecolocalización fuera de sus cuevas. [80] [81]

Las aves marinas, como los charranes y las gaviotas , que se alimentan en la superficie o se sumergen en busca de comida tienen gotitas de aceite rojo en los conos de sus retinas . Esto mejora el contraste y agudiza la visión a distancia, especialmente en condiciones de niebla. [4] Las aves que tienen que mirar a través de una interfaz aire/agua tienen pigmentos carotenoides de colores más profundos en las gotitas de aceite que otras especies. [28]
Esto les ayuda a localizar bancos de peces, aunque no se sabe con certeza si están avistando el fitoplancton del que se alimentan los peces u otras aves que se alimentan. [82]
Las aves que pescan a escondidas desde arriba del agua tienen que corregir la refracción, especialmente cuando observan a los peces desde un ángulo. Las garzas de arrecife y las garcetas comunes parecen ser capaces de hacer las correcciones necesarias al capturar peces y tienen más éxito en la captura de peces cuando los ataques se realizan en un ángulo agudo y este mayor éxito puede deberse a la incapacidad de los peces para detectar a sus depredadores. [83] Otros estudios indican que las garcetas trabajan dentro de un ángulo de ataque preferido y que la probabilidad de fallar aumenta cuando el ángulo se aleja demasiado de la vertical, lo que lleva a una mayor diferencia entre la profundidad aparente y real de la presa. [84]
Las aves que persiguen a los peces bajo el agua, como los alcas y los colimbos, tienen muchas menos gotitas de aceite rojo, [4] pero tienen lentes flexibles especiales y utilizan la membrana nictitante como lente adicional. Esto permite una mayor acomodación óptica para una buena visión en el aire y el agua. [5] Los cormoranes tienen un mayor rango de acomodación visual , de 50 dioptrías , que cualquier otra ave, pero se considera que los martines pescadores tienen la mejor visión panorámica (aire y agua). [4]
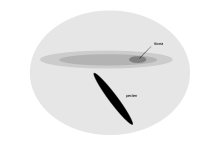
Las aves marinas de nariz tubular , que llegan a la costa solo para reproducirse y pasan la mayor parte de su vida deambulando cerca de la superficie de los océanos, tienen una zona estrecha y larga de sensibilidad visual en la retina [1]. Esta región, el área giganto cellularis , se ha encontrado en la pardela pichoneta , el petrel de Kerguelen , la pardela cenicienta , el petrel de pico ancho y el petrel buceador común . Se caracteriza por la presencia de células ganglionares que están dispuestas de forma regular y son más grandes que las que se encuentran en el resto de la retina, y morfológicamente parecen similares a las células de la retina de los gatos . La ubicación y la morfología celular de esta nueva área sugieren una función en la detección de elementos en un pequeño campo binocular que se proyecta debajo y alrededor del pico. No está relacionada principalmente con la alta resolución espacial, pero puede ayudar a detectar presas cerca de la superficie del mar cuando un ave vuela bajo sobre ella. [85]
La pardela pichoneta , como muchas otras aves marinas, visita sus colonias de cría por la noche para reducir las posibilidades de ser atacada por depredadores aéreos. Dos aspectos de su estructura óptica sugieren que el ojo de esta especie está adaptado a la visión nocturna. En los ojos de la pardela, el cristalino realiza la mayor parte de la curvatura de la luz necesaria para producir una imagen enfocada en la retina. La córnea, la cubierta exterior del ojo, es relativamente plana y, por lo tanto, de bajo poder refractivo . En un ave diurna como la paloma, ocurre lo contrario; la córnea es muy curvada y es el principal componente refractivo. La relación entre la refracción del cristalino y la de la córnea es de 1,6 para la pardela y de 0,4 para la paloma; la cifra para la pardela es consistente con la de una variedad de aves y mamíferos nocturnos. [86]
La distancia focal más corta de los ojos de la pardela le da una imagen más pequeña, pero más brillante, que la de las palomas, por lo que estas últimas tienen una visión diurna más nítida. Aunque la pardela pichoneta tiene adaptaciones para la visión nocturna, el efecto es pequeño y es probable que estas aves también utilicen el olfato y el oído para localizar sus nidos. [86]
Se solía pensar que los pingüinos tenían visión de futuro en tierra. Aunque la córnea es plana y está adaptada para nadar bajo el agua, el cristalino es muy fuerte y puede compensar la reducción del enfoque corneal cuando están fuera del agua. [77] La solución casi opuesta es la que utiliza el serreta encapuchado , que puede abultar parte del cristalino a través del iris cuando está sumergido. [77]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )