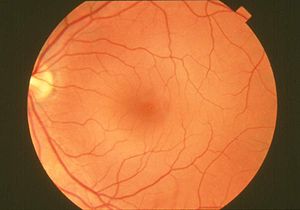
Retina
La retina de los vertebrados es un tejido sensible a la luz situado en la superficie interior del ojo.
Está formada básicamente por varias capas de neuronas interconectadas mediante sinapsis.
Las únicas células sensibles directamente a la luz son los conos y los bastones.
La retina procede de una evaginación bilateral del prosencéfalo llamada vesícula óptica primaria, que tras una invaginación local se transforma en la vesícula óptica secundaria que tiene forma de copa.
La retina puede afectarse por diferentes enfermedades que en ocasiones disminuyen considerablemente la capacidad visual.