La anilina (del portugués anil 'arbusto índigo', y -ine indica una sustancia derivada) [6] es un compuesto orgánico con la fórmula C 6 H 5 NH 2 . Consiste en un grupo fenilo ( −C 6 H 5 ) unido a un grupo amino ( −NH 2 ), la anilina es la amina aromática más simple . Es un producto químico de importancia industrial , así como un material de partida versátil para la síntesis química fina . Su principal uso es en la fabricación de precursores de poliuretano , tintes y otros productos químicos industriales. Como la mayoría de las aminas volátiles, tiene olor a pescado podrido . Se enciende fácilmente, ardiendo con una llama humeante característica de los compuestos aromáticos. [7] Es tóxico para los humanos.
En comparación con el benceno, la anilina es "rica en electrones", por lo que participa más rápidamente en reacciones de sustitución aromática electrofílica . Asimismo, también es propensa a la oxidación : si bien la anilina recién purificada es un aceite casi incoloro, la exposición al aire da como resultado un oscurecimiento gradual hasta el amarillo o el rojo, debido a la formación de impurezas oxidadas de color intenso. La anilina se puede diazotar para dar una sal de diazonio , que luego puede experimentar varias reacciones de sustitución nucleofílica.
Al igual que otras aminas, la anilina es a la vez una base (p K aH = 4,6) y un nucleófilo , aunque menos que las aminas alifáticas estructuralmente similares .
Debido a que una fuente temprana del benceno del cual se derivan fue el alquitrán de hulla , los tintes de anilina también se denominan tintes de alquitrán de hulla .

En la anilina, la longitud del enlace C−N es de 1,41 Å , [8] en comparación con la longitud del enlace C−N de 1,47 Å para la ciclohexilamina , [9] lo que indica un enlace π parcial entre C(arilo) y N. [10] La longitud del enlace químico de C( arilo )−NH2 en las anilinas es muy sensible a los efectos de los sustituyentes . La longitud del enlace C−N es de 1,34 Å en la 2,4,6-trinitroanilina frente a los 1,44 Å de la 3-metilanilina . [11]
El grupo amino en las anilinas es una molécula ligeramente piramidalizada, con hibridación del nitrógeno en algún lugar entre sp 3 y sp 2 . Se describe que el nitrógeno tiene un carácter p alto. El grupo amino en la anilina es más plano (es decir, es una "pirámide menos profunda") que el de una amina alifática, debido a la conjugación del par solitario con el sustituyente arilo . La geometría observada refleja un compromiso entre dos factores en competencia: 1) la estabilización del par solitario N en un orbital con un carácter s significativo favorece la piramidalización (los orbitales con carácter s tienen menor energía), mientras que 2) la deslocalización del par solitario N en el anillo arilo favorece la planaridad (un par solitario en un orbital p puro da la mejor superposición con los orbitales del sistema π del anillo de benceno). [12] [13]
En consonancia con estos factores, las anilinas sustituidas con grupos donadores de electrones están más piramidales, mientras que las que tienen grupos atractores de electrones son más planas. En la anilina original, el par solitario tiene aproximadamente un 12 % de carácter s, lo que corresponde a una hibridación sp 7,3 . [12] [ aclaración necesaria ] (A modo de comparación, las alquilaminas generalmente tienen pares solitarios en orbitales que están cerca de sp 3 ).
El ángulo de piramidalización entre el enlace C–N y la bisectriz del ángulo H–N–H es 142,5°. [14] A modo de comparación, en el grupo amina más fuertemente piramidal de la metilamina , este valor es ~125°, mientras que el del grupo amina de la formamida tiene un ángulo de 180°.
La producción industrial de anilina implica la hidrogenación (normalmente a 200–300 °C) en presencia de catalizadores metálicos : [15] Se producen aproximadamente 4 mil millones de kg al año. Los catalizadores incluyen níquel, cobre, paladio y platino, [7] y se siguen descubriendo catalizadores más nuevos. [16]
La reducción de nitrobenceno a anilina fue realizada por primera vez por Nikolay Zinin en 1842, utilizando sales de sulfuro ( reacción de Zinin ). La reducción de nitrobenceno a anilina también fue realizada como parte de las reducciones por Antoine Béchamp en 1854, utilizando hierro como reductor ( reducción de Bechamp ). Estas rutas estequiométricas siguen siendo útiles para las anilinas especiales. [17]
La anilina también se puede preparar a partir de amoníaco y fenol derivados del proceso del cumeno . [7]
En el comercio se distinguen tres marcas de anilina: el aceite de anilina para el azul, que es anilina pura; el aceite de anilina para el rojo, una mezcla de cantidades equimoleculares de anilina y orto- y para-toluidinas ; y el aceite de anilina para la safranina , que contiene anilina y orto- toluidina y se obtiene a partir del destilado (échappés) de la fusión de la fucsina . [18]
Se conocen muchos análogos y derivados de la anilina en los que el grupo fenilo se sustituye adicionalmente. Estos incluyen toluidinas , xilidinas , cloroanilinas , ácidos aminobenzoicos , nitroanilinas y muchos otros. También se preparan habitualmente mediante nitración de los compuestos aromáticos sustituidos seguida de reducción. Por ejemplo, este enfoque se utiliza para convertir tolueno en toluidinas y clorobenceno en 4-cloroanilina . [7] Alternativamente, utilizando el acoplamiento de Buchwald-Hartwig o los enfoques de reacción de Ullmann, los haluros de arilo se pueden aminar con amoníaco acuoso o gaseoso. [19]
La química de la anilina es muy rica porque el compuesto ha estado disponible a bajo precio durante muchos años. A continuación se presentan algunas clases de sus reacciones.
2C6H3NH2sample.jpg/440px-2,6-(iPr)2C6H3NH2sample.jpg)
La oxidación de la anilina ha sido ampliamente investigada y puede dar lugar a reacciones localizadas en el nitrógeno o, más comúnmente, a la formación de nuevos enlaces CN. En solución alcalina, se forma azobenceno , mientras que el ácido arsénico produce la materia de coloración violeta violanilina. El ácido crómico la convierte en quinona , mientras que los cloratos , en presencia de ciertas sales metálicas (especialmente de vanadio ), dan lugar al negro de anilina . El ácido clorhídrico y el clorato de potasio dan lugar al cloranil . El permanganato de potasio en solución neutra lo oxida a nitrobenceno ; en solución alcalina a azobenceno , amoníaco y ácido oxálico ; en solución ácida a negro de anilina. El ácido hipocloroso da lugar a 4-aminofenol y para-amino difenilamina . [18] La oxidación con persulfato produce una variedad de polianilinas . Estos polímeros presentan ricas propiedades redox y ácido-base.
Al igual que los fenoles , los derivados de anilina son muy susceptibles a las reacciones de sustitución electrofílica . Su alta reactividad refleja que es una enamina , lo que mejora la capacidad del anillo para donar electrones. Por ejemplo, la reacción de la anilina con ácido sulfúrico a 180 °C produce ácido sulfanílico , H 2 NC 6 H 4 SO 3 H .
Si se añade agua de bromo a la anilina, ésta se decolora y se forma un precipitado blanco de 2,4,6-tribromoanilina . Para generar el producto monosustituido se requiere una protección con cloruro de acetilo:

La reacción para formar 4-bromoanilina es proteger la amina con cloruro de acetilo y luego hidrolizarla nuevamente para reformar anilina.
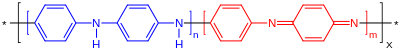
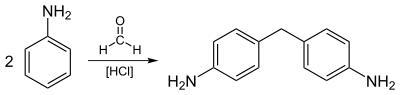
La reacción industrial a mayor escala de la anilina implica su alquilación con formaldehído . Se muestra una ecuación idealizada:
La diamina resultante es el precursor del 4,4'-MDI y diisocianatos relacionados.
La anilina es una base débil . Las aminas aromáticas como la anilina son, en general, bases mucho más débiles que las aminas alifáticas . La anilina reacciona con ácidos fuertes para formar el ion anilinio (o fenilamonio) ( C 6 H 5 −NH+3). [20]
Tradicionalmente, la basicidad débil de la anilina se atribuye a una combinación de efecto inductivo del carbono sp 2 más electronegativo y efectos de resonancia, ya que el par solitario en el nitrógeno está parcialmente deslocalizado en el sistema pi del anillo de benceno. (ver la imagen a continuación):

En este tipo de análisis no se tiene en cuenta la solvatación . Por ejemplo, la anilina es más básica que el amoníaco en fase gaseosa, pero diez mil veces menos en solución acuosa. [21]
La anilina reacciona con cloruros de acilo , como el cloruro de acetilo , para formar amidas . Las amidas formadas a partir de la anilina a veces se denominan anilidas , por ejemplo, CH 3 −C(=O) −NH −C 6 H 5 es acetanilida . A altas temperaturas, la anilina y los ácidos carboxílicos reaccionan para formar las anilidas. [22]
La N- metilación de anilina con metanol a temperaturas elevadas sobre catalizadores ácidos produce N -metilanilina y N , N -dimetilanilina :
La N -metilanilina y la N , N -dimetilanilina son líquidos incoloros con puntos de ebullición de 193-195 °C y 192 °C, respectivamente. Estos derivados son importantes en la industria del color.
Hervido con disulfuro de carbono , da sulfocarbanilida (difeniltiourea ) ( S=C(−NH−C 6 H 5 ) 2 ), que puede descomponerse en isotiocianato de fenilo ( C 6 H 5 −N=C=S ), y trifenilguanidina ( C 6 H 5 −N =C(−NH−C 6 H 5 ) 2 ). [18]
La anilina y sus derivados sustituidos en el anillo reaccionan con el ácido nitroso para formar sales de diazonio . Un ejemplo es el tetrafluoroborato de bencenodiazonio . A través de estos intermediarios, el grupo amina se puede convertir en un grupo hidroxilo ( −OH ), cianuro ( −CN ) o haluro ( −X , donde X es un halógeno ) mediante reacciones de Sandmeyer . Esta sal de diazonio también se puede hacer reaccionar con NaNO2 y fenol para producir un colorante conocido como bencenoazofenol , en un proceso llamado acoplamiento . La reacción de conversión de amina aromática primaria en sal de diazonio se llama diazotación. En esta reacción, se permite que la amina aromática primaria reaccione con nitrito de sodio y 2 moles de HCl , lo que se conoce como "mezcla helada" porque la temperatura de la reacción fue tan baja como 0,5 °C. La sal de bencenodiazonio se forma como producto principal junto con los subproductos agua y cloruro de sodio .
Reacciona con nitrobenceno para producir fenazina en la reacción de Wohl-Aue . La hidrogenación da ciclohexilamina .
Al ser un reactivo estándar en los laboratorios, la anilina se utiliza para muchas reacciones específicas. Su acetato se utiliza en la prueba del acetato de anilina para carbohidratos, identificando las pentosas por conversión a furfural . Se utiliza para teñir el ARN neuronal de azul en la tinción de Nissl . [ cita requerida ]
Además, la anilina es el componente inicial en la producción de diglicidil anilina . [23] La epiclorhidrina es el otro ingrediente principal. [23] [24]
La anilina se utiliza predominantemente para la preparación de metilendianilina y compuestos relacionados mediante condensación con formaldehído. Las diaminas se condensan con fosgeno para dar diisocianato de metileno difenilo , un precursor de los polímeros de uretano. [7]
Otros usos incluyen productos químicos para el procesamiento del caucho (9%), herbicidas (2%) y tintes y pigmentos (2%). [25] Como aditivos para el caucho, los derivados de la anilina, como las fenilendiaminas y la difenilamina , son antioxidantes. Un ejemplo de los fármacos preparados a partir de la anilina es el paracetamol (acetaminofén, Tylenol ). El principal uso de la anilina en la industria de los tintes es como precursor del índigo , el azul de los pantalones vaqueros . [7]

El aceite de anilina también se utiliza para la identificación de hongos. Kerrigan's 2016 Agaricus of North America P45: (Refiriéndose a la reacción de Schaffer) "De hecho, recomiendo cambiar a la siguiente prueba modificada. Frank (1988) desarrolló una formulación alternativa en la que el aceite de anilina se combina con ácido acético glacial (GAA, esencialmente vinagre destilado) en una solución 50:50. El GAA es un ácido mucho más seguro y menos reactivo. Este reactivo combinado único es relativamente estable en el tiempo. Un solo punto o línea aplicada al píleo (u otra superficie). En mi experiencia, la formulación más nueva funciona tan bien como la de Schaffer y, al mismo tiempo, es más segura y más conveniente". [26]
La anilina fue aislada por primera vez en 1826 por Otto Unverdorben mediante la destilación destructiva del índigo . [27] La llamó Crystallin . En 1834, Friedlieb Runge aisló una sustancia del alquitrán de hulla que se volvía de un hermoso color azul cuando se trataba con cloruro de cal . La llamó kyanol o cianol . [28] En 1840, Carl Julius Fritzsche (1808-1871) trató el índigo con potasa cáustica y obtuvo un aceite al que llamó anilina , en honor a una planta productora de índigo, el anil ( Indigofera suffruticosa ). [29] [30] En 1842, Nikolay Nikolaevich Zinin redujo el nitrobenceno y obtuvo una base que llamó benzidam . [31] En 1843, August Wilhelm von Hofmann demostró que todas eran la misma sustancia, conocida a partir de entonces como fenilamina o anilina . [32]
En 1856, mientras intentaba sintetizar quinina , el alumno de von Hofmann, William Henry Perkin, descubrió la malva . La malva se convirtió rápidamente en un colorante comercial. Le siguieron otros colorantes sintéticos , como la fucsina , la safranina y la indulina . En la época del descubrimiento de la malva, la anilina era cara. Poco después, aplicando un método descrito en 1854 por Antoine Béchamp , [33] se preparaba "por toneladas". [34] La reducción de Béchamp permitió la evolución de una enorme industria de colorantes en Alemania. Hoy, el nombre de BASF , originalmente Badische Anilin- und Soda-Fabrik (en español: Fábrica de anilina y soda de Baden ), ahora el mayor proveedor de productos químicos, se hace eco del legado de la industria de colorantes sintéticos, construida a través de colorantes de anilina y extendida a través de los colorantes azoicos relacionados . El primer colorante azoico fue el amarillo de anilina . [35]
A finales del siglo XIX, los derivados de la anilina, como la acetanilida y la fenacetina, surgieron como fármacos analgésicos , cuyos efectos secundarios supresores del corazón a menudo se contrarrestaban con cafeína . [36] Durante la primera década del siglo XX, mientras intentaba modificar los tintes sintéticos para tratar la enfermedad del sueño africana , Paul Ehrlich , que había acuñado el término quimioterapia para su enfoque de bala mágica para la medicina, fracasó y cambió a modificar el atoxil de Béchamp , el primer fármaco arsenical orgánico , y obtuvo por casualidad un tratamiento para la sífilis , el salvarsan , el primer agente de quimioterapia exitoso. El microorganismo objetivo del salvarsan , aún no reconocido como bacteria, todavía se pensaba que era un parásito, y los bacteriólogos médicos, creyendo que las bacterias no eran susceptibles al enfoque quimioterapéutico, pasaron por alto el informe de Alexander Fleming en 1928 sobre los efectos de la penicilina . [37]
En 1932, Bayer buscó aplicaciones médicas para sus colorantes. Gerhard Domagk identificó como antibacteriano un colorante azoico rojo, introducido en 1935 como el primer fármaco antibacteriano, el prontosil , que pronto se descubrió en el Instituto Pasteur como un profármaco degradado in vivo en sulfanilamida , un intermedio incoloro para muchos colorantes azoicos altamente resistentes al color , ya con una patente vencida, sintetizado en 1908 en Viena por el investigador Paul Gelmo para su investigación doctoral. [37] En la década de 1940, se produjeron más de 500 fármacos sulfamidas relacionados. [37] Medicamentos de gran demanda durante la Segunda Guerra Mundial (1939-45), estos primeros fármacos milagrosos , quimioterapia de amplia eficacia, impulsaron la industria farmacéutica estadounidense. [38] En 1939, en la Universidad de Oxford , buscando una alternativa a las sulfamidas, Howard Florey desarrolló la penicilina de Fleming hasta convertirla en el primer antibiótico sistémico , la penicilina G. ( La gramicidina , desarrollada por René Dubos en el Instituto Rockefeller en 1939, fue el primer antibiótico, pero su toxicidad la restringió al uso tópico ). Después de la Segunda Guerra Mundial, Cornelius P. Rhoads introdujo el enfoque quimioterapéutico para el tratamiento del cáncer. [39]
Algunos de los primeros cohetes estadounidenses, como el Aerobee y el WAC Corporal , utilizaban una mezcla de anilina y alcohol furfurílico como combustible, con ácido nítrico como oxidante. La combinación es hipergólica y se enciende al entrar en contacto entre el combustible y el oxidante. También es densa y se puede almacenar durante períodos prolongados. La anilina fue posteriormente sustituida por hidracina . [40]
La anilina es tóxica por inhalación de vapor, ingestión o absorción percutánea. [41] [42] El IARC la clasifica en el Grupo 2A ( probablemente cancerígena para los humanos ) y se la ha vinculado específicamente con el cáncer de vejiga. [43] La anilina ha sido implicada como una posible causa de la muerte regresiva de los bosques . [44]
Existen muchos métodos para la detección de anilina. [45]
La exposición de ratas a la anilina puede provocar una respuesta tóxica para el bazo , incluida una respuesta tumorigénica . [46] Las ratas expuestas a la anilina en el agua potable mostraron un aumento significativo del daño oxidativo del ADN en el bazo, detectado como un aumento de 2,8 veces en 8-hidroxi-2'-desoxiguanosina (8-OHdG) en su ADN . [46] Aunque la vía de reparación por escisión de bases también se activó, su actividad no fue suficiente para prevenir la acumulación de 8-OHdG. La acumulación de daños oxidativos del ADN en el bazo después de la exposición a la anilina puede aumentar los eventos mutagénicos que subyacen a la tumorigénesis.
La anilina, para C 6 H 5 -NH 2 , es el único nombre para una amina primaria que se mantiene como un nombre IUPAC preferido para el cual se permite la sustitución completa en el anillo y el átomo de nitrógeno. Es un nombre mantenido de Tipo 2a; para las reglas de sustitución, consulte P-15.1.8.2. La sustitución se limita a los grupos sustituyentes citados como prefijos de acuerdo con la antigüedad de los grupos funcionales expresados explícitamente o implícitos en el nombre del compuesto original funcional. El nombre bencenamina se puede utilizar en la nomenclatura general.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )