Las plaquetas o trombocitos (del griego antiguo θρόμβος ( thrómbos ) 'coágulo' y κύτος ( kútos ) 'célula') son un componente de la sangre cuya función (junto con los factores de coagulación ) es reaccionar al sangrado por lesión de los vasos sanguíneos aglutinándose, iniciando así un coágulo sanguíneo . [1] Las plaquetas no tienen núcleo celular ; son fragmentos de citoplasma derivados de los megacariocitos [2] de la médula ósea o el pulmón, [3] que luego ingresan a la circulación. Las plaquetas se encuentran solo en mamíferos, mientras que en otros vertebrados (p. ej. , aves , anfibios ), los trombocitos circulan como células mononucleares intactas . [4] : 3
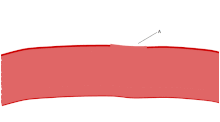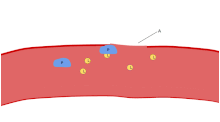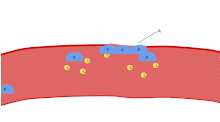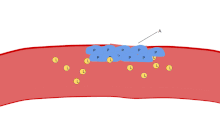
Una de las principales funciones de las plaquetas es contribuir a la hemostasia : el proceso de detener el sangrado en el sitio del endotelio interrumpido . Se reúnen en el sitio y, a menos que la interrupción sea físicamente demasiado grande, tapan el orificio. Primero, las plaquetas se adhieren a sustancias fuera del endotelio interrumpido: adhesión . Segundo, cambian de forma, activan receptores y secretan mensajeros químicos : activación . Tercero, se conectan entre sí a través de puentes receptores: agregación . [5] La formación de este tapón plaquetario (hemostasia primaria) está asociada con la activación de la cascada de coagulación , con la deposición y unión de fibrina resultante (hemostasia secundaria). Estos procesos pueden superponerse: el espectro va desde un tapón predominantemente plaquetario, o "coágulo blanco", hasta un coágulo predominantemente de fibrina, o "coágulo rojo" o la mezcla más típica. Berridge agrega la retracción y la inhibición plaquetaria como cuarto y quinto pasos, [6] mientras que otros agregarían un sexto paso, la reparación de la herida . [ cita requerida ] Las plaquetas participan en las respuestas inmunes intravasculares tanto innatas [7] como adaptativas [8] .
Además de facilitar el proceso de coagulación, las plaquetas contienen citocinas y factores de crecimiento que pueden promover la cicatrización de heridas y la regeneración de tejidos dañados. [9] [10]
El término trombocito (célula del coágulo) comenzó a usarse a principios de la década de 1900 y a veces se usa como sinónimo de plaqueta; pero no generalmente en la literatura científica, excepto como una palabra raíz para otros términos relacionados con las plaquetas (por ejemplo, trombocitopenia que significa plaquetas bajas). [4] : v3 El término trombocitos es apropiado para las células mononucleares que se encuentran en la sangre de vertebrados no mamíferos: son el equivalente funcional de las plaquetas, pero circulan como células intactas en lugar de fragmentos citoplasmáticos de megacariocitos de médula ósea. [4] : 3
En algunos contextos, la palabra trombo se utiliza indistintamente con la palabra coágulo , independientemente de su composición (blanca, roja o mixta). En otros contextos se utiliza para contrastar un coágulo normal de uno anormal: el trombo surge de la hemostasia fisiológica, la trombosis surge de una cantidad patológica y excesiva de coágulo. [11] En un tercer contexto se utiliza para contrastar el resultado del proceso: el trombo es el resultado, la trombosis es el proceso.
Estructuralmente la plaqueta se puede dividir en cuatro zonas, desde la periférica a la más interna: [ cita requerida ]
Las plaquetas inactivadas circulantes son estructuras discoides biconvexas (en forma de lente), [12] [4] : 117–118 2–3 μm en el diámetro máximo. [13] Las plaquetas activadas tienen proyecciones de membrana celular que cubren su superficie.
En una primera aproximación, la forma puede considerarse similar a los esferoides oblatos , con una relación de semieje de 2 a 8. [14] Esta aproximación se puede utilizar para modelar las propiedades hidrodinámicas y ópticas de una población, así como para restaurar los parámetros geométricos de plaquetas individuales medidas por citometría de flujo . [15] Los modelos biofísicos más precisos de la morfología de la superficie de las plaquetas que modelan su forma a partir de los primeros principios, permiten obtener una geometría de plaquetas más realista en un estado tranquilo y activado. [16]
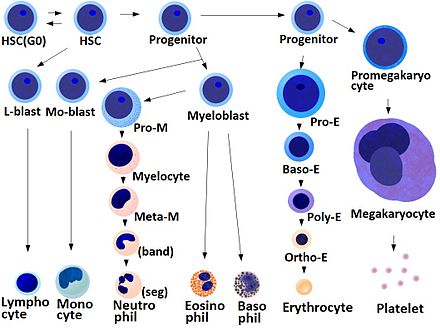
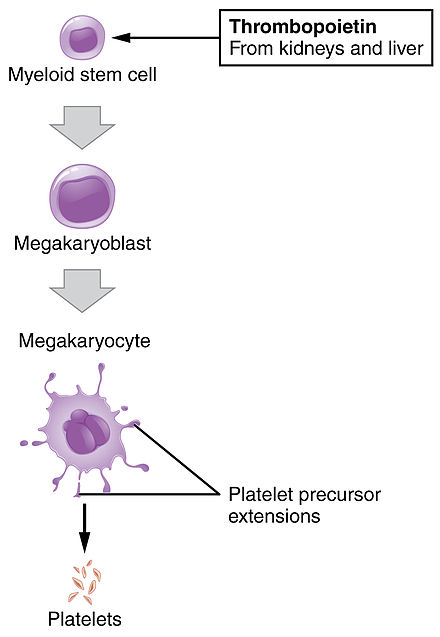

La función fundamental de las plaquetas es agruparse para detener una hemorragia aguda. Este proceso es complejo, ya que en la dinámica plaquetaria intervienen más de 193 proteínas y 301 interacciones. [5] A pesar de la gran superposición, la función plaquetaria se puede modelar en tres pasos:
La formación de trombos en un endotelio intacto se previene mediante óxido nítrico , [19] prostaciclina , [20] y CD39 . [21]
Las células endoteliales se adhieren al colágeno subendotelial mediante el factor de von Willebrand (VWF), que estas células producen. El VWF también se almacena en los cuerpos de Weibel-Palade de las células endoteliales y se secreta de forma constitutiva en la sangre. Las plaquetas almacenan el VWF en sus gránulos alfa.
Cuando se rompe la capa endotelial, el colágeno y el VWF anclan las plaquetas al subendotelio. El receptor plaquetario GP1b-IX-V se une al VWF; y el receptor GPVI y la integrina α2β1 se unen al colágeno. [22]

El revestimiento endotelial intacto inhibe la activación plaquetaria mediante la producción de óxido nítrico , ADPasa endotelial y PGI 2 (prostaciclina). La ADPasa endotelial degrada el activador plaquetario ADP . [ cita requerida ]
Las plaquetas en reposo mantienen un eflujo de calcio activo a través de una bomba de calcio activada por AMP cíclico . La concentración intracelular de calcio determina el estado de activación plaquetaria, ya que es el segundo mensajero que impulsa el cambio conformacional y la desgranulación plaquetaria. La prostaciclina endotelial se une a los receptores de prostanoides en la superficie de las plaquetas en reposo. Este evento estimula la proteína Gs acoplada para aumentar la actividad de la adenilato ciclasa y aumenta la producción de AMPc, lo que promueve aún más el eflujo de calcio y reduce la disponibilidad intracelular de calcio para la activación plaquetaria. [ cita requerida ]
Por otra parte, el ADP se une a los receptores purinérgicos en la superficie de las plaquetas. Dado que el receptor purinérgico trombocítico P2Y12 está acoplado a las proteínas Gi , el ADP reduce la actividad de la adenilato ciclasa plaquetaria y la producción de AMPc, lo que lleva a la acumulación de calcio dentro de la plaqueta al inactivar la bomba de eflujo de calcio del AMPc. El otro receptor de ADP, P2Y1, se acopla a Gq que activa la fosfolipasa C-beta 2 ( PLCB2 ), lo que da como resultado la generación de inositol 1,4,5-trifosfato (IP3) y la liberación intracelular de más calcio. Esto en conjunto induce la activación plaquetaria. La ADPasa endotelial degrada el ADP y evita que esto suceda. El clopidogrel y los medicamentos antiplaquetarios relacionados también funcionan como antagonistas del receptor purinérgico P2Y12 . [ cita requerida ] Los datos sugieren que el ADP activa la vía PI3K/Akt durante una primera ola de agregación, lo que conduce a la generación de trombina y la activación de PAR-1 , que evoca una segunda ola de agregación. [23]
La activación plaquetaria comienza segundos después de que se produce la adhesión. Se desencadena cuando el colágeno del subendotelio se une a sus receptores ( receptor GPVI e integrina α2β1) en la plaqueta. El GPVI está asociado con la cadena gamma del receptor Fc y conduce, a través de la activación de una cascada de tirosina quinasas, a la activación de PLC-gamma2 ( PLCG2 ) y a una mayor liberación de calcio. [ cita requerida ]
El factor tisular también se une al factor VII en la sangre, lo que inicia la cascada de coagulación extrínseca para aumentar la producción de trombina . La trombina es un potente activador plaquetario, que actúa a través de Gq y G12. Estos son receptores acoplados a la proteína G y activan las vías de señalización mediadas por calcio dentro de la plaqueta, superando el eflujo de calcio basal. Las familias de tres proteínas G (Gq, Gi, G12) operan juntas para la activación completa. La trombina también promueve el refuerzo secundario de fibrina del tapón plaquetario. La activación plaquetaria a su vez desgranula y libera el factor V y el fibrinógeno , lo que potencia la cascada de coagulación. El taponamiento plaquetario y la coagulación ocurren simultáneamente, y cada uno induce al otro a formar el trombo final reticulado con fibrina. [ cita requerida ]
La señalización de GPVI mediada por colágeno aumenta la producción plaquetaria de tromboxano A2 (TXA2) y disminuye la producción de prostaciclina . Esto ocurre al alterar el flujo metabólico de la vía de síntesis de eicosanoides de las plaquetas , que involucra las enzimas fosfolipasa A2 , ciclooxigenasa 1 y tromboxano-A sintasa . Las plaquetas secretan tromboxano A2, que actúa sobre los propios receptores de tromboxano de la plaqueta en la superficie de la plaqueta (de ahí el llamado mecanismo "out-in"), y los de otras plaquetas. Estos receptores desencadenan la señalización intraplaquetaria, que convierte los receptores GPIIb/IIIa a su forma activa para iniciar la agregación . [5]

Las plaquetas contienen gránulos densos , gránulos lambda y gránulos alfa . Las plaquetas activadas secretan el contenido de estos gránulos a través de sus sistemas canaliculares hacia el exterior. Las plaquetas unidas y activadas se desgranulan para liberar agentes quimiotácticos plaquetarios que atraen más plaquetas al sitio de la lesión endotelial. Características de los gránulos:
Como se muestra mediante citometría de flujo y microscopía electrónica , el signo más sensible de activación, cuando se expone a plaquetas usando ADP, son los cambios morfológicos. [24] La hiperpolarización mitocondrial es un evento clave en el inicio de los cambios morfológicos. [25] La concentración de calcio intraplaquetario aumenta, estimulando la interacción entre el complejo microtúbulo/filamento de actina. Los cambios continuos en la forma de la plaqueta inactivada a la completamente activada se ven mejor a través de la microscopía electrónica de barrido . Los tres pasos a lo largo de este camino se denominan dendrítico temprano , propagación temprana y propagación . La superficie de la plaqueta inactivada se parece a la superficie del cerebro: una apariencia arrugada de numerosos pliegues superficiales que aumentan el área de superficie; dendrítico temprano , un pulpo con múltiples brazos y piernas; propagación temprana , un huevo frito crudo en una sartén, la "yema" es el cuerpo central; y la propagación , un huevo frito cocido con un cuerpo central más denso.
Todos estos cambios se producen por la interacción del complejo microtúbulo/actina con la membrana celular plaquetaria y el sistema canalicular abierto (SAC), que es una extensión e invaginación de esa membrana. Este complejo corre justo debajo de estas membranas y es el motor químico que saca el SAC invaginado del interior de la plaqueta, como si se dieran vuelta los bolsillos de los pantalones, creando las dendritas. Este proceso es similar al mecanismo de contracción en una célula muscular . [26] De este modo, todo el SAC se vuelve indistinguible de la membrana plaquetaria inicial a medida que forma el "huevo frito". Este aumento espectacular de la superficie se produce sin estirar ni añadir fosfolípidos a la membrana plaquetaria. [27]
La activación de las plaquetas hace que su superficie de membrana se cargue negativamente. Una de las vías de señalización activa la scramblasa , que mueve los fosfolípidos cargados negativamente desde la superficie de la membrana plaquetaria interna a la externa. Estos fosfolípidos se unen a los complejos de tenasa y protrombinasa , dos de los sitios de interacción entre las plaquetas y la cascada de coagulación. Los iones de calcio son esenciales para la unión de estos factores de coagulación.
Además de interactuar con vWF y fibrina, las plaquetas interactúan con trombina, factores X, Va, VIIa, XI, IX y protrombina para completar la formación a través de la cascada de coagulación. [28] [29] Las plaquetas humanas no expresan factor tisular . [28] Las plaquetas de rata expresan proteína de factor tisular y transportan tanto pre-ARNm de factor tisular como ARNm maduro. [30]

La agregación plaquetaria comienza minutos después de la activación y se produce como resultado de la activación del receptor GPIIb/IIIa , lo que permite que estos receptores se unan con vWF o fibrinógeno . [5] Cada plaqueta tiene alrededor de 60.000 de estos receptores. [31] Cuando uno o más de al menos nueve receptores diferentes de la superficie de las plaquetas se activan durante la activación, las vías de señalización intraplaquetaria hacen que los receptores GpIIb/IIIa existentes cambien de forma (de curvados a rectos) y, por lo tanto, se vuelvan capaces de unirse. [5]
Dado que el fibrinógeno es una proteína con forma de varilla y nódulos en cada extremo capaces de unirse a GPIIb/IIIa, las plaquetas activadas con GPIIb/IIIa expuesta pueden unirse al fibrinógeno para formar agregados. El GPIIb/IIIa también puede anclar aún más las plaquetas al vWF subendotelial para lograr una estabilización estructural adicional.
Clásicamente se pensaba que este era el único mecanismo involucrado en la agregación, pero se han identificado otros tres mecanismos que pueden iniciar la agregación, dependiendo de la velocidad del flujo sanguíneo (es decir, rango de cizallamiento). [32]
Las plaquetas tienen un papel central en la inmunidad innata , iniciando y participando en múltiples procesos inflamatorios, uniéndose directamente e incluso destruyendo patógenos. Los datos clínicos muestran que muchos pacientes con infecciones bacterianas o virales graves tienen trombocitopenia , lo que reduce su contribución a la inflamación. Los agregados plaquetario-leucocíticos (PLA) que se encuentran en la circulación son típicos en la sepsis o la enfermedad inflamatoria intestinal , lo que muestra la conexión entre los trombocitos y las células inmunes. [33]
La membrana de las plaquetas tiene receptores para el colágeno. Tras la rotura de la pared de los vasos sanguíneos, las plaquetas quedan expuestas y se adhieren al colágeno del tejido circundante.
Como la hemostasia es una función básica de los trombocitos en los mamíferos, también tiene sus usos en el posible confinamiento de infecciones. [7] En caso de lesión, las plaquetas, junto con la cascada de coagulación, proporcionan la primera línea de defensa formando un coágulo sanguíneo. La hemostasia y la defensa del huésped se entrelazaron así en la evolución. Por ejemplo, en el cangrejo herradura del Atlántico (que se estima que tiene más de 400 millones de años), el único tipo de célula sanguínea, el amebocito , facilita tanto la función hemostática como la encapsulación y fagocitosis de patógenos mediante la exocitosis de gránulos intracelulares que contienen moléculas de defensa bactericidas . La coagulación sanguínea apoya la función inmunológica atrapando las bacterias. [34]
Aunque la trombosis, la coagulación de la sangre en vasos sanguíneos intactos, generalmente se considera una respuesta inmunitaria patológica que conduce a la obturación del lumen del vaso sanguíneo y al posterior daño tisular hipóxico, en algunos casos, la trombosis dirigida, llamada inmunotrombosis, puede controlar localmente la propagación de una infección. La trombosis se dirige en concordancia con las plaquetas, los neutrófilos y los monocitos . El proceso lo inician las células inmunitarias al activar sus receptores de reconocimiento de patrones (PRR) o mediante la unión plaqueta-bacteriana. Las plaquetas pueden unirse a las bacterias directamente a través de los PRR trombocíticos [33] y las proteínas de superficie bacterianas, o mediante proteínas plasmáticas que se unen tanto a las plaquetas como a las bacterias. [35] Los monocitos responden a los patrones moleculares asociados a patógenos bacterianos (PAMP) o patrones moleculares asociados a daños (DAMP) activando la vía extrínseca de la coagulación. Los neutrófilos facilitan la coagulación sanguínea mediante NETosis , mientras que las plaquetas facilitan la NETosis de los neutrófilos. Los NET se unen al factor tisular, uniendo los centros de coagulación al lugar de la infección. También activan la vía intrínseca de la coagulación al proporcionar su superficie cargada negativamente al factor XII. Otras secreciones de neutrófilos, como las enzimas proteolíticas que escinden los inhibidores de la coagulación, también refuerzan el proceso. [7]
En caso de desequilibrio en la regulación de la inmunotrombosis, este proceso puede volverse aberrante. Se sospecha que los defectos de regulación en la inmunotrombosis son un factor importante en la trombosis patológica en formas como la coagulación intravascular diseminada (CID) o la trombosis venosa profunda . La CID en la sepsis es un excelente ejemplo tanto del proceso de coagulación desregulado como de una respuesta inflamatoria sistémica indebida, que da lugar a una multitud de microtrombos de composición similar a la de la inmunotrombosis fisiológica: fibrina, plaquetas, neutrófilos y NET. [7]
Las plaquetas se despliegan rápidamente en sitios de lesión o infección y potencialmente modulan los procesos inflamatorios al interactuar con los leucocitos y secretar citocinas , quimiocinas y otros mediadores inflamatorios. [36] [37] [38] [39] [40] Las plaquetas también secretan el factor de crecimiento derivado de plaquetas (PDGF).
Las plaquetas modulan los neutrófilos mediante la formación de agregados plaquetario-leucocíticos (PLA). Estas formaciones inducen una mayor producción de la integrina αmβ2 ( Mac-1 ) en los neutrófilos. La interacción con los PLA también induce la desgranulación y el aumento de la fagocitosis en los neutrófilos.
Las plaquetas son la mayor fuente de CD40L soluble que induce la producción de especies reactivas de oxígeno (ROS) y regula positivamente la expresión de moléculas de adhesión, como E-selectina , ICAM-1 y VCAM-1 , en los neutrófilos, activa los macrófagos y activa la respuesta citotóxica en los linfocitos T y B. [33]
Las plaquetas de los mamíferos que carecen de núcleo pueden realizar una locomoción autónoma. [41] Las plaquetas son carroñeras activas, que escalan las paredes de los vasos sanguíneos y reorganizan el trombo. Son capaces de reconocer y adherirse a muchas superficies, incluidas las bacterias, y pueden envolverlas en su sistema canalicular abierto (OCP), lo que llevó a una propuesta de denominar al proceso como cobertizosis (OCS) en lugar de fagocitosis, ya que el OCS es simplemente una invaginación de la membrana plasmática externa. Estos haces plaquetas-bacterias proporcionan una plataforma de interacción para los neutrófilos que destruyen las bacterias mediante la NETosis y la fagocitosis.
Las plaquetas también participan en enfermedades inflamatorias crónicas, como la sinovitis o la artritis reumatoide . [42] Las plaquetas son activadas por la glucoproteína IV del receptor de colágeno (GPVI). Las microvesículas plaquetarias proinflamatorias desencadenan la secreción constante de citocinas de los sinoviocitos vecinos similares a fibroblastos , principalmente Il-6 e Il-8 . El daño inflamatorio a la matriz extracelular circundante revela continuamente más colágeno, lo que mantiene la producción de microvesículas.
Las plaquetas activadas pueden participar en la inmunidad adaptativa , interactuando con los anticuerpos . Son capaces de unirse específicamente a la IgG a través de FcγRIIA , un receptor para el fragmento constante de la IgG (Fc). Cuando se activan y se unen a las bacterias opsonizadas por IgG , las plaquetas liberan especies reactivas de oxígeno (ROS), péptidos antimicrobianos, defensinas , quinocidinas y proteasas , matando a las bacterias directamente. [43] Las plaquetas también secretan mediadores proinflamatorios y procoagulantes como los polifosfatos inorgánicos o el factor plaquetario 4 (PF4), que conectan las respuestas inmunes innatas y adaptativas. [43] [44]
Los trastornos plaquetarios pueden provocar hemorragias espontáneas y excesivas. Estas hemorragias pueden ser causadas por una cantidad deficiente de plaquetas, por plaquetas disfuncionales o por una densidad plaquetaria superior a 1 millón/microlitro. (Las cantidades excesivas crean una deficiencia relativa del factor de von Willebrand debido al secuestro). [45] [46]
El sangrado debido a un trastorno plaquetario o un trastorno del factor de coagulación se puede distinguir por las características y la ubicación del sangrado. [4] : 815, Tabla 39-4 El sangrado plaquetario implica sangrado de un corte que es rápido y excesivo, pero se puede controlar con presión; sangrado espontáneo en la piel que causa una mancha violácea denominada por su tamaño: petequias , púrpura , equimosis ; sangrado en las membranas mucosas que causa sangrado de encías, sangrado nasal y sangrado gastrointestinal; menorragia; y sangrado intrarretiniano e intracraneal.
La cantidad excesiva de plaquetas o la respuesta de plaquetas normales a paredes vasculares anormales puede provocar trombosis venosa y trombosis arterial . Los síntomas dependen del lugar de la trombosis.
La concentración de plaquetas en la sangre (es decir, el recuento de plaquetas) se puede medir manualmente utilizando un hemocitómetro o colocando sangre en un analizador de plaquetas automatizado utilizando el recuento de partículas, como un contador Coulter o métodos ópticos. [47] Los métodos de análisis de sangre más comunes incluyen el recuento de plaquetas en sus mediciones, generalmente informado como PLT . [48]
Las concentraciones de plaquetas varían entre individuos y a lo largo del tiempo, con un promedio poblacional entre 250.000 y 260.000 células por mm 3 (equivalente a por microlitro), pero el rango normal típico aceptado por el laboratorio es entre 150.000 y 400.000 células por mm 3 o 150–400 × 10 9 por litro. [48] [47]

En un frotis de sangre teñido , las plaquetas aparecen como manchas de color púrpura oscuro, de aproximadamente el 20 % del diámetro de los glóbulos rojos. El frotis revela el tamaño, la forma, el número cualitativo y la aglutinación . Un adulto sano normalmente tiene entre 10 y 20 veces más glóbulos rojos que plaquetas.
El tiempo de sangrado fue desarrollado como una prueba de la función plaquetaria por Duke en 1910. [49] La prueba de Duke midió el tiempo que tardaba en detenerse el sangrado de una herida estandarizada en el lóbulo de la oreja que se secaba cada 30 segundos, considerando menos de 3 minutos como normal. [50] El tiempo de sangrado tiene baja sensibilidad y especificidad para los trastornos plaquetarios leves a moderados y ya no se recomienda para la detección. [51]
En la agregometría con electrodos múltiples , se mezcla sangre completa anticoagulada con solución salina y un agonista plaquetario en una cubeta de un solo uso con dos pares de electrodos. El aumento de la impedancia entre los electrodos a medida que las plaquetas se agregan sobre ellos se mide y se visualiza como una curva. [52] [53]
En la agregometría por transmisión de luz (LTA), el plasma rico en plaquetas se coloca entre una fuente de luz y una fotocélula . El plasma no agregado permite que pase relativamente poca luz. Después de agregar un agonista, las plaquetas se agregan, lo que aumenta la transmisión de luz, que es detectada por una fotocélula. [56]
La agregometría por impedancia de sangre total (WBA) mide el cambio en la impedancia eléctrica entre dos electrodos cuando un agonista induce la agregación plaquetaria. La lumiagregometría de sangre total puede aumentar la sensibilidad de la prueba para detectar alteraciones en la secreción de gránulos plaquetarios. [57]
El PFA-100 (Platelet Function Assay — 100) es un sistema para analizar la función plaquetaria en el que se aspira sangre entera citratada a través de un cartucho desechable que contiene una abertura dentro de una membrana recubierta de colágeno y epinefrina o colágeno y ADP. Estos agonistas inducen la adhesión, activación y agregación plaquetaria, lo que lleva a una rápida oclusión de la abertura y al cese del flujo sanguíneo denominado tiempo de cierre (CT). Un CT elevado con EPI y colágeno puede indicar defectos intrínsecos como la enfermedad de von Willebrand , uremia o inhibidores plaquetarios circulantes. Se utiliza una prueba de seguimiento que involucra colágeno y ADP para indicar si el CT anormal con colágeno y EPI fue causado por los efectos del ácido acetil sulfosalicílico (aspirina) o medicamentos que contienen inhibidores. [58] El PFA-100 es altamente sensible a la enfermedad de von Willebrand, pero solo es moderadamente sensible a los defectos en la función plaquetaria. [59]
La concentración baja de plaquetas se denomina trombocitopenia y se debe a una menor producción o a una mayor destrucción. La concentración elevada de plaquetas se denomina trombocitosis y puede ser congénita , reactiva (a las citocinas ) o deberse a una producción no regulada: una de las neoplasias mieloproliferativas o ciertas otras neoplasias mieloides . Un trastorno de la función plaquetaria se denomina trombocitopatía o trastorno de la función plaquetaria. [4] : vii
Las plaquetas normales pueden responder a una anomalía en la pared del vaso en lugar de a una hemorragia, lo que da lugar a una adhesión/activación plaquetaria inadecuada y a una trombosis : la formación de un coágulo dentro de un vaso intacto. Este tipo de trombosis surge por mecanismos diferentes a los de un coágulo normal: extensión de la fibrina de la trombosis venosa ; extensión de una placa arterial inestable o rota, lo que causa trombosis arterial ; y trombosis microcirculatoria. Un trombo arterial puede obstruir parcialmente el flujo sanguíneo, lo que causa isquemia posterior , o puede obstruirlo por completo, lo que causa muerte tisular posterior .: [4] : vii
Las tres grandes categorías de trastornos plaquetarios son "insuficiente", "disfuncional" y "demasiado". [4] : vii
Algunos fármacos utilizados para tratar la inflamación tienen el efecto secundario no deseado de suprimir la función plaquetaria normal. Estos son los fármacos antiinflamatorios no esteroideos (AINE). La aspirina altera irreversiblemente la función plaquetaria al inhibir la ciclooxigenasa -1 (COX1) y, por lo tanto, la hemostasia normal. Las plaquetas resultantes son incapaces de producir nueva ciclooxigenasa porque no tienen ADN. La función plaquetaria normal no se recupera hasta que se ha cesado el uso de aspirina y se han reemplazado suficientes plaquetas afectadas por otras nuevas, lo que puede llevar más de una semana. El ibuprofeno , otro AINE , no tiene un efecto de tan larga duración, ya que la función plaquetaria suele recuperarse en 24 horas [66] , y tomar ibuprofeno antes de la aspirina previene los efectos irreversibles de la aspirina [67] .
Estos medicamentos se utilizan para prevenir la formación de trombos.
La transfusión de plaquetas se utiliza con mayor frecuencia para corregir recuentos plaquetarios inusualmente bajos, ya sea para prevenir sangrado espontáneo (normalmente en recuentos inferiores a 10×10 9 /L) o en previsión de procedimientos médicos que necesariamente implican algún sangrado. Por ejemplo, en pacientes sometidos a cirugía , un nivel inferior a 50×10 9 /L se asocia con sangrado quirúrgico anormal, y los procedimientos anestésicos regionales como las epidurales se evitan para niveles inferiores a 80×10 9 /L. [68] Las plaquetas también pueden transfundirse cuando el recuento plaquetario es normal pero las plaquetas son disfuncionales, como cuando una persona está tomando aspirina o clopidogrel . [69] Finalmente, las plaquetas pueden transfundirse como parte de un protocolo de transfusión masiva , en el que los tres componentes sanguíneos principales (glóbulos rojos, plasma y plaquetas) se transfunden para abordar una hemorragia grave . La transfusión de plaquetas está contraindicada en la púrpura trombocitopénica trombótica (PTT), ya que alimenta la coagulopatía . La transfusión de plaquetas generalmente es ineficaz y, por lo tanto, está contraindicada para la profilaxis de la trombocitopenia inmunitaria (PTI), porque las plaquetas transfundidas se eliminan inmediatamente; sin embargo, está indicada para tratar el sangrado. [70]

Las plaquetas se aíslan de unidades de sangre total recolectadas y se agrupan para preparar una dosis terapéutica, o se recolectan mediante aféresis plaquetaria : se extrae sangre del donante, se pasa a través de un dispositivo que elimina las plaquetas y el resto se devuelve al donante en un circuito cerrado. La norma de la industria es que las plaquetas se analicen para detectar bacterias antes de la transfusión para evitar reacciones sépticas, que pueden ser fatales. Recientemente, las Normas de la industria de la AABB para bancos de sangre y servicios de transfusión (5.1.5.1) han permitido el uso de tecnología de reducción de patógenos como alternativa a las pruebas bacterianas en las plaquetas. [71]
Las plaquetas de sangre entera agrupadas, a veces llamadas plaquetas "al azar", se separan mediante uno de dos métodos. [72] En los EE. UU., se coloca una unidad de sangre entera en una gran centrífuga en lo que se conoce como "centrifugación suave". En estas configuraciones, las plaquetas permanecen suspendidas en el plasma. El plasma rico en plaquetas (PRP) se extrae de los glóbulos rojos y luego se centrifuga a una velocidad mayor para extraer las plaquetas del plasma. En otras regiones del mundo, la unidad de sangre entera se centrifuga utilizando configuraciones que hacen que las plaquetas queden suspendidas en la capa de " capa leucocítica ", que incluye las plaquetas y los glóbulos blancos. La "capa leucocítica" se aísla en una bolsa estéril, se suspende en una pequeña cantidad de glóbulos rojos y plasma y luego se centrifuga nuevamente para separar las plaquetas y el plasma de los glóbulos rojos y blancos. Independientemente del método inicial de preparación, se pueden combinar múltiples donaciones en un recipiente utilizando un dispositivo de conexión estéril para fabricar un solo producto con la dosis terapéutica deseada.
Las plaquetas de aféresis se recolectan utilizando un dispositivo mecánico que extrae sangre del donante y centrifuga la sangre recolectada para separar las plaquetas y otros componentes que se deben recolectar. La sangre restante se devuelve al donante. La ventaja de este método es que una sola donación proporciona al menos una dosis terapéutica, a diferencia de las donaciones múltiples para las plaquetas de sangre completa. Esto significa que un receptor está expuesto a menos donantes y tiene menos riesgo de enfermedades transmitidas por transfusión y otras complicaciones. A veces, una persona, como un paciente con cáncer que requiere transfusiones rutinarias de plaquetas, recibe donaciones repetidas de un donante específico para minimizar el riesgo. La reducción de patógenos de plaquetas utilizando, por ejemplo, tratamientos con riboflavina y luz ultravioleta puede reducir la carga infecciosa de patógenos contenidos en los productos sanguíneos donados. [73] [74] Se ha desarrollado otro proceso de tratamiento fotoquímico que utiliza amotosaleno y luz UVA para la inactivación de virus, bacterias, parásitos y leucocitos. [75] Además, las plaquetas de aféresis tienden a contener menos glóbulos rojos contaminantes porque el método de recolección es más eficiente que la centrifugación de "centrifugado suave".
Las plaquetas recolectadas por cualquiera de los dos métodos tienen una vida útil típica de cinco días. Esto genera escasez de suministros, ya que las pruebas de las donaciones suelen requerir hasta un día completo. No se han ideado soluciones conservantes eficaces para las plaquetas.
Las plaquetas se almacenan en agitación constante a 20–24 °C (68–75 °F). Las unidades no se pueden refrigerar, ya que esto hace que las plaquetas cambien de forma y pierdan su función. El almacenamiento a temperatura ambiente proporciona un entorno en el que cualquier bacteria introducida puede proliferar y posteriormente causar bacteriemia . Estados Unidos exige que los productos se analicen para detectar la presencia de contaminación bacteriana antes de la transfusión. [76]

Las plaquetas no necesitan pertenecer al mismo grupo sanguíneo ABO que el receptor ni ser compatibles para asegurar la compatibilidad inmunológica entre el donante y el receptor, a menos que contengan una cantidad significativa de glóbulos rojos. La presencia de glóbulos rojos le da un color naranja rojizo al producto y generalmente se asocia con plaquetas de sangre completa. Algunos sitios pueden tipificar plaquetas, pero esto no es crítico.
Antes de entregar las plaquetas al receptor, se las puede irradiar para prevenir la enfermedad de injerto contra huésped asociada a la transfusión o se las puede lavar para eliminar el plasma.
El cambio en el recuento de plaquetas del receptor después de la transfusión se denomina "incremento" y se calcula restando el recuento de plaquetas anterior a la transfusión del recuento posterior a la transfusión. Muchos factores afectan el incremento, incluidos el tamaño corporal, la cantidad de plaquetas transfundidas y las características clínicas que pueden causar la destrucción prematura de las plaquetas transfundidas. Cuando los receptores no demuestran un incremento adecuado posterior a la transfusión, esto se denomina refractariedad a la transfusión de plaquetas .
Las plaquetas, ya sean obtenidas por aféresis o de donantes aleatorios, pueden procesarse mediante un proceso de reducción de volumen. En este proceso, las plaquetas se centrifugan y se elimina el plasma, dejando entre 10 y 100 ml de concentrado de plaquetas. Estas plaquetas de volumen reducido normalmente se transfunden solo a pacientes neonatales y pediátricos cuando un gran volumen de plasma podría sobrecargar el pequeño sistema circulatorio del niño. El menor volumen de plasma también reduce las posibilidades de una reacción adversa a la transfusión de proteínas plasmáticas. [77] Las plaquetas de volumen reducido tienen una vida útil de cuatro horas. [78]
El coágulo sanguíneo es sólo una solución temporal para detener el sangrado; es necesaria la reparación del tejido. Las pequeñas interrupciones en el endotelio se manejan mediante mecanismos fisiológicos; las interrupciones grandes, por un cirujano traumatólogo. [79] La fibrina se disuelve lentamente por la enzima fibrinolítica, plasmina , y las plaquetas se eliminan por fagocitosis . [80]
Las plaquetas liberan el factor de crecimiento derivado de plaquetas (PDGF), un potente agente quimiotáctico ; y TGF beta , que estimula la deposición de la matriz extracelular ; factor de crecimiento de fibroblastos , factor de crecimiento similar a la insulina 1 , factor de crecimiento epidérmico derivado de plaquetas y factor de crecimiento endotelial vascular . La aplicación local de estos factores en concentraciones aumentadas a través del plasma rico en plaquetas (PRP) se utiliza como complemento en la cicatrización de heridas. [81]
En lugar de plaquetas, los vertebrados no mamíferos tienen trombocitos nucleados, que se parecen a los linfocitos B en morfología. Se agregan en respuesta a la trombina, pero no al ADP, la serotonina ni la adrenalina, como lo hacen las plaquetas. [82] [83]
{{cite book}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace )