La síntesis total de Kuwajima Taxol realizada por el grupo de Isao Kuwajima del Instituto de Tecnología de Tokio es uno de varios esfuerzos en la síntesis total de taxol publicados en la década de 1990. [1] [2] La síntesis total de Taxol se considera un hito en la síntesis orgánica .
Esta síntesis es verdaderamente sintética sin la ayuda de pequeños precursores de biomoléculas y también es una síntesis lineal con una construcción de anillo molecular en el orden de A, B, C, D. En algún momento, la quiralidad queda encerrada en la molécula a través de un paso de síntesis asimétrico que es único. en comparación con los otros esfuerzos. Al igual que los otros esfuerzos, la adición de la cola se basa en la lactama Ojima .
El cuadro de 20 carbonos está construido a partir de varias piezas: alcohol propargílico (C1, C2, C14), propionaldehído (C13, C12, C18), ácido isobutírico (C15, C16, C17, C11), trimetil(feniltiometil)silano (C10), 2-bromobenzaldehído (C3 a C9), cianuro de dietilaluminio (C19) y bromuro de trimetilsililmetilo (C20)
La síntesis del anillo A ( esquema 1 ) comenzó uniendo el alcohol propargílico protegido por THP 1.1 (el fragmento C2-C1-C14) y el propionaldehído 1.2 (fragmento C13-C12-C18) en una adición nucleofílica con n -butillitio al alcohol 1.3 . Luego, el catalizador Lindlar redujo el alquino al alqueno en 1,4 y la oxidación de Swern convirtió el grupo alcohol en el grupo enona en 1,5 . Luego se añadió el fragmento C11-C15-C16-C17 1.6 como enolato de litio de éster etílico del ácido isobutírico en una adición conjugada a gamma cetoéster 1.7 . Una condensación de Claisen cerró el anillo a 1,8 y el enol intermedio es capturado por cloruro de pivaloilo (piv) como grupo protector . El grupo THP se eliminó con TsOH a 1,9 y el alcohol formado se oxidó mediante oxidación de Swern a aldehído 1,10 . El TIPS silil enol éter 1.11 se formó mediante reacción con el triflato TIPSOtf y DBU en DMAP , preparando el escenario para la dihidroxilación asimétrica al hidroxialdehído 1.12 . Luego, el grupo protector piv se reemplazó por un grupo TIPS en 1.14 después de proteger el aldehído como aminal 1.13 y como este grupo se pierde automáticamente en la cromatografía en columna , el paso se repitió hasta el aminal 1.15. Luego se introdujo el fragmento C10 mediante la sal de litio de trimetil(feniltiometil)silano 1.16 en una olefinación de Peterson hasta el sulfuro 1.17 seguido de desprotección hasta completar el anillo A 1.18 . El anillo A ahora está completo con el grupo aldehído y el grupo de sulfuro en su lugar para anclarse con el anillo C formando el anillo B.
La parte inferior del anillo B se construyó mediante adición nucleofílica al aldehído de 2.1 ( esquema 2 ) con dibencilacetal de 2-bromobenzaldehído 2.2 como arillitio . Este paso es muy común con la síntesis del anillo B en la síntesis total de Nicolaou Taxol, excepto que el grupo aldehído está ubicado en el anillo A y no en el anillo B. El diol en 2.3 se protegió como el éster borónico 2.4 preparando la molécula para la parte superior del anillo. cierre con tetracloruro de estaño al triciclo 2,5 en una reacción similar a la fragmentación de Grob .
Después de la desprotección ( pinacol ) a diol 2,6 , la reducción de DIBAL a triol 2,7 y la reprotección con TBS (TBSOtf, lutidina ) a alcohol 2,8, fue posible eliminar el grupo fenilsulfuro con un hidruro de tributilestaño y AIBN (ver Desoxigenación de Barton-McCombie ) a alcohol 2,9. . La hidrogenación de paladio sobre carbono eliminó el grupo protector bencilo permitiendo la oxidación de Swern de 2,10 a cetona 2,11.
La finalización del anillo C requirió la reducción completa del areno, la colocación de átomos de oxígeno para y, lo que es más importante, la introducción del grupo metilo C19. El primer asalto al anillo aromático en 3.1 ( esquema 3 ) se lanzó con la reducción de Birch ( potasio , amoniaco , tetrahidrofurano , -78 °C, luego etanol ) a dieno 3.2 . La desprotección ( TBAF ) a diol 3.3 , la reprotección como benzaldehído acetal 3.4 y la reducción ( borohidruro de sodio ) a alcohol 3.5 permitieron la oxidación del dieno a 1,4-butenodiol 3.6 . En esta cicloadición fotoquímica [4+2] , se generó oxígeno singlete a partir de oxígeno y rosa de bengala y el peróxido intermedio se redujo con tiourea . La siguiente orden del día fue la introducción del fragmento C19: el nuevo grupo diol se protegió como PMP acetal 3.7 (PMP significa p-metoxifenilo ), permitiendo la oxidación del alcohol C4 a cetona 3.8 con el periodinano de Dess-Martin . El cianuro de dietilaluminio reaccionó en una adición conjugada al grupo enona para formar nitrilo 3.9 . El enol se protegió como éter TBS 3.10 permitiendo la reducción del grupo nitrilo primero al aldehído con DIBAL y luego al alcohol 3.11 con hidruro de litio y aluminio . El grupo alcohol fue reemplazado por bromo en una reacción de Appel que provocó una reacción de eliminación (pérdida de HBr) a ciclopropano 3,12 . El tratamiento con ácido clorhídrico formó la cetona 3.13 , la reacción con yoduro de samario (II) dio como resultado la apertura del anillo y finalmente colocó el grupo metilo C19 en su lugar en 3.14 y la desprotección (TBAF) y la conversión de enol-cetona dieron la hidroxicetona 3.15.
Protegiendo el grupo diol en el triol 4.1 ( esquema 4 ) como éster fenilborónico 4.2 , el grupo alcohol restante podría protegerse como el éter TBS 4.3 . Después de desproteger el grupo diol ( peróxido de hidrógeno , bicarbonato de sodio ) nuevamente en 4.4 fue posible oxidar el alcohol C19 a la cetona 4.5 con periodinano de Dess-Martin . En una nueva ronda de protecciones, el alcohol C7 se convirtió en 2-metoxi-2-propil (MOP) éter 4.6 con 2-propenilmetiléter y PPTS y la cetona C7 se convirtió en su enolato 4.7 mediante reacción con KHMDS y N,N- bis(trifluorometilsulfonil)anilina . Estos preámbulos facilitaron la introducción del fragmento C20 final que faltaba como reactivo de Grignard, bromuro de trimetilsililmetilmagnesio , que se acopló con el triflato en una reacción catalizada por tetrakis(trifenilfosfina)paladio(0) para obtener el silano 4.8 . El grupo trimetilsililo se eliminó al agregar NCS al organocloruro 4.9 . Antes de cerrar el anillo D, había algunos asuntos pendientes en el anillo C. Se introdujo un alcohol C10 mediante oxidación de MoOPH a 4,10 , pero con una estereoquímica incorrecta . Después de la acetilación a 4.11 y la inversión de la configuración con la base DBN añadida, este problema se solucionó en el compuesto 4.12 . La siguiente dihidroxilación con óxido de osmio (VIII) formó el diol 4.13 con el alcohol primario al agregar la base DBU desplazando el átomo de cloro en una sustitución alifática nucleofílica del oxetano 4.14 .
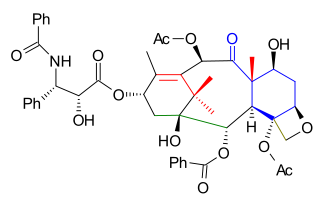
Los grupos funcionales C1, C2 y C4 se colocaron a continuación y, a partir del oxetano 5.1 ( esquema 5 ), el grupo protector MOM se elimina en 5.2 ( PPTS ) y se reemplaza por un grupo TES (TESCl) en 5.3 . El grupo acetal se eliminó en 5.4 ( hidrogenación PdOH 2 , H 2 ) y se reemplazó por un grupo éster carbonato en 5.5 ( trifosgeno , piridina ). El grupo alcohol terciario se acetiló en 5.6 y en el paso final el grupo carbonato se abrió mediante reacción con fenillitio para dar el hidroxiéster 5.7 .
Antes de la adición de la cola, el grupo protector TES se eliminó en 5.8 ( fluoruro de hidrógeno piridina ) y se reemplazó por un grupo TROC (carbonato de tricloroetilo, TROCCl) en 5.9 . El grupo protector de alcohol C13 se eliminó en 5.10 ( TASF ), lo que permitió la adición de cola de lactama Ojima 5.11 (este paso es común con todos los esfuerzos sintéticos totales hasta la fecha) a 5.12 con bis(trimetilsilil)amida de litio . La síntesis se completó con la eliminación de TROC ( cinc , ácido acético ) al taxol 5.13 .