La lactama de Ojima es un compuesto orgánico de cierta importancia en la producción comercial de Taxol . Esta lactama fue sintetizada por primera vez por Iwao Ojima . [1] La síntesis orgánica es una ilustración de la síntesis asimétrica a través de un auxiliar quiral .
La reacción se centra en una cicloadición de imina - enolato de litio . Para asegurar la estereoquímica correcta (el grupo fenilo y el éter sililo deben adoptar una configuración cis ) en la β-lactama se utiliza un auxiliar quiral en la síntesis de enolato. La síntesis de enolato comienza a partir de ácido glicólico . El grupo hidroxilo está protegido por un grupo bencilo y el ácido carboxílico se activa por reacción con cloruro de tionilo al cloruro de ácido . El cloruro de ácido reacciona con el auxiliar quiral trans-2-fenil-1-ciclohexanol . Luego se elimina el grupo bencilo y se reemplaza por un éter sililo TES por reacción con cloruro de trietilsililo. La reacción con fenil-litio produce el enolato .

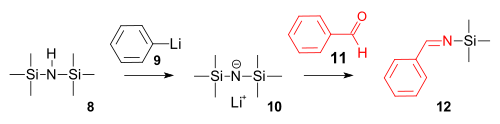
La síntesis de imina es una reacción de hexametildisilazano con fenillitio para formar una base de amida fuerte seguida de una reacción de condensación con benzaldehído .
Tanto el intermediario imina como el enol se unen en una reacción de cicloadición seguida de una sustitución intramolecular de la amina con expulsión del auxiliar quiral de la cis - lactama . El grupo trietilsililo se elimina mediante fluoruro de hidrógeno y el grupo benzoilo se añade en una reacción de Schotten-Baumann .
