Folding@home ( FAH o F@h ) es un proyecto de computación distribuida cuyo objetivo es ayudar a los científicos a desarrollar nuevas terapias para una variedad de enfermedades mediante la simulación de la dinámica de las proteínas . Esto incluye el proceso de plegamiento de proteínas y los movimientos de las proteínas , y se basa en simulaciones ejecutadas en las computadoras personales de los voluntarios . [5] Folding@home actualmente tiene su sede en la Universidad de Pensilvania y está dirigido por Greg Bowman, un ex alumno de Vijay Pande . [6]
El proyecto utiliza unidades de procesamiento gráfico (GPU), unidades centrales de procesamiento (CPU) y procesadores ARM como los de Raspberry Pi para computación distribuida e investigación científica. El proyecto utiliza una metodología de simulación estadística que supone un cambio de paradigma respecto de los métodos informáticos tradicionales. [7] Como parte de la arquitectura de red del modelo cliente-servidor , las máquinas voluntarias reciben cada una piezas de una simulación (unidades de trabajo), las completan y las devuelven a los servidores de bases de datos del proyecto , donde las unidades se compilan en una simulación general. Los voluntarios pueden realizar un seguimiento de sus contribuciones en el sitio web Folding@home, lo que hace que la participación de los voluntarios sea competitiva y fomenta la implicación a largo plazo.
Folding@home es uno de los sistemas informáticos más rápidos del mundo. Debido al gran interés que generó el proyecto como resultado de la pandemia de COVID-19 , [8] el sistema alcanzó una velocidad de aproximadamente 1,22 exaflops a fines de marzo de 2020 y alcanzó los 2,43 exaflops el 12 de abril de 2020, [9] lo que lo convirtió en el primer sistema informático de exaflops del mundo . Este nivel de rendimiento de su red informática a gran escala ha permitido a los investigadores ejecutar simulaciones a nivel atómico de plegamiento de proteínas, que requieren un gran esfuerzo computacional, miles de veces más tiempo que lo que se lograba anteriormente. Desde su lanzamiento el 1 de octubre de 2000, Folding@home participó en la producción de 226 artículos de investigación científica . [10] Los resultados de las simulaciones del proyecto concuerdan bien con los experimentos. [11] [12] [13]

Las proteínas son un componente esencial para muchas funciones biológicas y participan en prácticamente todos los procesos dentro de las células biológicas . A menudo actúan como enzimas , realizando reacciones bioquímicas que incluyen señalización celular , transporte molecular y regulación celular . Como elementos estructurales, algunas proteínas actúan como un tipo de esqueleto para las células y como anticuerpos , mientras que otras proteínas participan en el sistema inmunológico . Antes de que una proteína pueda asumir estas funciones, debe plegarse en una estructura tridimensional funcional , un proceso que a menudo ocurre de forma espontánea y depende de las interacciones dentro de su secuencia de aminoácidos y las interacciones de los aminoácidos con su entorno. El plegamiento de proteínas está impulsado por la búsqueda de la conformación energéticamente más favorable de la proteína, es decir, su estado nativo . Por lo tanto, comprender el plegamiento de proteínas es fundamental para comprender qué hace una proteína y cómo funciona, y se considera un santo grial de la biología computacional . [14] [15] A pesar de que el plegamiento ocurre dentro de un entorno celular abarrotado , normalmente se desarrolla sin problemas. Sin embargo, debido a las propiedades químicas de una proteína u otros factores, las proteínas pueden plegarse incorrectamente , es decir, plegarse por la vía incorrecta y terminar deformándose. A menos que los mecanismos celulares puedan destruir o volver a plegar las proteínas mal plegadas, pueden agregarse posteriormente y causar una variedad de enfermedades debilitantes. [16] Los experimentos de laboratorio que estudian estos procesos pueden tener un alcance y un detalle atómico limitados, lo que lleva a los científicos a utilizar modelos informáticos basados en la física que, al complementar los experimentos, buscan proporcionar una imagen más completa del plegamiento, el plegamiento incorrecto y la agregación de las proteínas. [17] [18]
Debido a la complejidad de la conformación o el espacio de configuración de las proteínas (el conjunto de posibles formas que puede adoptar una proteína) y a los límites en la potencia de cálculo, las simulaciones de dinámica molecular de todos los átomos se han visto severamente limitadas en las escalas de tiempo que pueden estudiar. Si bien la mayoría de las proteínas se pliegan típicamente en el orden de milisegundos [17] [19] , antes de 2010, las simulaciones solo podían alcanzar escalas de tiempo de nanosegundos a microsegundos [11] . Se han utilizado supercomputadoras de propósito general para simular el plegamiento de proteínas, pero dichos sistemas son intrínsecamente costosos y, por lo general, se comparten entre muchos grupos de investigación. Además, debido a que los cálculos en los modelos cinéticos se realizan en serie, la adaptación a gran escala de las simulaciones moleculares tradicionales a estas arquitecturas es excepcionalmente difícil [20] [21] . Además, como el plegamiento de proteínas es un proceso estocástico (es decir, aleatorio) y puede variar estadísticamente con el tiempo, es un desafío computacional utilizar simulaciones largas para obtener vistas integrales del proceso de plegamiento [22] [23] .
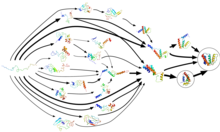
El plegamiento de proteínas no ocurre en un solo paso. [16] En cambio, las proteínas pasan la mayor parte de su tiempo de plegamiento, casi el 96% en algunos casos, [24] esperando en varios estados conformacionales intermedios , cada uno un mínimo de energía libre termodinámico local en el paisaje energético de la proteína . A través de un proceso conocido como muestreo adaptativo , Folding@home utiliza estas conformaciones como puntos de partida para un conjunto de trayectorias de simulación. A medida que las simulaciones descubren más conformaciones, las trayectorias se reinician a partir de ellas y se crea gradualmente un modelo de estado de Markov (MSM) a partir de este proceso cíclico. Los MSM son modelos de ecuaciones maestras de tiempo discreto que describen el paisaje conformacional y energético de una biomolécula como un conjunto de estructuras distintas y las breves transiciones entre ellas. El método del modelo de estado de Markov de muestreo adaptativo aumenta significativamente la eficiencia de la simulación, ya que evita el cálculo dentro del propio mínimo de energía local y es susceptible de computación distribuida (incluso en GPUGRID ), ya que permite la agregación estadística de trayectorias de simulación cortas e independientes. [25] La cantidad de tiempo que lleva construir un modelo de estados de Markov es inversamente proporcional al número de simulaciones paralelas ejecutadas, es decir, el número de procesadores disponibles. En otras palabras, logra una paralelización lineal , lo que lleva a una reducción de aproximadamente cuatro órdenes de magnitud en el tiempo total de cálculo serial. Un MSM completo puede contener decenas de miles de estados de muestra del espacio de fase de la proteína (todas las conformaciones que puede adoptar una proteína) y las transiciones entre ellos. El modelo ilustra eventos de plegamiento y vías (es decir, rutas) y los investigadores pueden usar posteriormente la agrupación cinética para ver una representación de grano grueso del modelo, que de otro modo sería altamente detallado. Pueden usar estos MSM para revelar cómo se pliegan mal las proteínas y para comparar cuantitativamente las simulaciones con los experimentos. [7] [22] [26]
Entre 2000 y 2010, la longitud de las proteínas estudiadas por Folding@home se ha multiplicado por cuatro, mientras que sus escalas de tiempo para las simulaciones de plegamiento de proteínas han aumentado en seis órdenes de magnitud. [27] En 2002, Folding@home utilizó modelos de estados de Markov para completar aproximadamente un millón de días de CPU de simulaciones a lo largo de varios meses, [13] y en 2011, los MSM paralelizaron otra simulación que requirió un total de 10 millones de horas de CPU de computación. [28] En enero de 2010, Folding@home utilizó MSM para simular la dinámica de la proteína NTL9 de 32 residuos de plegamiento lento hasta 1,52 milisegundos, una escala de tiempo consistente con las predicciones experimentales de la tasa de plegamiento pero mil veces más larga que la alcanzada anteriormente. El modelo consistía en muchas trayectorias individuales, cada una dos órdenes de magnitud más corta, y proporcionó un nivel de detalle sin precedentes en el paisaje energético de la proteína. [7] [11] [29] En 2010, el investigador de Folding@home Gregory Bowman recibió el premio Thomas Kuhn Paradigm Shift Award de la American Chemical Society por el desarrollo del software de código abierto MSMBuilder y por lograr un acuerdo cuantitativo entre la teoría y el experimento. [30] [31] Por su trabajo, Pande recibió el premio Michael y Kate Bárány 2012 para jóvenes investigadores por "desarrollar métodos computacionales que definen y modifican el campo para producir modelos teóricos líderes para el plegamiento de proteínas y ARN ", [32] y el premio Irving Sigal Young Investigator Award 2006 por sus resultados de simulación que "han estimulado un reexamen del significado de las mediciones de conjunto y de molécula única, haciendo que los esfuerzos de Pande sean contribuciones pioneras a la metodología de simulación". [33]
El plegamiento incorrecto de proteínas puede dar lugar a una variedad de enfermedades , entre ellas la enfermedad de Alzheimer, el cáncer , la enfermedad de Creutzfeldt-Jakob , la fibrosis quística , la enfermedad de Huntington, la anemia de células falciformes y la diabetes tipo II . [16] [34] [35] La infección celular por virus como el VIH y la gripe también implica eventos de plegamiento en las membranas celulares . [36] Una vez que se comprenda mejor el plegamiento incorrecto de proteínas, se pueden desarrollar terapias que aumenten la capacidad natural de las células para regular el plegamiento de proteínas. Dichas terapias incluyen el uso de moléculas diseñadas para alterar la producción de una proteína dada, ayudar a destruir una proteína mal plegada o ayudar en el proceso de plegamiento. [37] La combinación de modelado molecular computacional y análisis experimental tiene la posibilidad de dar forma fundamental al futuro de la medicina molecular y al diseño racional de terapias , [18] como acelerar y reducir los costos del descubrimiento de fármacos . [38] El objetivo de los primeros cinco años de Folding@home fue avanzar en la comprensión del plegamiento, mientras que el objetivo actual es comprender el plegamiento incorrecto y las enfermedades relacionadas, especialmente el Alzheimer. [39]
Las simulaciones que se ejecutan en Folding@home se utilizan junto con experimentos de laboratorio, [22] pero los investigadores pueden usarlas para estudiar cómo el plegamiento in vitro difiere del plegamiento en entornos celulares nativos. Esto es ventajoso para estudiar aspectos del plegamiento, el plegamiento incorrecto y sus relaciones con las enfermedades que son difíciles de observar experimentalmente. Por ejemplo, en 2011, Folding@home simuló el plegamiento de proteínas dentro de un túnel de salida ribosómico , para ayudar a los científicos a comprender mejor cómo el confinamiento natural y el hacinamiento pueden influir en el proceso de plegamiento. [40] [41] Además, los científicos suelen emplear desnaturalizantes químicos para desplegar proteínas desde su estado nativo estable. No se sabe generalmente cómo afecta el desnaturalizante al replegamiento de la proteína, y es difícil determinar experimentalmente si estos estados desnaturalizados contienen estructuras residuales que puedan influir en el comportamiento del plegamiento. En 2010, Folding@home utilizó GPU para simular los estados desplegados de la proteína L y predijo su tasa de colapso en fuerte acuerdo con los resultados experimentales. [42]
Los grandes conjuntos de datos del proyecto están disponibles de forma gratuita para que otros investigadores los utilicen a pedido y se puede acceder a algunos de ellos desde el sitio web Folding@home. [43] [44] El laboratorio Pande ha colaborado con otros sistemas de dinámica molecular como la supercomputadora Blue Gene , [45] y comparte el software clave de Folding@home con otros investigadores, de modo que los algoritmos que beneficiaron a Folding@home puedan ayudar a otras áreas científicas. [43] En 2011, lanzaron el software de código abierto Copernicus, que se basa en el MSM de Folding@home y otros métodos de paralelización y tiene como objetivo mejorar la eficiencia y la escalabilidad de las simulaciones moleculares en grandes clústeres de computadoras o supercomputadoras . [46] [47] Los resúmenes de todos los hallazgos científicos de Folding@home se publican en el sitio web Folding@home después de su publicación. [48]
La enfermedad de Alzheimer es una enfermedad neurodegenerativa incurable que afecta con mayor frecuencia a los ancianos y representa más de la mitad de todos los casos de demencia . Su causa exacta sigue siendo desconocida, pero la enfermedad se identifica como una enfermedad de plegamiento incorrecto de proteínas . La enfermedad de Alzheimer está asociada con agregaciones tóxicas del péptido beta amiloide (Aβ) , causadas por el plegamiento incorrecto de Aβ y la aglutinación junto con otros péptidos Aβ. Estos agregados de Aβ luego crecen en placas seniles significativamente más grandes , un marcador patológico de la enfermedad de Alzheimer. [49] [50] [51] Debido a la naturaleza heterogénea de estos agregados, los métodos experimentales como la cristalografía de rayos X y la resonancia magnética nuclear (RMN) han tenido dificultades para caracterizar sus estructuras. Además, las simulaciones atómicas de la agregación de Aβ son muy exigentes computacionalmente debido a su tamaño y complejidad. [52] [53]
Según Naeem y Fazili en un artículo de revisión de la literatura , prevenir la agregación de Aβ es un método prometedor para desarrollar fármacos terapéuticos para la enfermedad de Alzheimer. [54] En 2008, Folding@home simuló la dinámica de la agregación de Aβ con detalles atómicos en escalas de tiempo del orden de decenas de segundos. Estudios anteriores solo pudieron simular alrededor de 10 microsegundos. Folding@home pudo simular el plegamiento de Aβ durante seis órdenes de magnitud más de lo que era posible anteriormente. Los investigadores utilizaron los resultados de este estudio para identificar una horquilla beta que era una fuente importante de interacciones moleculares dentro de la estructura. [55] El estudio ayudó a preparar el laboratorio de Pande para futuros estudios de agregación y para futuras investigaciones para encontrar un pequeño péptido que pueda estabilizar el proceso de agregación. [52]
En diciembre de 2008, Folding@home encontró varios fármacos candidatos pequeños que parecen inhibir la toxicidad de los agregados de Aβ. [56] En 2010, en estrecha cooperación con el Centro de Maquinaria de Plegado de Proteínas, estos fármacos candidatos comenzaron a probarse en tejido biológico . [35] En 2011, Folding@home completó simulaciones de varias mutaciones de Aβ que parecen estabilizar la formación de agregados, lo que podría ayudar en el desarrollo de terapias farmacológicas terapéuticas para la enfermedad y ayudar en gran medida con los estudios experimentales de espectroscopia de resonancia magnética nuclear de oligómeros de Aβ . [53] [57] Más tarde ese año, Folding@home comenzó simulaciones de varios fragmentos de Aβ para determinar cómo varias enzimas naturales afectan la estructura y el plegamiento de Aβ. [58] [59]
La enfermedad de Huntington es un trastorno genético neurodegenerativo que se asocia con el plegamiento incorrecto y la agregación de proteínas. Las repeticiones excesivas del aminoácido glutamina en el extremo N de la proteína huntingtina causan agregación y, aunque el comportamiento de las repeticiones no se entiende completamente, sí conduce al deterioro cognitivo asociado con la enfermedad. [60] Al igual que con otros agregados, existe dificultad para determinar experimentalmente su estructura. [61] Los científicos están utilizando Folding@home para estudiar la estructura del agregado de proteína huntingtina y predecir cómo se forma, lo que ayuda a diseñar métodos racionales de fármacos para detener la formación del agregado. [35] El fragmento N17 de la proteína huntingtina acelera esta agregación y, aunque se han propuesto varios mecanismos, su papel exacto en este proceso sigue siendo en gran medida desconocido. [62] Folding@home ha simulado este y otros fragmentos para aclarar sus funciones en la enfermedad. [63] Desde 2008, sus métodos de diseño de fármacos para la enfermedad de Alzheimer se han aplicado a la enfermedad de Huntington. [35]
Más de la mitad de todos los cánceres conocidos implican mutaciones de p53 , una proteína supresora de tumores presente en cada célula que regula el ciclo celular y envía señales de muerte celular en caso de daño al ADN . Mutaciones específicas en p53 pueden alterar estas funciones, permitiendo que una célula anormal continúe creciendo sin control, lo que resulta en el desarrollo de tumores . El análisis de estas mutaciones ayuda a explicar las causas fundamentales de los cánceres relacionados con p53. [64] En 2004, Folding@home se utilizó para realizar el primer estudio de dinámica molecular del replegamiento del dímero proteico de p53 en una simulación de todos los átomos de agua . Los resultados de la simulación coincidieron con las observaciones experimentales y proporcionaron información sobre el replegamiento del dímero que antes no se podía obtener. [65] Esta fue la primera publicación revisada por pares sobre el cáncer de un proyecto de computación distribuida. [66] El año siguiente, Folding@home impulsó un nuevo método para identificar los aminoácidos cruciales para la estabilidad de una proteína determinada, que luego se utilizó para estudiar las mutaciones de p53. El método tuvo un éxito razonable en la identificación de mutaciones promotoras de cáncer y determinó los efectos de mutaciones específicas que de otro modo no podrían medirse experimentalmente. [67]
Folding@home también se utiliza para estudiar las chaperonas proteicas , [35] proteínas de choque térmico que desempeñan papeles esenciales en la supervivencia celular al ayudar con el plegamiento de otras proteínas en el entorno abarrotado y químicamente estresante dentro de una célula. Las células cancerosas de rápido crecimiento dependen de chaperonas específicas, y algunas chaperonas desempeñan papeles clave en la resistencia a la quimioterapia . Las inhibiciones de estas chaperonas específicas se consideran modos de acción potenciales para medicamentos de quimioterapia eficientes o para reducir la propagación del cáncer. [68] Utilizando Folding@home y trabajando en estrecha colaboración con el Centro de Maquinaria de Plegado de Proteínas, el laboratorio Pande espera encontrar un fármaco que inhiba aquellas chaperonas involucradas en células cancerosas. [69] Los investigadores también están utilizando Folding@home para estudiar otras moléculas relacionadas con el cáncer, como la enzima Src quinasa , y algunas formas del homeodominio engrailed : una proteína grande que puede estar involucrada en muchas enfermedades, incluido el cáncer. [70] [71] En 2011, Folding@home comenzó a realizar simulaciones de la dinámica de la pequeña proteína knottin EETI, que puede identificar carcinomas en exploraciones de imágenes al unirse a los receptores de superficie de las células cancerosas. [72] [73]
La interleucina 2 (IL-2) es una proteína que ayuda a las células T del sistema inmunológico a atacar a los patógenos y los tumores. Sin embargo, su uso como tratamiento contra el cáncer está restringido debido a efectos secundarios graves como el edema pulmonar . La IL-2 se une a estas células pulmonares de forma diferente a como lo hace con las células T, por lo que la investigación de la IL-2 implica comprender las diferencias entre estos mecanismos de unión. En 2012, Folding@home colaboró en el descubrimiento de una forma mutante de IL-2 que es trescientas veces más eficaz en su función del sistema inmunológico pero conlleva menos efectos secundarios. En los experimentos, esta forma alterada superó significativamente a la IL-2 natural en la prevención del crecimiento tumoral. Las empresas farmacéuticas han expresado interés en la molécula mutante, y los Institutos Nacionales de Salud la están probando contra una gran variedad de modelos tumorales para tratar de acelerar su desarrollo como terapia. [74] [75]
La osteogénesis imperfecta , conocida como enfermedad de los huesos de cristal, es un trastorno óseo genético incurable que puede ser letal. Las personas que padecen esta enfermedad no pueden producir tejido óseo conectivo funcional. Esto se debe más comúnmente a una mutación en el colágeno tipo I , [76] que cumple una variedad de funciones estructurales y es la proteína más abundante en los mamíferos . [77] La mutación causa una deformación en la estructura de triple hélice del colágeno , que si no se destruye de forma natural, conduce a un tejido óseo anormal y debilitado. [78] En 2005, Folding@home probó un nuevo método mecánico cuántico que mejoraba los métodos de simulación anteriores y que puede ser útil para futuros estudios informáticos del colágeno. [79] Aunque los investigadores han utilizado Folding@home para estudiar el plegamiento y el plegamiento incorrecto del colágeno, el interés se mantiene como un proyecto piloto en comparación con la investigación de Alzheimer y Huntington. [35]
Folding@home está ayudando en la investigación para prevenir que algunos virus , como la gripe y el VIH , reconozcan y entren en las células biológicas . [35] En 2011, Folding@home comenzó a realizar simulaciones de la dinámica de la enzima ARNasa H , un componente clave del VIH, para intentar diseñar fármacos para desactivarlo. [80] Folding@home también se ha utilizado para estudiar la fusión de membranas , un evento esencial para la infección viral y una amplia gama de funciones biológicas. Esta fusión implica cambios conformacionales de las proteínas de fusión viral y el acoplamiento de proteínas , [36] pero los mecanismos moleculares exactos detrás de la fusión siguen siendo en gran medida desconocidos. [81] Los eventos de fusión pueden consistir en más de medio millón de átomos que interactúan durante cientos de microsegundos. Esta complejidad limita las simulaciones informáticas típicas a unos diez mil átomos durante decenas de nanosegundos: una diferencia de varios órdenes de magnitud. [55] El desarrollo de modelos para predecir los mecanismos de fusión de membranas ayudará a la comprensión científica de cómo dirigir el proceso con fármacos antivirales. [82] En 2006, los científicos aplicaron modelos de estados de Markov y la red Folding@home para descubrir dos vías de fusión y obtener otros conocimientos mecanicistas. [55]
Tras simulaciones detalladas de Folding@home de pequeñas células conocidas como vesículas , en 2007, el laboratorio Pande introdujo un nuevo método informático para medir la topología de sus cambios estructurales durante la fusión. [83] En 2009, los investigadores utilizaron Folding@home para estudiar las mutaciones de la hemaglutinina de la gripe , una proteína que une un virus a su célula huésped y ayuda a la entrada viral. Las mutaciones de la hemaglutinina afectan a la eficacia con la que la proteína se une a las moléculas receptoras de la superficie celular de un huésped , lo que determina la infectividad de la cepa del virus para el organismo huésped. El conocimiento de los efectos de las mutaciones de la hemaglutinina ayuda al desarrollo de fármacos antivirales . [84] [85] A partir de 2012, Folding@home continúa simulando el plegamiento y las interacciones de la hemaglutinina, complementando los estudios experimentales de la Universidad de Virginia . [35] [86]
En marzo de 2020, Folding@home lanzó un programa para ayudar a investigadores de todo el mundo que están trabajando para encontrar una cura y aprender más sobre la pandemia de coronavirus . La ola inicial de proyectos simula dianas proteicas potencialmente farmacológicas del virus SARS-CoV-2 y el virus SARS-CoV relacionado, sobre el cual hay muchos más datos disponibles. [87] [88] [89]
Los fármacos funcionan uniéndose a lugares específicos de las moléculas objetivo y provocando algún cambio deseado, como desactivar un objetivo o provocar un cambio conformacional . Idealmente, un fármaco debería actuar de forma muy específica y unirse solo a su objetivo sin interferir con otras funciones biológicas. Sin embargo, es difícil determinar con precisión dónde y con qué fuerza se unirán dos moléculas. Debido a los límites de la potencia informática, los métodos in silico actuales suelen tener que sacrificar velocidad por precisión ; por ejemplo, utilizar métodos rápidos de acoplamiento de proteínas en lugar de cálculos de energía libre que requieren un gran esfuerzo computacional . El rendimiento informático de Folding@home permite a los investigadores utilizar ambos métodos y evaluar su eficiencia y fiabilidad. [39] [90] [91] El diseño de fármacos asistido por ordenador tiene el potencial de acelerar y reducir los costes del descubrimiento de fármacos. [38] En 2010, Folding@home utilizó MSM y cálculos de energía libre para predecir el estado nativo de la proteína villina con una desviación cuadrática media (RMSD) de 1,8 angstroms (Å) de la estructura cristalina determinada experimentalmente mediante cristalografía de rayos X. Esta precisión tiene implicaciones para los futuros métodos de predicción de la estructura de las proteínas , incluidas las proteínas intrínsecamente no estructuradas . [55] Los científicos han utilizado Folding@home para investigar la resistencia a los fármacos mediante el estudio de la vancomicina , un antibiótico de último recurso , y la beta-lactamasa , una proteína que puede descomponer antibióticos como la penicilina . [92] [93]
La actividad química se produce a lo largo del sitio activo de una proteína . Los métodos tradicionales de diseño de fármacos implican la unión estrecha a este sitio y el bloqueo de su actividad, bajo el supuesto de que la proteína diana existe en una estructura rígida. Sin embargo, este enfoque funciona para aproximadamente solo el 15% de todas las proteínas. Las proteínas contienen sitios alostéricos que, cuando se unen a moléculas pequeñas, pueden alterar la conformación de una proteína y, en última instancia, afectar la actividad de la proteína. Estos sitios son objetivos farmacológicos atractivos, pero localizarlos es muy costoso desde el punto de vista computacional . En 2012, se utilizaron Folding@home y MSMs para identificar sitios alostéricos en tres proteínas médicamente relevantes: beta-lactamasa, interleucina-2 y ARNasa H. [ 93] [94]
Aproximadamente la mitad de todos los antibióticos conocidos interfieren con el funcionamiento del ribosoma de una bacteria , una máquina bioquímica grande y compleja que realiza la biosíntesis de proteínas al traducir el ARN mensajero en proteínas. Los antibióticos macrólidos obstruyen el túnel de salida del ribosoma, impidiendo la síntesis de proteínas bacterianas esenciales. En 2007, el laboratorio Pande recibió una subvención para estudiar y diseñar nuevos antibióticos. [35] En 2008, utilizaron Folding@home para estudiar el interior de este túnel y cómo moléculas específicas pueden afectarlo. [95] La estructura completa del ribosoma se determinó recién en 2011, y Folding@home también ha simulado proteínas ribosomales , ya que muchas de sus funciones siguen siendo en gran parte desconocidas. [96]
Al igual que otros proyectos de computación distribuida , Folding@home es un proyecto de ciencia ciudadana en línea . En estos proyectos, los no especialistas contribuyen con la capacidad de procesamiento de las computadoras o ayudan a analizar los datos producidos por científicos profesionales. Los participantes reciben poca o ninguna recompensa evidente.
Se han llevado a cabo investigaciones sobre las motivaciones de los científicos ciudadanos y la mayoría de estos estudios han descubierto que los participantes están motivados a participar por razones altruistas; es decir, quieren ayudar a los científicos y hacer una contribución al avance de su investigación. [97] [98] [99] [100] Muchos participantes en la ciencia ciudadana tienen un interés subyacente en el tema de la investigación y gravitan hacia proyectos que se encuentran en disciplinas de su interés. Folding@home no es diferente en ese sentido. [101] La investigación realizada recientemente con más de 400 participantes activos reveló que querían ayudar a hacer una contribución a la investigación y que muchos tenían amigos o familiares afectados por las enfermedades que investigan los científicos de Folding@home.
Folding@home atrae a participantes que son entusiastas del hardware informático. Estos grupos aportan una experiencia considerable al proyecto y son capaces de construir ordenadores con una capacidad de procesamiento avanzada. [102] [ se necesita cita para verificar ] Otros proyectos de computación distribuida atraen a este tipo de participantes y los proyectos se utilizan a menudo para evaluar el rendimiento de ordenadores modificados, y este aspecto del hobby se adapta a través de la naturaleza competitiva del proyecto. Los individuos y los equipos pueden competir para ver quién puede procesar la mayor cantidad de unidades de procesamiento informático (CPU).
Esta última investigación sobre Folding@home, que incluyó entrevistas y observaciones etnográficas de grupos en línea, mostró que los equipos de entusiastas del hardware a veces pueden trabajar juntos y compartir las mejores prácticas con respecto a maximizar el rendimiento del procesamiento. Dichos equipos pueden convertirse en comunidades de práctica , con un lenguaje y una cultura en línea compartidos. Este patrón de participación se ha observado en otros proyectos de computación distribuida. [103] [104]
Otra observación clave de los participantes de Folding@home es que muchos son hombres. [101] Esto también se ha observado en otros proyectos distribuidos. Además, muchos participantes trabajan en empleos y carreras relacionados con la informática y la tecnología. [101] [105] [106]
No todos los participantes de Folding@home son entusiastas del hardware. Muchos de ellos ejecutan el software del proyecto en máquinas sin modificar y participan en competiciones. En enero de 2020, el número de usuarios se había reducido a 30.000. [107] Sin embargo, es difícil determinar qué proporción de participantes son entusiastas del hardware. Aunque, según los directores del proyecto, la contribución de la comunidad de entusiastas es sustancialmente mayor en términos de potencia de procesamiento. [108]

El rendimiento de los superordenadores en FLOPS se evalúa ejecutando el benchmark LINPACK heredado . Esta prueba a corto plazo tiene dificultades para reflejar con precisión el rendimiento sostenido en tareas del mundo real porque LINPACK se adapta de forma más eficiente al hardware de los superordenadores. Los sistemas informáticos varían en arquitectura y diseño, por lo que la comparación directa es difícil. A pesar de esto, los FLOPS siguen siendo la métrica de velocidad principal utilizada en supercomputación. [109] [ necesita cita para verificar ] Por el contrario, Folding@home determina sus FLOPS utilizando el tiempo de reloj de pared midiendo cuánto tiempo tardan sus unidades de trabajo en completarse. [110]
El 16 de septiembre de 2007, debido en gran parte a la participación de las consolas PlayStation 3, el proyecto Folding@home alcanzó oficialmente un nivel de rendimiento sostenido superior a un petaFLOPS nativo , convirtiéndose en el primer sistema informático de cualquier tipo en lograrlo. [111] [112] La supercomputadora más rápida de Top500 en ese momento era BlueGene/L , con 0,280 petaFLOPS. [113] Al año siguiente, el 7 de mayo de 2008, el proyecto alcanzó un nivel de rendimiento sostenido superior a dos petaFLOPS nativos, [114] seguido de los hitos de tres y cuatro petaFLOPS nativos en agosto de 2008 [115] [116] y el 28 de septiembre de 2008 respectivamente. [117] El 18 de febrero de 2009, Folding@home alcanzó cinco petaFLOPS nativos, [118] [119] y fue el primer proyecto informático en cumplir estos cinco niveles. [120] [121] En comparación, la supercomputadora más rápida de noviembre de 2008 fue Roadrunner de IBM con 1,105 petaFLOPS. [122] El 10 de noviembre de 2011, el rendimiento de Folding@home superó los seis petaFLOPS nativos con el equivalente a casi ocho petaFLOPS x86. [112] [123] A mediados de mayo de 2013, Folding@home alcanzó más de siete petaFLOPS nativos, con el equivalente a 14,87 petaFLOPS x86. Luego alcanzó ocho petaFLOPS nativos el 21 de junio, seguido de nueve el 9 de septiembre de ese año, con 17,9 petaFLOPS x86. [124] El 11 de mayo de 2016, Folding@home anunció que se estaba acercando a alcanzar la marca de 100 petaFLOPS x86. [125]
Su uso aumentó a partir de una mayor conciencia y participación en el proyecto a raíz de la pandemia de coronavirus en 2020. El 20 de marzo de 2020, Folding@home anunció a través de Twitter que estaba funcionando con más de 470 petaFLOPS nativos, [126] el equivalente a 958 x86 petaFLOPS. [127] El 25 de marzo alcanzó los 768 petaFLOPS, o 1,5 x86 exaFLOPS, lo que lo convirtió en el primer sistema informático exaFLOP . [128]
Al 20 de julio de 2024 [update], la potencia de cálculo de Folding@home es de 13,8 petaFLOPS, o 26,9 x86 petaFLOPS. [129]
De manera similar a otros proyectos de computación distribuida, Folding@home evalúa cuantitativamente las contribuciones de computación de los usuarios al proyecto a través de un sistema de créditos. [130] Todas las unidades de un proyecto de proteínas determinado tienen un crédito base uniforme, que se determina comparando una o más unidades de trabajo de ese proyecto en una máquina de referencia oficial antes de que se publique el proyecto. [130] Cada usuario recibe estos puntos base por completar cada unidad de trabajo, aunque mediante el uso de una clave de acceso pueden recibir puntos de bonificación adicionales por completar de manera confiable y rápida unidades que son más exigentes computacionalmente o tienen una mayor prioridad científica. [131] [132] Los usuarios también pueden recibir crédito por su trabajo por parte de clientes en múltiples máquinas. [133] Este sistema de puntos intenta alinear el crédito otorgado con el valor de los resultados científicos. [130]
Los usuarios pueden registrar sus contribuciones en un equipo, que combina los puntos de todos sus miembros. Un usuario puede iniciar su propio equipo o puede unirse a un equipo existente. En algunos casos, un equipo puede tener sus propias fuentes de ayuda o reclutamiento impulsadas por la comunidad, como un foro de Internet . [134] Los puntos pueden fomentar una competencia amistosa entre individuos y equipos para calcular la mayor cantidad de puntos para el proyecto, lo que puede beneficiar a la comunidad de plegado y acelerar la investigación científica. [130] [135] [136] Las estadísticas individuales y de equipo se publican en el sitio web Folding@home. [130]
Si un usuario no forma un equipo nuevo o no se une a un equipo existente, dicho usuario pasa a formar parte automáticamente de un equipo "Predeterminado". Este equipo "Predeterminado" tiene un número de equipo de "0". Se acumulan estadísticas para este equipo "Predeterminado", así como para los equipos con nombres especiales.
El software Folding@home del lado del usuario implica tres componentes principales: unidades de trabajo, núcleos y un cliente.
Una unidad de trabajo son los datos de proteínas que se le pide al cliente que procese. Las unidades de trabajo son una fracción de la simulación entre los estados en un modelo de Markov . Después de que la unidad de trabajo ha sido descargada y procesada completamente por la computadora de un voluntario, se devuelve a los servidores de Folding@home, que luego otorgan al voluntario los puntos de crédito. Este ciclo se repite automáticamente. [135] Todas las unidades de trabajo tienen fechas límite asociadas, y si se excede esta fecha límite, el usuario puede no obtener crédito y la unidad se volverá a emitir automáticamente a otro participante. Como el plegamiento de proteínas ocurre en serie, y muchas unidades de trabajo se generan a partir de sus predecesoras, esto permite que el proceso de simulación general proceda normalmente si una unidad de trabajo no se devuelve después de un período de tiempo razonable. Debido a estas fechas límite, el requisito mínimo del sistema para Folding@home es una CPU Pentium 3 de 450 MHz con extensiones Streaming SIMD (SSE). [133] Sin embargo, las unidades de trabajo para clientes de alto rendimiento tienen una fecha límite mucho más corta que las del cliente monoprocesador, ya que una parte importante del beneficio científico depende de completar rápidamente las simulaciones. [137]
Antes de su lanzamiento público, las unidades de trabajo pasan por varios pasos de control de calidad para evitar que las unidades problemáticas estén completamente disponibles. Estas etapas de prueba incluyen la interna, la beta y la avanzada, antes de un lanzamiento completo final en Folding@home. [138] Las unidades de trabajo de Folding@home normalmente se procesan solo una vez, excepto en el caso poco frecuente de que ocurran errores durante el procesamiento. Si esto ocurre para tres usuarios diferentes, la unidad se retira automáticamente de la distribución. [139] [140] El foro de soporte de Folding@home se puede utilizar para diferenciar entre problemas que surgen de hardware problemático y unidades de trabajo defectuosas. [141]
Los programas especializados de dinámica molecular, denominados "FahCores" y a menudo abreviados como "núcleos", realizan los cálculos en la unidad de trabajo como un proceso en segundo plano . Una gran mayoría de los núcleos de Folding@home se basan en GROMACS , [135] uno de los paquetes de software de dinámica molecular más rápidos y populares, que consiste en gran medida en código de lenguaje ensamblador optimizado manualmente y optimizaciones de hardware. [142] [143] Aunque GROMACS es un software de código abierto y existe un esfuerzo cooperativo entre el laboratorio Pande y los desarrolladores de GROMACS, Folding@home utiliza una licencia de código cerrado para ayudar a garantizar la validez de los datos. [144] Los núcleos menos activos incluyen ProtoMol y SHARPEN. Folding@home ha utilizado AMBER , CPMD , Desmond y TINKER , pero estos ya se han retirado y ya no están en servicio activo. [4] [145] [146] Algunos de estos núcleos realizan cálculos de solvatación explícitos en los que el disolvente circundante (normalmente agua) se modela átomo por átomo; mientras que otros realizan métodos de solvatación implícitos , en los que el disolvente se trata como un continuo matemático. [147] [148] El núcleo está separado del cliente para permitir que los métodos científicos se actualicen automáticamente sin necesidad de una actualización del cliente. Los núcleos crean periódicamente puntos de control de cálculo de modo que, si se interrumpen, pueden reanudar el trabajo desde ese punto al iniciarse. [135]

Un participante de Folding@home instala un programa cliente en su computadora personal . El usuario interactúa con el cliente, que administra los otros componentes de software en segundo plano. A través del cliente, el usuario puede pausar el proceso de plegado, abrir un registro de eventos, verificar el progreso del trabajo o ver estadísticas personales. [149] Los clientes de computadora se ejecutan continuamente en segundo plano con una prioridad muy baja, utilizando potencia de procesamiento inactiva para que el uso normal de la computadora no se vea afectado. [133] El uso máximo de CPU se puede ajustar a través de la configuración del cliente. [149] [150] El cliente se conecta a un servidor Folding@home y recupera una unidad de trabajo y también puede descargar el núcleo apropiado para la configuración del cliente, el sistema operativo y la arquitectura de hardware subyacente. Después del procesamiento, la unidad de trabajo se devuelve a los servidores Folding@home. Los clientes de computadora están diseñados para sistemas de procesador monoprocesador y multinúcleo , y unidades de procesamiento de gráficos . La diversidad y potencia de cada arquitectura de hardware proporciona a Folding@home la capacidad de completar de manera eficiente muchos tipos de simulaciones en el tiempo previsto (en unas pocas semanas o meses en lugar de años), lo que tiene un valor científico significativo. En conjunto, estos clientes permiten a los investigadores estudiar cuestiones biomédicas que antes se consideraban poco prácticas de abordar mediante computación. [39] [135] [137]
Los desarrolladores de software profesionales son responsables de la mayor parte del código de Folding@home, tanto del lado del cliente como del servidor. El equipo de desarrollo incluye programadores de Nvidia , ATI , Sony y Cauldron Development. [151] Los clientes se pueden descargar solo desde el sitio web oficial de Folding@home o sus socios comerciales, y solo interactuarán con archivos de computadora de Folding@home. Cargarán y descargarán datos con los servidores de datos de Folding@home (a través del puerto 8080, con 80 como alternativa), y la comunicación se verifica utilizando firmas digitales de 2048 bits . [133] [152] Si bien la interfaz gráfica de usuario (GUI) del cliente es de código abierto, [153] el cliente es un software propietario que cita la seguridad y la integridad científica como las razones. [154] [155] [156]
Sin embargo, esta lógica de usar software propietario es discutida ya que mientras que la licencia podría ser ejecutable en el dominio legal retrospectivamente, no impide prácticamente la modificación (también conocida como parcheo ) de los archivos binarios ejecutables . Del mismo modo, la distribución solo binaria no impide la modificación maliciosa del código binario ejecutable, ya sea a través de un ataque de hombre en el medio mientras se descarga a través de Internet, [157] o por la redistribución de binarios por un tercero que han sido modificados previamente ya sea en su estado binario (es decir, parcheado ), [158] o descompilándolos [159] y volviéndolos a compilar después de la modificación. [160] [161] Estas modificaciones son posibles a menos que los archivos binarios -y el canal de transporte- estén firmados y la persona/sistema receptor sea capaz de verificar la firma digital, en cuyo caso las modificaciones no garantizadas deberían ser detectables, pero no siempre. [162] De cualquier manera, dado que en el caso de Folding@home los datos de entrada y el resultado de salida procesados por el software cliente están ambos firmados digitalmente, [133] [152] la integridad del trabajo se puede verificar independientemente de la integridad del propio software cliente.
Folding@home utiliza las bibliotecas de software Cosm para la creación de redes. [135] [151] Folding@home se lanzó el 1 de octubre de 2000 y fue el primer proyecto de computación distribuida destinado a sistemas biomoleculares. [163] Su primer cliente fue un protector de pantalla que se ejecutaba mientras la computadora no estaba en uso. [164] [165] En 2004, el laboratorio Pande colaboró con David P. Anderson para probar un cliente complementario en el marco de código abierto BOINC . Este cliente se lanzó en versión beta cerrada en abril de 2005; [166] sin embargo, el método se volvió inviable y se archivó en junio de 2006. [167]
El hardware especializado de las unidades de procesamiento gráfico (GPU) está diseñado para acelerar la representación de aplicaciones gráficas en 3D, como los videojuegos, y puede superar significativamente a las CPU en algunos tipos de cálculos. Las GPU son una de las plataformas informáticas más potentes y de más rápido crecimiento, y muchos científicos e investigadores están buscando la computación de propósito general en unidades de procesamiento gráfico (GPGPU). Sin embargo, el hardware de la GPU es difícil de usar para tareas no gráficas y, por lo general, requiere una reestructuración significativa del algoritmo y una comprensión avanzada de la arquitectura subyacente. [168] Dicha personalización es un desafío, más aún para los investigadores con recursos limitados de desarrollo de software. Folding@home utiliza la biblioteca de código abierto OpenMM , que utiliza un patrón de diseño de puente con dos niveles de interfaz de programación de aplicaciones (API) para interconectar el software de simulación molecular con una arquitectura de hardware subyacente. Con la adición de optimizaciones de hardware, las simulaciones de GPU basadas en OpenMM no necesitan modificaciones significativas, pero logran un rendimiento casi igual al código de GPU ajustado a mano y superan en gran medida las implementaciones de CPU. [147] [169]
Antes de 2010, la fiabilidad informática del hardware de consumo GPGPU era en gran medida desconocida, y la evidencia circunstancial relacionada con la falta de detección y corrección de errores integrada en la memoria de la GPU planteaba problemas de fiabilidad. En la primera prueba a gran escala de la precisión científica de la GPU, un estudio de 2010 de más de 20.000 hosts en la red Folding@home detectó errores leves en los subsistemas de memoria de dos tercios de las GPU probadas. Estos errores estaban fuertemente correlacionados con la arquitectura de la placa, aunque el estudio concluyó que la computación fiable en la GPU era muy factible siempre que se prestara atención a las características del hardware, como la detección de errores del lado del software. [170]
La primera generación del cliente GPU de Folding@home (GPU1) se lanzó al público el 2 de octubre de 2006, [167] ofreciendo una aceleración de 20 a 30 veces para algunos cálculos en comparación con sus contrapartes GROMACS basadas en CPU . [171] Fue la primera vez que se usaron GPU para computación distribuida o cálculos importantes de dinámica molecular. [172] [173] GPU1 proporcionó a los investigadores un conocimiento y una experiencia significativos con el desarrollo de software GPGPU , pero en respuesta a imprecisiones científicas con DirectX , el 10 de abril de 2008, fue reemplazado por GPU2, la segunda generación del cliente. [171] [174] Tras la introducción de GPU2, GPU1 se retiró oficialmente el 6 de junio. [171] En comparación con GPU1, GPU2 era científicamente más confiable y productiva, se ejecutaba en GPU Nvidia habilitadas para ATI y CUDA , y admitía algoritmos más avanzados, proteínas más grandes y visualización en tiempo real de la simulación de proteínas. [175] [176] Después de esto, la tercera generación del cliente GPU de Folding@home (GPU3) se lanzó el 25 de mayo de 2010. Si bien era compatible con versiones anteriores de GPU2, GPU3 era más estable, eficiente y flexible en sus capacidades científicas, [177] y usaba OpenMM sobre un marco OpenCL . [177] [178] Aunque estos clientes GPU3 no admitían de forma nativa los sistemas operativos Linux y macOS , los usuarios de Linux con tarjetas gráficas Nvidia podían ejecutarlos a través de la aplicación de software Wine . [179] [180] Las GPU siguen siendo la plataforma más poderosa de Folding@home en FLOPS . A partir de noviembre de 2012, los clientes de GPU representan el 87% del rendimiento x86 FLOPS de todo el proyecto. [181]
El soporte nativo para tarjetas gráficas Nvidia y AMD en Linux se introdujo con FahCore 17, que utiliza OpenCL en lugar de CUDA. [182]

Desde marzo de 2007 hasta noviembre de 2012, Folding@home aprovechó la potencia de cálculo de las PlayStation 3. En el momento de su creación, su procesador principal Cell ofrecía un aumento de velocidad 20 veces mayor que el de las PC para algunos cálculos, una potencia de procesamiento que no se podía encontrar en otros sistemas como la Xbox 360. [39] [183] La alta velocidad y eficiencia de la PS3 introdujeron otras oportunidades para optimizaciones valiosas de acuerdo con la ley de Amdahl , y cambiaron significativamente el equilibrio entre la eficiencia de cálculo y la precisión general, lo que permitió el uso de modelos moleculares más complejos con un pequeño costo de cálculo adicional. [184] Esto permitió a Folding@home ejecutar cálculos biomédicos que de otro modo habrían sido inviables computacionalmente. [185]
El cliente PS3 fue desarrollado en un esfuerzo colaborativo entre Sony y el laboratorio Pande y fue lanzado por primera vez como un cliente independiente el 23 de marzo de 2007. [39] [186] Su lanzamiento convirtió a Folding@home en el primer proyecto de computación distribuida en usar PS3. [187] El 18 de septiembre del año siguiente, el cliente PS3 se convirtió en un canal de Life with PlayStation en su lanzamiento. [188] [189] En los tipos de cálculos que puede realizar, en el momento de su introducción, el cliente encajaba entre la flexibilidad de una CPU y la velocidad de una GPU. [135] Sin embargo, a diferencia de los clientes que se ejecutan en computadoras personales , los usuarios no podían realizar otras actividades en su PS3 mientras ejecutaban Folding@home. [185] El entorno de consola uniforme de la PS3 facilitó el soporte técnico e hizo que Folding@home fuera más fácil de usar . [39] La PS3 también tenía la capacidad de transmitir datos rápidamente a su GPU, que se usaba para la visualización a nivel atómico en tiempo real de la dinámica proteica actual. [184]
El 6 de noviembre de 2012, Sony finalizó el soporte para el cliente Folding@home PS3 y otros servicios disponibles en Life with PlayStation. Durante su vida útil de cinco años y siete meses, más de 15 millones de usuarios contribuyeron con más de 100 millones de horas de computación a Folding@home, lo que ayudó en gran medida al proyecto con la investigación de enfermedades. Después de las conversaciones con el laboratorio de Pande, Sony decidió finalizar la aplicación. Pande consideró que el cliente PlayStation 3 era un "cambio de juego" para el proyecto. [190] [191] [192]
Folding@home puede utilizar las capacidades de computación paralela de los procesadores multinúcleo modernos. La capacidad de utilizar varios núcleos de CPU simultáneamente permite completar la simulación completa mucho más rápido. Al trabajar juntos, estos núcleos de CPU completan unidades de trabajo individuales proporcionalmente más rápido que el cliente monoprocesador estándar. Este método es científicamente valioso porque permite realizar trayectorias de simulación mucho más largas en la misma cantidad de tiempo y reduce las dificultades tradicionales de escalar una simulación grande a muchos procesadores separados. [193] Una publicación de 2007 en el Journal of Molecular Biology se basó en el procesamiento multinúcleo para simular el plegamiento de parte de la proteína villina aproximadamente 10 veces más de lo que era posible con un cliente de un solo procesador, de acuerdo con las tasas de plegamiento experimentales. [194]
En noviembre de 2006, los clientes de multiprocesamiento simétrico (SMP) de primera generación se lanzaron públicamente para pruebas beta abiertas, conocidos como SMP1. [167] Estos clientes usaban protocolos de comunicación de Interfaz de paso de mensajes (MPI) para el procesamiento paralelo, ya que en ese momento los núcleos GROMACS no estaban diseñados para usarse con múltiples subprocesos. [137] Esta fue la primera vez que un proyecto de computación distribuida había usado MPI. [195] Aunque los clientes funcionaron bien en sistemas operativos basados en Unix como Linux y macOS, fueron problemáticos en Windows . [193] [195] El 24 de enero de 2010, SMP2, la segunda generación de los clientes SMP y el sucesor de SMP1, se lanzó como una beta abierta y reemplazó el complejo MPI con una implementación basada en subprocesos más confiable . [132] [151]
SMP2 admite una prueba de una categoría especial de unidades de trabajo bigadv , diseñadas para simular proteínas que son inusualmente grandes y computacionalmente intensivas y tienen una gran prioridad científica. Estas unidades originalmente requerían un mínimo de ocho núcleos de CPU, [196] que se aumentó a dieciséis más tarde, el 7 de febrero de 2012. [197] Junto con estos requisitos de hardware adicionales sobre las unidades de trabajo SMP2 estándar, requieren más recursos del sistema como memoria de acceso aleatorio (RAM) y ancho de banda de Internet . A cambio, los usuarios que las ejecutan son recompensados con un aumento del 20% sobre el sistema de puntos de bonificación de SMP2. [198] La categoría bigadv permite a Folding@home ejecutar simulaciones especialmente exigentes durante largos tiempos que anteriormente requerían el uso de clústeres de supercomputación y no se podían realizar en ningún otro lugar en Folding@home. [196] Muchos usuarios con hardware capaz de ejecutar unidades bigadv han visto posteriormente su configuración de hardware considerada no elegible para unidades de trabajo bigadv cuando se aumentaron los mínimos de núcleos de CPU, dejándolos solo capaces de ejecutar las unidades de trabajo SMP normales. Esto frustró a muchos usuarios que invirtieron cantidades significativas de dinero en el programa y poco después su hardware quedó obsoleto para los fines de Bigadv. Como resultado, Pande anunció en enero de 2014 que el programa Bigadv finalizaría el 31 de enero de 2015. [199]

El cliente V7 es la séptima y última generación del software cliente Folding@home, y es una reescritura y unificación completa de los clientes anteriores para los sistemas operativos Windows , macOS y Linux . [200] [201] Fue lanzado el 22 de marzo de 2012. [202] Al igual que sus predecesores, V7 puede ejecutar Folding@home en segundo plano con una prioridad muy baja , lo que permite que otras aplicaciones utilicen los recursos de la CPU según lo necesiten. Está diseñado para hacer que la instalación, el inicio y el funcionamiento sean más fáciles de usar para los novatos y ofrecer una mayor flexibilidad científica a los investigadores que los clientes anteriores. [203] V7 utiliza Trac para administrar sus tickets de errores para que los usuarios puedan ver su proceso de desarrollo y proporcionar comentarios. [201]
V7 consta de cuatro elementos integrados. El usuario normalmente interactúa con la interfaz gráfica de usuario de código abierto de V7 , denominada FAHControl. [153] [204] Esta tiene modos de interfaz de usuario Novato, Avanzado y Experto, y tiene la capacidad de supervisar, configurar y controlar muchos clientes de plegado remotos desde una computadora. FAHControl dirige FAHClient, una aplicación de back-end que a su vez administra cada FAHSlot (o slot ). Cada slot actúa como reemplazo de los clientes de computadora monoprocesador, SMP o GPU de Folding@home v6, que antes eran distintos, ya que puede descargar, procesar y cargar unidades de trabajo de forma independiente. La función FAHViewer, modelada a partir del visor de PS3, muestra una representación 3D en tiempo real, si está disponible, de la proteína que se está procesando actualmente. [200] [201]
En 2014, se lanzó un cliente para los navegadores web Google Chrome y Chromium , que permitía a los usuarios ejecutar Folding@home en su navegador web. El cliente usaba la función Native Client (NaCl) de Google en los navegadores web basados en Chromium para ejecutar el código de Folding@home a una velocidad casi nativa en un entorno aislado en la máquina del usuario. [205] Debido a la eliminación gradual de NaCL y los cambios en Folding@home, el cliente web se cerró permanentemente en junio de 2019. [206]
En julio de 2015, se lanzó en Google Play un cliente para teléfonos móviles Android con Android 4.4 KitKat o posterior. [207] [208]
El 16 de febrero de 2018, el cliente de Android, que se ofrecía en cooperación con Sony , fue eliminado de Google Play. Se anunciaron planes para ofrecer una alternativa de código abierto en el futuro. [209]
Rosetta@home es un proyecto de computación distribuida que apunta a la predicción de la estructura de proteínas y es uno de los predictores de estructura terciaria más precisos. [210] [211] Los estados conformacionales del software de Rosetta se pueden utilizar para inicializar un modelo de estado de Markov como puntos de partida para simulaciones Folding@home. [25] Por el contrario, los algoritmos de predicción de estructura se pueden mejorar a partir de modelos termodinámicos y cinéticos y los aspectos de muestreo de las simulaciones de plegamiento de proteínas. [212] Como Rosetta solo intenta predecir el estado plegado final, y no cómo se produce el plegamiento, Rosetta@home y Folding@home son complementarios y abordan cuestiones moleculares muy diferentes. [25] [213]
Anton es una supercomputadora de propósito especial construida para simulaciones de dinámica molecular. En octubre de 2011, Anton y Folding@home eran los dos sistemas de dinámica molecular más poderosos. [214] Anton es único en su capacidad de producir trayectorias moleculares únicas ultralargas y computacionalmente costosas, [215] como una en 2010 que alcanzó el rango de milisegundos. [216] [217] Estas trayectorias largas pueden ser especialmente útiles para algunos tipos de problemas bioquímicos. [218] [219] Sin embargo, Anton no utiliza modelos de estados de Markov (MSM) para el análisis. En 2011, el laboratorio de Pande construyó un MSM a partir de dos simulaciones de Anton de 100 μs y encontró vías de plegamiento alternativas que no eran visibles a través del análisis tradicional de Anton. Concluyeron que había poca diferencia entre los MSM construidos a partir de un número limitado de trayectorias largas o uno ensamblado a partir de muchas trayectorias más cortas. [215] En junio de 2011, Folding@home agregó un muestreo de una simulación de Anton en un esfuerzo por determinar mejor cómo se comparan sus métodos con los de Anton. [220] [221] Sin embargo, a diferencia de las trayectorias más cortas de Folding@home, que son más adecuadas para la computación distribuida y otros métodos de paralelización, las trayectorias más largas no requieren un muestreo adaptativo para muestrear suficientemente el espacio de fase de la proteína . Debido a esto, es posible que una combinación de los métodos de simulación de Anton y Folding@home proporcione un muestreo más completo de este espacio. [215]
{{cite journal}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: DOI inactive as of June 2024 (link) CS1 maint: bot: original URL status unknown (link){{cite journal}}: CS1 maint: multiple names: authors list (link){{cite news}}: CS1 maint: numeric names: authors list (link) Hasta donde sabemos, estos son los primeros resultados revisados por pares de un proyecto de computación distribuida relacionado con el cáncer.{{cite book}}: CS1 maint: location missing publisher (link){{citation}}: CS1 maint: numeric names: authors list (link)