.jpg/440px-E._coli_Bacteria_(7316101966).jpg)
La microbiota intestinal , el microbioma intestinal o la flora intestinal son los microorganismos , incluidas las bacterias , las arqueas , los hongos y los virus , que viven en el tracto digestivo de los animales . [1] [2] El metagenoma gastrointestinal es el agregado de todos los genomas de la microbiota intestinal . [3] [4] El intestino es la ubicación principal del microbioma humano . [5] La microbiota intestinal tiene amplios impactos, incluidos los efectos sobre la colonización , la resistencia a los patógenos , el mantenimiento del epitelio intestinal , la metabolización de compuestos dietéticos y farmacéuticos, el control de la función inmune e incluso el comportamiento a través del eje intestino-cerebro . [4]
La composición microbiana de la microbiota intestinal varía según las regiones del tracto digestivo. El colon contiene la mayor densidad microbiana de cualquier comunidad microbiana asociada a humanos estudiada hasta ahora, representando entre 300 y 1000 especies diferentes . [6] Las bacterias son el componente más grande y mejor estudiado hasta la fecha y el 99% de las bacterias intestinales provienen de alrededor de 30 o 40 especies. [7] Hasta el 60% de la masa seca de las heces son bacterias. [8] Más del 99% de las bacterias en el intestino son anaerobias , pero en el ciego , las bacterias aeróbicas alcanzan altas densidades. [5] Se estima que la microbiota intestinal humana tiene alrededor de cien veces más genes que los que hay en el genoma humano .

En los seres humanos, la microbiota intestinal tiene la mayor cantidad y especies de bacterias en comparación con otras áreas del cuerpo. [9] El número aproximado de bacterias que componen la microbiota intestinal es de aproximadamente 10 13 –10 14 (10 000 a 100 000 mil millones). [10] En los seres humanos, la flora intestinal se establece al nacer y gradualmente pasa a un estado similar al de los adultos a la edad de dos años, [11] coincidiendo con el desarrollo y la maduración del epitelio intestinal y la barrera mucosa intestinal . Esta barrera es esencial para sustentar una relación simbiótica con la flora intestinal al tiempo que brinda protección contra organismos patógenos. [12] [13]
La relación entre algunas microbiotas intestinales y los humanos no es meramente comensal (una coexistencia no dañina), sino más bien una relación mutualista . [5] : 700 Algunos microorganismos intestinales humanos benefician al huésped fermentando la fibra dietética en ácidos grasos de cadena corta (AGCC), como el ácido acético y el ácido butírico , que luego son absorbidos por el huésped. [9] [14] Las bacterias intestinales también juegan un papel en la síntesis de vitamina B y vitamina K , así como en el metabolismo de ácidos biliares , esteroles y xenobióticos . [5] [14] La importancia sistémica de los AGCC y otros compuestos que producen son como las hormonas y la propia flora intestinal parece funcionar como un órgano endocrino . [14] La desregulación de la flora intestinal se ha correlacionado con una serie de enfermedades inflamatorias y autoinmunes. [9] [15]
La composición de la microbiota intestinal humana cambia con el tiempo, cuando cambia la dieta y a medida que cambia la salud general. [9] [15] Una revisión sistemática de 2016 examinó los ensayos preclínicos y pequeños en humanos que se han realizado con ciertas cepas de bacterias probióticas disponibles comercialmente e identificó aquellas que tenían el mayor potencial para ser útiles para ciertos trastornos del sistema nervioso central . [16] También cabe destacar que la dieta mediterránea, rica en verduras y fibras, estimula la actividad y el crecimiento de bacterias beneficiosas para el cerebro. [17]
La composición microbiana de la microbiota intestinal varía a lo largo del tracto digestivo. En el estómago y el intestino delgado , por lo general, hay relativamente pocas especies de bacterias. [6] [18] El colon , por el contrario, contiene la mayor densidad microbiana de cualquier comunidad microbiana asociada a los humanos estudiada hasta ahora [19] con entre 10 10 y 10 11 (10 a 100 mil millones) de células por gramo de contenido intestinal. [20] Estas bacterias representan entre 300 y 1000 especies diferentes . [6] [18] Sin embargo, el 99% de las bacterias provienen de unas 30 o 40 especies. [7] Como consecuencia de su abundancia en el intestino, las bacterias también representan hasta el 60% de la masa seca de las heces . [8] Los hongos , protistas , arqueas y virus también están presentes en la flora intestinal, pero se sabe menos sobre sus actividades. [21]
Más del 99% de las bacterias del intestino son anaerobias , pero en el ciego las bacterias aeróbicas alcanzan altas densidades. [5] Se estima que esta flora intestinal tiene alrededor de cien veces más genes en total que los que hay en el genoma humano . [22]
Muchas especies del intestino no han sido estudiadas fuera de sus huéspedes porque no pueden ser cultivadas . [18] [7] [23] Si bien hay una pequeña cantidad de especies microbianas básicas compartidas por la mayoría de los individuos, las poblaciones de microbios pueden variar ampliamente. [24] Dentro de un individuo, sus poblaciones microbianas permanecen bastante constantes a lo largo del tiempo, con algunas alteraciones que ocurren debido a cambios en el estilo de vida, la dieta y la edad. [6] [25] El Proyecto del Microbioma Humano se ha propuesto describir mejor la microbiota del intestino humano y otras ubicaciones del cuerpo. [ cita requerida ]
Los cuatro filos bacterianos dominantes en el intestino humano son Bacillota (Firmicutes), Bacteroidota , Actinomycetota y Pseudomonadota . [26] La mayoría de las bacterias pertenecen a los géneros Bacteroides , Clostridium , Faecalibacterium , [6] [7] Eubacterium , Ruminococcus , Peptococcus , Peptostreptococcus y Bifidobacterium . [6] [7] Otros géneros, como Escherichia y Lactobacillus , están presentes en menor medida. [6] Las especies del género Bacteroides por sí solas constituyen alrededor del 30% de todas las bacterias en el intestino, lo que sugiere que este género es especialmente importante en el funcionamiento del huésped. [18]
Los géneros de hongos que se han detectado en el intestino incluyen Candida , Saccharomyces , Aspergillus , Penicillium , Rhodotorula , Trametes , Pleospora , Sclerotinia , Bullera y Galactomyces , entre otros. [27] [28] Rhodotorula se encuentra con mayor frecuencia en individuos con enfermedad inflamatoria intestinal , mientras que Candida se encuentra con mayor frecuencia en individuos con cirrosis de hepatitis B y hepatitis B crónica. [27]
Debido a la prevalencia de hongos en el ambiente natural, es difícil determinar qué géneros y especies son miembros permanentes del micobioma intestinal. [29] [30] Se están realizando investigaciones para determinar si Penicillium es un miembro permanente o transitorio de la flora intestinal, obtenido de fuentes dietéticas como el queso , aunque se sabe que varias especies del género sobreviven a temperaturas de alrededor de 37 °C, aproximadamente la misma que la temperatura corporal central . [30] Se sabe que Saccharomyces cerevisiae , la levadura de cerveza, llega a los intestinos después de ser ingerida y puede ser responsable del síndrome de autocervecería en los casos en que es sobreabundante, [30] [31] [32] mientras que Candida albicans es probablemente un miembro permanente, y se cree que se adquiere al nacer a través de transmisión vertical . [33] [ cita médica necesaria ]
Las arqueas constituyen otra gran clase de flora intestinal que es importante en el metabolismo de los productos bacterianos de la fermentación.
La industrialización está asociada con cambios en la microbiota y la reducción de la diversidad podría llevar a ciertas especies a la extinción; en 2018, los investigadores propusieron un repositorio de biobanco de microbiota humana. [34]
Un enterotipo es una clasificación de organismos vivos basada en su ecosistema bacteriológico en el microbioma intestinal humano, que no está determinada por la edad, el sexo, el peso corporal o las divisiones nacionales. [35] Hay indicios de que la dieta a largo plazo influye en el enterotipo. [36] Se han propuesto tres enterotipos humanos, [35] [37] pero su valor ha sido cuestionado. [38]
Debido a la alta acidez del estómago , la mayoría de los microorganismos no pueden sobrevivir allí. Las principales bacterias de la microbiota gástrica pertenecen a cinco filos principales: Firmicutes , Bacteroidetes , Actinobacteria , Fusobacteriota y Proteobacteria . Los géneros dominantes son Prevotella , Streptococcus , Veillonella , Rothia y Haemophilus . [39] La interacción entre la microbiota gástrica preexistente con la introducción de H. pylori puede influir en la progresión de la enfermedad . [39] Cuando hay presencia de H. pylori se convierte en el dominante de la microbiota. [40]
El intestino delgado contiene una cantidad mínima de microorganismos debido a la proximidad e influencia del estómago. Los cocos grampositivos y las bacterias en forma de bastón son los microorganismos predominantes que se encuentran en el intestino delgado. [5] Sin embargo, en la porción distal del intestino delgado las condiciones alcalinas favorecen la presencia de bacterias gramnegativas de las Enterobacteriaceae . [5] La flora bacteriana del intestino delgado ayuda en una amplia gama de funciones intestinales. La flora bacteriana proporciona señales reguladoras que permiten el desarrollo y la utilidad del intestino. El crecimiento excesivo de bacterias en el intestino delgado puede provocar insuficiencia intestinal. [42] Además, el intestino grueso contiene el ecosistema bacteriano más grande del cuerpo humano. [5] Aproximadamente el 99% de la flora del intestino grueso y de las heces está formada por anaerobios obligados como Bacteroides y Bifidobacterium. [43] Los factores que alteran la población de microorganismos del intestino grueso incluyen antibióticos, estrés y parásitos. [5]
Las bacterias constituyen la mayor parte de la flora del colon [44] y representan el 60% del nitrógeno fecal . [6] Este hecho hace que las heces sean una fuente ideal de flora intestinal para cualquier prueba y experimento mediante la extracción del ácido nucleico de las muestras fecales y la generación de secuencias del gen 16S rRNA bacteriano con cebadores bacterianos. Esta forma de prueba también suele ser preferible a técnicas más invasivas, como las biopsias.
Cinco filos dominan la microbiota intestinal: Bacteroidota , Bacillota (Firmicutes), Actinomycetota , Pseudomonadota y Verrucomicrobiota , con Bacteroidota y Bacillota constituyendo el 90% de la composición. [45] Entre 300 [6] y 1000 especies diferentes viven en el intestino, [18] con la mayoría de las estimaciones en alrededor de 500. [46] [47] Sin embargo, es probable que el 99% de las bacterias provengan de alrededor de 30 o 40 especies, siendo Faecalibacterium prausnitzii (filo firmicutes) la especie más común en adultos sanos. [7] [48]
Las investigaciones sugieren que la relación entre la flora intestinal y los humanos no es meramente comensal (una coexistencia no dañina), sino más bien una relación mutualista y simbiótica . [18] Aunque las personas pueden sobrevivir sin flora intestinal, [46] los microorganismos realizan una serie de funciones útiles, como fermentar sustratos energéticos no utilizados, entrenar el sistema inmunológico a través de productos finales del metabolismo como el propionato y el acetato , prevenir el crecimiento de especies dañinas, regular el desarrollo del intestino, producir vitaminas para el huésped (como la biotina y la vitamina K ) y producir hormonas para indicarle que almacene grasas. [5] La modificación y los desequilibrios extensos de la microbiota intestinal y su microbioma o colección de genes están asociados con la obesidad. [49] Sin embargo, en ciertas condiciones, se cree que algunas especies son capaces de causar enfermedades al causar infecciones o aumentar el riesgo de cáncer para el huésped. [6] [44]
Los hongos y los protistas también forman parte de la flora intestinal, pero se sabe menos sobre sus actividades. [50]
El viroma humano está compuesto principalmente de bacteriófagos . [51]
Existen patrones comunes de evolución de la composición del microbioma a lo largo de la vida. [52] En general, la diversidad de la composición de la microbiota de las muestras fecales es significativamente mayor en los adultos que en los niños, aunque las diferencias interpersonales son mayores en los niños que en los adultos. [53] Gran parte de la maduración de la microbiota hacia una configuración similar a la de los adultos ocurre durante los primeros tres años de vida. [53]
A medida que cambia la composición del microbioma, también cambia la composición de las proteínas bacterianas producidas en el intestino. En los microbiomas de los adultos, se ha encontrado una alta prevalencia de enzimas involucradas en la fermentación, la metanogénesis y el metabolismo de la arginina, el glutamato, el aspartato y la lisina. Por el contrario, en los microbiomas de los bebés, las enzimas dominantes están involucradas en el metabolismo de la cisteína y las vías de fermentación. [53]
La composición del microbioma intestinal depende del origen geográfico de las poblaciones. Las variaciones en la relación entre Prevotella , la representación del gen de la ureasa y la representación de los genes que codifican la glutamato sintasa/degradación u otras enzimas involucradas en la degradación de aminoácidos o la biosíntesis de vitaminas muestran diferencias significativas entre las poblaciones de origen estadounidense, de Malawi o amerindio. [53]
La población estadounidense tiene una alta representación de enzimas que codifican la degradación de glutamina y enzimas involucradas en la biosíntesis de vitaminas y ácido lipoico ; mientras que las poblaciones de Malawi y Amerindias tienen una alta representación de enzimas que codifican la glutamato sintasa y también tienen una sobrerrepresentación de α-amilasa en sus microbiomas. Como la población estadounidense tiene una dieta más rica en grasas que las poblaciones amerindias o malauíes que tienen una dieta rica en maíz, la dieta es probablemente el principal determinante de la composición bacteriana intestinal. [53]
Estudios posteriores han indicado una gran diferencia en la composición de la microbiota entre los niños europeos y los niños rurales africanos. Las bacterias fecales de los niños de Florencia se compararon con las de los niños del pequeño pueblo rural de Boulpon en Burkina Faso . La dieta de un niño típico que vive en este pueblo carece en gran medida de grasas y proteínas animales y es rica en polisacáridos y proteínas vegetales. Las bacterias fecales de los niños europeos estaban dominadas por Firmicutes y mostraron una marcada reducción en la biodiversidad, mientras que las bacterias fecales de los niños de Boulpon estaban dominadas por Bacteroidetes . La mayor biodiversidad y la diferente composición del microbioma intestinal en las poblaciones africanas pueden ayudar a la digestión de polisacáridos vegetales normalmente indigeribles y también pueden resultar en una menor incidencia de enfermedades colónicas no infecciosas. [54]
En una escala más pequeña, se ha demostrado que compartir numerosas exposiciones ambientales comunes en una familia es un fuerte determinante de la composición del microbioma individual. Este efecto no tiene influencia genética y se observa de manera consistente en poblaciones culturalmente diferentes. [53]
Los niños desnutridos tienen una microbiota intestinal menos madura y menos diversa que los niños sanos, y los cambios en el microbioma asociados con la escasez de nutrientes pueden a su vez ser una causa fisiopatológica de la desnutrición. [55] [56] Los niños desnutridos también suelen tener una flora intestinal más potencialmente patógena y más levadura en la boca y la garganta. [57] La modificación de la dieta puede provocar cambios en la composición y la diversidad de la microbiota intestinal. [58]
Los investigadores del American Gut Project y del Human Microbiome Project descubrieron que doce familias de microbios variaban en abundancia según la raza o la etnia del individuo. La fuerza de estas asociaciones está limitada por el pequeño tamaño de la muestra: el American Gut Project recopiló datos de 1.375 individuos, el 90% de los cuales eran blancos. [59] El estudio Healthy Life in an Urban Setting (HELIUS) en Ámsterdam descubrió que las personas de ascendencia holandesa tenían el nivel más alto de diversidad de microbiota intestinal, mientras que las de ascendencia del sur de Asia y Surinam tenían la diversidad más baja. Los resultados del estudio sugirieron que las personas de la misma raza o etnia tienen microbiomas más similares que las personas de diferentes orígenes raciales. [59]
En 2020, al menos dos estudios han demostrado un vínculo entre el nivel socioeconómico (NSE) de un individuo y su microbiota intestinal. Un estudio en Chicago descubrió que las personas en vecindarios con un nivel socioeconómico más alto tenían una mayor diversidad de microbiota. Las personas de vecindarios con un nivel socioeconómico más alto también tenían bacterias Bacteroides más abundantes. De manera similar, un estudio de gemelos en el Reino Unido descubrió que un nivel socioeconómico más alto también estaba relacionado con una mayor diversidad intestinal. [59]
El establecimiento de una flora intestinal es crucial para la salud de un adulto, así como para el funcionamiento del tracto gastrointestinal. [60] En los seres humanos, una flora intestinal similar a la de un adulto se forma entre uno y dos años después del nacimiento, ya que la microbiota se adquiere a través de la transmisión de padres a hijos y la transferencia de alimentos, agua y otras fuentes ambientales. [61] [12]

La visión tradicional del tracto gastrointestinal de un feto normal es que es estéril, aunque esta visión ha sido cuestionada en los últimos años. [ ¿período de tiempo? ] [62] Han comenzado a surgir múltiples líneas de evidencia que sugieren que puede haber bacterias en el ambiente intrauterino. En humanos, la investigación ha demostrado que la colonización microbiana puede ocurrir en el feto [63] con un estudio que mostró que las especies de Lactobacillus y Bifidobacterium estaban presentes en biopsias placentarias. [64] Varios estudios con roedores han demostrado la presencia de bacterias en el líquido amniótico y la placenta, así como en el meconio de bebés nacidos por cesárea estéril. [65] [66] En otro estudio, los investigadores administraron un cultivo de bacterias por vía oral a ratones preñados y detectaron las bacterias en la descendencia, probablemente como resultado de la transmisión entre el tracto digestivo y el líquido amniótico a través del torrente sanguíneo. [67] Sin embargo, los investigadores advierten que aún no se comprende la fuente de estas bacterias intrauterinas, si están vivas y su papel. [68] [64]
Durante el nacimiento y poco después, las bacterias de la madre y del entorno circundante colonizan el intestino del bebé. [12] Las fuentes exactas de bacterias no se comprenden por completo, pero pueden incluir el canal de parto, otras personas (padres, hermanos, trabajadores del hospital), la leche materna, los alimentos y el entorno general con el que interactúa el bebé. [69] Las investigaciones han demostrado que el microbioma de los bebés nacidos por vía vaginal difiere significativamente del de los bebés nacidos por cesárea y que los bebés nacidos por vía vaginal obtuvieron la mayoría de sus bacterias intestinales de su madre, mientras que la microbiota de los bebés nacidos por cesárea tenía más bacterias asociadas con los entornos hospitalarios. [70]
Durante el primer año de vida, la composición de la flora intestinal es generalmente simple y cambia mucho con el tiempo y no es la misma en todos los individuos. [12] La población bacteriana inicial son generalmente organismos anaeróbicos facultativos ; los investigadores creen que estos colonizadores iniciales disminuyen la concentración de oxígeno en el intestino, lo que a su vez permite que las bacterias anaeróbicas obligadas como Bacteroidota , Actinomycetota y Bacillota se establezcan y prosperen. [12] Los bebés amamantados se vuelven dominados por bifidobacterias , posiblemente debido al contenido de factores de crecimiento bifidobacterianos en la leche materna, y por el hecho de que la leche materna lleva componentes prebióticos, lo que permite un crecimiento bacteriano saludable. [64] [71] La leche materna también contiene niveles más altos de inmunoglobulina A (IgA) para ayudar con la tolerancia y regulación del sistema inmunológico del bebé. [72] Por el contrario, la microbiota de los bebés alimentados con fórmula es más diversa, con un alto número de Enterobacteriaceae , enterococos , bifidobacterias, Bacteroides y clostridios. [73]
La cesárea, los antibióticos y la alimentación con fórmula pueden alterar la composición del microbioma intestinal. [64] Los niños tratados con antibióticos tienen comunidades florales menos estables y menos diversas. [74] Se ha demostrado que las cesáreas alteran la transmisión de bacterias de madre a hijo, lo que afecta la salud general de la descendencia al aumentar los riesgos de enfermedades como la enfermedad celíaca , el asma y la diabetes tipo 1. [64] Esto evidencia aún más la importancia de un microbioma intestinal saludable. Se están explorando varios métodos de restauración del microbioma, que generalmente implican la exposición del bebé a los contenidos vaginales maternos y probióticos orales. [64]
Cuando se comenzó a estudiar la flora intestinal en 1995, [75] se pensaba que tenía tres funciones clave: defensa directa contra patógenos , fortalecimiento de la defensa del huésped por su papel en el desarrollo y mantenimiento del epitelio intestinal e inducción de la producción de anticuerpos allí, y metabolización de compuestos de los alimentos que de otro modo no serían digeribles. Trabajos posteriores descubrieron su papel en el entrenamiento del sistema inmunológico en desarrollo, y aún más trabajos se centraron en su papel en el eje intestino-cerebro . [76]
La comunidad de la flora intestinal desempeña un papel directo en la defensa contra los patógenos al colonizar completamente el espacio, hacer uso de todos los nutrientes disponibles y secretar compuestos conocidos como citocinas que matan o inhiben a los organismos no deseados que competirían con ella por los nutrientes. [77] Diferentes cepas de bacterias intestinales provocan la producción de diferentes citocinas. Las citocinas son compuestos químicos producidos por nuestro sistema inmunológico para iniciar la respuesta inflamatoria contra las infecciones. La alteración de la flora intestinal permite que se establezcan organismos competidores como el Clostridium difficile , que de otro modo se mantendrían en suspenso. [77]
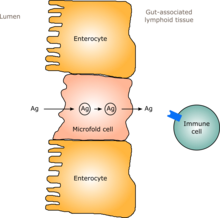
En los seres humanos, una flora intestinal similar a la de un adulto se forma entre uno y dos años después del nacimiento. [12] A medida que la flora intestinal se establece, el revestimiento de los intestinos (el epitelio intestinal y la barrera mucosa intestinal que secreta) también se desarrolla, de una manera que es tolerante e incluso favorecedora de los microorganismos comensales hasta cierto punto y también proporciona una barrera a los patógenos. [12] En concreto, las células caliciformes que producen la mucosa proliferan y la capa mucosa se engrosa, proporcionando una capa mucosa externa en la que los microorganismos "amistosos" pueden anclarse y alimentarse, y una capa interna que ni siquiera estos organismos pueden penetrar. [12] [13] Además, el desarrollo del tejido linfoide asociado al intestino (GALT), que forma parte del epitelio intestinal y que detecta y reacciona ante los patógenos, aparece y se desarrolla durante el tiempo en que la flora intestinal se desarrolla y se establece. [12] El GALT que se desarrolla es tolerante a las especies de flora intestinal, pero no a otros microorganismos. [ 12] El GALT normalmente también se vuelve tolerante a los alimentos a los que está expuesto el bebé, así como a los productos digestivos de los alimentos y a los metabolitos de la flora intestinal (moléculas formadas a partir del metabolismo) producidos a partir de los alimentos. [12]
El sistema inmunológico humano crea citocinas que pueden impulsar al sistema inmunológico a producir inflamación para protegerse, y que pueden reducir la respuesta inmunológica para mantener la homeostasis y permitir la curación después de una agresión o lesión. [12] Se ha demostrado que diferentes especies bacterianas que aparecen en la flora intestinal pueden impulsar al sistema inmunológico a crear citocinas de forma selectiva; por ejemplo, Bacteroides fragilis y algunas especies de Clostridia parecen impulsar una respuesta antiinflamatoria, mientras que algunas bacterias filamentosas segmentadas impulsan la producción de citocinas inflamatorias. [12] [78] La flora intestinal también puede regular la producción de anticuerpos por parte del sistema inmunológico. [12] [79] Una función de esta regulación es hacer que las células B cambien de clase a IgA . En la mayoría de los casos, las células B necesitan la activación de las células T auxiliares para inducir el cambio de clase ; sin embargo, en otra vía, la flora intestinal provoca la señalización de NF-kB por parte de las células epiteliales intestinales, lo que da como resultado la secreción de más moléculas de señalización. [80] Estas moléculas de señalización interactúan con las células B para inducir el cambio de clase a IgA. [80] La IgA es un tipo importante de anticuerpo que se utiliza en entornos mucosos como el intestino. Se ha demostrado que la IgA puede ayudar a diversificar la comunidad intestinal y ayuda a eliminar las bacterias que causan respuestas inflamatorias. [81] En última instancia, la IgA mantiene un entorno saludable entre el huésped y las bacterias intestinales. [81] Estas citocinas y anticuerpos pueden tener efectos fuera del intestino, en los pulmones y otros tejidos. [12]
El sistema inmunológico también puede verse alterado debido a la capacidad de las bacterias intestinales de producir metabolitos que pueden afectar a las células del sistema inmunológico. Por ejemplo, algunas bacterias intestinales pueden producir ácidos grasos de cadena corta (AGCC) a través de la fermentación . [82] Los AGCC estimulan un aumento rápido en la producción de células inmunes innatas como neutrófilos , basófilos y eosinófilos . [82] Estas células son parte del sistema inmunológico innato que intenta limitar la propagación de la infección.
Sin la flora intestinal, el cuerpo humano no podría utilizar algunos de los carbohidratos no digeridos que consume, porque algunos tipos de flora intestinal tienen enzimas de las que carecen las células humanas para descomponer ciertos polisacáridos . [14] Los roedores criados en un ambiente estéril y carentes de flora intestinal necesitan comer un 30% más de calorías solo para mantener el mismo peso que sus contrapartes normales. [14] Los carbohidratos que los humanos no pueden digerir sin ayuda bacteriana incluyen ciertos almidones , fibra , oligosacáridos y azúcares que el cuerpo no puede digerir ni absorber, como la lactosa en el caso de la intolerancia a la lactosa y los alcoholes de azúcar , el moco producido por el intestino y las proteínas. [9] [14]
Las bacterias convierten los carbohidratos que fermentan en ácidos grasos de cadena corta mediante una forma de fermentación llamada fermentación sacarolítica. [47] Los productos incluyen ácido acético , ácido propiónico y ácido butírico . [7] [47] Estos materiales pueden ser utilizados por las células huésped, proporcionando una fuente importante de energía y nutrientes. [47] Los gases (que están involucrados en la señalización [87] y pueden causar flatulencia ) y ácidos orgánicos , como el ácido láctico , también se producen por fermentación. [7] El ácido acético es utilizado por los músculos , el ácido propiónico facilita la producción hepática de ATP y el ácido butírico proporciona energía a las células intestinales. [47]
La flora intestinal también sintetiza vitaminas como la biotina y el folato , y facilita la absorción de minerales dietéticos , incluidos magnesio, calcio y hierro. [6] [25] Methanobrevibacter smithii es única porque no es una especie de bacteria, sino más bien un miembro del dominio Archaea , y es la especie arqueal productora de metano más abundante en la microbiota gastrointestinal humana. [88]
La microbiota intestinal también sirve como fuente de vitaminas K y B 12 , que no son producidas por el cuerpo o se producen en poca cantidad. [89] [90]
Las bacterias que degradan la celulosa (como Ruminococcus ) son frecuentes entre los grandes simios , las sociedades humanas antiguas, las comunidades de cazadores-recolectores e incluso las poblaciones rurales modernas. Sin embargo, son raras en las sociedades industrializadas. Las cepas asociadas a los humanos han adquirido genes que pueden degradar fibras vegetales específicas como el maíz , el arroz y el trigo . Las cepas bacterianas que se encuentran en los primates también pueden degradar la quitina , un polímero abundante en los insectos, que forman parte de la dieta de muchos primates no humanos . La disminución de estas bacterias en el intestino humano probablemente estuvo influenciada por el cambio hacia los estilos de vida occidentales. [91]
El metagenoma humano (es decir, la composición genética de un individuo y todos los microorganismos que residen en o dentro del cuerpo del individuo) varía considerablemente entre individuos. [92] [93] Dado que el número total de células microbianas en el cuerpo humano (más de 100 billones) supera en gran medida a las células del Homo sapiens (decenas de billones), [nota 1] [92] [94] existe un potencial considerable de interacciones entre los fármacos y el microbioma de un individuo, incluyendo: fármacos que alteran la composición del microbioma humano , metabolismo de fármacos por enzimas microbianas que modifican el perfil farmacocinético del fármaco y metabolismo microbiano de fármacos que afecta la eficacia clínica y el perfil de toxicidad de un fármaco . [92] [93] [95]
Además de los carbohidratos, la microbiota intestinal también puede metabolizar otros xenobióticos como fármacos, fitoquímicos y tóxicos alimentarios. Se ha demostrado que más de 30 fármacos son metabolizados por la microbiota intestinal. [96] El metabolismo microbiano de los fármacos a veces puede inactivarlos. [97]
La microbiota intestinal es una comunidad enriquecida que contiene diversos genes con enormes capacidades bioquímicas para modificar los fármacos, especialmente los que se toman por vía oral. [98] La microbiota intestinal puede afectar el metabolismo de los fármacos a través de mecanismos directos e indirectos. [99] El mecanismo directo está mediado por las enzimas microbianas que pueden modificar la estructura química de los fármacos administrados. [100] Por el contrario, la vía indirecta está mediada por los metabolitos microbianos que afectan la expresión de las enzimas metabolizadoras del huésped, como el citocromo P450 . [101] [99] Los efectos de la microbiota intestinal sobre la farmacocinética y la biodisponibilidad del fármaco se han investigado hace algunas décadas. [102] [103] [104] Estos efectos pueden variar; podría activar los fármacos inactivos como la lovastatina, [105] inactivar el fármaco activo como la digoxina [106] o inducir toxicidad del fármaco como en el irinotecán . [107] Desde entonces, se han estudiado en profundidad los efectos de la microbiota intestinal en la farmacocinética de muchos fármacos. [108] [98]
La microbiota intestinal humana desempeña un papel crucial en la modulación del efecto de los fármacos administrados en el ser humano. Directamente, la microbiota intestinal puede sintetizar y liberar una serie de enzimas con la capacidad de metabolizar fármacos, como la biotransformación microbiana de L-dopa por las enzimas descarboxilasa y deshidroxilasa. [100] Por el contrario, la microbiota intestinal también puede alterar el metabolismo de los fármacos modulando el metabolismo de los fármacos del huésped. Este mecanismo puede estar mediado por metabolitos microbianos o modificando los metabolitos del huésped que, a su vez, cambian la expresión de las enzimas metabolizadoras del huésped. [101]
Un gran número de estudios han demostrado el metabolismo de más de 50 fármacos por la microbiota intestinal. [108] [99] Por ejemplo, la lovastatina (un agente reductor del colesterol), que es un profármaco de lactona, es parcialmente activada por la microbiota intestinal humana formando metabolitos hidroxilados con ácido activo. [105] Por el contrario, la digoxina (un fármaco utilizado para tratar la insuficiencia cardíaca congestiva) es inactivada por un miembro de la microbiota intestinal (es decir, Eggerthella lanta ). [109] Eggerthella lanta tiene un operón codificador de citocromo regulado positivamente por digoxina y asociado con la inactivación de digoxina. [109] La microbiota intestinal también puede modular la eficacia y toxicidad de agentes quimioterapéuticos como el irinotecán. [110] Este efecto se deriva de las enzimas β-glucuronidasa codificadas por el microbioma que recuperan la forma activa del irinotecán causando toxicidad gastrointestinal. [111]
Esta comunidad microbiana en el intestino tiene una enorme capacidad bioquímica para producir metabolitos secundarios distintos que a veces se producen a partir de la conversión metabólica de alimentos dietéticos como fibras , compuestos biológicos endógenos como el indol o los ácidos biliares . [112] [113] [114] Los metabolitos microbianos, especialmente los ácidos grasos de cadena corta (AGCC) y los ácidos biliares secundarios (AB), desempeñan funciones importantes para el ser humano en estados de salud y enfermedad. [115] [116] [117]
Uno de los metabolitos bacterianos más importantes producidos por la microbiota intestinal son los ácidos biliares secundarios (AB). [114] Estos metabolitos se producen por la biotransformación bacteriana de los ácidos biliares primarios como el ácido cólico (CA) y el ácido quenodesoxicólico (CDCA) en ácidos biliares secundarios (AB) ácido litocólico (LCA) y ácido desoxicólico (DCA) respectivamente. [118] Los ácidos biliares primarios que son sintetizados por los hepatocitos y almacenados en la vesícula biliar poseen caracteres hidrofóbicos. Estos metabolitos son posteriormente metabolizados por la microbiota intestinal en metabolitos secundarios con mayor hidrofobicidad. [118] Las hidrolasas de sales biliares (BSH) que se conservan en los filos de la microbiota intestinal como Bacteroides , Firmicutes y Actinobacteria son responsables del primer paso del metabolismo de los ácidos biliares secundarios. [118] Se ha demostrado que los ácidos biliares secundarios (AB) como el DCA y el LCA inhiben tanto la germinación como el crecimiento de Clostridium difficile . [117]
La microbiota intestinal es importante para mantener la homeostasis en el intestino. El desarrollo del cáncer intestinal está asociado con un desequilibrio en la microflora natural (disbiosis). [119] El ácido biliar secundario ácido desoxicólico está asociado con alteraciones de la comunidad microbiana que conducen a un aumento de la carcinogénesis intestinal. [119] El aumento de la exposición del colon a los ácidos biliares secundarios resultantes de la disbiosis puede causar daño al ADN , y dicho daño puede producir mutaciones cancerígenas en las células del colon. [120] La alta densidad de bacterias en el colon (alrededor de 10 12 por ml) que están sujetas a disbiosis en comparación con la densidad relativamente baja en el intestino delgado (alrededor de 10 2 por ml) puede explicar la incidencia más de 10 veces mayor de cáncer en el colon en comparación con el intestino delgado. [120]
El eje intestino-cerebro es la señalización bioquímica que tiene lugar entre el tracto gastrointestinal y el sistema nervioso central . [76] Ese término se ha ampliado para incluir el papel de la flora intestinal en la interacción; el término "eje microbioma-cerebro" a veces se utiliza para describir paradigmas que incluyen explícitamente la flora intestinal. [76] [121] [122] En términos generales, el eje intestino-cerebro incluye el sistema nervioso central, los sistemas neuroendocrino y neuroinmune, incluido el eje hipotálamo-hipofisario-suprarrenal (eje HPA), los brazos simpático y parasimpático del sistema nervioso autónomo, incluido el sistema nervioso entérico , el nervio vago y la microbiota intestinal . [76] [122]
Una revisión sistemática de 2016 examinó los ensayos preclínicos y en pequeños ensayos humanos que se han realizado con ciertas cepas de bacterias probióticas disponibles comercialmente y encontró que entre las analizadas, los géneros Bifidobacterium y Lactobacillus ( B. longum , B. breve , B. infantis , L. helveticus , L. rhamnosus , L. plantarum y L. casei ) tenían el mayor potencial para ser útiles para ciertos trastornos del sistema nervioso central . [16]
La alteración del número de bacterias intestinales, por ejemplo mediante la toma de antibióticos de amplio espectro , puede afectar a la salud del huésped y a su capacidad para digerir los alimentos. [123] Los antibióticos pueden causar diarrea asociada a los antibióticos al irritar directamente el intestino , cambiar los niveles de microbiota o permitir el crecimiento de bacterias patógenas . [7] Otro efecto nocivo de los antibióticos es el aumento del número de bacterias resistentes a los antibióticos que se encuentran después de su uso, las cuales, cuando invaden al huésped, causan enfermedades que son difíciles de tratar con antibióticos. [123]
La modificación de la cantidad y las especies de la microbiota intestinal puede reducir la capacidad del cuerpo para fermentar carbohidratos y metabolizar los ácidos biliares , lo que puede provocar diarrea . Los carbohidratos que no se descomponen pueden absorber demasiada agua y provocar heces líquidas, o la falta de AGCC producidos por la microbiota intestinal puede provocar diarrea. [7]
Una reducción en los niveles de especies bacterianas nativas también altera su capacidad para inhibir el crecimiento de especies dañinas como C. difficile y Salmonella Kedougou, y estas especies pueden salirse de control, aunque su sobrecrecimiento puede ser incidental y no ser la verdadera causa de la diarrea. [6] [7] [123] Los protocolos de tratamiento emergentes para las infecciones por C. difficile implican el trasplante de microbiota fecal de heces de donantes (ver Trasplante fecal ). [124] Los informes iniciales del tratamiento describen tasas de éxito del 90%, con pocos efectos secundarios. Se especula que la eficacia resulta de la restauración de los equilibrios bacterianos de las clases de bacterias bacteroides y firmicutes. [125]
La composición del microbioma intestinal también cambia en las enfermedades graves, debido no solo al uso de antibióticos sino también a factores como la isquemia intestinal, la ingestión de alimentos y el compromiso inmunológico . Los efectos negativos de esto han generado interés en la descontaminación selectiva del tracto digestivo, un tratamiento para matar solo las bacterias patógenas y permitir el restablecimiento de las saludables. [126]
Los antibióticos alteran la población de la microbiota en el tracto gastrointestinal , y esto puede cambiar las interacciones metabólicas intracomunitarias, modificar la ingesta calórica mediante el uso de carbohidratos y afectar globalmente la homeostasis metabólica, hormonal e inmunitaria del huésped. [127]
Hay evidencia razonable de que tomar probióticos que contienen especies de Lactobacillus puede ayudar a prevenir la diarrea asociada a antibióticos y que tomar probióticos con Saccharomyces (por ejemplo, Saccharomyces boulardii ) puede ayudar a prevenir la infección por Clostridium difficile después del tratamiento con antibióticos sistémicos. [128]
La microbiota intestinal de una mujer cambia a medida que avanza el embarazo , con cambios similares a los que se observan en síndromes metabólicos como la diabetes. El cambio en la microbiota intestinal no causa efectos nocivos. La microbiota intestinal del recién nacido se asemeja a las muestras del primer trimestre de la madre. La diversidad del microbioma disminuye del primer al tercer trimestre, a medida que aumenta el número de ciertas especies. [64] [129]
Los probióticos son microorganismos que se cree que proporcionan beneficios para la salud cuando se consumen. [130] [131] Con respecto a la microbiota intestinal, los prebióticos son típicamente compuestos de fibra no digeribles que pasan sin digerir a través de la parte superior del tracto gastrointestinal y estimulan el crecimiento o la actividad de la flora intestinal beneficiosa al actuar como sustrato para ellos. [47] [132]
Los simbióticos se refieren a ingredientes alimentarios o suplementos dietéticos que combinan probióticos y prebióticos en una forma de sinergismo . [133]
El término "farmabióticos" se utiliza de diversas maneras para referirse a: formulaciones farmacéuticas (fabricación estandarizada que puede obtener la aprobación regulatoria como medicamento) de probióticos, prebióticos o simbióticos ; [134] probióticos que han sido modificados genéticamente u optimizados de otra manera para un mejor rendimiento (vida útil, supervivencia en el tracto digestivo, etc.); [135] y los productos naturales del metabolismo de la flora intestinal (vitaminas, etc.). [136]
Hay algunas evidencias de que el tratamiento con algunas cepas probióticas de bacterias puede ser eficaz en el síndrome del intestino irritable , [137] [138] distensión abdominal [139] y estreñimiento idiopático crónico . Los organismos con más probabilidades de producir una disminución de los síntomas incluyen:
Las heces de alrededor del 10-15% de las personas flotan constantemente en el agua del inodoro ("flotadores"), mientras que el resto produce heces que se hunden ("hundedores") y la producción de gas hace que las heces floten. [143] Mientras que los ratones convencionales a menudo producen "flotadores", los ratones gnotobióticos libres de gérmenes sin microbiota intestinal (criados en un aislador libre de gérmenes) producen "hundedores", y la colonización de la microbiota intestinal en ratones libres de gérmenes conduce a la transformación de los alimentos en biomasa microbiana y al enriquecimiento de múltiples especies bacterianas gasogénicas que convierten a los "hundedores" en "flotadores". [144]
Se realizaron pruebas para determinar si los medicamentos no antibióticos pueden afectar las bacterias asociadas al intestino humano mediante análisis in vitro en más de 1000 medicamentos comercializados contra 40 cepas bacterianas intestinales, lo que demostró que el 24% de los medicamentos inhibieron el crecimiento de al menos una de las cepas bacterianas. [145]
Recientemente se ha demostrado que la microbiota intestinal y el ejercicio están interconectados. Tanto el ejercicio moderado como el intenso suelen formar parte del régimen de entrenamiento de los atletas de resistencia, pero ejercen diferentes efectos sobre la salud. La interconexión entre la microbiota intestinal y los deportes de resistencia depende de la intensidad del ejercicio y del estado de entrenamiento. [146]
Las bacterias del tracto digestivo pueden contribuir a la aparición de enfermedades y verse afectadas por ellas de diversas maneras. La presencia o la sobreabundancia de algunos tipos de bacterias puede contribuir a la aparición de trastornos inflamatorios, como la enfermedad inflamatoria intestinal . [6] Además, los metabolitos de ciertos miembros de la flora intestinal pueden influir en las vías de señalización del huésped, lo que contribuye a la aparición de trastornos como la obesidad y el cáncer de colon . [6] Algunas bacterias intestinales también pueden causar infecciones y sepsis , por ejemplo, cuando se les permite pasar del intestino al resto del cuerpo . [6]
La infección por Helicobacter pylori puede iniciar la formación de úlceras de estómago cuando las bacterias penetran el revestimiento epitelial del estómago, provocando luego una respuesta fagocítica inflamatoria . [147] A su vez, la inflamación daña las células parietales que liberan ácido clorhídrico excesivo en el estómago y producen menos moco protector. [148] La lesión del revestimiento del estómago, que conduce a úlceras , se desarrolla cuando el ácido gástrico abruma las propiedades defensivas de las células e inhibe la síntesis endógena de prostaglandinas , reduce la secreción de moco y bicarbonato, reduce el flujo sanguíneo de la mucosa y disminuye la resistencia a las lesiones. [148] Las propiedades protectoras reducidas del revestimiento del estómago aumentan la vulnerabilidad a más lesiones y la formación de úlceras por el ácido del estómago, la pepsina y las sales biliares. [147] [148]
Las bacterias normalmente comensales pueden dañar al huésped si salen del tracto intestinal. [12] [13] La translocación, que ocurre cuando las bacterias abandonan el intestino a través de su revestimiento mucoso , puede ocurrir en varias enfermedades diferentes. [13] Si el intestino está perforado, las bacterias invaden el intersticio , causando una infección potencialmente mortal . [5] : 715
Los dos tipos principales de enfermedades inflamatorias del intestino , la enfermedad de Crohn y la colitis ulcerosa , son trastornos inflamatorios crónicos del intestino; las causas de estas enfermedades son desconocidas y se han implicado problemas con la flora intestinal y su relación con el huésped en estas afecciones. [15] [149] [150] [151] Además, parece que las interacciones de la flora intestinal con el eje intestino-cerebro tienen un papel en la EII, con estrés fisiológico mediado a través del eje hipotálamo-hipofisario-suprarrenal impulsando cambios en el epitelio intestinal y la flora intestinal a su vez liberando factores y metabolitos que desencadenan la señalización en el sistema nervioso entérico y el nervio vago . [4]
La diversidad de la flora intestinal parece estar significativamente disminuida en personas con enfermedades inflamatorias del intestino en comparación con personas sanas; además, en personas con colitis ulcerosa, Proteobacteria y Actinobacteria parecen dominar; en personas con enfermedad de Crohn, Enterococcus faecium y varias Proteobacteria parecen estar sobrerrepresentadas. [4]
Existe evidencia razonable de que corregir los desequilibrios de la flora intestinal tomando probióticos con Lactobacilli y Bifidobacteria puede reducir el dolor visceral y la inflamación intestinal en la EII. [128]
El síndrome del intestino irritable es el resultado del estrés y la activación crónica del eje HPA; sus síntomas incluyen dolor abdominal, cambios en los movimientos intestinales y un aumento de las citocinas proinflamatorias. En general, los estudios han encontrado que la microbiota luminal y mucosa está alterada en individuos con síndrome del intestino irritable, y estos cambios pueden estar relacionados con el tipo de irritación, como diarrea o estreñimiento . Además, hay una disminución en la diversidad del microbioma con niveles bajos de Lactobacilli y Bifidobacteria fecales, niveles altos de bacterias anaeróbicas facultativas como Escherichia coli y mayores proporciones de Firmicutes: Bacteroidetes. [122]
Con el asma, se han planteado dos hipótesis para explicar su creciente prevalencia en el mundo desarrollado. La hipótesis de la higiene postula que los niños en el mundo desarrollado no están expuestos a suficientes microbios y, por lo tanto, pueden contener una menor prevalencia de taxones bacterianos específicos que desempeñan funciones protectoras. [152] La segunda hipótesis se centra en la dieta de patrón occidental , que carece de cereales integrales y fibra y tiene una sobreabundancia de azúcares simples . [15] Ambas hipótesis convergen en el papel de los ácidos grasos de cadena corta (AGCC) en la inmunomodulación . Estos metabolitos de fermentación bacteriana están involucrados en la señalización inmunológica que previene el desencadenamiento del asma y los niveles más bajos de AGCC se asocian con la enfermedad. [152] [153] La falta de géneros protectores como Lachnospira , Veillonella , Rothia y Faecalibacterium se ha relacionado con niveles reducidos de AGCC. [152] Además, los AGCC son el producto de la fermentación bacteriana de la fibra, que es baja en la dieta de patrón occidental. [15] [153] Los AGCC ofrecen un vínculo entre la flora intestinal y los trastornos inmunológicos y, a partir de 2016, este era un área activa de investigación. [15] También se han postulado hipótesis similares para el aumento de las alergias a los alimentos y a otros alimentos. [154]
La conexión entre la microbiota intestinal y la diabetes mellitus tipo 1 también se ha relacionado con los AGCC, como el butirato y el acetato. Las dietas que producen butirato y acetato a partir de la fermentación bacteriana muestran una mayor expresión de T reg . [155] Las células T reg regulan negativamente las células T efectoras , lo que a su vez reduce la respuesta inflamatoria en el intestino. [156] El butirato es una fuente de energía para las células del colon. Las dietas que producen butirato reducen la permeabilidad intestinal al proporcionar suficiente energía para la formación de uniones estrechas . [157] Además, también se ha demostrado que el butirato reduce la resistencia a la insulina, lo que sugiere que las comunidades intestinales bajas en microbios productores de butirato pueden aumentar las posibilidades de adquirir diabetes mellitus tipo 2. [158] Las dietas que producen butirato también pueden tener posibles efectos de supresión del cáncer colorrectal . [157]
La flora intestinal se ha visto implicada en la obesidad y el síndrome metabólico debido a su papel clave en el proceso digestivo; la dieta de patrón occidental parece impulsar y mantener cambios en la flora intestinal que, a su vez, cambian la cantidad de energía que se deriva de los alimentos y cómo se utiliza esa energía. [151] [159] Un aspecto de una dieta saludable que a menudo falta en la dieta de patrón occidental es la fibra y otros carbohidratos complejos que una flora intestinal saludable requiere para florecer; los cambios en la flora intestinal en respuesta a una dieta de patrón occidental parecen aumentar la cantidad de energía generada por la flora intestinal, lo que puede contribuir a la obesidad y al síndrome metabólico. [128] También hay evidencia de que la microbiota influye en los comportamientos alimentarios en función de las preferencias de la microbiota, lo que puede llevar a que el huésped consuma más alimentos, lo que eventualmente resulta en obesidad. En general, se ha observado que con una mayor diversidad de microbioma intestinal, la microbiota gastará energía y recursos en competir con otra microbiota y menos en manipular al huésped. Lo opuesto se observa con una menor diversidad de microbioma intestinal, y estas microbiotas pueden trabajar juntas para crear antojos de alimentos en el huésped. [58]
Además, el hígado desempeña un papel dominante en la homeostasis de la glucosa en sangre al mantener un equilibrio entre la captación y el almacenamiento de glucosa a través de las vías metabólicas de la glucogénesis y la gluconeogénesis . Los lípidos intestinales regulan la homeostasis de la glucosa que involucra un eje intestino-cerebro-hígado. La administración directa de lípidos en el intestino superior aumenta los niveles de acil graso de cadena larga-coenzima A (LCFA-CoA) en el intestino superior y suprime la producción de glucosa incluso bajo vagotomía subdiafragmática o deaferenciación vagal intestinal . Esto interrumpe la conexión neuronal entre el cerebro y el intestino y bloquea la capacidad de los lípidos del intestino superior para inhibir la producción de glucosa. El eje intestino-cerebro-hígado y la composición de la microbiota intestinal pueden regular la homeostasis de la glucosa en el hígado y proporcionar posibles métodos terapéuticos para tratar la obesidad y la diabetes. [160]
Así como la flora intestinal puede funcionar en un ciclo de retroalimentación que puede impulsar el desarrollo de la obesidad, existe evidencia de que restringir la ingesta de calorías (es decir, hacer dieta ) puede impulsar cambios en la composición de la flora intestinal. [151]
La composición del microbioma intestinal humano es similar a la de otros grandes simios. Sin embargo, la biota intestinal de los humanos ha disminuido en diversidad y ha cambiado en composición desde nuestra separación evolutiva de Pan . [161] Los humanos muestran aumentos en Bacteroidetes, un filo bacteriano asociado con dietas ricas en proteínas y grasas animales, y disminuciones en Methanobrevibacter y Fibrobacter, grupos que fermentan polisacáridos vegetales complejos. [161] Estos cambios son el resultado de los cambios dietéticos, genéticos y culturales combinados que los humanos han experimentado desde la divergencia evolutiva de Pan . [ cita requerida ]
Además de los humanos y los vertebrados, algunos insectos también tienen una microbiota intestinal compleja y diversa que desempeña funciones nutricionales clave. [2] Las comunidades microbianas asociadas con las termitas pueden constituir la mayoría del peso de los individuos y desempeñar funciones importantes en la digestión de la lignocelulosa y la fijación de nitrógeno . [162] Estas comunidades son específicas del hospedador, y las especies de insectos estrechamente relacionadas comparten similitudes comparables en la composición de la microbiota intestinal. [163] [164] En las cucarachas , se ha demostrado que la microbiota intestinal se ensambla de manera determinista, independientemente del inóculo ; [165] la razón de este ensamblaje específico del hospedador sigue sin estar clara. Las comunidades bacterianas asociadas con insectos como las termitas y las cucarachas están determinadas por una combinación de fuerzas, principalmente la dieta, pero hay algunos indicios de que la filogenia del hospedador también puede desempeñar un papel en la selección de linajes. [163] [164]
Desde hace más de 51 años se sabe que la administración de dosis bajas de agentes antibacterianos promueve el crecimiento de los animales de granja para aumentar la ganancia de peso. [127]
En un estudio realizado en ratones, la proporción de Firmicutes y Lachnospiraceae se elevó significativamente en animales tratados con dosis subterapéuticas de diferentes antibióticos. Al analizar el contenido calórico de las heces y la concentración de ácidos grasos de cadena corta (AGCC) en el tracto gastrointestinal, se concluyó que los cambios en la composición de la microbiota conducen a una mayor capacidad para extraer calorías de constituyentes que de otro modo no serían digeribles y a una mayor producción de AGCC. Estos hallazgos proporcionan evidencia de que los antibióticos perturban no solo la composición del microbioma gastrointestinal sino también sus capacidades metabólicas, específicamente con respecto a los AGCC. [127]
Un grupo de científicos informa ahora de que existen sólo tres ecosistemas distintos en los intestinos de las personas que han estudiado.
Lactobacillus
spp. convierte el triptófano en indol-3-aldehído (I3A) a través de enzimas no identificadas [125].
Clostridium sporogenes
convierte el triptófano en IPA [6], probablemente a través de una triptófano desaminasa. ... El IPA también elimina de forma potente los radicales hidroxilo
Se demostró que la producción de IPA depende completamente de la presencia de microflora intestinal y podría establecerse mediante la colonización con la bacteria
Clostridium sporogenes
.
[El ácido indol-3-propiónico (IPA)] se ha identificado previamente en el plasma y el líquido cefalorraquídeo de humanos, pero sus funciones no se conocen. ... En experimentos de competencia cinética con agentes que atrapan radicales libres, la capacidad del IPA para eliminar radicales hidroxilo superó a la de la melatonina, una indolamina considerada el eliminador natural de radicales libres más potente. A diferencia de otros antioxidantes, el IPA no se convirtió en intermediarios reactivos con actividad prooxidante.
La composición del microbioma varía según el sitio anatómico (Figura 1). El determinante principal de la composición de la comunidad es la ubicación anatómica: la variación interpersonal es sustancial
23,24
y es mayor que la variabilidad temporal observada en la mayoría de los sitios en un solo individuo
25
.