Los inhibidores de mTOR son una clase de fármacos que se utilizan para tratar varias enfermedades humanas, entre ellas el cáncer, las enfermedades autoinmunes y la neurodegeneración. Funcionan inhibiendo la diana mamífera de la rapamicina (mTOR) (también conocida como diana mecanística de la rapamicina), que es una proteína quinasa específica de serina/treonina que pertenece a la familia de las quinasas relacionadas con la fosfatidilinositol-3 quinasa (PI3K) (PIKK). mTOR regula el metabolismo, el crecimiento y la proliferación celular mediante la formación y la señalización a través de dos complejos proteicos , mTORC1 y mTORC2 . Los inhibidores de mTOR más establecidos son los llamados rapálogos (rapamicina y sus análogos), que han mostrado respuestas tumorales en ensayos clínicos contra varios tipos de tumores. [1]
El descubrimiento de mTOR se realizó en 1994 mientras se investigaba el mecanismo de acción de su inhibidor , la rapamicina . [2] [3] La rapamicina fue descubierta por primera vez en 1975 en una muestra de suelo de la Isla de Pascua del Pacífico Sur , también conocida como Rapa Nui, de donde deriva su nombre. [4] La rapamicina es un macrólido , producido por el microorganismo Streptomyces hygroscopicus y mostró propiedades antifúngicas . Poco después de su descubrimiento, se detectaron propiedades inmunosupresoras , lo que más tarde llevó al establecimiento de la rapamicina como inmunosupresor. En la década de 1980, también se descubrió que la rapamicina tenía actividad anticancerígena, aunque el mecanismo de acción exacto permaneció desconocido hasta muchos años después. [2] [5] [6]
En la década de 1990 se produjo un cambio drástico en este campo debido a los estudios sobre el mecanismo de acción de la rapamicina y la identificación del objetivo farmacológico. [4] Se descubrió que la rapamicina inhibía la proliferación celular y la progresión del ciclo celular . La investigación sobre la inhibición de mTOR ha sido una rama en crecimiento en la ciencia y ha tenido resultados prometedores. [7]

En general, las proteínas quinasas se clasifican en dos categorías principales según su especificidad de sustrato: las proteínas tirosina quinasas y las proteínas serina/treonina quinasas . Las quinasas de especificidad dual son una subclase de las tirosina quinasas. [8]
mTOR es una quinasa dentro de la familia de las quinasas relacionadas con la fosfatidilinositol-3 quinasa (PIKKs) , [9] que es una familia de quinasas de proteína serina/treonina, con una similitud de secuencia con la familia de quinasas lipídicas, PI3Ks . [8] Estas quinasas tienen diferentes funciones biológicas, [8] pero todas son proteínas grandes con una estructura de dominio común. [9]

Las PIKK tienen cuatro dominios a nivel proteico, que las distinguen de otras proteínas quinasas. Desde el extremo N hasta el extremo C , estos dominios se denominan FRAP-ATM-TRAAP (FAT), el dominio quinasa (KD), el dominio regulador de PIKK (PRD) y el FAT-C-terminal (FATC). [8] El dominio FAT, que consta de cuatro hélices α , es N-terminal a KD, pero esa parte se conoce como el dominio de unión a rapamicina FKBP12 (FRB), que se une al complejo FKBP12-rapamicina. [8] El dominio FAT consta de repeticiones, denominadas HEAT ( Huntingtina , factor de elongación 3 , subunidad A de la proteína fosfatasa 2A y TOR1). [9] Los activadores de proteínas específicos regulan las quinasas PIKK, pero su unión al complejo de quinasas provoca un cambio conformacional que aumenta el acceso del sustrato al dominio de la quinasa. [9]
Las proteínas quinasas se han convertido en dianas farmacológicas populares. [10] Se han utilizado para el descubrimiento y diseño de inhibidores de moléculas pequeñas y productos biológicos como posibles agentes terapéuticos. Los inhibidores de moléculas pequeñas de las proteínas quinasas generalmente previenen la fosforilación de los sustratos de las proteínas o la autofosforilación de la propia quinasa. [11]
Parece que los factores de crecimiento , los aminoácidos , el ATP y los niveles de oxígeno regulan la señalización de mTOR. Varias vías posteriores que regulan la progresión del ciclo celular, [12] la traducción , la iniciación , las respuestas al estrés transcripcional, [13] la estabilidad de las proteínas y la supervivencia de las células se comunican mediante mTOR.

La serina/treonina quinasa mTOR es un efector descendente de la vía PI3K/AKT y forma dos complejos multiproteicos distintos , mTORC1 y mTORC2 . [1] Estos dos complejos tienen una red separada de proteínas asociadas, bucles de retroalimentación , sustratos y reguladores. [15] mTORC1 consta de mTOR y dos subunidades reguladoras positivas, raptor y mamífero LST8 ( mLST8 ), y dos reguladores negativos, sustrato AKT rico en prolina 40 (PRAS40) y DEPTOR. [1] mTORC2 consta de mTOR, mLST8, mSin1 , protor, rictor y DEPTOR. [16]
mTORC1 es sensible a la rapamicina, pero se considera que mTORC2 es resistente y generalmente es insensible a los nutrientes y las señales energéticas. mTORC2 es activado por factores de crecimiento , fosforila PKCα , AKT y paxilina , y regula la actividad de las pequeñas GTPasas , Rac y Rho relacionadas con la supervivencia celular, la migración y la regulación del citoesqueleto de actina .
La cascada de señalización mTORC1 es activada por AKT fosforilado y da como resultado la fosforilación de S6K1 y 4EBP1 , que conducen a la traducción del ARNm . [1]

Muchos tumores humanos se producen debido a la desregulación de la señalización de mTOR y pueden conferir una mayor susceptibilidad a los inhibidores de mTOR. [17] Las desregulaciones de múltiples elementos de la vía mTOR, como la amplificación / mutación de PI3K , la pérdida de función de PTEN , la sobreexpresión de AKT y la sobreexpresión de S6K1, 4EBP1 y eIF4E se han relacionado con muchos tipos de cáncer. Por lo tanto, mTOR es un objetivo terapéutico interesante para el tratamiento de múltiples cánceres, tanto con los inhibidores de mTOR por sí mismos como en combinación con inhibidores de otras vías. [1]
En sentido ascendente, la señalización PI3K/AKT se desregula a través de diversos mecanismos, entre los que se incluyen la sobreexpresión o activación de receptores de factores de crecimiento , como HER-2 (receptor 2 del factor de crecimiento epidérmico humano) e IGFR (receptor del factor de crecimiento similar a la insulina), mutaciones en PI3K y mutaciones/amplificaciones de AKT. [1] La fosfatasa supresora de tumores y el homólogo de la tensina eliminado en el cromosoma 10 (PTEN) es un regulador negativo de la señalización PI3K. En muchos cánceres, la expresión de PTEN disminuye y puede estar regulada a la baja a través de varios mecanismos, entre los que se incluyen mutaciones , pérdida de heterocigosidad , metilación e inestabilidad proteica. [16]
En sentido descendente, los efectores mTOR S6 kinase 1 (S6K1), eukaryotic starting factor 4E-binding protein 1 (4EBP1) y eukaryotic starting factor 4E (eIF4E) están relacionados con la transformación celular. [1] S6K1 es un regulador clave del crecimiento celular y también fosforila otros objetivos importantes. Tanto eIF4E como S6K1 están incluidos en la transformación celular y su sobreexpresión se ha relacionado con un mal pronóstico del cáncer. [16]
Desde el descubrimiento de mTOR, se han llevado a cabo muchas investigaciones sobre el tema, utilizando rapamicina y rapálogos para comprender sus funciones biológicas. [15] [18] Los resultados clínicos obtenidos al actuar sobre esta vía no fueron tan sencillos como se pensaba en un principio. Esos resultados han cambiado el curso de la investigación clínica en este campo. [15]
Inicialmente, la rapamicina se desarrolló como un fármaco antifúngico contra Candida albicans , Aspergillus fumigatus y Cryptococcus neoformans . [5] Unos años más tarde se detectaron sus propiedades inmunosupresoras. Estudios posteriores llevaron al establecimiento de la rapamicina como un importante inmunosupresor contra el rechazo de trasplantes , junto con la ciclosporina A. [ 2] La combinación de rapamicina con ciclosporina A mejoró la prevención del rechazo en el trasplante renal . Por lo tanto, fue posible utilizar dosis más bajas de ciclosporina, lo que minimizó la toxicidad del fármaco. [5]
En la década de 1980, la Rama Terapéutica del Desarrollo del Instituto Nacional del Cáncer (NCI) evaluó la rapamicina y descubrió que tenía una actividad anticancerígena y no era citotóxica, pero tenía actividad citostática contra varios tipos de cáncer humano. [5] Sin embargo, debido a las propiedades farmacocinéticas desfavorables, el desarrollo de inhibidores de mTOR para el tratamiento del cáncer no tuvo éxito en ese momento. [3] Desde entonces, la rapamicina también ha demostrado ser eficaz para prevenir la reestenosis de la arteria coronaria y para el tratamiento de enfermedades neurodegenerativas . [5]
El desarrollo de la rapamicina como agente anticancerígeno comenzó de nuevo en la década de 1990 con el descubrimiento del temsirolimus (CCI-779). Este nuevo derivado soluble de la rapamicina tenía un perfil toxicológico favorable en animales. Desde entonces se han desarrollado más derivados de la rapamicina con farmacocinética mejorada y efectos inmunosupresores reducidos para el tratamiento del cáncer . [5] Estos rapálogos incluyen temsirolimus (CCI-779), everolimus (RAD001) y ridaforolimus (AP-23573) que se están evaluando en ensayos clínicos sobre el cáncer . [19] Los análogos de la rapamicina tienen efectos terapéuticos similares a la rapamicina. Sin embargo, han mejorado la hidrofilicidad y se pueden utilizar para administración oral e intravenosa . [4] En 2012, el Instituto Nacional del Cáncer enumeró más de 200 ensayos clínicos que prueban la actividad anticancerígena de los rapálogos tanto como monoterapia o como parte de una terapia combinada para muchos tipos de cáncer. [7]
Los rapálogos, que son los inhibidores de mTOR de primera generación, han demostrado ser eficaces en una variedad de modelos preclínicos . Sin embargo, el éxito en los ensayos clínicos se limita a solo unos pocos cánceres raros. [20] Los estudios animales y clínicos muestran que los rapálogos son principalmente citostáticos y, por lo tanto, efectivos como estabilizadores de la enfermedad en lugar de para la regresión. [21] La tasa de respuesta en tumores sólidos donde se han utilizado rapálogos como terapia de agente único ha sido modesta. Debido a la inhibición parcial de mTOR como se mencionó anteriormente, los rapálogos no son suficientes para lograr un efecto anticanceroso amplio y sólido, al menos cuando se utilizan como monoterapia . [19] [20] [22]
Otra razón para el éxito limitado es que existe un ciclo de retroalimentación entre mTORC1 y AKT en ciertas células tumorales. Parece que la inhibición de mTORC1 por rapálogos no logra reprimir un ciclo de retroalimentación negativo que resulta en la fosforilación y activación de AKT. [18] [23] Estas limitaciones han llevado al desarrollo de la segunda generación de inhibidores de mTOR. [7]
La rapamicina y los rapálogos (derivados de la rapamicina) son inhibidores de moléculas pequeñas , [24] que se han evaluado como agentes anticancerígenos. Los rapálogos tienen un perfil farmacocinético más favorable en comparación con la rapamicina, el fármaco original, [3] a pesar de los mismos sitios de unión para mTOR y FKBP12. [5]

El producto natural bacteriano rapamicina o sirolimus , [6] un agente citostático , se ha utilizado en terapia combinada con corticosteroides y ciclosporina en pacientes que recibieron trasplante de riñón para prevenir el rechazo de órganos tanto en los EE. UU. [25] como en Europa, [26] debido a sus propiedades farmacocinéticas insatisfactorias. [3] En 2003, la Administración de Alimentos y Medicamentos de los EE. UU. aprobó los stents coronarios liberadores de sirolimus, que se utilizan en pacientes con estrechamiento de las arterias coronarias , o la llamada aterosclerosis . [27]
Recientemente, la rapamicina ha demostrado ser eficaz en la inhibición del crecimiento de varios cánceres humanos y líneas celulares murinas. [5] La rapamicina es el principal inhibidor de mTOR, pero ridaforolimus /deforolimus (AP23573), everolimus (RAD001) y temsirolimus (CCI-779) son los análogos de rapamicina desarrollados recientemente. [2]
El análogo de rapamicina temsirolimus (CCI-779) [2] también es un agente no citotóxico que retrasa la proliferación tumoral.
El temsirolimus es un profármaco de la rapamicina. Está aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) [25] y la Agencia Europea de Medicamentos (EMA), [28] para el tratamiento del carcinoma de células renales (CCR). El temsirolimus tiene una mayor solubilidad en agua que la rapamicina y, por lo tanto, se administra por inyección intravenosa. [3] [6] Fue aprobado el 30 de mayo de 2007 por la FDA para el tratamiento del CCR avanzado. [6]
El temsirolimus también se ha utilizado en un ensayo clínico de fase I junto con neratinib , un inhibidor irreversible de la tirosina quinasa pan-HER de molécula pequeña . Este estudio incluyó a pacientes que estaban siendo tratados por cáncer de mama amplificado por HER2 , cáncer de pulmón de células no pequeñas con mutación de HER2 y otros tumores sólidos avanzados. Si bien las toxicidades comunes incluyeron náuseas , estomatitis y anemia , se observaron respuestas. [29]

Everolimus es el segundo análogo novedoso de la rapamicina. [2] En comparación con el compuesto original rapamicina , everolimus es más selectivo para el complejo proteico mTORC1 , con poco impacto en el complejo mTORC2 . [30] Se ha demostrado que la inhibición de mTORC1 por everolimus normaliza los vasos sanguíneos tumorales, aumenta los linfocitos infiltrantes del tumor y mejora la terapia de transferencia celular adoptiva . [31]
Desde el 30 de marzo de 2009 hasta el 5 de mayo de 2011, la FDA de los EE. UU. aprobó everolimus para el tratamiento del carcinoma avanzado de células renales después del fracaso del tratamiento con sunitinib o sorafenib , astrocitoma subependimario de células gigantes (SEGA) asociado con esclerosis tuberosa (TS) y tumores neuroendocrinos progresivos de origen pancreático (PNET). [32] En julio y agosto de 2012, se aprobaron dos nuevas indicaciones, para cáncer de mama avanzado con receptor hormonal positivo y HER2 negativo en combinación con exemestano, y pacientes pediátricos y adultos con SEGA. [32] En 2009 y 2011, también se aprobó en toda la Unión Europea para cáncer de mama avanzado, tumores neuroendocrinos pancreáticos, carcinoma avanzado de células renales, [33] y SEGA en pacientes con esclerosis tuberosa. [34]
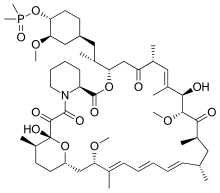
El ridaforolimus (AP23573, MK-8669), o deforolimus, es otro análogo de la rapamicina que no es un profármaco del sirolimus. [2] Al igual que el temsirolimus, se puede administrar por vía intravenosa y se está estimando una formulación oral para el tratamiento del sarcoma . [3]
El umirolimus es un inmunosupresor utilizado en stents liberadores de fármacos. [35]
El zotarolimus es un inmunosupresor utilizado en stents coronarios liberadores de fármacos. [36]

La segunda generación de inhibidores de mTOR se conoce como inhibidores de la quinasa mTOR ATP-competitivos. [7] [37] Los inhibidores duales mTORC1/mTORC2 como torin-1 , torin-2 y vistusertib, están diseñados para competir con el ATP en el sitio catalítico de mTOR. Inhiben todas las funciones dependientes de la quinasa de mTORC1 y mTORC2 y bloquean la activación por retroalimentación de la señalización PI3K/AKT, a diferencia de los rapálogos, que solo se dirigen a mTORC1. [7] [18] El desarrollo de estos fármacos ha llegado a ensayos clínicos, aunque algunos, como vistusertib, se han interrumpido. [37] Al igual que los rapálogos, disminuyen la traducción de proteínas , atenúan la progresión del ciclo celular e inhiben la angiogénesis en muchas líneas celulares cancerosas y también en el cáncer humano. De hecho, se ha demostrado que son más potentes que los rapálogos. [7]
En teoría, las ventajas más importantes de estos inhibidores de mTOR son la considerable disminución de la fosforilación de AKT en el bloqueo de mTORC2 y además una mejor inhibición en mTORC1. [15] Sin embargo, existen algunos inconvenientes. Si bien estos compuestos han sido eficaces en líneas celulares insensibles a la rapamicina, solo han demostrado un éxito limitado en tumores impulsados por KRAS . Esto sugiere que la terapia combinada puede ser necesaria para el tratamiento de estos cánceres. Otro inconveniente es también su posible toxicidad . Estos hechos han suscitado inquietudes sobre la eficacia a largo plazo de este tipo de inhibidores. [7]
La estrecha interacción de mTOR con la vía PI3K también ha llevado al desarrollo de inhibidores duales de mTOR/PI3K. [7] En comparación con los fármacos que inhiben mTORC1 o PI3K, estos fármacos tienen el beneficio de inhibir mTORC1, mTORC2 y todas las isoformas catalíticas de PI3K. Al actuar sobre ambas quinasas al mismo tiempo se reduce la regulación positiva de PI3K, que normalmente se produce con una inhibición de mTORC1. [15] Se ha demostrado que la inhibición de la vía PI3K/mTOR bloquea de forma potente la proliferación al inducir el arresto de G1 en diferentes líneas de células tumorales. También se ha observado una fuerte inducción de apoptosis y autofagia . A pesar de los buenos resultados prometedores, hay evidencia preclínica de que algunos tipos de cáncer pueden ser insensibles a esta inhibición dual. También es probable que los inhibidores duales de PI3K/mTOR tengan una mayor toxicidad. [7]
Los estudios de la rapamicina como agente inmunosupresor nos permitieron comprender su mecanismo de acción . [5] Inhibe la proliferación de células T y las respuestas proliferativas inducidas por varias citocinas , incluidas la interleucina 1 (IL-1) , IL-2 , IL-3 , IL-4 , IL-6 , IGF , PDGF y factores estimulantes de colonias (CSF) . [5] Los inhibidores de la rapamicina y los rapálogos pueden dirigirse al crecimiento tumoral tanto de forma directa como indirecta. El impacto directo de ellos sobre las células cancerosas depende de la concentración del fármaco y de ciertas características celulares. La forma indirecta se basa en la interacción con los procesos necesarios para la angiogénesis tumoral . [5]

La rapamicina y los rapálogos forman enlaces cruzados con la proteína de unión a la inmunofilina FK506 , tacrolimus o FKBP-12, a través de su grupo metoxi . El complejo rapamicina-FKBP12 interfiere con el dominio FRB de mTOR. [5] [6] La interacción molecular entre FKBP12, mTOR y rapamicina puede durar unos tres días (72 horas). La inhibición de mTOR bloquea la unión de la proteína accesoria raptor (proteína asociada a la regulación de mTOR) a mTOR, pero eso es necesario para la fosforilación posterior de S6K1 y 4EBP1 . [5] [22]
Como consecuencia, S6K1 se desfosforila, lo que reduce la síntesis de proteínas y disminuye la mortalidad y el tamaño celular. La rapamicina también induce la desfosforilación de 4EBP1, lo que resulta en un aumento de p27 y una disminución de la expresión de ciclina D1 . Eso conduce al bloqueo tardío del ciclo celular G1/S . Se ha demostrado que la rapamicina induce la muerte de células cancerosas al estimular la autofagia o la apoptosis , pero el mecanismo molecular de la apoptosis en las células cancerosas aún no se ha resuelto por completo. Una sugerencia de la relación entre la inhibición de mTOR y la apoptosis podría ser a través del objetivo descendente S6K1, que puede fosforilar BAD , una molécula proapoptótica, en Ser136. [5] Esa reacción rompe la unión de BAD a BCL-XL y BCL2 , inhibidores de la muerte mitocondrial , lo que resulta en la inactivación de BAD [5] y una disminución de la supervivencia celular. [6] También se ha demostrado que la rapamicina induce apoptosis independiente de p53 en ciertos tipos de cáncer. [5]

La angiogénesis tumoral depende de interacciones entre factores de crecimiento vascular endotelial que pueden activar PI3K/AKT/mTOR en células endoteliales, pericitos o células cancerosas. Ejemplos de estos factores de crecimiento son la angiopoyetina 1 (ANG1) , ANG 2, factor de crecimiento básico de fibroblastos (bFGF) , efrina-B2 , factor de crecimiento endotelial vascular (VEGF) y miembros de la superfamilia del factor de crecimiento tumoral-β (TGFβ) . Uno de los principales estímulos de la angiogénesis es la hipoxia, que resulta en la activación de factores de transcripción inducibles por hipoxia (HIF) y la expresión de ANG2, bFGF, PDGF, VEGF y VEGFR. La inhibición de la traducción de HIF1α al prevenir PDGF/PDGFR y VEGF/VEGFR puede ser resultado de la inhibición de mTOR. Un bloqueo del ciclo celular G0-G1 puede ser consecuencia de la inactivación de mTOR en pericitos y células endoteliales activados por hipoxia. [5]
Existe cierta evidencia de que la terapia prolongada con rapamicina también puede tener efecto sobre AKT y mTORC2. [2] [38]
La regulación farmacológica a la baja de la vía (mTOR) durante la quimioterapia en un modelo murino previene la activación de los folículos primordiales, preserva la función ovárica y mantiene la fertilidad normal utilizando los inhibidores INK y RAD disponibles clínicamente. De esa manera, ayuda a mantener la fertilidad durante los tratamientos de quimioterapia. Estos inhibidores de mTOR, cuando se administran como pretratamiento o cotratamiento con la quimioterapia gonadotóxica estándar, ayudan a mantener los folículos ováricos en su estado primordial. [39]
mTOR promueve la síntesis de proteínas necesaria para la plasticidad sináptica . [40] [41] Estudios en cultivos celulares y cortes de hipocampo indican que la inhibición de mTOR reduce la potenciación a largo plazo . [41] La activación de mTOR puede proteger contra cierta neurodegeneración asociada con ciertas enfermedades. [42] Por otro lado, la promoción de la autofagia por inhibición de mTOR puede reducir el deterioro cognitivo asociado con la neurodegeneración. [40]
Se ha demostrado que una reducción moderada de la actividad de mTOR en un 25-30% mejora la función cerebral, lo que sugiere que la relación entre mTOR y cognición se optimiza con dosis intermedias (2,24 mg/kg/día en ratones, equivalente humano de aproximadamente 0,19 mg/kg/día [43] ), donde dosis muy altas o muy bajas perjudican la cognición. [44] Se ha demostrado que la reducción de la citocina inflamatoria interleucina 1 beta (IL-1β) en ratones mediante la inhibición de mTOR (con rapamicina en dosis de 20 mg/kg/día, equivalente humano de aproximadamente 1,6 mg/kg/día [43] ) mejora el aprendizaje y la memoria. [45] Aunque IL-1β es necesaria para la memoria, IL-1β normalmente aumenta con la edad, lo que perjudica la función cognitiva. [44]
La región pipecolada de la estructura de la rapamicina parece necesaria para la unión de la rapamicina a FKBP12 . Este paso es necesario para la unión posterior de la rapamicina a la quinasa mTOR, que es la enzima clave en muchas acciones biológicas de la rapamicina. [46]
La alta afinidad de la unión de la rapamicina a FKBP12 se explica por el número de enlaces de hidrógeno a través de dos bolsillos de unión hidrofóbicos diferentes , y esto ha sido revelado por la estructura cristalina de rayos X del compuesto unido a la proteína . Las características estructurales comunes al temsirolimus y al sirolimus; el ácido pipecólico , la región tricarbonilo de C13-C15 y las funcionalidades de lactona desempeñan el papel clave en los grupos de unión con FKBP12. [19] [47]
Los enlaces de hidrógeno más importantes son el oxígeno del carbonilo de la lactona en C-21 a la cadena principal NH de Ile56 , el carbonilo de la amida en C-15 al grupo fenólico en la cadena lateral de Tyr82 y el protón hidroxilo en el carbono hemicetal , C-13, a la cadena lateral de Asp37 . [47]

Los cambios estructurales en la estructura de la rapamicina pueden afectar la unión a mTOR. Esto podría incluir la unión directa e indirecta como parte de la unión a FKBP12. La interacción del complejo FKBP12-rapamicina con mTOR se corresponde con la flexibilidad conformacional del dominio efector de la rapamicina. Este dominio consta de regiones moleculares que realizan interacciones hidrofóbicas con el dominio FKB y la región de trienos desde C-1-C-6, el grupo metoxi en C-7 y los grupos metilo en C-33, C-27 y C-25. Todos los cambios del anillo macrólido pueden tener efectos impredecibles en la unión y, por lo tanto, hacen que la determinación de SAR para rapálogos sea problemática. [47] [48]
La rapamicina no contiene grupos funcionales que se ionicen en el rango de pH de 1 a 10 y, por lo tanto, es bastante insoluble en agua. [24] A pesar de su eficacia en modelos de cáncer preclínico, su baja solubilidad en agua, su estabilidad y su larga vida media de eliminación dificultaron su uso parenteral, pero el desarrollo de análogos solubles de la rapamicina superó varias barreras. [2]
Sin embargo, los análogos de rapamicina que han sido aprobados para uso humano están modificados en el grupo hidroxilo C-43 y muestran mejoras en los parámetros farmacocinéticos , así como en las propiedades del fármaco, por ejemplo, la solubilidad. [48]
La rapamicina y el temsirolimus tienen estructuras químicas similares y se unen a FKBP12, aunque su mecanismo de acción difiere. [19]
El temsirolimus es un éster de ácido dihidroximetilpropiónico de la rapamicina y su primer derivado. [2] Por lo tanto, es más soluble en agua y, debido a su solubilidad en agua, se puede administrar mediante formulación intravenosa. [6] [19]
El everolimus tiene una sustitución de cadena de hidroxietilo O-2 y el deforolimus tiene una sustitución de óxido de fosfina en la posición C-43 en el anillo de lactona de la rapamicina. [19]
El deforolimus (Ridaforolimus) tiene una fracción de alcohol secundario C43 del grupo ciclohexilo de la rapamicina que fue sustituida por grupos fosfonato y fosfinato, lo que evita la unión de alta afinidad a mTOR y FKBP. Los estudios de modelado computacional ayudaron a la síntesis del compuesto. [6]
El tratamiento con inhibidores de mTOR puede complicarse por efectos adversos. Los efectos adversos más frecuentes son estomatitis, exantema, anemia, fatiga, hiperglucemia/hipertrigliceridemia, disminución del apetito, náuseas y diarrea. Además, la enfermedad pulmonar intersticial es un efecto adverso de particular importancia. La enfermedad pulmonar intersticial inducida por mTORi suele ser asintomática (con anomalías en vidrio esmerilado en la TC de tórax) o leve (con tos no productiva), pero también puede ser muy grave. Se han descrito incluso casos fatales. Por lo tanto, es esencial un diagnóstico y tratamiento cuidadosos. Recientemente, se ha propuesto un nuevo enfoque de manejo diagnóstico y terapéutico. [49]
La identificación de biomarcadores predictivos de eficacia para tipos de tumores sensibles a los inhibidores de mTOR sigue siendo un problema importante. [1] [50] Los posibles biomarcadores predictivos de la respuesta tumoral a los inhibidores de mTOR, como se ha descrito en células de glioblastoma , cáncer de mama y próstata , pueden ser la expresión diferencial de las proteínas de la vía mTOR, PTEN , AKT y S6. [1] Por lo tanto, estos datos se basan en ensayos preclínicos, basados en líneas celulares tumorales cultivadas in vitro , que sugieren que los efectos de los inhibidores de mTOR pueden ser más pronunciados en cánceres que muestran pérdida de funciones de PTEN o mutaciones de PIK3CA . Sin embargo, el uso de PTEN, mutaciones de PIK3CA y el estado de AKT-fosfo para predecir la sensibilidad al rapálogo no se ha validado completamente en la clínica. Hasta la fecha, los intentos de identificar biomarcadores de la respuesta al rapálogo no han tenido éxito. [21]
Los datos clínicos y translacionales sugieren que los tipos de tumores sensibles, con parámetros adecuados y vías de apoptosis funcionales , podrían no necesitar dosis altas de inhibidores de mTOR para desencadenar la apoptosis. En la mayoría de los casos, las células cancerosas podrían ser solo parcialmente sensibles a los inhibidores de mTOR debido a la transducción de señales redundante o la falta de vías de señalización de apoptosis funcionales. En situaciones como esta, podrían requerirse dosis altas de inhibidores de mTOR. En un estudio reciente de pacientes con carcinoma de células renales , la resistencia a Temsirolimus se asoció con niveles bajos de p-AKT y p-S6K1, que desempeñan el papel clave en la activación de mTOR. Estos datos sugieren firmemente el número de tumores con una vía de señalización PI3K/AKT/mTOR activada que no responde a los inhibidores de mTOR. Para estudios futuros, se recomienda excluir a los pacientes con niveles bajos o negativos de p-AKT de los ensayos con inhibidores de mTOR.
Los datos actuales son insuficientes para predecir la sensibilidad de los tumores a la rapamicina. Sin embargo, los datos existentes nos permiten caracterizar los tumores que podrían no responder a los rapálogos. [5]
Estos inhibidores de mTOR de segunda generación se unen al sitio de unión de ATP en el dominio de la quinasa mTOR necesario para las funciones de mTORC1 y mTORC2 , y dan como resultado una regulación negativa de la vía de señalización de mTOR. Debido a la capacidad de PI3K y mTORC2 para regular la fosforilación de AKT, estos dos compuestos desempeñan un papel clave en la minimización de la activación por retroalimentación de AKT. [20]
Se han desarrollado varios inhibidores duales de mTOR/PI3K (TPdI), que se encuentran en la etapa inicial de ensayos preclínicos y muestran resultados prometedores. Su desarrollo se ha beneficiado de estudios previos con inhibidores selectivos de PI3K. [20] La actividad de estas pequeñas moléculas difiere de la actividad rapáloga en la forma en que bloquea tanto la fosforilación de S6K1 dependiente de mTORC1 como la fosforilación del residuo Ser473 de AKT dependiente de mTORC2. [1]

Los inhibidores duales de mTOR/PI3K incluyen dactolisib , voxtalisib , BGT226, SF1126, PKI-587 y muchos más. Por ejemplo, Novartis ha desarrollado el compuesto NVPBE235 que se informó que inhibe el crecimiento tumoral en varios modelos preclínicos. Mejora la actividad antitumoral de algunos otros medicamentos como la vincristina . [20] Dactolisib parece inhibir eficazmente tanto la forma salvaje como la mutante de PI3KCA, lo que sugiere su uso contra una amplia variedad de tumores. Los estudios han demostrado una actividad antiproliferativa superior a los rapálogos y los modelos in vivo han confirmado estos potentes efectos antineoplásicos de los inhibidores duales de mTOR/PI3K. [1] [7] Estos inhibidores se dirigen a las isoformas de PI3K (p110α, β y γ) junto con los sitios de unión de ATP de mTORC1 y mTORC2 al bloquear la señalización de PI3K/AKT, incluso en tipos de cáncer con mutaciones en esta vía. [7]

Los nuevos inhibidores específicos de mTOR surgieron a partir de los esfuerzos de detección y descubrimiento de fármacos . Estos compuestos bloquean la actividad de ambos complejos mTOR y se denominan inhibidores duales mTORC1/mTORC2. [20] Los compuestos con estas características, como sapanisertib (nombre en código INK128), AZD8055 y AZD2014, han entrado en ensayos clínicos . Se ha estudiado una serie de estos inhibidores de la quinasa mTOR. Su estructura se deriva del andamiaje de morfolino pirazolopirimidina. [20] [22] [51] Se han realizado mejoras de este tipo de inhibidores intercambiando las morfolinas con morfolinas puenteadas en los inhibidores de pirazolopirimidina y los resultados mostraron un aumento de la selectividad a mTOR de 26000 veces. [22] [52]
Aunque la nueva generación de inhibidores de mTOR es muy prometedora para la terapia contra el cáncer y está pasando rápidamente a ensayos clínicos, hay muchas cuestiones importantes que determinan su éxito en la clínica. En primer lugar, no se dispone de biomarcadores predecibles para el beneficio de estos inhibidores. Parece que los determinantes genéticos predisponen a las células cancerosas a ser sensibles o resistentes a estos compuestos. Los tumores que dependen de la vía PI3K/mTOR deberían responder a estos agentes, pero no está claro si los compuestos son eficaces en cánceres con lesiones genéticas distintivas. [20]
La inhibición de mTOR es una estrategia prometedora para el tratamiento de varios tipos de cáncer. La limitada actividad clínica de los agentes selectivos de mTORC1 ha hecho que sea poco probable que tengan un impacto en el tratamiento del cáncer. El desarrollo de inhibidores catalíticos de ATP competitivos tiene la capacidad de bloquear tanto mTORC1 como mTORC2. [53]
Las limitaciones de los rapálogos actualmente disponibles han dado lugar a nuevos enfoques para la focalización de mTOR. Los estudios sugieren que los inhibidores de mTOR pueden tener actividad anticancerígena en muchos tipos de cáncer, como el CCR , los tumores neuroendocrinos , el cáncer de mama , el carcinoma hepatocelular , el sarcoma y el linfoma de células B grandes . [3] Una limitación importante para el desarrollo de la terapia de inhibición de mTOR es que actualmente no se dispone de biomarcadores para predecir qué paciente responderá a ellos. Aún se requiere una mejor comprensión de los mecanismos moleculares que intervienen en la respuesta de las células cancerosas a los inhibidores de mTOR para que esto sea posible. [7]
Una forma de superar la resistencia y mejorar la eficacia de los agentes dirigidos a mTOR puede ser mediante la estratificación de los pacientes y la selección de terapias de combinación de fármacos. Esto puede conducir a una terapia contra el cáncer más eficaz y personalizada. [1] [7] Aunque se necesita más investigación, la focalización de mTOR sigue siendo una opción terapéutica atractiva y prometedora para el tratamiento del cáncer. [7]