
Un esteroide es un compuesto orgánico con cuatro anillos fusionados (designados A, B, C y D) dispuestos en una configuración molecular específica .
Los esteroides tienen dos funciones biológicas principales: como componentes importantes de las membranas celulares que alteran la fluidez de la membrana ; y como moléculas de señalización . Los ejemplos incluyen el lípido colesterol , las hormonas sexuales estradiol y testosterona , [2] : 10–19 esteroides anabólicos y el fármaco corticosteroide antiinflamatorio dexametasona . [3] Cientos de esteroides se encuentran en hongos , plantas y animales . Todos los esteroides se fabrican en células a partir de los esteroles lanosterol ( opistocontos ) o cicloartenol (plantas). El lanosterol y el cicloartenol se derivan de la ciclización del triterpeno escualeno . [4]
Los esteroides reciben su nombre del esteroide colesterol [5] , que se describió por primera vez en los cálculos biliares a partir del griego antiguo chole- ' bilis ' y stereos 'sólido'. [6] [7] [8]
El núcleo esteroide ( estructura central ) se llama gonano (ciclopentanoperhidrofenantreno). [9] Por lo general, está compuesto por diecisiete átomos de carbono , unidos en cuatro anillos fusionados: tres anillos de ciclohexano de seis miembros (anillos A, B y C en la primera ilustración) y un anillo de ciclopentano de cinco miembros (el anillo D). Los esteroides varían según los grupos funcionales unidos a este núcleo de cuatro anillos y por el estado de oxidación de los anillos. Los esteroles son formas de esteroides con un grupo hidroxi en la posición tres y un esqueleto derivado del colestano . [1] : 1785f [10] Los esteroides también pueden modificarse de forma más radical, como por ejemplo mediante cambios en la estructura del anillo, por ejemplo, cortando uno de los anillos. Cortar el anillo B produce secosteroides, uno de los cuales es la vitamina D 3 .


El gonano , también conocido como esterano o ciclopentanoperhidrofenantreno, el esteroide más simple y el núcleo de todos los esteroides y esteroles, [11] [12] está compuesto por diecisiete átomos de carbono en enlaces carbono-carbono que forman cuatro anillos fusionados en una forma tridimensional . Los tres anillos de ciclohexano (A, B y C en la primera ilustración) forman el esqueleto de un derivado perhidro del fenantreno . El anillo D tiene una estructura de ciclopentano . Cuando están presentes los dos grupos metilo y ocho cadenas laterales de carbono (en C-17, como se muestra para el colesterol), se dice que el esteroide tiene una estructura de colestano. Las dos formas estereoisoméricas comunes 5α y 5β de los esteroides existen debido a las diferencias en el lado del sistema de anillo en gran parte plano donde está unido el átomo de hidrógeno (H) en el carbono-5, lo que da como resultado un cambio en la conformación del anillo A del esteroide. La isomerización en la cadena lateral C-21 produce una serie paralela de compuestos, denominados isoesteroides. [13]
Ejemplos de estructuras esteroides son:
Además de las escisiones (divisiones), expansiones y contracciones de los anillos (divisiones y recierres en anillos más grandes o más pequeños), todas ellas variaciones en la estructura del enlace carbono-carbono, los esteroides también pueden variar:
Por ejemplo, los esteroles como el colesterol y el lanosterol tienen un grupo hidroxilo unido en la posición C-3, mientras que la testosterona y la progesterona tienen un carbonilo (sustituyente oxo) en C-3. Entre estos compuestos, solo el lanosterol tiene dos grupos metilo en C-4. El colesterol, que tiene un doble enlace C-5 a C-6, se diferencia de la testosterona y la progesterona, que tienen un doble enlace C-4 a C-5.
Casi todos los esteroides biológicamente relevantes pueden presentarse como un derivado de una estructura de hidrocarburo similar al colesterol que sirve como esqueleto . [14] [15] Estas estructuras parentales tienen nombres específicos, como pregnano , androstano , etc. Los derivados llevan varios grupos funcionales llamados sufijos o prefijos después de los números respectivos, indicando su posición en el núcleo esteroide. [16] Hay nombres de esteroides triviales ampliamente utilizados de origen natural con actividad biológica significativa, como progesterona , testosterona o cortisol . Algunos de estos nombres se definen en La nomenclatura de los esteroides. [17] Estos nombres triviales también se pueden usar como base para derivar nuevos nombres, sin embargo, agregando solo prefijos en lugar de sufijos, por ejemplo, el esteroide 17α-hidroxiprogesterona tiene un grupo hidroxi (-OH) en la posición 17 del núcleo esteroide en comparación con la progesterona.
Las letras α y β [18] denotan la estereoquímica absoluta en los centros quirales , una nomenclatura específica distinta de la convención R/S [19] de la química orgánica para denotar la configuración absoluta de los grupos funcionales, conocida como reglas de prioridad de Cahn-Ingold-Prelog . La convención R/S asigna prioridades a los sustituyentes en un centro quiral en función de su número atómico. El grupo de mayor prioridad se asigna al átomo con el número atómico más alto, y el grupo de menor prioridad se asigna al átomo con el número atómico más bajo. Luego, la molécula se orienta de modo que el grupo de menor prioridad apunte lejos del observador, y los tres grupos restantes se organizan en orden de prioridad decreciente alrededor del centro quiral. Si esta disposición es en el sentido de las agujas del reloj, se le asigna una configuración R; si es en el sentido contrario a las agujas del reloj, se le asigna una configuración S. [20] Por el contrario, la nomenclatura de esteroides utiliza α y β para denotar la estereoquímica en los centros quirales. Las designaciones α y β se basan en la orientación de los sustituyentes entre sí en un sistema de anillo específico. En general, α se refiere a un sustituyente que está orientado hacia el plano del sistema de anillo, mientras que β se refiere a un sustituyente que está orientado en dirección contraria al plano del sistema de anillo. En los esteroides dibujados desde la perspectiva estándar utilizada en este artículo, los enlaces α se representan en las figuras como cuñas discontinuas y los enlaces β como cuñas sólidas. [14]
El nombre " 11-desoxicortisol " es un ejemplo de un nombre derivado que utiliza cortisol como estructura principal sin un átomo de oxígeno (de ahí "desoxi") unido a la posición 11 (como parte de un grupo hidroxi). [14] [21] La numeración de las posiciones de los átomos de carbono en el núcleo del esteroide se establece en una plantilla que se encuentra en la Nomenclatura de esteroides [22] que se utiliza independientemente de si un átomo está presente en el esteroide en cuestión. [14]
Los carbonos insaturados (generalmente, los que forman parte de un doble enlace) en el núcleo esteroide se indican cambiando -ano a -eno. [23] Este cambio se hacía tradicionalmente en el nombre original, añadiendo un prefijo para indicar la posición, con o sin Δ (delta mayúscula griega) que designa insaturación, por ejemplo, 4-pregneno-11β,17α-diol-3,20-diona (también Δ 4 -pregneno-11β,17α-diol-3,20-diona) o 4-androsteno-3,11,17-triona (también Δ 4 -androsteno-3,11,17-triona). Sin embargo, la Nomenclatura de Esteroides recomienda que el localizador de un doble enlace esté siempre adyacente a la sílaba que designa la insaturación, por lo tanto, teniéndolo como sufijo en lugar de prefijo, y sin el uso del carácter Δ, es decir, pregn-4-eno-11β,17α-diol-3,20-diona o androst-4-eno-3,11,17-triona . El doble enlace se designa por el átomo de carbono de número más bajo, es decir, "Δ 4 -" o "4-eno" significa el doble enlace entre las posiciones 4 y 5. La saturación de carbonos de un esteroide original se puede realizar añadiendo el prefijo "dihidro-", [24] es decir, una saturación de los carbonos 4 y 5 de la testosterona con dos átomos de hidrógeno es 4,5α-dihidrotestosterona o 4,5β-dihidrotestosterona. Generalmente, cuando no hay ambigüedad, se puede omitir un número de una posición de hidrógeno de un esteroide con un enlace saturado, dejando solo la posición del segundo átomo de hidrógeno, por ejemplo, 5α-dihidrotestosterona o 5β-dihidrotestosterona . Los esteroides Δ 5 son aquellos con un doble enlace entre los carbonos 5 y 6 y los esteroides Δ 4 son aquellos con un doble enlace entre los carbonos 4 y 5. [25] [23]
Las abreviaturas como " P4 " para progesterona y " A4 " para androstenediona se refieren a Δ 4 -esteroides, mientras que " P5 " para pregnenolona y " A5 " para androstenediol se refieren a Δ 5 -esteroides. [14]
El sufijo -ol denota un grupo hidroxi , mientras que el sufijo -ona denota un grupo oxo. Cuando dos o tres grupos idénticos están unidos a la estructura base en diferentes posiciones, el sufijo se indica como -diol o -triol para hidroxi, y -diona o -triona para grupos oxo, respectivamente. Por ejemplo, 5α-pregnano-3α,17α-diol-20-ona tiene un átomo de hidrógeno en la posición 5α (de ahí el prefijo "5α-"), dos grupos hidroxi (-OH) en las posiciones 3α y 17α (de ahí el sufijo "3α,17α-diol") y un grupo oxo (=O) en la posición 20 (de ahí el sufijo "20-ona"). Sin embargo, se pueden encontrar usos erróneos de sufijos, por ejemplo, "5α-pregnan-17α-diol-3,11,20-triona" [26] [ sic ] —ya que tiene solo un grupo hidroxi (en 17α) en lugar de dos, entonces el sufijo debería ser -ol, en lugar de -diol, para que el nombre correcto sea "5α-pregnan-17α-ol-3,11,20-triona".
Según la regla establecida en la Nomenclatura de Esteroides, la "e" terminal en el nombre de la estructura original debe ser eliminada antes de la vocal (la presencia o ausencia de un número no afecta dicha elisión). [14] [16] Esto significa, por ejemplo, que si el sufijo inmediatamente añadido al nombre de la estructura original comienza con una vocal, la "e" final se elimina de ese nombre. Un ejemplo de dicha eliminación es " 5α-pregnan-17α-ol-3,20-dione ", donde la última "e" de " pregnane " se elimina debido a la vocal ("o") al comienzo del sufijo -ol. Algunos autores usan incorrectamente esta regla, eliminando la "e" terminal donde debería mantenerse, o viceversa. [27]
El término "11-oxigenado" se refiere a la presencia de un átomo de oxígeno como un sustituyente oxo (=O) o hidroxi (-OH) en el carbono 11. "Oxigenado" se utiliza consistentemente dentro de la química de los esteroides [28] desde la década de 1950. [29] Algunos estudios utilizan el término "11-oxiandrógenos" [30] [31] como una abreviatura de andrógenos 11-oxigenados, para enfatizar que todos tienen un átomo de oxígeno unido al carbono en la posición 11. [32] [33] Sin embargo, en la nomenclatura química, el prefijo "oxi" está asociado con grupos funcionales éter, es decir, un compuesto con un átomo de oxígeno conectado a dos grupos alquilo o arilo (ROR), [34] por lo tanto, el uso de "oxi" dentro del nombre de una clase de esteroides puede ser engañoso. Se pueden encontrar ejemplos claros de "oxigenado" para referirse a una amplia clase de moléculas orgánicas que contienen una variedad de grupos funcionales que contienen oxígeno en otros dominios de la química orgánica, [35] y es apropiado utilizar esta convención. [14]
Aunque "ceto" es un prefijo estándar en química orgánica, las recomendaciones de 1989 de la Comisión Conjunta de Nomenclatura Bioquímica desalientan la aplicación del prefijo "ceto" para los nombres de esteroides y favorecen el prefijo "oxo" (por ejemplo, esteroides 11-oxo en lugar de esteroides 11-ceto), porque "ceto" incluye el carbono que es parte del núcleo del esteroide y el mismo átomo de carbono no debe especificarse dos veces. [36] [14]
Los esteroides se encuentran en todos los dominios de la vida, incluidas las bacterias , las arqueas y los eucariotas . En los eucariotas, los esteroides se encuentran en hongos, plantas y animales. [37] [38]
Las células eucariotas , que incluyen animales, plantas, hongos y protistas, tienen estructuras celulares complejas con un núcleo verdadero y orgánulos limitados por membrana. [39]
Los esteroides son parte integral de las membranas celulares eucariotas, donde ayudan a mantener la integridad y la función de la membrana. [40]
Durante la eucariogénesis (la aparición de las células eucariotas modernas), los esteroides probablemente jugaron un papel en la adquisición de mitocondrias a través de endocitosis. [41]
En los procariotas , existen vías biosintéticas para la estructura esteroide tetracíclica (por ejemplo, en mixobacterias ) [42] –donde se conjetura que su origen proviene de eucariotas [43] – y la estructura hopanoide triterpinoide pentacíclica más común . [44]
Los esteroides fúngicos incluyen los ergosteroles , que participan en el mantenimiento de la integridad de la membrana celular fúngica. Varios fármacos antimicóticos , como la anfotericina B y los antimicóticos azólicos , utilizan esta información para matar hongos patógenos . [45] Los hongos pueden alterar su contenido de ergosterol (por ejemplo, a través de mutaciones de pérdida de función en las enzimas ERG3 o ERG6 , que inducen el agotamiento de ergosterol, o mutaciones que disminuyen el contenido de ergosterol) para desarrollar resistencia a los fármacos que se dirigen al ergosterol. [46]
El ergosterol es análogo al colesterol que se encuentra en las membranas celulares de los animales (incluidos los humanos), o los fitoesteroles que se encuentran en las membranas celulares de las plantas. [46] Todos los hongos contienen grandes cantidades de ergosterol, en el rango de decenas a cientos de miligramos por cada 100 gramos de peso seco. [46] El oxígeno es necesario para la síntesis de ergosterol en los hongos. [46]
El ergosterol es responsable del contenido de vitamina D que se encuentra en los hongos; el ergosterol se convierte químicamente en provitamina D2 por exposición a la luz ultravioleta . [46] La provitamina D2 forma espontáneamente vitamina D2. [46] Sin embargo, no todos los hongos utilizan ergosterol en sus membranas celulares; por ejemplo, la especie fúngica patógena Pneumocystis jirovecii no lo hace, lo que tiene importantes implicaciones clínicas (dado el mecanismo de acción de muchos fármacos antimicóticos). Usando el hongo Saccharomyces cerevisiae como ejemplo, otros esteroides importantes incluyen ergosta-5,7,22,24(28)-tetraen-3β-ol, zimosterol y lanosterol . S. cerevisiae utiliza 5,6-dihidroergosterol en lugar de ergosterol en su membrana celular. [46]
Los esteroides vegetales incluyen alcaloides esteroides encontrados en Solanaceae [47] y Melanthiaceae (especialmente el género Veratrum ), [48] glucósidos cardíacos , [49] los fitoesteroles y los brasinoesteroides (que incluyen varias hormonas vegetales).
Los esteroides animales incluyen compuestos de origen vertebrado e insecto , entre los que se incluyen ecdisteroides como la ecdisterona (que controla la muda en algunas especies). Entre los ejemplos de vertebrados se incluyen las hormonas esteroides y el colesterol; este último es un componente estructural de las membranas celulares que ayuda a determinar la fluidez de las membranas celulares y es un componente principal de la placa (implicada en la aterosclerosis ). Las hormonas esteroides incluyen:
Las principales clases de hormonas esteroides , con miembros destacados y ejemplos de funciones relacionadas, son: [50] [51]
Las clases adicionales de esteroides incluyen:
Además de la siguiente clase de secosteroides (esteroides de anillo abierto):
Los esteroides se pueden clasificar según su composición química. [52] Un ejemplo de cómo MeSH realiza esta clasificación está disponible en el catálogo MeSH de Wikipedia. Algunos ejemplos de esta clasificación son:

En biología, es común nombrar las clases de esteroides anteriores por el número de átomos de carbono presentes cuando se hace referencia a las hormonas: esteroides C 18 para los estranos (principalmente estrógenos), esteroides C 19 para los androstanos (principalmente andrógenos) y esteroides C 21 para los pregnanos (principalmente corticosteroides). [53] La clasificación " 17-cetoesteroide " también es importante en medicina.
El gonano (núcleo esteroide) es la molécula de hidrocarburo tetracíclico de 17 carbonos sin cadenas laterales de alquilo . [54]
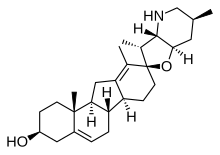
Los secosteroides (del latín seco , "cortar") son una subclase de compuestos esteroidales que resultan, biosintéticamente o conceptualmente, de la escisión (división) de anillos esteroides progenitores (generalmente uno de los cuatro). Las principales subclases de secosteroides se definen por los átomos de carbono del esteroide donde ha tenido lugar esta escisión. Por ejemplo, el secoteroide prototípico colecalciferol , vitamina D3 ( mostrada), está en la subclase 9,10-secosteroides y deriva de la escisión de los átomos de carbono C-9 y C-10 del anillo B del esteroide; los 5,6-secosteroides y los 13,14-esteroides son similares. [55]
Los noresteroides ( nor- , L. norma ; "normal" en química, lo que indica la eliminación de carbono) [56] y los homosteroides (homo-, griego homos ; "igual", lo que indica la adición de carbono) son subclases estructurales de esteroides formados a partir de pasos biosintéticos. Los primeros implican reacciones enzimáticas de expansión-contracción del anillo , y los últimos se logran ( biomiméticamente ) o (más frecuentemente) a través de cierres de anillo de precursores acíclicos con más (o menos) átomos de anillo que la estructura del esteroide original. [57]
En la naturaleza se conocen combinaciones de estas alteraciones de los anillos. Por ejemplo, las ovejas que pastan en lirios de maíz ingieren ciclopamina (mostrada) y veratramina , dos de una subfamilia de esteroides donde los anillos C y D se contraen y expanden respectivamente a través de una migración biosintética del átomo C-13 original. La ingestión de estos homosteroides C-nor-D produce defectos de nacimiento en los corderos: ciclopía por ciclopamina y deformidad en las patas por veratramina. [58] Otro homosteroides C-nor-D (nakiterpiosina) es excretado por las cianobacterias de Okinawa , por ejemplo, Terpios hoshinota , lo que provoca la mortalidad de los corales por la enfermedad del coral negro. [59] Los esteroides de tipo nakiterpiosina son activos contra la vía de señalización que involucra a las proteínas smoothened y hedgehog , una vía que es hiperactiva en varios cánceres. [ cita requerida ]
Los esteroides y sus metabolitos a menudo funcionan como moléculas de señalización (los ejemplos más notables son las hormonas esteroides), y los esteroides y los fosfolípidos son componentes de las membranas celulares . [60] Los esteroides como el colesterol disminuyen la fluidez de la membrana . [61] Al igual que los lípidos , los esteroides son depósitos de energía altamente concentrados. Sin embargo, no suelen ser fuentes de energía; en los mamíferos, normalmente se metabolizan y excretan.
Los esteroides desempeñan un papel fundamental en una serie de trastornos, incluidas enfermedades malignas como el cáncer de próstata , donde la producción de esteroides dentro y fuera del tumor promueve la agresividad de las células cancerosas. [62]

Los cientos de esteroides que se encuentran en animales, hongos y plantas están hechos de lanosterol (en animales y hongos; ver ejemplos anteriores) o cicloartenol (en otros eucariotas). Tanto el lanosterol como el cicloartenol derivan de la ciclización del triterpenoide escualeno . [4] El lanosterol y el cicloartenol a veces se denominan protosteroles porque sirven como compuestos iniciales para todos los demás esteroides.
La biosíntesis de esteroides es una vía anabólica que produce esteroides a partir de precursores simples. En los animales se sigue una vía biosintética única (en comparación con muchos otros organismos ), lo que la convierte en un objetivo común para los antibióticos y otros medicamentos antiinfecciosos. El metabolismo de los esteroides en los seres humanos también es el objetivo de los medicamentos para reducir el colesterol, como las estatinas . En los seres humanos y otros animales, la biosíntesis de esteroides sigue la vía del mevalonato, que utiliza acetil-CoA como bloques de construcción para el difosfato de dimetilalilo (DMAPP) y el difosfato de isopentenilo (IPP). [63] [ se necesita una mejor fuente ]
En los pasos posteriores, DMAPP e IPP se conjugan para formar farnesil difosfato (FPP), que a su vez se conjuga entre sí para formar el triterpenoide lineal escualeno. La biosíntesis de escualeno es catalizada por la escualeno sintasa , que pertenece a la familia de las escualenos/fitoenos sintasas . La epoxidación y ciclización posteriores del escualeno generan lanosterol, que es el punto de partida para modificaciones adicionales en otros esteroides (esteroidogénesis). [64] En otros eucariotas, el producto de ciclización del escualeno epoxidado (oxidoscualeno) es cicloartenol.

La vía del mevalonato (también llamada vía de la HMG-CoA reductasa) comienza con acetil-CoA y termina con difosfato de dimetilalilo (DMAPP) y difosfato de isopentenilo (IPP).
DMAPP e IPP donan unidades de isopreno , que se ensamblan y modifican para formar terpenos e isoprenoides [65] (una gran clase de lípidos, que incluyen los carotenoides y forman la clase más grande de productos naturales de las plantas ). [66] Aquí, las unidades de isopreno activadas se unen para formar escualeno y se pliegan en un conjunto de anillos para formar lanosterol . [67] El lanosterol luego se puede convertir en otros esteroides, como el colesterol y el ergosterol . [67] [68]
Hay dos clases de medicamentos que actúan sobre la vía del mevalonato : las estatinas (como la rosuvastatina ), que se utilizan para reducir los niveles elevados de colesterol , [69] y los bifosfonatos (como el zoledronato ), que se utilizan para tratar diversas enfermedades degenerativas de los huesos. [70]

La esteroidogénesis es el proceso biológico por el cual los esteroides se generan a partir del colesterol y se transforman en otros esteroides. [72] Las vías de la esteroidogénesis difieren entre especies. Las principales clases de hormonas esteroides, como se señaló anteriormente (con sus miembros y funciones prominentes), son los progestágenos , los corticosteroides (corticoides), los andrógenos y los estrógenos . [25] [73] La esteroidogénesis humana de estas clases ocurre en varios lugares:
En plantas y bacterias, la vía no mevalonato (vía MEP) utiliza piruvato y gliceraldehído 3-fosfato como sustratos para producir IPP y DMAPP. [65] [78]
Durante las enfermedades, se pueden utilizar vías que de otro modo no serían importantes en los seres humanos sanos. Por ejemplo, en una forma de hiperplasia suprarrenal congénita, una deficiencia en la vía enzimática de la 21-hidroxilasa conduce a un exceso de 17α-hidroxiprogesterona (17-OHP); este exceso patológico de 17-OHP a su vez puede convertirse en dihidrotestosterona (DHT, un potente andrógeno) a través, entre otras, de la 17,20 liasa (un miembro de la familia de enzimas del citocromo P450 ), la 5α-reductasa y la 3α-hidroxiesteroide deshidrogenasa . [79]
Los esteroides son oxidados principalmente por las enzimas oxidasas del citocromo P450 , como CYP3A4 . Estas reacciones introducen oxígeno en el anillo esteroide, lo que permite que el colesterol sea descompuesto por otras enzimas en ácidos biliares. [80] Estos ácidos pueden luego eliminarse por secreción del hígado en la bilis . [81] La expresión del gen de la oxidasa puede ser regulada positivamente por el sensor de esteroides PXR cuando hay una alta concentración de esteroides en sangre. [82] Las hormonas esteroides, que carecen de la cadena lateral del colesterol y los ácidos biliares, generalmente se hidroxilan en varias posiciones del anillo o se oxidan en la posición 17 , se conjugan con sulfato o ácido glucurónico y se excretan en la orina. [83]
El aislamiento de esteroides , dependiendo del contexto, es el aislamiento de la materia química necesaria para la elucidación de la estructura química , la derivatización o la química de degradación, las pruebas biológicas y otras necesidades de investigación (generalmente miligramos a gramos, pero a menudo más [84] o el aislamiento de "cantidades analíticas" de la sustancia de interés (donde el enfoque está en identificar y cuantificar la sustancia (por ejemplo, en tejido o fluido biológico). La cantidad aislada depende del método analítico, pero generalmente es menos de un microgramo. [85] [ página necesaria ]
Los métodos de aislamiento para lograr las dos escalas de producto son distintos, pero incluyen extracción , precipitación, adsorción , cromatografía y cristalización . En ambos casos, la sustancia aislada se purifica hasta homogeneidad química; se eligen métodos combinados de separación y análisis, como LC-MS , para que sean "ortogonales" (logran sus separaciones en función de distintos modos de interacción entre la sustancia y la matriz de aislamiento) para detectar una sola especie en la muestra pura.
La determinación de la estructura se refiere a los métodos para determinar la estructura química de un esteroide puro aislado, utilizando una gama cambiante de métodos químicos y físicos que incluyen la RMN y la cristalografía de moléculas pequeñas . [2] : 10–19 Los métodos de análisis se superponen a las dos áreas anteriores, haciendo hincapié en los métodos analíticos para determinar si un esteroide está presente en una mezcla y determinar su cantidad. [85]
El catabolismo microbiano de las cadenas laterales de fitosterol produce esteroides C-19, esteroides C-22 y 17-cetosteroides (es decir, precursores de hormonas adrenocorticales y anticonceptivos ). [86] [87] [88] La adición y modificación de grupos funcionales es clave a la hora de producir la amplia variedad de medicamentos disponibles dentro de esta clasificación química. Estas modificaciones se realizan utilizando técnicas convencionales de síntesis orgánica y/o biotransformación . [89] [90]
La semisíntesis de esteroides a menudo comienza a partir de precursores como el colesterol , [88] fitoesteroles , [87] o sapogeninas . [91] Los esfuerzos de Syntex , una empresa involucrada en el comercio del barbasco mexicano , utilizaron Dioscorea mexicana para producir la sapogenina diosgenina en los primeros días de la industria farmacéutica de esteroides sintéticos . [84]
Algunas hormonas esteroides se obtienen económicamente solo por síntesis total a partir de productos petroquímicos (por ejemplo, los esteroides 13- alquilo ). [88] Por ejemplo, el fármaco Norgestrel comienza a partir de metoxi - 1-tetralona , un petroquímico derivado del fenol .
Se han otorgado varios premios Nobel por investigaciones sobre esteroides, entre ellos:
"Je nommerai cholesterine , de χολη, bile, et στερεος, solide, la sustancia cristallisée des calculs biliares humains, ..." (nombraré colesterina – de χολη (bilis) y στερεος (sólido) – la sustancia cristalizada de los cálculos biliares humanos ... )
condensados en unión no lineal o fenantreno (A, B y C) y un anillo de ciclopentano (D).1,2[ enlace muerto permanente ]
3S‐1.0. Definición de esteroides y esteroles. Los esteroides son compuestos que poseen el esqueleto de ciclopenta[a]fenantreno o un esqueleto derivado del mismo por una o más escisiones de enlaces o expansiones o contracciones de anillo. Los grupos metilo están normalmente presentes en C-10 y C-13. Una cadena lateral de alquilo también puede estar presente en C-17. Los esteroles son esteroides que llevan un grupo hidroxilo en C-3 y la mayor parte del esqueleto del colestano.
3S-4. GRUPOS FUNCIONALES. 3S-4.0. General. Casi todos los esteroides biológicamente importantes son derivados de los hidrocarburos originales (cf. Tabla 1) que llevan varios grupos funcionales. [...] Se añaden sufijos al nombre del sistema parental saturado o insaturado (véase 33-2.5), elidiéndose la e terminal de -ano, -eno, -ino, -adieno, etc. antes de una vocal (la presencia o ausencia de numerales no tiene efecto sobre dichas elisiones).
3S‐4.9. Nombres triviales de esteroides importantes En la Tabla 2 se dan ejemplos de nombres triviales conservados para derivados de esteroides importantes, que son principalmente compuestos naturales de actividad biológica significativa.
3S‐1.4. Orientación de las fórmulas de proyección. Cuando los anillos de un esteroide se denotan como proyecciones sobre el plano del papel, la fórmula normalmente se orientará como en 2a. Un átomo o grupo unido a un anillo representado como en la orientación 2a se denomina α (alfa) si se encuentra debajo del plano del papel o β (beta) si se encuentra sobre el plano del papel.
P‐91.2.1.1 Estereodescriptores de Cahn-Ingold-Prelog (CIP). Se recomiendan algunos estereodescriptores descritos en el sistema de prioridad de Cahn-Ingold-Prelog (CIP), denominados 'estereodescriptores CIP', para especificar la configuración de compuestos orgánicos, tal como se describe y ejemplifica en este Capítulo y se aplica en los Capítulos P‐1 a P‐8, y en la nomenclatura de productos naturales en el Capítulo P-10. Los siguientes estereodescriptores se utilizan como estereodescriptores preferidos (véase P‐92.1.2): (a) 'R' y 'S', para designar la configuración absoluta de los centros de quiralidad tetracoordinados (cuadriligantes);
P‐13.8.1.1 El prefijo 'de' (no 'des'), seguido del nombre de un grupo o átomo (distinto del hidrógeno), denota la eliminación (o pérdida) de ese grupo y la adición de los átomos de hidrógeno necesarios, es decir, el intercambio de ese grupo con átomos de hidrógeno. Como excepción, 'desoxi', cuando se aplica a compuestos hidroxi, denota la eliminación de un átomo de oxígeno de un grupo –OH con la reconexión del átomo de hidrógeno. 'Desoxi' se usa ampliamente como prefijo sustractivo en la nomenclatura de carbohidratos (véase P‐102.5.3).
3S-1.1. Numeración y letras de los anillos. Los esteroides se numeran y los anillos se escriben con letras como en la fórmula 1 .
3S‐2.5 Insaturación. La insaturación se indica cambiando -ano a -eno, -adieno, -ino, etc., o -an- a -en-, -adien-, -yn-, etc. Ejemplos: Androst-5-eno, no 5-androsteno; 5α-Cholest-6-eno; 5β-Cholesta-7,9(11)-dieno; 5α-Cholest-6-en-3β-ol. Notas. 1) Ahora se recomienda que el localizador de un doble enlace esté siempre adyacente a la sílaba que designa la insaturación.[...] 3) No se recomienda el uso del carácter Δ (delta mayúscula griega) para designar la insaturación en nombres individuales. Sin embargo, se puede utilizar en términos genéricos, como 'Δ
5
-esteroides'
P-31.2.2 Metodología general. Los prefijos 'hidro' y 'deshidro' están asociados con la hidrogenación y deshidrogenación, respectivamente, de un doble enlace; por lo tanto, los prefijos multiplicadores de valores pares, como 'di', 'tetra', etc. se utilizan para indicar la saturación de un doble enlace (por ejemplo, 'dihidro', 'tetrahidro'); o la creación de enlaces dobles (o triples), como 'didehidro', etc. En los nombres, se colocan inmediatamente al principio del nombre del hidruro original y delante de cualquier prefijo no separable. Los átomos de hidrógeno indicados tienen prioridad sobre los prefijos 'hidro' para localizadores bajos. Si los átomos de hidrógeno indicados están presentes en un nombre, los prefijos 'hidro' los preceden.
oxi* –O– P-15.3.1.2.1.1; P-63.2.2.1.1
El prefijo oxo- también debería utilizarse en relación con términos genéricos, p. ej., esteroides 17-oxo. El término 'esteroides 17-ceto', que se utiliza a menudo en la literatura médica, es incorrecto porque C-17 se especifica dos veces, ya que el término ceto denota C=O.
{{cite web}}: CS1 maint: bot: original URL status unknown (link)