La transformación de Richter (RT), también conocida como síndrome de Richter , es la conversión de la leucemia linfocítica crónica (LLC) o su variante, el linfoma linfocítico pequeño (SLL), en una enfermedad nueva y más agresivamente maligna. [1] CLL es la circulación de linfocitos B malignos con o sin infiltración de estas células en tejidos linfáticos u otros, mientras que SLL es la infiltración de estos linfocitos B malignos en tejidos linfáticos y/u otros con poca o ninguna circulación de estas células en la sangre. [2] CLL junto con su variante SLL se agrupan en el término CLL/SLL. [1]
La RT se diagnostica en personas que tienen CLL/SLL que se convierte en una enfermedad maligna con la histopatología microscópica de linfoma difuso de células B grandes (DLBCL) o, menos comúnmente, linfoma de Hodgkin (HL). [3] Hay casos raros de: 1) CLL/SLL que se convierten en linfoma linfoblástico , leucemia de células pilosas o un linfoma de células T de alto grado [4] como el linfoma anaplásico de células grandes o el linfoma angioinmunoblástico de células T ; [5] 2) CLL/SLL que se convierten en leucemia mieloide aguda ; [6] 3) CLL/SLL que se convierten o desarrollan neoplasias malignas no hematológicas como cáncer de pulmón, cáncer de cerebro, melanoma de ojo o piel, [5] [7] tumores de glándulas salivales y sarcomas de Kaposi ; [8] y 4) conversión de linfoma folicular , linfoma linfoblástico o linfoma de zona marginal en otros tipos de neoplasias malignas hematológicas. [9] Si bien algunas de estas conversiones se han denominado RT, la Organización Mundial de la Salud [10] y la mayoría de las revisiones han definido la RT como una conversión de CLL/SLL en una enfermedad con histopatología de DLBCL o HL. Aquí, las RT se consideran CLL/SLL que se convierten en una enfermedad con histopatología de DLBCL (aquí denominada DLBCL-RT) o histopatología de linfoma de Hodgkin (aquí denominada HL-RT).
CLL/SLL es la leucemia adulta más común en los países occidentales y representa el 1,2% de los nuevos cánceres diagnosticados cada año en los Estados Unidos. Suele ocurrir en adultos mayores ( edad media en el momento del diagnóstico 70 años) y sigue un curso indolente durante muchos años. [11] Aproximadamente entre el 1% y el 10% de los CLL/SLL desarrollan una transformación de Richter a una tasa del 0,5% al 1% por año. En estudios anteriores, se informó que la enfermedad transformada era mucho más agresiva que CLL/SLL con tiempos de supervivencia medios generales (es decir, tiempos en los que el 50% de los casos permanecen vivos) entre 1,1 y 16,3 meses. Los regímenes terapéuticos más nuevos están mejorando el pronóstico de DLBCL-RT y HL-RT. [12]
En 1928, Maurice Richter informó que un paciente con LLC desarrolló una agresiva inflamación generalizada de sus ganglios linfáticos , hígado y bazo debido a su infiltración por "células similares a sarcoma" de rápido crecimiento. El paciente falleció a causa de esta enfermedad a los 22 días de su presentación. El Dr. Richter denominó el trastorno "sarcoma de células reticulares generalizado". [13] En 1964, Lortholary et al. describieron la aparición de DLBCL en pacientes con LLC y denominaron a la condición transformación de Richter. [14] Estudios posteriores combinaron SLL con CLL e incluyeron HL-RT con DLBCL-RT en la definición de CLL/SLL RT. [4]
Los estudios han informado que CLL/SLL se transforma en DLBCL-RT en ~90% y en HL-RT en 0,7-15% de todos los RT. [1] Estas transformaciones pueden ocurrir en cualquier momento del curso de CLL/SLL. En un estudio de 77 personas, DLBCL-RT y HL-RT fueron diagnosticados simultáneamente con CLL/SLL en 6 casos o entre 3 y 171 meses después de haber sido diagnosticados con CLL/SLL en 71 casos. [15] Un estudio de 10 casos de RT informó que un individuo presentó CLL/SLL transformado y 9 se transformaron entre 12 y 111 meses después de haber sido diagnosticados con CLL/SLL. [9] La mediana de tiempo entre el diagnóstico de CLL/SLL y RT ha variado entre 1,8 y 5 años en otros 5 estudios. [dieciséis]
Los individuos con CLL/SLL que desarrollan RT típicamente presentan un rápido aumento en el tamaño de sus ganglios linfáticos superficiales (es decir , cervicales , axilares , inguinales y/o retrofaríngeos ); Esta puede ser la única señal de la transformación. [2] Otros síntomas pueden incluir síntomas B (es decir, fiebre en ausencia de infección, sudores nocturnos intensos y/o pérdida de peso inexplicable) y/o deterioro de la salud general. Estos síntomas suelen ir acompañados del desarrollo de enfermedades extraganglionares, es decir, hinchazón o tumores debido a la infiltración de linfocitos B malignos en el tracto gastrointestinal , [17] huesos, piel, sistema nervioso central , bazo , hígado, [2] orina. vejiga, glándula tiroides y/o pleura pulmonar . [9] Los hallazgos anormales de laboratorio incluyen elevación de los niveles de lactato deshidrogenasa en sangre en 50 a 80% de los casos, anemia que empeora progresivamente (es decir, disminución de los glóbulos rojos ), trombocitopenia (es decir, disminución de las plaquetas ), [1] y/o hipercalcemia ( es decir, elevación de los niveles de calcio sérico debido a menudo a afectación ósea). [6] La tomografía computarizada por emisión de positrones con FDG (es decir, FDG-PET-CT) puede determinar los sitios de invasión de tejido, los mejores sitios para la biopsia y, en algunos casos, sugerir el diagnóstico de DLBCL-RT al mostrar que los tejidos involucrados tienen niveles distintivamente altos de absorción de FDG. [2] [12] [18] Las personas que presentan RT en el momento del diagnóstico de CLL/SLL mostrarán estos síntomas y signos junto con evidencia histopatológica microscópica de CLL/SLL simultáneamente con DLBCL-RT o HL-RT.
Se considera que las personas con CLL/SLL tienen un mayor riesgo de desarrollar RT si tienen: 1) ganglios linfáticos, hígado y/o bazo agrandados; 2) enfermedad en etapa avanzada; 3) recuentos bajos de plaquetas en sangre y/o niveles elevados de beta-2-microglobulina sérica; 4) células CLL/SLL que desarrollan deleciones en el gen CDKN2A , alteraciones del gen TP53 , activación del gen C-MYC , trisomía (es decir, extra) del cromosoma 12 o mutaciones en el gen NOTCH1 ; [12] y/o 5) tratamiento previo de CLL/SLL con regímenes de quimioterapia que combinan análogos de purina y agentes alquilantes , múltiples tipos diferentes de quimioterapia, [12] y/o combinaciones de fludarabina , ciclofosfamida y rituximab (este último régimen se ha asociado con un riesgo 2,38 veces mayor de que CLL/SLL desarrolle un RT). [8]
La histopatología microscópica de DLBCL-RT en ganglios linfáticos afectados y otros tejidos teñidos con hemotoxilina y eosina generalmente muestra láminas confluentes de linfocitos B malignos grandes que se asemejan a centroblastos en ~80% de los casos o inmunoblastos en el ~20% restante de los casos. Estos linfocitos B malignos expresan la proteína de membrana de superficie CD20 en casi todos los casos, la proteína de membrana de superficie PD-1 en hasta el 80% de los casos (los niveles altos de PD-1 ayudan a las células cancerosas a evadir el sistema inmunológico del huésped), la proteína de membrana de superficie CD5 en ~30% de los casos, y proteína de membrana de superficie CD23 en ~15% de los casos. En el 90-95% de los casos, estas células también expresan IRF4 (un factor de transcripción que regula el desarrollo de los linfocitos, incluidos los linfocitos B) o en el otro 5-10% de los casos CD10 (una enzima que se encuentra en las células neoplásicas de las células pre-B). leucemias celulares y algunos casos de CLL/SLL). [12]
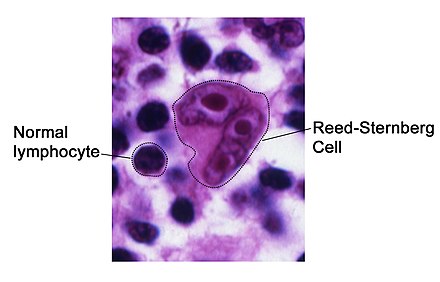
La histopatología de los tejidos implicados en HL-RT se diagnostica en función de la presencia de células de Reed-Sternberg (aquí denominadas células RS). La micrografía adyacente muestra una célula RS típica, rodeada de linfocitos normales. Las células RS son distintivamente grandes y tienen múltiples núcleos , como en su caso, o un núcleo con dos lóbulos. Las células RS expresan la proteína de la superficie celular CD30 (un miembro de la familia de receptores del factor de necrosis tumoral ) y CD15 (un carbohidrato de antígeno del grupo sanguíneo en la superficie celular). [19] Un estudio informó que las células RS en HL-RT no expresan CD20 [19] pero otro informó que ~35% sí lo hace. [20] Estas células también expresan una proteína ubicada en el núcleo celular , el factor 1 de unión al potenciador linfoide , en ~80% de los casos. [19] Las células RS en HL-RT están diseminadas en 1) un fondo similar a CLL/SLL de linfocitos pequeños de forma variable o 2) un fondo similar a células inflamatorias de histiocitos epitelioides , eosinófilos y células plasmáticas que es similar a que se encuentra en muchos casos de linfoma de Hodgkin no debido a RT (aquí denominado HL-no RT). Los casos de HL-RT con antecedentes similares a CLL/SLL se denominan HL-RT tipo 1 (o tipo I) y aquellos con antecedentes similares a células inflamatorias se denominan HL-RT tipo 2 (o tipo II). [1] Si bien algunos estudios han considerado las lesiones con histopatología tipo 1 como no verdaderos HL-RT, un estudio informó que, entre 26 casos de tipo 1 y 51 de tipo 2, 3 mostraron una evolución de la histopatología de tipo 1 a una histopatología de tipo 2 en series. Las biopsias y los dos tipos respondieron de manera similar a los regímenes de quimioterapia utilizados para tratar el linfoma de Hodgkin, no a la RT. [20] Un segundo estudio informó que la histopatología tipo 1 y 2 puede ocurrir no solo en sucesión sino también en la misma lesión. [21] Finalmente, un estudio de 51 casos de HL-RT tipo 2 mostró que las células RS expresaron PAX5 en 100%, CD30 en 100%, CD15 en 92%, CD20 en 47% y ZAP-70 en 32% de los casos. mientras que 26 casos de tipo 1 tenían células RS que expresaban estas proteínas respectivas en el 100%, 100%, 78%, 52% y 57% de los casos. [20] Aquí, se considera que HL-RT consiste en células leucémicas con histopatología tipo 1, tipo 2 o una mezcla del tipo 1 con tipo 2.
Más del 90% de la población mundial está infectada con el virus de Epstein-Barr (VEB). Durante la infección, el VEB ingresa a los linfocitos B y puede causar mononucleosis infecciosa , síntomas menores no específicos o ningún síntoma. Luego, el virus entra en una fase de latencia en la que los individuos infectados se convierten en portadores asintomáticos del VEB durante toda su vida en sus linfocitos B. Mucho después de su infección inicial y latencia, el EBV puede volver a activarse en los linfocitos B y causar una amplia gama de enfermedades asociadas al EBV, incluidas varias enfermedades linfoproliferativas asociadas al virus de Epstein-Barr . [22] La reactivación del VEB puede ocurrir en los linfocitos B de CLL/SLL y conducir a una forma más grave de CLL/SLL y/o a la transformación de Richter. [23] Se ha informado que la transformación RT rara vez es la base del desarrollo de DLBCL-RT, pero está asociada con el desarrollo de HL-RT tipo 1 en el 75 % de 51 casos de tipo 2 y el 65 % de 26 casos de tipo 1. [20] El VEB se detecta en 30 a 50 % de los casos de LH sin RT (consulte Linfoma de Hodgkin con virus de Epstein-Barr positivo ). [22] La infección por EBV en linfocitos B malignos CLL/SLL a menudo se diagnostica mediante hibridación in situ para detectar ARN pequeños codificados por el virus de Epstein-Barr (es decir, EBER) producidos por el virus. [19]
Los linfocitos B malignos en DLBCL-RT, pero no en DLBCL no relacionados con RT (es decir, DLBCL-no RT) portan un gen supresor de tumores TP53 inactivado en el 50-60% de los casos [12] y, a menudo, anomalías en sus genes NOTCH1 , MYC y CDKN2A. . [1] Las células DLBCL-RT generalmente no tienen anomalías en los genes que regulan la señalización celular o las vías de diferenciación de los linfocitos B que a menudo se encuentran en los linfocitos B malignos de los DLBCL, no RT. Los linfocitos B malignos DLBCL-RT también carecen de anomalías genéticas que se encuentran comúnmente en los DLBCL, no RT, como acetiltransferasa inactivada , proteína de unión a CREB , EP300 , genes de microglobulina beta-2 ; translocaciones de los genes BCL6 y BCL2 ; y pérdidas de los genes PRDM1 y TNFAIP3 . [1]
Existe una distinción importante en los DLBCL-RT basada en las similitudes de sus genes productores de anticuerpos con los de los linfocitos B malignos de CLL/SLL anteriores. Los linfocitos B normales producen anticuerpos que reconocen antígenos extraños y se unen a ellos . La formación de estos anticuerpos requiere la reordenación de los genes productores de anticuerpos (ver producción de anticuerpos ). Los análisis indicaron que ~80 % de los casos de DLBCL-RT tienen genes productores de anticuerpos en sus linfocitos B malignos que están relacionados con los genes productores de anticuerpos en sus linfocitos B malignos de CLL/SLL precedentes; estos casos representan verdaderas transformaciones de linfocitos B malignos CLL/SLL y aquí se denominan DLBCL-RT puros. El ~20% restante de los casos de DLBCL no tienen esa relación y, por lo tanto, no se originan a partir de los linfocitos B malignos de su predecesor CLL/SLL. [1] [3] Estos casos se denominan aquí DLBCL-RT de novo . [3] Una revisión de Vigilancia, Epidemiología y Resultados Finales de 530 casos diagnosticados con RT informó que los casos de RTDLCBL-RT pura y de novo DLBCL-RT tuvieron una mediana de supervivencia de 14,2 y 62,5 meses, respectivamente. [17] Dos estudios más pequeños informaron que los casos de DLBCL-RT puros y de novo DLBCL-RT tuvieron una mediana de supervivencia de 8 a 16 meses y ~ 60 meses, respectivamente, [24] y 14,2 y 62,5 meses, respectivamente. [1] Por lo tanto, la DLBCL-RT pura es una enfermedad mucho más agresiva que la DLBCL-RT de novo .
Las células RS en HL-RT también pueden mostrar reordenamientos de genes productores de anticuerpos que difieren de los de sus células CLL/SLL anteriores. [1] [19] Un estudio encontró que el 53 % de los 14 casos de HL-RT tipo 2 tenían, y el 47 % no tenían, cambios en los genes productores de anticuerpos en sus células RS que estaban relacionados con los de su predecesor CLL/SLL maligno. linfocitos B, mientras que el 29 % de los 14 casos de HL-RT tipo 1 tenían, y el 71 % no tenían, genes productores de anticuerpos relacionados con sus linfocitos B CLL/SLL anteriores. [20] Por lo tanto, los casos de HL-RT, al igual que los casos de DLBC-RTL, pueden ser evoluciones de la enfermedad a partir de sus linfocitos B malignos CLL/SLL o no tener esta relación. [12] En particular, la DL-RT tipo 1 es una enfermedad más agresiva que la HL-RT tipo 2 (consulte la sección Tratamiento y pronóstico de THL-RT). [21]
El diagnóstico de RT depende de encontrar que los individuos con antecedentes de CLL/SLL estable o que presentan por primera vez CLL/SLL tienen: 1) síntomas y/o signos que empeoran rápidamente, particularmente agrandamiento de los ganglios linfáticos o lesiones en los ganglios no linfáticos. tejidos de los ganglios (ver sección Presentación); [2] 2) Las exploraciones con FDG-PET-CT que pueden mostrar que los tejidos afectados tienen altos niveles de captación de FDG; [18] 3) biopsia por escisión (extirpación quirúrgica de un tejido afectado, como un ganglio linfático) o biopsia central (extirpación quirúrgica de una porción de un tejido afectado) que muestra la histopatología de DLBCL-RT o HL-RT ( aguja fina las biopsias por aspiración de los tejidos afectados no han sido clínicamente útiles, precisas ni valiosas para diagnosticar CLL/SLL-RT [1] ); y 4) análisis de expresión de genes y/o proteínas que pueden diferenciar la DLBLC-RT pura de la DLBCL-RT de novo (consulte la sección sobre anomalías del gen DLBCL-RT). [1] Un subgrupo de CLL/SLL (~23% de todos los casos) desarrolla CLL "acelerada", es decir, linfocitos B malignos que proliferan rápidamente. [11] Las personas con CCL/SLL acelerado muestran síntomas y signos que empeoran, así como una histopatología microscópica de los tejidos afectados que puede ser difícil de distinguir de los RT. [10] Las exploraciones con FDG-PET-CT pueden ayudar a distinguir la RT de la CLL/SLL acelerada si muestran que el tejido involucrado en la RT absorbe niveles muy altos de FDG. [2] [18] Sin embargo, el diagnóstico de estos RT puede ser difícil de distinguir entre sí y también de la LLC acelerada: el diagnóstico final de los RT debe ser realizado por un hematopatólogo familiarizado con esta área. [12]
En 2021, no se habían publicado ensayos controlados aleatorios que definieran el tratamiento óptimo para la RT. Los casos de DLBCL-RT se han tratado con quimioterapia (terapia dirigida a las células cancerosas) combinada con inmunoterapia (terapia dirigida al sistema inmunológico). El régimen de quimioinmunoterapia CHOP modificado denominado [R]-CHOEP, que consiste en rituximab (una preparación de anticuerpos de inmunoterapia que se une a la proteína de la superficie celular CD20), ciclofosfamida , doxorrubicina , vincristina y prednisona , ha dado tasas de respuesta generales del 50% al 60% con la mediana de la supervivencia general es de 15 a 21 meses. Se han utilizado otros regímenes de quimioinmunoterapia para tratar DLBCL-RT. El régimen R-EPOCH de rituximab, etopósido , prednisona, vincristina, ciclofosfamida y doxorrubicina produjo una tasa de respuesta general del 39 % y una tasa de supervivencia global mediana de 5,9 meses en un estudio de cohorte retrospectivo . R-DHAP (rituximab, dexametasona, citarabina y cisplatino ), R-ESHAP (rituximab, etopósido, metilprednisolona , citarabina y cisplatino) y regímenes de dosis intensificadas como R-hyper-CVAD (rituximab con hiperfraccionado [es decir, tratamiento intensivo con dosis pequeñas administradas más de una vez al día] ciclofosfamida, vincristina, doxorrubicina y dexametasona alternadas con dosis altas de metotrexato y citarabina como se describe en otra parte [25] ) han dado tasas de respuesta completa más altas , pero también eventos adversos más altos, mayor nivel de tratamiento. mortalidad relacionada y tiempos de supervivencia general más cortos en comparación con [R]-CHOEP. En consecuencia, estos otros regímenes no se usan comúnmente para tratar DLBCL-RT. Recientemente, se han agregado a los regímenes de quimioterapia e inmunoterapia medicamentos anticancerígenos de molécula pequeña (p. ej. , venetoclax , atezolizumab , duvelisib , ublituximab , zanubrutinib , obinutuzumab , olatuzumab y blinatumomab ) que se usan para tratar CLL/SLL y/o DLBCL-no RT. para tratar la RT. Si bien estos estudios se encuentran todavía en sus primeras etapas, es decir, en las etapas I o II , algunos han producido resultados alentadores. [1] Se están realizando más estudios de estos medicamentos de molécula pequeña, así como estudios que utilizan la tecnología CAR-T para tratar DLBCL-RT. [12]La quimioterapia combinada con inmunoterapia es y seguirá siendo el estándar de oro para el tratamiento de DLBCL-RT hasta que estudios futuros informen sobre regímenes más efectivos. [12]
Los pacientes con DLBCL-RT han sido tratados con trasplante de células madre hematopoyéticas autólogo o alogénico . En estos procedimientos, las células madre hematopoyéticas se aíslan del paciente para un trasplante autólogo o de un donante para un trasplante alogénico. Luego, los pacientes son tratados con un "régimen de terapia de ablación", es decir, quimioterapia en dosis altas con o sin inmunoterapia y radioterapia para erradicar o al menos detener o reducir el crecimiento adicional de sus linfocitos B malignos. Después de esta terapia, a los pacientes se les infunden sus propias células madre hematopoyéticas o las del donante. Un estudio informó una tasa de supervivencia a 3 años del 36 % y otro informó una mediana de tiempo de supervivencia libre de progresión (es decir, el tiempo que la enfermedad no empeora) de 11,2 meses con una mediana de tiempo de supervivencia general que no se alcanzó después de 54 meses de seguimiento. . [26] Un metanálisis de 4 estudios previos informó que 72 personas que recibieron un trasplante alogénico de células madre hematopoyéticas (AHSCT) para RT (casi todos los casos fueron DLBCL-RT) lograron una tasa de respuesta general (porcentaje de pacientes que mostraron una disminución en su enfermedad ) del 79 %, una tasa de respuesta completa (porcentaje de pacientes que muestran una desaparición aparente de la enfermedad) del 33 %, y tasas de supervivencia a 2 y 5 años del 46 y 35 %, respectivamente. Dado que el tiempo medio de supervivencia general en muchos estudios había sido inferior a 10 meses para las personas no tratadas con AHSCT, el estudio concluyó que AHSCT es una opción de tratamiento razonable para personas en buena forma cuya enfermedad respondió a la terapia de ablación. [27] Sin embargo, estos estudios, [27] así como otros estudios sobre trasplantes homólogos y/o autólogos para DLBCL-RT, seleccionaron individuos para el trasplante en función de sus respuestas parciales o completas a la terapia de ablación [26] y, a menudo, eligen solo pacientes que estaban en mejor forma física y por otros motivos para recibir el trasplante: en un estudio, solo 20 de 148 personas con DLBCL-RT se consideraron elegibles para el trasplante. [1] Se necesitan más estudios, preferiblemente ensayos controlados aleatorios, para determinar si este régimen de tratamiento mejora el resultado de pacientes con DLBCL-RT altamente seleccionados.
Históricamente, los casos de HL-RT generalmente se trataban con regímenes dirigidos contra CLL/SLL u otras neoplasias malignas, pero no con los utilizados para tratar los linfomas de Hodgkin no debidos a RT, es decir, HL-no RT. La mediana de la supervivencia general en individuos tratados con estos regímenes varió entre 0,8 y 3,9 años. [28] Actualmente, la HL-RT se trata con regímenes de quimioterapia como ABVD (es decir , adriamicina , bleomicina , vinblastina y dacarbazina ) que se utilizan para tratar la HL-no la RT. En un estudio multicéntrico, 62 personas con HL-RT fueron tratadas con ABVD o un régimen basado en AVD. Estos individuos tuvieron una mediana de supervivencia general de 13,2 años, un tiempo similar al observado en la mayoría de los subtipos de HL-no RT cuando se los comparó por edad del paciente en el momento del tratamiento. El trasplante de células madre hematopoyéticas en 7 de estos individuos no mejoró su mediana de supervivencia general. [28] Con base en este resultado, un estudio concluyó que el trasplante de células madre administrado como terapia de consolidación (es decir, terapia administrada para mejorar los beneficios de la terapia anterior) no se recomienda para tratar HL-RT. [1] En un estudio de 8 personas con HL-RT tratadas con BEACOPP (2 casos), ABVD (1 caso) u otros regímenes (5 casos) dirigidos contra HL-no RT, la mediana del tiempo de supervivencia general fue de 7 años. [29] Un estudio de revisión retrospectivo de casos de HL-RT tipo 1 (que tienen un peor pronóstico que el HL-RT tipo 2) encontró que las personas que recibieron regímenes terapéuticos dirigidos contra HL-no RT tuvieron una mediana de supervivencia general de 57 meses, significativamente mayores que los tratados con regímenes utilizados para tratar CLL/CSS (tiempo de supervivencia general medio de 8,4 meses). [21] Actualmente, los regímenes, particularmente ABVD, utilizados para tratar HL-no RT son el estándar de atención para tratar HL-RT. [1] [28]