La metilprednisolona (Depo-Medrol, Medrol, Solu-Medrol) es un glucocorticoide sintético , recetado principalmente por sus efectos antiinflamatorios e inmunosupresores. [4] [5] [6] Se usa en dosis bajas para enfermedades crónicas o se usa concomitantemente en dosis altas durante los brotes agudos. La metilprednisolona y sus derivados se pueden administrar por vía oral o parenteral. [7]
Independientemente de la vía de administración, la metilprednisolona se integra sistémicamente como lo demuestra su eficacia para reducir rápidamente la inflamación durante los brotes agudos. [8] Se asocia con muchas reacciones adversas que requieren una disminución gradual del medicamento tan pronto como la enfermedad esté bajo control. [9] Los efectos secundarios graves incluyen síndrome de Cushing iatrogénico , hipertensión, osteoporosis, diabetes, infección y atrofia de la piel. [9]
Químicamente, la metilprednisolona es una hormona esteroide sintética del embarazo derivada de la hidrocortisona y la prednisolona . Pertenece a una clase de glucocorticoides sintéticos y, más generalmente, a los corticosteroides . Actúa como agonista de los receptores de mineralocorticoides y glucocorticoides. En comparación con otros glucocorticoides exógenos, la metilprednisolona tiene una mayor afinidad por los receptores de glucocorticoides que por los receptores de mineralocorticoides.
El nombre de glucocorticoide se deriva del descubrimiento de su participación en la regulación del metabolismo de los carbohidratos. [9] Ahora se entiende que las funciones celulares de los glucocorticoides, como la metilprednisolona, regulan la homeostasis, el metabolismo, el desarrollo, la cognición y la inflamación. [9] Desempeñan un papel fundamental en la adaptación y respuesta al estrés ambiental, físico y emocional. [9]
La metilprednisolona fue sintetizada y fabricada por primera vez por The Upjohn Company (ahora Pfizer) y aprobada por la FDA en los Estados Unidos en octubre de 1957. [10] En 2021, fue el medicamento número 168 más recetado en los Estados Unidos, con más de 3 millones de recetas . . [11] [12] La metilprednisolona también figura en la Lista de medicamentos esenciales de la Organización Mundial de la Salud por sus efectos contra la leucemia linfoide . [13]
El uso principal de la metilprednisolona es suprimir las respuestas inflamatorias e inmunes. La metilprednisolona consigue esto principalmente regulando el número y la función de los leucocitos, citocinas y quimiocinas. [4] Su control inflamatorio generalizado es propicio para su uso en múltiples trastornos, independientemente de la patología. [4] La metilprednisolona se prescribe comúnmente como terapia a corto plazo para los brotes agudos, como se observa en la artritis gotosa aguda. Se puede prescribir durante el tratamiento en curso en dosis más bajas dependiendo de la monitorización de los efectos adversos. [5] La dosis y la formulación se optimizan según el uso médico. [6]
En 2001-2002, al 11,4% de los pacientes diagnosticados con asma y atendidos en una visita ambulatoria se les recetaron corticosteroides orales como terapia de control a largo plazo. [14] El Programa Nacional de Educación y Prevención del Asma (NAEPP) indica metilprednisolona sistémica en terapias a corto y largo plazo para controlar y suprimir rápidamente el asma persistente, respectivamente. [15] Para las exacerbaciones que resultan en una visita al Departamento de Emergencias (DE), se prefiere la metilprednisolona oral a la administración intravenosa, a menos que haya problemas de adherencia o vómitos. [15] [16] La metilprednisolona oral es menos invasiva y los estudios han demostrado una eficacia equivalente en comparación con la metilprednisolona intravenosa. [15] [16] No se recomiendan dosis superiores a 60–80 mg/día o 2 mg/kg/día ya que no se ha demostrado que altere la función pulmonar, la tasa de ingreso o la duración de la estadía en el hospital en comparación con dosis más bajas. . [16] Después del alta del servicio de urgencias, se recomienda prescribir un tratamiento de cinco días con metilprednisolona para disminuir la probabilidad de recaída o síntomas de abstinencia. [15] [16]
La metilprednisolona se usa para tratar varias enfermedades reumáticas, como el lupus eritematoso sistémico (LES) y la artritis reumatoide (AR). La dosis y administración de metilprednisolona para estas enfermedades es muy variable debido a la fisiopatología variada entre las enfermedades y dentro de los pacientes diagnosticados con una enfermedad determinada. [17] [18] En la nefritis lúpica, una manifestación común del LES, a los pacientes a menudo se les prescribe metilprednisolona de forma concomitante con inmunosupresores. Las manifestaciones graves a menudo se tratan con ciclofosfamida o rituximab y tres dosis de tratamiento con pulsos intravenosos de metilprednisolona (según lo recomendado por las pautas del ACR) antes de cambiar a prednisolona oral y azatioprina para mantenimiento. [17] [18]
Las inyecciones intraarticulares de corticosteroides (IACI) son una terapia de segunda línea para aliviar el dolor articular resultante de la artritis reumatoide. [19] Se inyecta más comúnmente en las articulaciones de las rodillas y los hombros. [19] Aunque la inyección es local, los estudios han demostrado una absorción sistémica como lo demuestran los efectos beneficiosos en las articulaciones distantes. [19] En un intento por minimizar la supresión del HPA, las directrices de la FDA han restringido las IACI a tres por año, con un mínimo de 30 días entre inyecciones. [20]
Por lo general, la metilprednisolona no se recomienda para la insuficiencia suprarrenocortical primaria o secundaria en comparación con otros corticosteroides que tienen una mayor afinidad por los receptores mineralocorticoides y las propiedades de retención de sal. [4]
Las indicaciones etiquetadas a continuación se clasifican por vía de administración y luego por disciplina médica.
Algunas de las indicaciones no autorizadas de metilprednisolona incluyen lesión aguda de la médula espinal , síndrome de dificultad respiratoria aguda , hepatitis alcohólica , reanimación hormonal en la recuperación de órganos cadavéricos y enfermedad pulmonar obstructiva crónica . [15]
Notas a pie de página:
1 Significa diferentes fortalezas de las formas disponibles. No es indicativo de frecuencia ni de dosis acumulada diaria; varía según el paciente y la afección.
2 El alcohol bencílico no debe usarse en recién nacidos
3 Formulación sin conservantes
Las personas que padecen infecciones fúngicas sistémicas no deben tomar metilprednisolona por vía oral, con la excepción de Depo-Medrol cuando se administra como inyección intraarticular para afecciones articulares localizadas. [23] La metilprednisolona está contraindicada en personas con hipersensibilidad conocida a la metilprednisolona o sus componentes. [21] Los esteroides deben usarse con precaución en pacientes con colitis ulcerosa, enfermedad cardíaca o hipertensión, úlcera péptica, insuficiencia renal, osteoporosis, miastenia gravis, glaucoma y diabetes. [4] [21] Pueden aparecer manifestaciones psíquicas mientras se toma metilprednisolona, que van desde euforia, insomnio y cambios de personalidad hasta depresión. Se requiere precaución en pacientes con psicosis predispuestas, ya que las tendencias psicóticas pueden exacerbarse mientras toman corticosteroides. [21]
La dosis de 40 mg de Solu-Medrol contiene lactosa monohidrato producida a partir de leche de vaca; No debe ser tomado por personas con hipersensibilidad conocida a los productos lácteos o sus componentes. [22] Se han asociado eventos médicos graves con la administración epidural de Solu-Medrol y Depo-Medrol, incluidos infarto de la médula espinal, paraplejía, cuadriplejía, ceguera cortical y accidente cerebrovascular. Las inyecciones intramusculares no deben administrarse a personas con púrpura trombocitopénica idiopática. Las formulaciones de Solu-Medrol y Depo-Medrol que contienen alcohol bencílico están contraindicadas para su uso en bebés prematuros. [22] La exposición del tejido neural a cantidades excesivas de alcohol bencílico se ha asociado con toxicidad y, en casos raros, ha provocado la muerte. [23]

Las reacciones adversas pueden eclipsar los efectos terapéuticos de la metilprednisolona. [9]
Existen criterios de diagnóstico clínico mínimos para definir los efectos adversos psíquicos (EAP) asociados con el uso de metilprednisolona en pacientes con lupus eritematoso sistémico (LES). [24] La prevalencia varía del 1,3 al 62% de los pacientes adultos tratados. [24] El tipo y la gravedad de los síntomas neuropsiquiátricos también varían significativamente entre pacientes: el 33% de los pacientes informan EAP de leve a moderado y el 5-10% informan EAP grave. [24] La dosis y la duración de la metilprednisolona se han relacionado con el desarrollo de PAE. 20 mg/día de prednisona (16 mg/día de metilprednisolona) es la dosis umbral para el desarrollo de EAP acordada por muchos estudios. [24] La terapia a corto plazo con pulsos intravenosos en dosis altas se asocia con una rápida aparición de síntomas maníacos e hipomaníacos, mientras que la terapia a largo plazo da lugar a síntomas depresivos (los intentos de suicidio son poco frecuentes). [24] Los PAE son reversibles con la reducción o la interrupción del tratamiento. [24]
El síndrome de Cushing iatrogénico es una complicación directa del tratamiento con glucocorticoides y la causa más común del síndrome de Cushing exógeno. [25] Las características clínicas del síndrome de Cushing incluyen muchos efectos adversos en la terapia con glucocorticoides. [25] Los síntomas tradicionales incluyen aumento de peso, miopatía, osteoporosis, mayor riesgo de infección, hipertensión y efectos psicológicos. La deposición de grasa está centralizada en el tronco, entre los hombros ("joroba de búfalo") y en la cara ("cara de luna"). [25] La educación del paciente y el seguimiento del proveedor es el primer paso para reconocer y diagnosticar el síndrome de Cushing iatrogénico. Los glucocorticoides exógenos suprimen la producción de hormona adrenocorticotrópica (ATCH), lo que puede verificarse mediante análisis bioquímicos de AM. [25] La aparición de efectos secundarios varía; Los síntomas neuropsiquiátricos pueden aparecer en unas pocas horas, mientras que la osteoporosis tardaría meses en desarrollarse. [25]
Los efectos metabólicos de tomar metilprednisolona implican la degradación continua de proteínas para que la gluconeogénesis aumente la necesidad de insulina. Esto produce hiperlipidemia, aumento de peso y miopatía que pueden incitar al paciente a suspender el tratamiento. [4]
La sección Inmunodeficiencia tabula los patógenos conocidos de interés en la inmunodeficiencia inducida por glucocorticoides.
La osteoporosis es un tipo de enfermedad ósea caracterizada por una pérdida de densidad, masa y arquitectura ósea que deja al paciente susceptible a fracturas. [26] La Organización Mundial de la Salud (OMS) define la osteoporosis en mujeres posmenopáusicas caucásicas como una densidad mineral ósea (DMO) y una puntuación T de -2,5 o menos. [27] [28] La prevalencia de osteoporosis en pacientes con LES varía geográficamente y algunos la atribuyen a la idoneidad del diagnóstico de la DMO y la puntuación T. [27] Británicos 10,3%, chinos 21,7% Las Guías de práctica clínica canadienses y el Colegio Americano de Reumatología han pasado a utilizar una puntuación Z como marcador de diagnóstico para la osteoporosis, pero no han logrado encontrar un umbral de diagnóstico clínico. [27] Además, un estudio realizado en el Reino Unido demostró que la DMO puede estar subrepresentada en un paciente con LES, ya que su riesgo de fracturas es un 22% mayor que el del individuo sano. [27]
Los corticosteroides exógenos inducen la osteoporosis al aumentar la resorción ósea y reducir la formación ósea. [27] La pérdida ósea puede ser pronunciada dentro de los primeros meses de iniciar el tratamiento con metilprednisolona, con una disminución constante con el uso crónico. La pérdida de hueso trabecular en la columna lumbar precede a la pérdida de hueso cortical en el cuello femoral. [27]
Alérgico: reacciones alérgicas o de hipersensibilidad, reacción anafiláctica, anafilaxia y urticaria. [21]
Cardiovascular: hipertensión, insuficiencia cardíaca congestiva en pacientes susceptibles, [21] enfermedad aterosclerótica prematura, arritmias y posible hiperlipidemia. [25]
Dermatológico: alteración de la cicatrización de heridas, petequias y equimosis, adelgazamiento de la piel, eritema facial y aumento de la sudoración. [21]
Endocrino: características cushingoides, supresión del crecimiento en niños, falta de respuesta secundaria adrenocortical e hipofisaria, irregularidades menstruales, disminución de la intolerancia a los carbohidratos y diabetes mellitus latente. En pacientes con diabetes, mayores requerimientos de insulina o agentes hipoglucemiantes orales. [21]
Alteraciones de líquidos y electrolitos: retención de sodio, retención de líquidos, pérdida de potasio, alcalosis hipopotasémica o insuficiencia cardíaca congestiva en pacientes susceptibles. [21]
Gastrointestinal: úlcera péptica, pancreatitis, distensión abdominal y esofagitis ulcerosa. [21]
Metabólico: catabolismo proteico que provoca un balance negativo de nitrógeno. [21]
Musculoesquelético: debilidad muscular, pérdida de masa muscular, miopatía por esteroides, osteoporosis, rotura del tendón (especialmente el de Aquiles), fracturas por compresión vertebral, necrosis aséptica de las cabezas femoral y humeral y fractura patológica de huesos largos. [21]
Neurológico: aumento de la presión intracraneal con papiledema, convulsiones, vértigo y dolor de cabeza. [21]
Oftálmicos: cataratas subcapsulares posteriores, aumento de la presión intraocular, glaucoma y exoftalmos. [21]
La retroalimentación de los glucocorticoides exógenos en el eje hipotalámico-pituitario-suprarrenal (HPA) inhibe la secreción de la hormona liberadora de corticotropina (CRH) y la hormona adrenocorticotrópica (ATCH) en el hipotálamo y la hipófisis, respectivamente. [29] La supresión prolongada conduce a respuestas inadecuadas al estrés físico y emocional, como enfermedades y traumas. [29] La supresión de ATCH puede provocar hipoplasia suprarrenal o atrofia secundaria de la glándula suprarrenal dentro de las 6 semanas posteriores al tratamiento con metilprednisolona, lo que deja al paciente en riesgo de desarrollar una crisis de insuficiencia suprarrenal potencialmente mortal. [9] [29] Los factores que contribuyen al grado de supresión del eje HPA incluyen la potencia de la hormona esteroide (tipo de compuesto y vía de administración), la dosis acumulada, la duración del tratamiento y el uso concomitante de fármacos. [9] Cualquier persona que haya tomado hormonas esteroides durante más de 2 semanas corre el riesgo de desarrollar supresión del eje HPA. [29] El riesgo sistémico de metilprednisolona se ha marcado como moderado dentro de la clase de glucocorticoides sintéticos. [29]
Consulte con su médico antes de suspender la metilprednisolona por cualquier motivo. [30] La interrupción abrupta del medicamento comúnmente causa síntomas transitorios no específicos, como pérdida de apetito, malestar estomacal, vómitos, somnolencia, confusión, dolor de cabeza, fiebre, dolor articular y muscular, descamación de la piel y pérdida de peso. [29] [30] Estos síntomas se pueden atribuir al síndrome de abstinencia de esteroides, insuficiencia suprarrenal o recaída de la enfermedad. [29] Aquellos que han estado tomando metilprednisolona como tratamiento a largo plazo pueden reducirse gradualmente para minimizar los síntomas de abstinencia y la posibilidad de recaída. [30] [29] Si los síntomas se exacerban, aumentar temporalmente la dosis de metilprednisolona ha demostrado relevancia clínica. [29] Los estudios que volvieron a realizar pruebas a pacientes tras la abstinencia de metilprednisolona mostraron insuficiencia suprarrenal persistente, y un estudio mostró 15% después de 3 años. [9] [31] Sin embargo, hubo una amplia gama de prevalencia y falta de uniformidad en el cronograma de seguimiento. [31]
Se recomienda precaución al tomar metilprednisolona al mismo tiempo que los medicamentos que se describen a continuación.
Todos los fármacos que pertenecen a la clase de inductores enzimáticos aumentan el aclaramiento y disminuyen la vida media de la metilprednisolona cuando se coadministran. [32] El fenobarbital , la fenitoína , la rifampicina , la carbamazepina y los barbitúricos aumentan las enzimas hepáticas y la tasa de eliminación, reduciendo así el efecto inmunosupresor de la metilprednisolona. [32] Es posible que se requieran dosis mayores para lograr el efecto deseado de la metilprednisolona. [32]
La troleandomicina , el ketoconazol y la claritromicina inhiben el metabolismo; y puede disminuir la tasa de eliminación y aumentar la vida media de la metilprednisolona. [21] [32] Las dosis deben reducirse en consecuencia para evitar efectos secundarios. Otro inhibidor del CYP 3A4, el jugo de pomelo, prolonga la vida media de la metilprednisolona oral. [32]
Los anticonceptivos orales inhiben los procesos oxidativos, como lo destaca su capacidad para disminuir el aclaramiento de metilprednisolona. [32]
Se ha demostrado que la metilprednisolona es un sustrato de la glicoproteína P; Se cree que su inhibición aumenta la absorción y distribución de metilprednisona. No se ha relacionado ninguna relevancia clínica. [32]
La metilprednisolona y la ciclosporina inhiben el metabolismo y, por lo tanto, aumentan la probabilidad de experimentar efectos secundarios asociados con cualquiera de los medicamentos individuales. Además de los efectos secundarios individuales conocidos, se han informado convulsiones. [21]
La metilprednisolona puede aumentar la tasa de eliminación con aspirina crónica en dosis altas . Los pacientes son susceptibles a un aumento de los niveles séricos de salicilatos o a la toxicidad de los salicilatos al finalizar el tratamiento con metilprednisolona. Se debe tener excesiva precaución al prescribir metilprednisolona y aspirina a pacientes con hipoprotrombinemia . [21]
Los anticoagulantes exhiben interacciones variables; Se recomienda monitorear los índices de coagulación para lograr el efecto deseado. [21]

La metilprednisolona es un glucocorticoide (GC) sintético que exhibe efectos pleiotrópicos sobre una variedad de mecanismos fisiológicos. [5] Sin embargo, se han recetado ampliamente por sus efectos sobre la inflamación y la inmunidad. [6] Los efectos de los glucocorticoides sintéticos, como la metilprednisolona, dependen de su asociación con los receptores de glucocorticoides (GR) intracelulares y, en menor medida, con los receptores de mineralocorticoides (MR). Los GR están ampliamente distribuidos en contraste con los MR que muestran una distribución tisular restringida. [9] Mediante este mecanismo, el receptor unido al ligando se traslada al núcleo y modula la expresión génica. [6]

En ausencia de GC endógenos o sintéticos, los GR monoméricos se ubican en el citoplasma y forman complejos multiproteicos con proteínas de choque térmico (HSP), inmunofilinas y otras chaperonas como src y p23. [4] El GR actúa de manera dependiente del ligando, y el complejo mantiene el GR en una forma inactiva con alta especificidad por el ligando. [6] Cuando la metilprednisolona del plasma o del líquido intersticial se difunde pasivamente a través de la membrana celular, se une al GR induciendo un cambio conformacional y la dimerización GC-GR. Anteriormente se pensaba que este cambio conformacional era necesario para disociar el complejo multiproteico y permitir que el receptor unido al ligando se translocara al núcleo. [4] [5] Sin embargo, estudios recientes han indicado que los acompañantes desempeñan un papel en la importación nuclear. [33] El complejo metilprednisolona-GR, ahora activo, puede transducir cambios no genómicos en el citoplasma o translocarse al núcleo y regular la actividad transcripcional de genes diana mediante mecanismos directos, de atadura o compuestos. [5]
Los mecanismos genómicos, independientemente de su tipo, provocan respuestas con un inicio lento y una disipación lenta. [32] Esto se atribuye a la duración de la transcripción y traducción del ARNm. [32] Los glucocorticoides tienen la capacidad de regular aproximadamente de 100 a 1000 genes con especificidad según el tipo de célula. [32]
Tres mecanismos principales han descrito cómo el complejo MP-GR altera la expresión génica uniéndose al ADN o a moduladores de la transcripción. [5] Un mecanismo de señalización genómica ocurre cuando el complejo MP-GR se une directamente a secuencias de ADN llamadas elementos de respuesta a glucocorticoides (GRE). [5] Los GRE están ubicados en regiones reguladoras de genes diana y median en su transactivación o transrepresión. [6] Por ejemplo, la activación de la lipocortina 1 (ANAX1) interfiere negativamente con la producción de prostaglandinas y leucotrienos , conocidas señales proinflamatorias. Asimismo, los GRE negativos (nGRE) son responsables de reprimir genes implicados en la activación de las células inmunitarias. [5]
Las modificaciones postraduccionales (PTM) también contribuyen a la señalización de metilprednisolona y pueden producir efectos genómicos y no genómicos. [33] El GR contiene varios sitios para la fosforilación, sumoilación, ubiquitinación y acetilación que ocurren principalmente después de la unión de la metilprednisolona intracelular al GR. [6] [34] Los PTM modulan muchas funciones, incluida la translocación nuclear, la fuerza y duración de la señalización del receptor y la interacción del cofactor. [33] Un ejemplo específico es la desacetilación por la histona desacetilasa 2 (HDACe) que fue necesaria para la transrepresión de NF-κB. [6] [34]
Los mecanismos de señalización no genómica son distintos de la señalización genómica, pero median vías similares y proporcionan relevancia terapéutica. [35] [36] Estos mecanismos se caracterizan por tener un inicio rápido (menos de 15 minutos), porque no dependen de una transcripción o traducción que requiere mucho tiempo y no son modificados por inhibidores de la transcripción. [32]
La señalización no genómica inducida por metilprednisolona se clasifica mediante tres mecanismos: (1) efectos no genómicos mediados por el receptor de glucocorticoides citoplásmico (cGR), (2) efectos no genómicos del receptor de glucocorticoides unido a la membrana (mGR) y (3) interacciones fisicoquímicas con membranas celulares (efectos no genómicos no específicos). [32] [35]
Las proteínas que se disocian del complejo GC-cGR activado inician mecanismos intracelulares independientes de la transcripción. [37] [27] Existe evidencia de que el SRC disociado es responsable de inhibir la liberación de ácido araquidónico (AA) de los fosfolípidos de la membrana celular. [35] El AA es necesario para la síntesis de mediadores inflamatorios (prostaglandinas y leucotrienos) y, por tanto, la inhibición del AA media en varias vías importantes, como el crecimiento celular, el metabolismo y la inflamación. [37] [27]
Estudios anteriores identificaron mGR en células de linfoma, pero no fue hasta 2004 que se identificaron mGR en células mononucleares periféricas humanas. [35] La prevalencia de mGR varía según el tipo de célula, con la concentración más alta en los linfocitos B, hasta un 12,3 %, hasta un 9,2 % en los monocitos y ausente en los linfocitos T. [35] Los estudios han demostrado una correlación positiva entre las células positivas para mGR y la actividad relacionada con la enfermedad. [35] No existen vías de señalización comprobadas asociadas con mGR en este momento. Algunos investigadores plantean la hipótesis de que la alta actividad de la enfermedad activa la expresión de mGR y, al administrar metilprednisolona, crea un circuito de retroalimentación negativa al inducir la apoptosis. [35]
Altas concentraciones de metilprednisolona se intercalan en plasma y membranas celulares mitocondriales. Esta asociación cambia las propiedades fisicoquímicas de la membrana; activando proteínas de membrana, alterando funciones celulares y, en última instancia, influyendo en el transporte de cationes a través de la membrana plasmática y estimulando la fuga de protones a través de la membrana mitocondrial interna. [32] [35] La fosforilación oxidativa obstaculizada compromete la producción de ATP, una importante fuente de energía para el metabolismo energético celular y la función inmune. Se ha demostrado que los estudios in vivo de timocitos estimulados con Con-A (en ratas) y células inmunes humanas a las que se les administraron altas dosis de metilprednisolona inhiben la respiración de una manera dependiente de la dosis, inhiben la absorción plasmática de calcio y sodio y aumentan la concentración de calcio citoplasmático. [35] El proceso sumativo es el siguiente: la metilprednisolona se intercala en la membrana plasmática, provoca cambios fisicoquímicos, activa proteínas de la membrana que inhiben la absorción plasmática de calcio y sodio (imitando un estado de déficit energético). El consumo de ATP disminuye (parecido a una respiración inhibida), lo que resulta en permeabilidad de las proteínas en la membrana mitocondrial interna y desacoplamiento de la fosforilación oxidativa. Es de destacar que la síntesis de ADN/ARN no se vio obstaculizada. [35] La dependencia de las células domésticas y de las células inmunitarias del ATP produce inmunosupresión durante el déficit de ATP. Las funciones inmunes específicas afectadas por este proceso son la citocinesis, la migración, la fagocitosis, el procesamiento y presentación de antígenos, la síntesis de anticuerpos, la citotoxicidad y la regulación. [35]

La activación del eje hipotalámico-pituitario (HPA) estimula la producción de glucocorticoides endógenos dentro de la corteza suprarrenal. [33] El HPA interpreta estímulos (estrés, inflamación y señales circadianas) y transduce una respuesta fisicoquímica correspondiente. [6] Los glucocorticoides liberados en la sangre sirven como mensajeros al unirse a receptores de glucocorticoides en una amplia distribución en todo el cuerpo, incluido el propio HPA. [33] Por lo tanto, el rango fisiológico de los GC es monitoreado por el circuito de retroalimentación negativa que los GC ejercen en cualquier porción del HPA. [6]

La metilprednisolona está aprobada para administración oral y parenteral. La metilprednisolona (Medrol) para administración oral está disponible en tabletas con concentraciones de 2 mg, 4 mg, 8 mg, 16 mg o 32 mg. [21] Tanto el acetato de metilprednisolona (Depo-Medrol) como el succinato de metilprednisolona (Solu-Medrol) están aprobados para inyección intramuscular. [23] [22] Depo-Medrol también está aprobado para inyecciones intralesionales, intraarticulares y de tejidos blandos. Depo-Medrol está disponible como solución acuosa estéril en concentraciones de 20 mg/ml, 40 mg/ml u 80 mg/ml. [23] Solu-Medrol es el único derivado de metilprednisolona aprobado para infusión intravenosa, ya que el polvo estéril es soluble en agua y se puede mezclar con un diluyente. Las concentraciones varían de 40 mg a 2 g. [22]
Los glucocorticoides sintéticos son similares a los esteroides endógenos en el metabolismo, pero difieren en la afinidad por los receptores de glucocorticoides y mineralocorticoides, la afinidad por la unión a proteínas, la tasa de eliminación y los productos metabólicos. [4]
La metilprednisolona oral se absorbe fácilmente en el tracto gastrointestinal con una biodisponibilidad del 89,9%. [38] A diferencia de los GC endógenos, la metilprednisolona no se une a la glicoproteína transcortina (globulina transportadora de corticosteroides, CBG), pero sí tiene una unión moderada a la albúmina. [32] Por lo tanto, la farmacocinética de la metilprednisolona es lineal y no muestra dependencia de la dosis. [32] Los pacientes que presentan concentraciones bajas de albúmina corren el riesgo de sufrir efectos adversos durante el tratamiento con glucocorticoides. [32] La metilprednisolona oral tiene una distribución moderada en los tejidos a 1,38 l/kg. [39]
La metilprednisolona se elimina principalmente mediante metabolismo hepático y excreción renal de metabolitos; con excreción renal de metilprednisolona inalterada de sólo 1,3 a 9,2%. [39] La metilprednisolona se puede interconvertir con metilprednisona. [32] El metabolismo hepático está mediado por 11 beta-hidroxiesteroide deshidrogenasas (11 β-HSD) y 20-cetosteroides reductasas. [39] La metilprednisolona sufre excreción renal de metabolitos hidrófilos inactivos, incluida la 20-carboximeltilprednisolona y la 6β-hidroxi-20α-hidroximetilprednisolona. [32]
La metilprednisolona oral (Medrol) y sus derivados son un polvo cristalino blanco e inodoro. Su solubilidad varía desde prácticamente insoluble en agua, muy ligeramente soluble en éter, ligeramente soluble en acetona y cloroformo hasta escasamente soluble en alcohol, dioxano y metanol. [40] La suspensión de acetato de metilprednisolona (Depo-Medrol) es un derivado 6-metilo de la prednisolona que se funde a 215 grados Celsius con cierta descomposición. [23] El succinato sódico de metilprednisolona (Solu-Medrol) es el éster de succinato sódico de la metilprednisolona. Al contrario de las solubilidades anteriores, el succinato sódico de metilprednisolona es soluble en agua y alcohol, ligeramente soluble en acetona e insoluble en cloroformo [22]
.jpg/440px-Depo-Medrol_(Methylprednisolone_Acetate_injectable_suspension,_USP).jpg)
La metilprednisolona, o 6α-metilprednisolona, también conocida como 11β,17,21-trihidroxi-6α-metilpregna-1,4-dieno-3,20-diona, es un esteroide pregnano sintético y un derivado de la hidrocortisona (11β,17α,21 -trihidroxipregn-4-eno-3,20-diona) y prednisolona (11β,17α,21-trihidroxipregn-1,4-dieno-3,20-diona). [41] [42] Existe una variedad de ésteres de metilprednisolona con diferentes características que se han comercializado para uso médico. [41] [42] Incluyen aceponato de metilprednisolona (Advantan), acetato de metilprednisolona (Depo-Medrol), succinato de metilprednisolona (Solu-Medrol) y suleptanato de metilprednisolona (Medrosol, Promedrol). [41] [42]
Los esteroides sintéticos se sintetizan a partir de ácido cólico y sapogeninas obtenidas del ganado y de las plantas, respectivamente. [4]
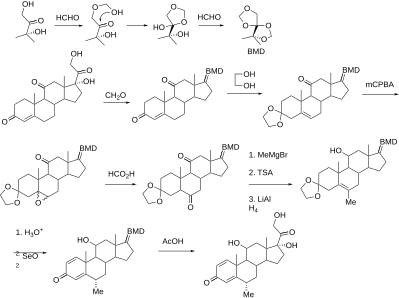
La metilprednisolona fue sintetizada y fabricada por primera vez por The Upjohn Company (ahora Pfizer) y la Administración de Alimentos y Medicamentos (FDA) aprobada en los Estados Unidos en octubre de 1957. [10] La patente expiró y hay genéricos disponibles. En 2021, ocupó el puesto 168 entre los medicamentos más recetados en los Estados Unidos, con más de 3 millones de recetas. [11] [12]
La metilprednisolona ha sido una terapia recetada en medio de la pandemia de COVID-19 , pero no hay evidencia de que sea segura o eficaz para este propósito. [43] [44]