La tomografía por emisión de positrones ( PET ) [1] es una técnica de imagen funcional que utiliza sustancias radiactivas conocidas como radiotrazadores para visualizar y medir cambios en los procesos metabólicos y en otras actividades fisiológicas , incluido el flujo sanguíneo , la composición química regional y la absorción. Se utilizan diferentes trazadores para diversos fines de obtención de imágenes, según el proceso objetivo dentro del cuerpo.
Por ejemplo:
La PET es una técnica de imagen común , una técnica de gammagrafía médica utilizada en medicina nuclear . Se inyecta en el cuerpo un radiofármaco (un radioisótopo adherido a un fármaco) como marcador . Cuando el radiofármaco sufre desintegración beta plus , se emite un positrón , y cuando el positrón interactúa con un electrón ordinario, las dos partículas se aniquilan y se emiten dos rayos gamma en direcciones opuestas. [2] Estos rayos gamma son detectados por dos cámaras gamma para formar una imagen tridimensional.
Los escáneres PET pueden incorporar un escáner de tomografía computarizada (CT) y se conocen como escáneres PET-CT . Las imágenes de la exploración por PET se pueden reconstruir mediante una exploración por tomografía computarizada realizada con un escáner durante la misma sesión.
Una de las desventajas de un escáner PET es su alto costo inicial y sus costos operativos continuos. [3]
La PET es una herramienta médica y de investigación que se utiliza en entornos clínicos y preclínicos. Se utiliza mucho en la obtención de imágenes de tumores y la búsqueda de metástasis dentro del campo de la oncología clínica , y para el diagnóstico clínico de ciertas enfermedades cerebrales difusas, como las que causan varios tipos de demencias . La PET es una valiosa herramienta de investigación para aprender y mejorar nuestro conocimiento sobre el cerebro humano normal, la función cardíaca y apoyar el desarrollo de fármacos. El PET también se utiliza en estudios preclínicos con animales. Permite investigaciones repetidas sobre los mismos sujetos a lo largo del tiempo, donde los sujetos pueden actuar como su propio control y reduce sustancialmente la cantidad de animales necesarios para un estudio determinado. Este enfoque permite que los estudios de investigación reduzcan el tamaño de muestra necesario y al mismo tiempo aumenten la calidad estadística de sus resultados. [ cita necesaria ]
Los procesos fisiológicos conducen a cambios anatómicos en el cuerpo. Dado que la PET es capaz de detectar procesos bioquímicos así como la expresión de algunas proteínas, la PET puede proporcionar información a nivel molecular mucho antes de que los cambios anatómicos sean visibles. La exploración por PET hace esto mediante el uso de sondas moleculares radiomarcadas que tienen diferentes tasas de captación según el tipo y la función del tejido involucrado. La captación regional del trazador en diversas estructuras anatómicas se puede visualizar y cuantificar relativamente en términos de emisor de positrones inyectado dentro de una exploración por PET. [ cita necesaria ]
La mejor forma de realizar imágenes PET es utilizando un escáner PET exclusivo. También es posible adquirir imágenes PET utilizando una cámara gamma convencional de doble cabezal equipada con un detector de coincidencias. La calidad de las imágenes PET con cámara gamma es menor y las exploraciones tardan más en adquirirse. Sin embargo, este método permite una solución in situ de bajo costo para instituciones con baja demanda de escaneo PET. Una alternativa sería derivar a estos pacientes a otro centro o confiar en la visita de un escáner móvil.
Los métodos alternativos de imágenes médicas incluyen la tomografía computarizada por emisión de fotón único (SPECT), la tomografía computarizada (CT), la resonancia magnética (MRI) y la resonancia magnética funcional (fMRI) y la ecografía . SPECT es una técnica de imágenes similar a la PET que utiliza radioligandos para detectar moléculas en el cuerpo. SPECT es menos costosa y proporciona una calidad de imagen inferior que PET.

La exploración por PET con el radiotrazador [ 18 F]fluorodesoxiglucosa (FDG) se utiliza ampliamente en oncología clínica. La FDG es un análogo de la glucosa que es absorbido por las células que utilizan glucosa y fosforilado por la hexoquinasa (cuya forma mitocondrial está significativamente elevada en tumores malignos de rápido crecimiento ). [4] El atrapamiento metabólico de la molécula de glucosa radiactiva permite utilizar la exploración por PET. Las concentraciones del trazador de FDG en las imágenes indican la actividad metabólica del tejido, ya que corresponde a la absorción regional de glucosa. La FDG se utiliza para explorar la posibilidad de que el cáncer se propague a otras partes del cuerpo ( metástasis del cáncer ). Estas exploraciones PET con FDG para detectar metástasis de cáncer son las más comunes en la atención médica estándar (representan el 90% de las exploraciones actuales). El mismo marcador también puede utilizarse para el diagnóstico de tipos de demencia . Con menos frecuencia, se utilizan otros trazadores radiactivos , normalmente pero no siempre marcados con flúor-18 ( 18 F), para obtener imágenes de la concentración tisular de diferentes tipos de moléculas de interés dentro del cuerpo. [ cita necesaria ]
Una dosis típica de FDG utilizada en una exploración oncológica tiene una dosis de radiación efectiva de 7,6 mSv . [5] Debido a que el grupo hidroxi que se reemplaza por flúor-18 para generar FDG es necesario para el siguiente paso en el metabolismo de la glucosa en todas las células, no se producen más reacciones en la FDG. Además, la mayoría de los tejidos (con la notable excepción del hígado y los riñones) no pueden eliminar el fosfato añadido por la hexoquinasa. Esto quiere decir que la FDG queda atrapada en cualquier célula que la absorba hasta descomponerse, ya que los azúcares fosforilados , por su carga iónica, no pueden salir de la célula. Esto da como resultado un intenso radiomarcado de tejidos con alta absorción de glucosa, como el cerebro, el hígado, los riñones y la mayoría de los cánceres, que tienen una mayor absorción de glucosa que la mayoría de los tejidos normales debido al efecto Warburg . Como resultado, la FDG-PET se puede utilizar para el diagnóstico, la estadificación y el seguimiento del tratamiento de los cánceres, particularmente en el linfoma de Hodgkin , [6] el linfoma no Hodgkin , [7] y el cáncer de pulmón . [8] [9] [10]
Una revisión de 2020 de la investigación sobre el uso de PET para el linfoma de Hodgkin encontró evidencia de que los hallazgos negativos en las exploraciones PET provisionales están relacionados con una mayor supervivencia general y una supervivencia libre de progresión ; sin embargo, la certeza de la evidencia disponible fue moderada para la supervivencia y muy baja para la supervivencia libre de progresión. [11]
Poco a poco se están introduciendo en la oncología algunos otros isótopos y radiotrazadores con fines específicos. Por ejemplo,El metomidato marcado con 11C ( 11C-metomidato) se ha utilizado para detectar tumores de origen adrenocortical . [12] [13] Además, la PET/CT con fluorodopa ( FDOPA ) (también llamada PET/CT con F-18-DOPA) ha demostrado ser una alternativa más sensible para encontrar y localizar el feocromocitoma que la exploración con iobenguano (MIBG) . [14] [15] [16]

Las imágenes PET con oxígeno-15 miden indirectamente el flujo sanguíneo al cerebro. En este método, una mayor señal de radiactividad indica un mayor flujo sanguíneo que se supone que se correlaciona con una mayor actividad cerebral. Debido a su vida media de 2 minutos , el oxígeno-15 debe ser canalizado directamente desde un ciclotrón médico para tales usos, lo cual es difícil. [17]
Las imágenes PET con FDG aprovechan el hecho de que el cerebro normalmente utiliza rápidamente glucosa. La PET con FDG estándar del cerebro mide el uso regional de glucosa y puede usarse en el diagnóstico neuropatológico.
Las patologías cerebrales como la enfermedad de Alzheimer (EA) disminuyen en gran medida el metabolismo cerebral tanto de la glucosa como del oxígeno en conjunto. Por lo tanto, la PET con FDG del cerebro también se puede utilizar para diferenciar con éxito la enfermedad de Alzheimer de otros procesos demenciales, y también para realizar diagnósticos tempranos de la enfermedad de Alzheimer. La ventaja del PET FDG para estos usos es su disponibilidad mucho más amplia. Algunos trazadores radiactivos a base de flúor-18 utilizados para el Alzheimer incluyen florbetapir , flutemetamol , compuesto B de Pittsburgh (PiB) y florbetaben , que se utilizan para detectar placas de beta amiloide , un biomarcador potencial del Alzheimer en el cerebro. [18]
Las imágenes PET con FDG también se pueden utilizar para la localización del "foco convulsivo". Un foco convulsivo aparecerá como hipometabólico durante una exploración interictal. [19] Se han desarrollado varios radiotrazadores (es decir, radioligandos) para PET que son ligandos para subtipos de neurorreceptores específicos como [ 11 C] racloprida , [ 18 F] falyprida y [ 18 F] desmetoxifalprida para los receptores de dopamina D 2 / D 3 ; [ 11 C] McN5652 y [ 11 C] DASB para transportadores de serotonina ; [ 18 F] mefway para los receptores de serotonina 5HT 1A ; y [ 18 F] nifeno para receptores nicotínicos de acetilcolina o sustratos enzimáticos (por ejemplo, 6- FDOPA para la enzima AADC ). Estos agentes permiten la visualización de grupos de neurorreceptores en el contexto de una pluralidad de enfermedades neuropsiquiátricas y neurológicas.
La PET también se puede utilizar para el diagnóstico de la esclerosis del hipocampo , que causa la epilepsia. Para este propósito se han explorado la FDG y los trazadores menos comunes flumazenil y MPPF . [20] [21] Si la esclerosis es unilateral (hipocampo derecho o hipocampo izquierdo), la captación de FDG se puede comparar con la del lado sano. Incluso si el diagnóstico es difícil con la resonancia magnética, se puede diagnosticar con PET. [22] [23]
El desarrollo de una serie de sondas novedosas para la obtención de imágenes PET in vivo y no invasivas de neuroagregados en el cerebro humano ha acercado las imágenes de amiloide al uso clínico. Las primeras sondas de imágenes de amiloide incluyeron [ 18 F]FDDNP [24] desarrollada en la Universidad de California, Los Ángeles y el compuesto B de Pittsburgh (PiB) [25] desarrollado en la Universidad de Pittsburgh . Estas sondas permiten la visualización de placas amiloides en el cerebro de pacientes con Alzheimer y podrían ayudar a los médicos a realizar un diagnóstico clínico positivo de EA pre-mortem y ayudar en el desarrollo de nuevas terapias antiamiloideas. [ 11 C] polimetilpenteno (PMP) es un nuevo radiofármaco utilizado en imágenes PET para determinar la actividad del sistema neurotransmisor acetilcolinérgico al actuar como sustrato de la acetilcolinesterasa . El examen post mortem de pacientes con EA ha mostrado niveles reducidos de acetilcolinesterasa. [ 11 C]PMP se utiliza para mapear la actividad de la acetilcolinesterasa en el cerebro, lo que podría permitir diagnósticos premortem de la EA y ayudar a controlar los tratamientos de la EA. [26] Avid Radiopharmaceuticals ha desarrollado y comercializado un compuesto llamado florbetapir que utiliza el radionúclido flúor-18 de mayor duración para detectar placas amiloides mediante exploraciones PET. [27]
Examinar los vínculos entre procesos o trastornos psicológicos específicos y la actividad cerebral.
Numerosos compuestos que se unen selectivamente a neurorreceptores de interés en psiquiatría biológica han sido radiomarcados con C-11 o F-18. Radioligandos que se unen a receptores de dopamina ( D 1 , [28] D 2 , [29] [30] transportador de recaptación), receptores de serotonina ( 5HT 1A , 5HT 2A , transportador de recaptación), receptores de opioides ( mu y kappa ), receptores colinérgicos ( nicotínico y muscarínico ) y otros sitios se han utilizado con éxito en estudios con sujetos humanos. Se han realizado estudios que examinan el estado de estos receptores en pacientes en comparación con controles sanos en esquizofrenia , abuso de sustancias , trastornos del estado de ánimo y otras afecciones psiquiátricas. [ cita necesaria ]
La PET también se puede utilizar en cirugía guiada por imágenes para el tratamiento de tumores intracraneales, malformaciones arteriovenosas y otras afecciones tratables quirúrgicamente. [31]
Estudio de cardiología , aterosclerosis y enfermedades vasculares: la PET con FDG puede ayudar a identificar el miocardio en hibernación . Sin embargo, no está clara la rentabilidad de la PET para esta función frente a la SPECT . También es factible obtener imágenes de aterosclerosis mediante PET con FDG para detectar pacientes con riesgo de sufrir un accidente cerebrovascular . Además, puede ayudar a probar la eficacia de nuevas terapias contra la aterosclerosis. [32]
La obtención de imágenes de infecciones con tecnologías de imágenes moleculares puede mejorar el diagnóstico y el seguimiento del tratamiento. Clínicamente, la PET se ha utilizado ampliamente para obtener imágenes de infecciones bacterianas utilizando FDG para identificar la respuesta inflamatoria asociada a la infección. Se han desarrollado tres agentes de contraste PET diferentes para obtener imágenes de infecciones bacterianas in vivo: [ 18 F] maltosa , [33] [ 18 F]maltohexaosa y [ 18 F]2-fluorodesoxisorbitol ( FDS). [34] FDS tiene el beneficio adicional de poder apuntar solo a Enterobacteriaceae .
En ensayos preclínicos, se puede marcar radiactivamente un nuevo fármaco e inyectarlo en animales. Estas exploraciones se denominan estudios de biodistribución. La información sobre la absorción, retención y eliminación del fármaco a lo largo del tiempo se puede obtener de forma rápida y rentable en comparación con la técnica más antigua de matar y diseccionar a los animales. Comúnmente, la ocupación del fármaco en un supuesto sitio de acción se puede inferir indirectamente mediante estudios de competencia entre fármacos no marcados y compuestos radiomarcados para unirse con especificidad al sitio. De esta manera se puede utilizar un solo radioligando para probar muchos candidatos potenciales a fármacos para el mismo objetivo. Una técnica relacionada implica la exploración con radioligandos que compiten con una sustancia endógena (de origen natural) en un receptor determinado para demostrar que un fármaco provoca la liberación de la sustancia natural. [35]
Se ha construido un PET animal en miniatura que es lo suficientemente pequeño como para escanear una rata completamente consciente. [36] Este RatCAP (PET para animales conscientes de ratas) permite escanear animales sin los efectos confusos de la anestesia . Los escáneres PET diseñados específicamente para obtener imágenes de roedores , a menudo denominados microPET, así como escáneres para pequeños primates , se comercializan para investigaciones académicas y farmacéuticas. Los escáneres se basan en centelleadores microminiatura y fotodiodos de avalancha (APD) amplificados mediante un sistema que utiliza fotomultiplicadores de silicio de un solo chip . [1]
En 2018, la Facultad de Medicina Veterinaria de UC Davis se convirtió en el primer centro veterinario en emplear un pequeño escáner PET clínico como escáner para el diagnóstico clínico (en lugar de investigación) de animales. Debido al costo y a la utilidad marginal de detectar metástasis cancerosas en animales de compañía (el uso principal de esta modalidad), se espera que la exploración por PET veterinaria rara vez esté disponible en el futuro inmediato. [ cita necesaria ]
Las imágenes PET se han utilizado para obtener imágenes de músculos y huesos. La FDG es el trazador más utilizado para obtener imágenes de músculos y el NaF-F18 es el trazador más utilizado para obtener imágenes de huesos.
La PET es una técnica factible para estudiar los músculos esqueléticos durante el ejercicio. [37] Además, la PET puede proporcionar datos de activación muscular sobre los músculos profundos (como el vasto intermedio y el glúteo menor ) en comparación con técnicas como la electromiografía , que solo se puede utilizar en los músculos superficiales directamente debajo de la piel. Sin embargo, una desventaja es que la PET no proporciona información sobre el tiempo de activación muscular porque debe medirse después de completar el ejercicio. Esto se debe al tiempo que tarda la FDG en acumularse en los músculos activados. [ cita necesaria ]
Junto con el [ 18 F]floruro de sodio, la PET para imágenes óseas se utiliza desde hace 60 años para medir el metabolismo óseo regional y el flujo sanguíneo mediante exploraciones estáticas y dinámicas. Recientemente, los investigadores también han comenzado a utilizar floruro de sodio [ 18 F] para estudiar la metástasis ósea. [38]
La exploración PET no es invasiva, pero implica exposición a radiación ionizante . [3] La FDG, que ahora es el radiotrazador estándar utilizado para la neuroimagen PET y el tratamiento de pacientes con cáncer, [39] tiene una dosis de radiación efectiva de 14 mSv . [5]
La cantidad de radiación en FDG es similar a la dosis efectiva de pasar un año en la ciudad estadounidense de Denver, Colorado (12,4 mSv/año). [40] A modo de comparación, la dosis de radiación para otros procedimientos médicos oscila entre 0,02 mSv para una radiografía de tórax y 6,5 a 8 mSv para una tomografía computarizada del tórax. [41] [42] Las tripulaciones aéreas civiles promedio están expuestas a 3 mSv/año, [43] y el límite de dosis ocupacional para todo el cuerpo para los trabajadores de la energía nuclear en los EE. UU. es de 50 mSv/año. [44] Para conocer la escala, consulte Órdenes de magnitud (radiación) .
Para la exploración PET-CT, la exposición a la radiación puede ser sustancial: alrededor de 23 a 26 mSv (para una persona de 70 kg; es probable que la dosis sea mayor para pesos corporales más altos). [45] [46]

Los radionucleidos se incorporan a compuestos utilizados normalmente por el organismo, como la glucosa (o análogos de la glucosa), el agua o el amoníaco , o a moléculas que se unen a receptores u otros sitios de acción de los fármacos. Estos compuestos marcados se conocen como radiotrazadores . La tecnología PET se puede utilizar para rastrear la ruta biológica de cualquier compuesto en humanos vivos (y también en muchas otras especies), siempre que pueda radiomarcarse con un isótopo PET. Por tanto, los procesos específicos que pueden investigarse con PET son prácticamente ilimitados y se siguen sintetizando radiotrazadores para nuevas moléculas y procesos diana. En el momento de escribir este artículo ya hay docenas en uso clínico y cientos aplicados en investigación. En 2020, con diferencia, el radiotrazador más utilizado en la exploración por PET clínica es el derivado de carbohidratos FDG. Este radiotrazador se utiliza esencialmente en todas las exploraciones oncológicas y en la mayoría de las exploraciones en neurología, por lo que constituye la gran mayoría de los radiotrazadores (>95%) utilizados en exploraciones PET y PET-CT.
Debido a la corta vida media de la mayoría de los radioisótopos emisores de positrones, los radiotrazadores se han producido tradicionalmente utilizando un ciclotrón muy cerca de la instalación de imágenes PET. La vida media del flúor-18 es lo suficientemente larga como para que los radiotrazadores marcados con flúor-18 puedan fabricarse comercialmente en ubicaciones externas y enviarse a centros de imágenes. Recientemente, se han comercializado generadores de rubidio -82. [48] Estos contienen estroncio-82, que se desintegra por captura de electrones para producir rubidio-82 emisor de positrones.
Se ha revisado el uso de isótopos de metales emisores de positrones en las exploraciones PET, incluidos elementos no enumerados anteriormente, como los lantánidos. [49]
El isótopo 89 Zr se ha aplicado al seguimiento y cuantificación de anticuerpos moleculares con cámaras PET (método denominado "inmuno-PET"). [50] [51] [52]
La vida media biológica de los anticuerpos suele ser del orden de días; véanse daclizumab y erenumab a modo de ejemplo. Para visualizar y cuantificar la distribución de dichos anticuerpos en el cuerpo, el isótopo PET 89 Zr es muy adecuado porque su vida media física coincide con la vida media biológica típica de los anticuerpos, consulte la tabla anterior.

Para realizar la exploración, se inyecta un isótopo trazador radiactivo de corta duración en el sujeto vivo (normalmente en la circulación sanguínea). Cada átomo trazador ha sido incorporado químicamente a una molécula biológicamente activa. Hay un período de espera mientras la molécula activa se concentra en los tejidos de interés. Luego se coloca al sujeto en el escáner de imágenes. La molécula más utilizada para este fin es la FDG, un azúcar, cuyo período de espera suele ser de una hora. Durante la exploración, se realiza un registro de la concentración del tejido a medida que el marcador se desintegra.
A medida que el radioisótopo sufre una desintegración de la emisión de positrones (también conocida como desintegración beta positiva ), emite un positrón, una antipartícula del electrón con carga opuesta. El positrón emitido viaja en el tejido una distancia corta (normalmente menos de 1 mm, pero depende del isótopo [53] ), tiempo durante el cual pierde energía cinética, hasta que desacelera hasta un punto en el que puede interactuar con un electrón. [54] El encuentro aniquila tanto al electrón como al positrón, produciendo un par de fotones de aniquilación ( gamma ) que se mueven en direcciones aproximadamente opuestas. Estos se detectan cuando alcanzan un centelleador en el dispositivo de escaneo, creando una ráfaga de luz que es detectada por tubos fotomultiplicadores o fotodiodos de avalancha de silicio (Si APD). La técnica depende de la detección simultánea o coincidente del par de fotones que se mueven en direcciones aproximadamente opuestas (estarían exactamente opuestos en su marco de centro de masa , pero el escáner no tiene forma de saberlo, por lo que tiene una ligera dirección incorporada). -tolerancia a errores). Los fotones que no llegan en "pares" temporales (es decir, dentro de una ventana de tiempo de unos pocos nanosegundos) se ignoran.
La fracción más significativa de aniquilaciones electrón-positrón da como resultado la emisión de dos fotones gamma de 511 keV a casi 180 grados entre sí. Por lo tanto, es posible localizar su fuente a lo largo de una línea recta de coincidencia (también llamada línea de respuesta o LOR ). En la práctica, el LOR tiene un ancho distinto de cero ya que los fotones emitidos no están exactamente separados 180 grados. Si el tiempo de resolución de los detectores es inferior a 500 picosegundos en lugar de aproximadamente 10 nanosegundos , es posible localizar el evento en un segmento de una cuerda , cuya longitud está determinada por la resolución de temporización del detector. A medida que mejora la resolución de sincronización, la relación señal-ruido (SNR) de la imagen mejorará, lo que requerirá menos eventos para lograr la misma calidad de imagen. Esta tecnología aún no es común, pero está disponible en algunos sistemas nuevos. [55]
Los datos sin procesar recopilados por un escáner PET son una lista de "eventos coincidentes" que representan la detección casi simultánea (normalmente, dentro de una ventana de 6 a 12 nanosegundos entre sí) de fotones de aniquilación por parte de un par de detectores. Cada evento de coincidencia representa una línea en el espacio que conecta los dos detectores a lo largo de los cuales ocurrió la emisión de positrones (es decir, la línea de respuesta (LOR)).
Se utilizan comúnmente técnicas analíticas, muy parecidas a la reconstrucción de datos de tomografía computarizada (CT) y tomografía computarizada por emisión de fotón único (SPECT), aunque el conjunto de datos recopilados en PET es mucho más deficiente que el de CT, por lo que las técnicas de reconstrucción son más difíciles. Los eventos de coincidencia se pueden agrupar en imágenes de proyección, llamadas sinogramas . Los sinogramas están ordenados por el ángulo de cada vista e inclinación (para imágenes 3D). Las imágenes de los sinogramas son análogas a las proyecciones capturadas por los escáneres de tomografía computarizada y pueden reconstruirse de manera similar. Las estadísticas de los datos así obtenidos son mucho peores que las obtenidas mediante tomografía de transmisión. Un conjunto de datos PET normal tiene millones de recuentos para toda la adquisición, mientras que el CT puede alcanzar unos pocos miles de millones de recuentos. Esto contribuye a que las imágenes PET parezcan "más ruidosas" que las CT. Dos fuentes principales de ruido en PET son la dispersión (un par de fotones detectados, al menos uno de los cuales fue desviado de su trayectoria original por la interacción con la materia en el campo de visión, lo que llevó a que el par fuera asignado a un LOR incorrecto) y el ruido aleatorio. eventos (fotones originados en dos eventos de aniquilación diferentes pero registrados incorrectamente como un par de coincidencia porque su llegada a sus respectivos detectores ocurrió dentro de una ventana de tiempo de coincidencia).
En la práctica, se requiere un preprocesamiento considerable de los datos: corrección de coincidencias aleatorias, estimación y resta de fotones dispersos , corrección del tiempo muerto del detector (después de la detección de un fotón, el detector debe "enfriarse" nuevamente) y Corrección de sensibilidad (tanto para la sensibilidad inherente del detector como para los cambios en la sensibilidad debido al ángulo de incidencia).
La retroproyección filtrada (FBP) se ha utilizado con frecuencia para reconstruir imágenes a partir de las proyecciones. Este algoritmo tiene la ventaja de ser simple y al mismo tiempo requiere pocos recursos informáticos. Las desventajas son que el ruido del disparo en los datos sin procesar es prominente en las imágenes reconstruidas y las áreas de alta captación del trazador tienden a formar rayas a lo largo de la imagen. Además, FBP trata los datos de manera determinista: no tiene en cuenta la aleatoriedad inherente asociada con los datos PET, por lo que requiere todas las correcciones previas a la reconstrucción descritas anteriormente.
Enfoques estadísticos basados en la probabilidad : Los algoritmos estadísticos basados en la probabilidad [56] [57] iterativos de maximización de expectativas, como el algoritmo Shepp-Vardi [58], son ahora el método preferido de reconstrucción. Estos algoritmos calculan una estimación de la distribución probable de los eventos de aniquilación que condujeron a los datos medidos, basándose en principios estadísticos. La ventaja es un mejor perfil de ruido y resistencia a los artefactos de rayas comunes con FBP, pero la desventaja son mayores requisitos de recursos informáticos. Una ventaja adicional de las técnicas estadísticas de reconstrucción de imágenes es que los efectos físicos que deberían corregirse previamente cuando se utiliza un algoritmo de reconstrucción analítica, como fotones dispersos, coincidencias aleatorias, atenuación y tiempo muerto del detector, se pueden incorporar a la probabilidad. modelo que se utiliza en la reconstrucción, lo que permite una reducción adicional del ruido. También se ha demostrado que la reconstrucción iterativa da como resultado mejoras en la resolución de las imágenes reconstruidas, ya que se pueden incorporar modelos más sofisticados de la física del escáner al modelo de probabilidad que los utilizados por los métodos de reconstrucción analítica, lo que permite una mejor cuantificación de la distribución de la radiactividad. [59]
Las investigaciones han demostrado que los métodos bayesianos que involucran una función de probabilidad de Poisson y una probabilidad previa apropiada (por ejemplo, un suavizado previo que conduce a una regularización de variación total o una distribución laplaciana que conduce a una regularización basada en una ondícula u otro dominio), como a través de Ulf Grenander El estimador de tamiz [60] [61] o mediante los métodos de penalización de Bayes [62] [63] o mediante el método de rugosidad de IJ Good [64] [65] pueden producir un rendimiento superior a los métodos basados en la maximización de expectativas que involucran un método de Poisson. función de verosimilitud, pero no implica tal previa. [66] [67] [68]
Corrección de atenuación : las imágenes PET cuantitativas requieren corrección de atenuación. [69] En estos sistemas, la corrección de atenuación se basa en un escaneo de transmisión utilizando una fuente de varilla giratoria de 68 Ge. [70]
Los escaneos de transmisión miden directamente los valores de atenuación a 511 keV. [71] La atenuación se produce cuando los fotones emitidos por el radiotrazador dentro del cuerpo son absorbidos por el tejido intermedio entre el detector y la emisión del fotón. Como diferentes LOR deben atravesar diferentes espesores de tejido, los fotones se atenúan de manera diferencial. El resultado es que se reconstruyen estructuras profundas del cuerpo con una captación de trazador falsamente baja. Los escáneres contemporáneos pueden estimar la atenuación utilizando equipos de TC de rayos X integrados, en lugar de equipos anteriores que ofrecían una forma tosca de TC utilizando una fuente de rayos gamma ( emisora de positrones ) y detectores PET.
Si bien las imágenes con corrección de atenuación son generalmente representaciones más fieles, el proceso de corrección es en sí mismo susceptible a artefactos significativos. Como resultado, tanto las imágenes corregidas como las no corregidas siempre se reconstruyen y leen juntas.
Reconstrucción 2D/3D : los primeros escáneres PET tenían un solo anillo de detectores, por lo que la adquisición de datos y la posterior reconstrucción estaban restringidas a un solo plano transversal. Los escáneres más modernos ahora incluyen múltiples anillos, que esencialmente forman un cilindro de detectores.
Hay dos métodos para reconstruir datos de dicho escáner:
Las técnicas 3D tienen mejor sensibilidad (porque se detectan y utilizan más coincidencias), por lo tanto, menos ruido, pero son más sensibles a los efectos de la dispersión y las coincidencias aleatorias, además de requerir mayores recursos informáticos. La llegada de detectores de resolución de temporización inferior a nanosegundos permite un mejor rechazo de coincidencias aleatorias, favoreciendo así la reconstrucción de imágenes en 3D.
PET de tiempo de vuelo (TOF) : para los sistemas modernos con una resolución de tiempo más alta (aproximadamente 3 nanosegundos), se utiliza una técnica llamada "tiempo de vuelo" para mejorar el rendimiento general. La PET de tiempo de vuelo utiliza detectores de rayos gamma muy rápidos y un sistema de procesamiento de datos que puede decidir con mayor precisión la diferencia de tiempo entre la detección de los dos fotones. Es imposible localizar exactamente el punto de origen del evento de aniquilación (actualmente dentro de los 10 cm). Por lo tanto, todavía es necesaria la reconstrucción de la imagen. La técnica TOF ofrece una mejora notable en la calidad de la imagen, especialmente en la relación señal-ruido.
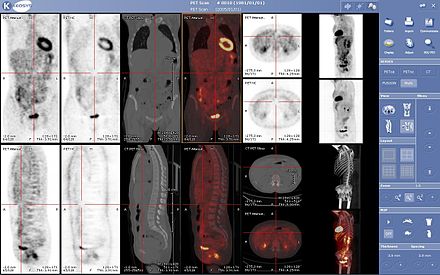

Las exploraciones PET se leen cada vez más junto con las exploraciones CT o MRI, y la combinación ( registro conjunto ) brinda información tanto anatómica como metabólica (es decir, cuál es la estructura y qué está haciendo bioquímicamente). Debido a que las imágenes PET son más útiles en combinación con imágenes anatómicas, como la TC, los escáneres PET modernos ahora están disponibles con escáneres CT de filas múltiples de detectores (PET-CT) integrados de alta gama. Debido a que las dos exploraciones se pueden realizar en secuencia inmediata durante la misma sesión, sin que el paciente cambie de posición entre los dos tipos de exploraciones, los dos conjuntos de imágenes se registran con mayor precisión , de modo que las áreas de anormalidad en las imágenes PET pueden ser más claras. perfectamente correlacionado con la anatomía en las imágenes de TC. Esto es muy útil para mostrar vistas detalladas de órganos o estructuras en movimiento con mayor variación anatómica, que es más común fuera del cerebro.
En abril de 2009, en el Instituto Jülich de Neurociencias y Biofísica empezó a funcionar el dispositivo PET-MRI más grande del mundo: un tomógrafo por resonancia magnética (MRT) de 9,4 teslas combinado con un PET. Actualmente, sólo se pueden obtener imágenes de la cabeza y el cerebro con estas altas intensidades de campo magnético. [72]
Para imágenes cerebrales, el registro de tomografías computarizadas, resonancias magnéticas y tomografías por emisión de positrones se puede lograr sin la necesidad de un escáner PET-CT o PET-MRI integrado mediante el uso de un dispositivo conocido como N-localizer . [31] [73] [74] [75]
La minimización de la dosis de radiación que recibe el sujeto es una característica atractiva del uso de radionucleidos de vida corta. Además de su papel establecido como técnica de diagnóstico, la PET tiene un papel cada vez más importante como método para evaluar la respuesta a la terapia, en particular a la terapia contra el cáncer, [76] donde el riesgo para el paciente por falta de conocimiento sobre el progreso de la enfermedad es mucho mayor que el riesgo de la radiación de prueba. Dado que los trazadores son radiactivos, las personas mayores [ dudoso ] y las embarazadas no pueden utilizarlos debido a los riesgos que plantea la radiación.
Las limitaciones al uso generalizado de PET surgen de los altos costos de los ciclotrones necesarios para producir los radionucleidos de vida corta para la exploración PET y la necesidad de aparatos de síntesis química in situ especialmente adaptados para producir los radiofármacos después de la preparación de los radioisótopos. Las moléculas de radiotrazadores orgánicos que contendrán un radioisótopo emisor de positrones no se pueden sintetizar primero y luego preparar el radioisótopo dentro de ellas, porque el bombardeo con un ciclotrón para preparar el radioisótopo destruye cualquier portador orgánico para él. En cambio, primero se debe preparar el isótopo y luego la química para preparar cualquier radiotrazador orgánico (como la FDG) se realiza muy rápidamente, en el corto tiempo antes de que el isótopo se desintegre. Pocos hospitales y universidades son capaces de mantener dichos sistemas, y la mayoría de las PET clínicas cuentan con el respaldo de proveedores externos de radiotrazadores que pueden suministrar a muchos sitios simultáneamente. Esta limitación restringe la PET clínica principalmente al uso de trazadores marcados con flúor-18, que tiene una vida media de 110 minutos y puede transportarse a una distancia razonable antes de su uso, o al rubidio-82 (usado como cloruro de rubidio-82 ) con una vida media de 1,27 minutos, que se crea en un generador portátil y se utiliza para estudios de perfusión miocárdica . En los últimos años, algunos ciclotrones in situ con blindaje integrado y "laboratorios calientes" (laboratorios de química automatizados que pueden trabajar con radioisótopos) han comenzado a acompañar a las unidades de PET a hospitales remotos. La presencia del pequeño ciclotrón in situ promete ampliarse en el futuro a medida que los ciclotrones se reduzcan en respuesta al alto coste del transporte de isótopos a máquinas de PET remotas. [77] En los últimos años, la escasez de exploraciones PET se ha aliviado en los EE. UU., ya que el despliegue de radiofarmacias para suministrar radioisótopos ha crecido un 30% al año. [78]
Debido a que la vida media del flúor-18 es de aproximadamente dos horas, la dosis preparada de un radiofármaco que contenga este radionúclido sufrirá múltiples vidas medias de desintegración durante la jornada laboral. Esto requiere una recalibración frecuente de la dosis restante (determinación de la actividad por unidad de volumen) y una planificación cuidadosa con respecto a la programación de los pacientes.

El concepto de tomografía de emisión y transmisión fue introducido por David E. Kuhl , Luke Chapman y Roy Edwards a finales de los años cincuenta. Su trabajo condujo posteriormente al diseño y construcción de varios instrumentos tomográficos en la Universidad de Pensilvania . En 1975, Michel Ter-Pogossian , Michael E. Phelps , Edward J. Hoffman y otros desarrollaron aún más las técnicas de imágenes tomográficas en la Facultad de Medicina de la Universidad de Washington . [79] [80]
El trabajo de Gordon Brownell, Charles Burnham y sus asociados en el Hospital General de Massachusetts a partir de la década de 1950 contribuyó significativamente al desarrollo de la tecnología PET e incluyó la primera demostración de radiación de aniquilación para imágenes médicas. [81] Sus innovaciones, incluido el uso de tubos de luz y análisis volumétrico, han sido importantes en el despliegue de imágenes PET. En 1961, James Robertson y sus asociados del Laboratorio Nacional de Brookhaven construyeron el primer escáner PET de un solo plano, apodado el "encogedor de cabezas". [82]
Uno de los factores más responsables de la aceptación de las imágenes con positrones fue el desarrollo de radiofármacos. En particular, el desarrollo de 2-fluorodesoxi-D-glucosa (2FDG) marcada por el grupo Brookhaven bajo la dirección de Al Wolf y Joanna Fowler fue un factor importante en la ampliación del alcance de las imágenes por PET. [83] El compuesto fue administrado por primera vez a dos voluntarios humanos normales por Abass Alavi en agosto de 1976 en la Universidad de Pensilvania. Las imágenes cerebrales obtenidas con un escáner nuclear ordinario (no PET) demostraron la concentración de FDG en ese órgano. Más tarde, la sustancia se utilizó en escáneres tomográficos de positrones específicos para obtener el procedimiento moderno.
La extensión lógica de la instrumentación de positrones fue un diseño que utilizaba dos matrices bidimensionales. PC-I fue el primer instrumento que utilizó este concepto y se diseñó en 1968, se completó en 1969 y se informó en 1972. Las primeras aplicaciones de PC-I en modo tomográfico a diferencia del modo tomográfico computarizado se informaron en 1970. [84] Pronto quedó claro para muchos de los involucrados en el desarrollo de PET que una matriz circular o cilíndrica de detectores era el siguiente paso lógico en la instrumentación de PET. Aunque muchos investigadores adoptaron este enfoque, James Robertson [85] y Zang-Hee Cho [86] fueron los primeros en proponer un sistema de anillos que se ha convertido en el prototipo de la forma actual del PET.
El escáner PET-CT, atribuido a David Townsend y Ronald Nutt, fue nombrado por Time como el invento médico del año 2000. [87]
En agosto de 2008, Cancer Care Ontario informa que el costo incremental promedio actual para realizar una exploración por TEP en la provincia es de 1.000 a 1.200 dólares canadienses por exploración. Esto incluye el costo del radiofármaco y un estipendio para el médico que lee la exploración. [88]
En los Estados Unidos, se estima que una exploración por TEP cuesta 5.000 dólares estadounidenses, y la mayoría de las compañías de seguros no pagan por exploraciones por TEP de rutina después del tratamiento del cáncer debido al hecho de que estas exploraciones a menudo son innecesarias y presentan potencialmente más riesgos que beneficios. [89]
En Inglaterra, el coste de referencia del Servicio Nacional de Salud (2015-2016) para una exploración PET ambulatoria en adultos es de £798. [90]
En Australia, a partir de julio de 2018, la tarifa del programa de beneficios de Medicare para la PET con FDG de cuerpo entero oscila entre 953 y 999 dólares australianos, según la indicación de la exploración. [91]
El rendimiento general de los sistemas PET se puede evaluar mediante herramientas de control de calidad como el fantasma de Jaszczak . [92]
{{cite journal}}: Citar diario requiere |journal=( ayuda )