

La tiroiditis de Hashimoto , también conocida como tiroiditis linfocítica crónica y enfermedad de Hashimoto , es una enfermedad autoinmune en la que la glándula tiroides se destruye gradualmente. [1] [6] Un término ligeramente más amplio es tiroiditis autoinmune , idéntico aparte de que también se usa para describir una afección similar sin bocio. [7] [8]
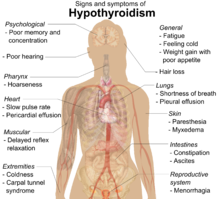
Al principio, es posible que los síntomas no se noten. [1] Con el tiempo, la tiroides puede agrandarse y formar un bocio indoloro . [1] Algunas personas eventualmente desarrollan hipotiroidismo acompañado de aumento de peso , fatiga , estreñimiento , depresión , caída del cabello y dolores generales. [1] Después de muchos años, la tiroides generalmente se reduce de tamaño. [1] Las posibles complicaciones incluyen el linfoma de tiroides . [2] Además, debido a que es común que los pacientes de Hashimoto no tratados desarrollen hipotiroidismo, otras complicaciones pueden incluir, entre otras, colesterol alto , enfermedades cardíacas , insuficiencia cardíaca , presión arterial alta , mixedema y posibles problemas durante el embarazo. [9]
Se cree que la tiroiditis de Hashimoto se debe a una combinación de factores genéticos y ambientales . [4] Los factores de riesgo incluyen antecedentes familiares de la afección y tener otra enfermedad autoinmune. [1] El diagnóstico se confirma con análisis de sangre para TSH , T4 y autoanticuerpos antitiroideos . [1] Otras afecciones que pueden producir síntomas similares incluyen la enfermedad de Graves y el bocio nodular no tóxico . [5]
La tiroiditis de Hashimoto normalmente se trata con levotiroxina . [1] [10] Si no hay hipotiroidismo, algunos pueden recomendar ningún tratamiento, mientras que otros pueden tratarlo para tratar de reducir el tamaño del bocio. [1] [11] Los afectados deben evitar comer grandes cantidades de yodo ; sin embargo, se requiere suficiente yodo, especialmente durante el embarazo. [1] Rara vez se requiere cirugía para tratar el bocio. [5]
La tiroiditis de Hashimoto afecta aproximadamente al 5% de los caucásicos en algún momento de sus vidas. [4] Es la causa más común de hipotiroidismo en áreas del mundo con suficiente yodo. [12] Por lo general, comienza entre las edades de 30 y 50 años y es mucho más común en mujeres que en hombres. [1] [3] Las tasas de la enfermedad parecen estar aumentando. [5] Fue descrito por primera vez por el médico japonés Hakaru Hashimoto en 1912. [13] En 1957, fue reconocido como un trastorno autoinmune. [14]

Muchos síntomas se atribuyen al desarrollo de la tiroiditis de Hashimoto. Los síntomas más comunes incluyen: fatiga , aumento de peso, cara pálida o hinchada, sensación de frío, dolor en las articulaciones y músculos , estreñimiento , cabello seco y ralo, flujo menstrual abundante o períodos irregulares , depresión , trastorno de pánico , frecuencia cardíaca lenta y problemas. quedar embarazada y abortos espontáneos . [15]
Algunos pacientes en la etapa inicial de la enfermedad pueden experimentar síntomas de hipertiroidismo debido a la liberación de hormonas tiroideas debido a la destrucción intermitente de la tiroides. [dieciséis]
La enfermedad de Hashimoto es aproximadamente siete veces más común en mujeres que en hombres. Puede ocurrir en adolescentes y mujeres jóvenes, pero aparece más comúnmente en la mediana edad , particularmente en los hombres. Las personas que desarrollan la enfermedad de Hashimoto a menudo tienen familiares que tienen tiroides u otras enfermedades autoinmunes y, a veces, ellos mismos tienen otras enfermedades autoinmunes. [17]
Las primeras etapas de la tiroiditis autoinmune pueden tener un examen físico normal con o sin bocio. [18] Un bocio es una inflamación difusa, a menudo simétrica, de la glándula tiroides visible en la parte anterior del cuello que puede desarrollarse. [18] La glándula tiroides puede volverse firme, grande y lobulada en la tiroiditis de Hashimoto, pero los cambios en la tiroides también pueden ser no palpables. [19] El agrandamiento de la tiroides se debe a la infiltración linfocítica y a la fibrosis , más que a la hipertrofia del tejido . Si bien su papel en la destrucción inicial de los folículos no está claro, los anticuerpos contra la peroxidasa tiroidea o la tiroglobulina son relevantes, ya que sirven como marcadores para detectar la enfermedad y su gravedad. [20] Se cree que son productos secundarios de la destrucción de la glándula mediada por células T. [21]
A medida que avanza la infiltración linfocítica, los pacientes pueden presentar signos de hipotiroidismo en múltiples sistemas corporales, incluidos, entre otros, un bocio más grande, aumento de peso, intolerancia al frío, fatiga, mixedema, estreñimiento, alteraciones menstruales, piel pálida o seca y piel seca. cabello quebradizo, depresión, ataxia y debilidad muscular. [18] [12]
Los pacientes con bocio que han tenido tiroiditis autoinmune durante muchos años pueden ver cómo su bocio se reduce en las últimas etapas de la enfermedad debido a la destrucción de la tiroides. [dieciséis]
Aunque son raras, las complicaciones más graves del hipotiroidismo resultante de la tiroiditis autoinmune son el derrame pericárdico , el derrame pleural , los cuales requieren atención médica adicional, y el coma mixedema , que es una emergencia endocrina. [12]
La tiroiditis autoinmune es la causa más común de hipotiroidismo en entornos con suficiente yodo . [12] Se estima que afecta al 2% de la población mundial. [22] Puede afectar hasta el 5% de la población de los Estados Unidos. [23] Cualquiera puede desarrollar esta enfermedad, pero la tiroiditis autoinmune afecta a las mujeres con más frecuencia que a los hombres, aproximadamente 10 veces. [22] La diferencia en la prevalencia entre géneros se debe a los efectos de las hormonas sexuales . [24] La incidencia alcanza su punto máximo en la quinta década de la vida, pero los pacientes generalmente son diagnosticados entre los 30 y los 50 años. [16] [23]
La autoinmunidad tiroidea puede ser familiar. [7] Muchos pacientes informan antecedentes familiares de tiroiditis autoinmune o enfermedad de Graves . [18] Los estudios de gemelos han revelado una concordancia de la enfermedad de Hashimoto en gemelos monocigóticos. [12]
La tiroiditis autoinmune tiene una mayor prevalencia en sociedades que tienen una mayor ingesta de yodo en su dieta, como Estados Unidos y Japón. Es la causa más común de hipotiroidismo en áreas con suficiente yodo. [12] Además, la tasa de infiltración linfocítica aumentó en áreas donde la ingesta de yodo alguna vez fue baja, pero aumentó debido a la suplementación con yodo. [7]
Se ha demostrado que "la prevalencia de pruebas positivas de anticuerpos tiroideos aumenta con la edad, con una frecuencia de hasta el 33 por ciento en mujeres de 70 años o más". [7] La incidencia alcanza su punto máximo en la quinta década de la vida y la prevalencia aumenta con la edad. [12] [23]
La enfermedad de Graves puede ocurrir antes o después del desarrollo de tiroiditis autoinmune. [24] Los pacientes también pueden tener enfermedades autoinmunes coexistentes de otros órganos. Estos pueden incluir la enfermedad de Addison , la diabetes tipo 1 , el síndrome de Sjogren , la enfermedad celíaca y la artritis reumatoide . [18] [16] También se ha observado tiroiditis autoinmune en pacientes con síndromes poliendocrinos autoinmunes tipo 1 y 2. [24]
El fuerte componente genético se confirma en estudios en gemelos monocigóticos , con una concordancia del 38-55%, con una concordancia aún mayor de anticuerpos tiroideos circulantes no en relación con la presentación clínica (hasta un 80% en gemelos monocigóticos). Ninguno de los resultados se observó en un grado similar en gemelos dicigóticos , lo que favorece fuertemente la etiología genética alta . [25]
Ciertos medicamentos o drogas se han asociado con alterar e interferir con la función tiroidea. De estos fármacos, existen dos principales mecanismos de interferencia que pueden tener. [ cita necesaria ]
Uno de los mecanismos de interferencia es cuando un fármaco altera las proteínas de transferencia sérica de la hormona tiroidea. [26] El estrógeno , el tamoxifeno , la heroína , la metadona , el clofibrato , el 5-fluoroacilo , el mitotano y la perfenazina aumentan la concentración de globulina transportadora de tiroides (TBG). [26] Los andrógenos , los esteroides anabólicos como el danazol , los glucocorticoides y el ácido nicotínico de liberación lenta disminuyen las concentraciones de TBG. La furosemida , el fenoflenac, el ácido mefenámico , los salicilatos , la fenitoína , el diazepam , las sulfonilureas , los ácidos grasos libres y la heparina interfieren con la unión de la hormona tiroidea a la TBG y/o la transtiretina . [ cita necesaria ]
El otro mecanismo que pueden utilizar los medicamentos para interferir con la función tiroidea sería alterar el metabolismo extratiroideo de la hormona tiroidea. El propiltiouracilo, los glucocorticoides, el propranolol, los agentes de contraste iondados, la amiodarona y la clomipramina inhiben la conversión de T4 y T3. [26] El fenobarbital, la rifampicina, la fenitoína y la carbamazepina aumentan el metabolismo hepático. [26] Finalmente, la colestramina, el colestipol, el hidróxido de aluminio, el sulfato ferroso y el sucralfato son medicamentos que disminuyen la absorción de T4 o mejoran la excreción. [26]
El primer locus genético asociado con la enfermedad tiroidea autoinmune fue la región del complejo mayor de histocompatibilidad (MHC) en el cromosoma 6p21. Codifica HLA. Los alelos HLA específicos tienen una mayor afinidad por los péptidos tiroideos autoantigénicos y pueden contribuir al desarrollo de enfermedades tiroideas autoinmunes. Específicamente, en la enfermedad de Hashimoto se ha demostrado una expresión aberrante de HLA II en los tirocitos. Pueden presentar autoantígenos tiroideos e iniciar una enfermedad tiroidea autoinmune. [27] Los alelos de susceptibilidad no son consistentes en la enfermedad de Hashimoto. En los caucásicos, se informa que varios alelos están asociados con la enfermedad, incluidos DR3, DR5 y DQ7. [28] [29]
Este gen es el segundo gen inmunorregulador importante relacionado con la enfermedad tiroidea autoinmune. Los polimorfismos del gen CTLA-4 pueden contribuir a la inhibición reducida de la proliferación de células T y aumentar la susceptibilidad a la respuesta autoinmune. [30] CTLA-4 es un gen importante de susceptibilidad a los autoanticuerpos tiroideos. Un análisis de enlace de todo el genoma demostró un vínculo de la región CTLA-4 con la presencia de autoanticuerpos tiroideos. [31] Se confirmó que CTLA-4 es el locus principal para los autoanticuerpos tiroideos. [32]
PTPN22 es el gen inmunorregulador identificado más recientemente asociado con la enfermedad tiroidea autoinmune. Se encuentra en el cromosoma 1p13 y se expresa en linfocitos. Actúa como un regulador negativo de la activación de las células T. La mutación en este gen es un factor de riesgo para muchas enfermedades autoinmunes. Una señalización más débil de las células T puede provocar una alteración de la deleción tímica de las células T autorreactivas, y una mayor función de PTPN22 puede dar lugar a la inhibición de las células T reguladoras, que protegen contra la autoinmunidad. [33]
El IFN-γ promueve la citotoxicidad mediada por células contra las mutaciones tiroideas que causan una mayor producción de IFN-γ y se asociaron con la gravedad del hipotiroidismo. [34] El hipotiroidismo grave se asocia con mutaciones que conducen a una menor producción de IL-4 (autoinmunidad mediada por células supresoras de citocinas Th2), [35] menor secreción de TGF-β (inhibidor de la producción de citocinas), [36] y mutaciones de FoxP3 , un factor regulador esencial para el desarrollo de Tregs. [37] El desarrollo de la enfermedad de Hashimoto se asoció con la mutación del gen del TNF-α (estimulador de la producción de IFN-γ), lo que provocó su mayor concentración. [38]
Los factores ambientales prevenibles, incluida la ingesta elevada de yodo, la deficiencia de selenio y las enfermedades infecciosas y ciertos medicamentos, se han implicado en el desarrollo de enfermedades tiroideas autoinmunes en individuos genéticamente predispuestos. [39]
La ingesta excesiva de yodo es un factor ambiental bien establecido que desencadena la autoinmunidad tiroidea. Los autoanticuerpos tiroideos son más prevalentes en áreas geográficas con niveles más altos de yodo en la dieta. Se han propuesto varios mecanismos por los cuales el yodo puede promover la autoinmunidad tiroidea. La exposición al yodo conduce a una mayor yodación de la tiroglobulina, lo que aumenta su inmunogenicidad al crear nuevos epítopos que contienen yodo o exponer epítopos crípticos. Puede facilitar la presentación por parte de APC, mejorar la afinidad de unión del receptor de células T y activar células T específicas. [40]
Se ha demostrado que la exposición al yodo aumenta el nivel de especies reactivas de oxígeno. Mejoran la expresión de la molécula de adhesión intracelular-1 en las células foliculares de la tiroides, lo que podría atraer a las células inmunocompetentes a la glándula tiroides. [41]
El yodo es tóxico para los tirocitos ya que especies de oxígeno altamente reactivas pueden unirse a los lípidos y proteínas de la membrana. Provoca daño a los tirocitos y la liberación de autoantígenos. El yodo también promueve la apoptosis de las células foliculares y tiene influencia sobre las células inmunes (mayor maduración de las células dendríticas, mayor número de células T, estimulación de la producción de inmunoglobulinas de las células B). [42] [43]
Los datos de la Investigación Danesa sobre la ingesta de yodo y la enfermedad tiroidea muestran que dentro de dos cohortes (hombres, mujeres) con deficiencia moderada y leve de yodo , los niveles de peroxidasa tiroidea y anticuerpos contra tiroglobulina son más altos en las mujeres, y las tasas de prevalencia de ambos anticuerpos aumentan con edad. [44]
Un estudio de gemelos daneses sanos divididos en tres grupos (monocigóticos y dicigóticos del mismo sexo y pares de gemelos de sexo opuesto) estimó que la contribución genética a la susceptibilidad a los anticuerpos contra la peroxidasa tiroidea fue del 61 % en los hombres y del 72 % en las mujeres, y la contribución a la susceptibilidad a los anticuerpos contra la tiroglobulina fue del 39 % en hombres y 75% en mujeres. [45]
El alto predominio femenino en la autoinmunidad tiroidea puede estar asociado con el cromosoma X. Contiene genes sexuales e inmunitarios responsables de la tolerancia inmunitaria. [46] Se informó una mayor incidencia de autoinmunidad tiroidea en pacientes con una tasa más alta de monosomía del cromosoma X en los glóbulos blancos periféricos. [47]
Otro mecanismo potencial podría ser la inactivación sesgada del cromosoma X, que conduce al escape de los autoantígenos ligados al cromosoma X de su presentación en el timo y a la pérdida de la tolerancia de las células T. [ cita necesaria ]
Tener otras enfermedades autoinmunes es un factor de riesgo para desarrollar tiroiditis de Hashimoto, y lo contrario también es cierto. [1] Las enfermedades autoinmunes más comúnmente asociadas con la tiroiditis de Hashimoto incluyen la enfermedad celíaca , la diabetes tipo 1 , el vitíligo y la alopecia . [48]
Los genes implicados varían en diferentes grupos étnicos y la incidencia aumenta en personas con trastornos cromosómicos, incluidos los síndromes de Turner , Down y Klinefelter generalmente asociados con autoanticuerpos contra la tiroglobulina y la tiroperoxidasa . El agotamiento progresivo de estas células a medida que la respuesta inmune citotóxica conduce a grados más altos de hipotiroidismo primario, que se presenta con niveles bajos de T3/T4 y elevaciones compensatorias de TSH. [ cita necesaria ]
El mecanismo de la tiroiditis autoinmune no se comprende bien, pero se cree que se desarrolla como resultado de una interacción compleja de factores genéticos y ambientales. [22] Los autoanticuerpos tiroideos aparecen principalmente con la presencia de linfocitos en el órgano objetivo. [7] [49] Los linfocitos producen anticuerpos dirigidos a tres proteínas tiroideas diferentes: anticuerpos contra la peroxidasa tiroidea (TPOAb), anticuerpos contra la tiroglobulina (TgAb) y anticuerpos contra el receptor de la hormona estimulante de la tiroides (TRAb). [7] [50] Los ataques de anticuerpos finalmente conducen al hipotiroidismo, que es causado por el reemplazo de células foliculares con tejido parenquimatoso. [51]
Los dos anticuerpos más comúnmente implicados en la tiroiditis autoinmune son los anticuerpos contra la peroxidasa tiroidea (TPOAb) y la tiroglobulina (TgAb). [22] Se supone que se desarrollan como resultado del daño tiroideo, donde los linfocitos T están sensibilizados a la peroxidasa tiroidea residual y la tiroglobulina, en lugar de ser la causa del daño tiroideo. [22] Sin embargo, pueden exacerbar una mayor destrucción de la tiroides al unirse al sistema del complemento y desencadenar la apoptosis de las células tiroideas. [22] Los factores ambientales que pueden predisponer a los pacientes a este tipo de desregulación inmune incluyen toxinas, medicamentos, factores dietéticos y agentes infecciosos. [24]
Algunos pacientes sanos o asintomáticos pueden dar positivo en más de uno de estos anticuerpos. Lo más probable es que los médicos que atienden a estos pacientes los controlen, ya que existe la posibilidad de que desarrollen algún tipo de disfunción con el tiempo. [50]
Se observan cambios morfológicos importantes dentro de la tiroides en el agrandamiento general, que es mucho más localmente nodular e irregular que los patrones más difusos (como el del hipertiroidismo ). Si bien la cápsula está intacta y la glándula misma aún se distingue del tejido circundante, el examen microscópico puede proporcionar una indicación más reveladora del nivel de daño. [52]

La patología macroscópica de una tiroides con tiroiditis autoinmune puede mostrar una tiroides agrandada simétricamente. [22] A menudo es de color más pálido, en comparación con el tejido tiroideo normal, que es de color marrón rojizo. [22] El examen microscópico mostrará infiltración de linfocitos y células plasmáticas. Los linfocitos son predominantemente linfocitos T con una representación de células CD4 positivas y CD8 positivas. [22] Las células plasmáticas son policlonales, con centros germinales presentes que se asemejan a la estructura de un ganglio linfático. [22] También se puede encontrar tejido fibroso en toda la tiroides afectada. [22] Generalmente, los hallazgos patológicos de la tiroides están relacionados con la cantidad de función tiroidea existente: cuanto más infiltración y fibrosis, es menos probable que un paciente tenga una función tiroidea normal. [22] En las últimas etapas de la enfermedad, la tiroides puede estar atrófica. [12]
Histológicamente, la hipersensibilidad se observa como una infiltración parenquimatosa difusa por linfocitos, particularmente células B plasmáticas , que a menudo pueden verse como folículos linfoides secundarios (centros germinales, que no deben confundirse con los folículos normalmente presentes llenos de coloides que constituyen la tiroides). La atrofia de los cuerpos coloides está revestida por células de Hürthle , células con citoplasma granular intensamente eosinófilo , una metaplasia de las células cúbicas normales que constituyen el revestimiento de los folículos tiroideos. La atrofia tiroidea grave se presenta a menudo con bandas fibróticas de colágeno más densas que permanecen dentro de los límites de la cápsula tiroidea. [52]
También se caracteriza por la invasión del tejido tiroideo por leucocitos , principalmente linfocitos T. Una complicación rara pero grave es el linfoma de tiroides , generalmente linfoma no Hodgkin de tipo de células B. [53]

El diagnóstico generalmente se realiza mediante la detección de niveles elevados de anticuerpos antitiroideos peroxidasa en el suero, pero también es posible la tiroiditis seronegativa (sin autoanticuerpos circulantes). [54] Una ecografía puede ser útil para detectar tiroiditis de Hashimoto, especialmente en aquellos con tiroiditis seronegativa, debido a las características clave detectadas en la ecografía de una persona con tiroiditis de Hashimoto, como "ecogenicidad, heterogeneidad, hipervascularidad y presencia de pequeños quistes". " [55]
Se pueden elegir varias pruebas dependiendo de los síntomas que se presenten. Para los pacientes con tiroiditis autoinmune, si bien se sabe que muchos pacientes pueden tener anticuerpos circulantes antes de presentar cualquier síntoma, los pacientes pueden acudir a sus médicos para una evaluación con síntomas de hipotiroidismo. [12] Los médicos a menudo comienzan evaluando los síntomas informados y realizando un examen físico completo, incluido un examen del cuello. [12]
Dados los síntomas relativamente inespecíficos del hipotiroidismo inicial, la tiroiditis de Hashimoto a menudo se diagnostica erróneamente como depresión , ciclotimia , síndrome premenstrual , síndrome de fatiga crónica , fibromialgia y, con menos frecuencia, como disfunción eréctil o un trastorno de ansiedad . En el examen macroscópico, a menudo se presenta un bocio duro que no es doloroso al tacto; [52] Otros síntomas observados con hipotiroidismo, como el mixedema periorbitario , dependen del estado actual de progresión de la respuesta, especialmente dado el desarrollo generalmente gradual del hipotiroidismo clínicamente relevante. Las pruebas de hormona estimulante de la tiroides (TSH), T3 libre, T4 libre y anticuerpos antitiroglobulina (anti-Tg), anticuerpos antiperoxidasa tiroidea (anti-TPO o TPOAb) y anticuerpos antimicrosomales pueden ayudar a obtener un diagnóstico preciso. [56] Una evaluación temprana de la persona puede presentar niveles elevados de tiroglobulina debido a tirotoxicosis transitoria , ya que la inflamación dentro de la tiroides causa daño a la integridad del almacenamiento de tiroglobulina en el folículo tiroideo; La secreción de TSH de la hipófisis anterior aumenta en respuesta a una disminución de la inhibición por retroalimentación negativa secundaria a la disminución de las hormonas tiroideas séricas. Normalmente, la T4 es la prueba de hormona tiroidea preferida para el hipotiroidismo. [57] Se cree que esta exposición del cuerpo a cantidades sustanciales de enzimas tiroideas previamente aisladas contribuye a la exacerbación de la degradación de la tolerancia, dando lugar a síntomas más pronunciados que se observan más adelante en la enfermedad. La infiltración linfocítica de los tejidos asociados a tirocitos a menudo conduce al hallazgo histológicamente significativo de desarrollo del centro germinal dentro de la glándula tiroides. [ cita necesaria ]
El síndrome de Hashimoto cuando se presenta como manía se conoce como síndrome de Prasad en honor a Ashok Prasad, el psiquiatra que lo describió por primera vez. [58]
La evaluación diagnóstica inicial comenzará con la concentración plasmática de la hormona estimulante de la tiroides (TSH). [16] Si está elevado, significa hipotiroidismo. [16] La elevación suele ser un aumento marcado sobre el rango normal y generalmente es superior a 20 mg/dl. [18] Los niveles de T4 libre generalmente se reducirán, pero a veces pueden ser normales. [59]
Los médicos pueden comprobar los anticuerpos contra tiroglobulina (TgAb) cada vez que se realiza una prueba de tiroglobulina para ver si el anticuerpo está interfiriendo. TgAb también se puede solicitar a intervalos regulares después de que a una persona se le haya diagnosticado cáncer de tiroides y, al igual que TPOAb, puede asociarse con la tiroiditis de Hashimoto. [50] El complemento más común de los valores de laboratorio en pacientes con tiroiditis autoinmune son TSH alta, T4 baja y anticuerpos TPO positivos. [59]

Cuando los pacientes tienen valores de laboratorio normales pero síntomas de tiroiditis autoinmune, la ecografía juega un papel en el diagnóstico. [16] Las imágenes obtenidas con ultrasonido pueden evaluar el tamaño de la tiroides y respaldar aún más el diagnóstico de tiroiditis autoinmune, revelar la presencia de nódulos o proporcionar pistas para el diagnóstico de otras afecciones de la tiroides. [dieciséis]

El hipotiroidismo causado por la tiroiditis de Hashimoto se trata con agentes de reemplazo de la hormona tiroidea como levotiroxina , triyodotironina o extracto desecado de tiroides . Una tableta tomada una vez al día generalmente mantiene normales los niveles de hormona tiroidea. En la mayoría de los casos, el tratamiento debe durar el resto de la vida de la persona. Si el hipotiroidismo es causado por tiroiditis de Hashimoto, se puede recomendar que los niveles de TSH se mantengan por debajo de 3,0 m UI /l. [60]
El estándar de atención es la terapia con levotiroxina , que es un medicamento oral estructurado como T4 endógeno. [22] La dosis de levotiroxina se puede basar en el peso, más comúnmente, o en la elevación de TSH. [22] Por lo general, la dosis prescrita oscila entre 1,6 mcg/kg y 1,8 mcg/kg, pero se puede ajustar según cada paciente. [12] Por ejemplo, la dosis puede reducirse en pacientes de edad avanzada o pacientes con ciertas afecciones cardíacas, pero debe aumentarse en pacientes embarazadas. [12] Debe administrarse en un horario constante. [22] Algunos pacientes eligen la terapia combinada con levotiroxina y liotironina , que es una T3 sintética; sin embargo, los estudios sobre la terapia combinada son limitados. [22]
Los efectos secundarios de la terapia de reemplazo tiroideo están asociados con el hipertiroidismo iatrogénico . [22] Los síntomas a tener en cuenta incluyen, entre otros, ansiedad, temblores, pérdida de peso, sensibilidad al calor, diarrea y dificultad para respirar. Los síntomas más preocupantes incluyen fibrilación auricular y pérdida de densidad ósea. [22]
La TSH es el valor de laboratorio de elección para monitorear la respuesta al tratamiento con levotiroxina. [59] Cuando se inicia el tratamiento por primera vez, los niveles de TSH se pueden controlar con una frecuencia de cada 6 a 8 semanas. [59] Cada vez que se ajusta la dosis, los niveles de TSH se pueden medir con esa frecuencia hasta que se determine la dosis correcta. [59] Una vez titulado a una dosis adecuada, los niveles de TSH se controlarán anualmente. [59]
La cirugía no es el tratamiento inicial de elección para la enfermedad autoinmunitaria y la tiroiditis de Hashimoto no complicada no es una indicación para la tiroidectomía. [22] Los pacientes generalmente pueden hablar sobre la cirugía con su médico si experimentan síntomas de presión importantes, problemas estéticos o si tienen nódulos presentes en la ecografía. [22] Un estudio bien realizado de pacientes con síntomas generales problemáticos y con niveles de antitiroperoxidasa (anti-TPO) superiores a 1000 UI/ml (normal <100 UI/ml) mostró que la tiroidectomía total provocó que los síntomas se resolvieran, pero hubo complicaciones postoperatorias en el 14%.
REFERENCIA: Guldvog I et al. Anales de Medicina Interna 2019; 21: 161-167.
La disfunción tiroidea manifiesta y sintomática es la complicación más común, y aproximadamente el 5% de las personas con hipotiroidismo subclínico y tiroiditis autoinmune crónica progresan a insuficiencia tiroidea cada año. A veces ocurren períodos transitorios de tirotoxicosis (hiperactividad de la tiroides) y, en raras ocasiones, la enfermedad puede progresar a hipertiroidismo completo. Enfermedad de Graves con orbitopatía activa (ojos saltones e inflamados). Los casos raros de tiroiditis fibrosa autoinmune se presentan con dificultad para respirar grave y dificultad para tragar , parecidos a tumores de tiroides agresivos, pero estos síntomas siempre mejoran con cirugía o terapia con corticosteroides. Aunque el linfoma primario de células B de tiroides afecta a menos de una de cada 1000 personas, es más probable que afecte a aquellas con tiroiditis autoinmune de larga duración, [61] ya que existe un riesgo de 67 a 80 veces mayor de desarrollar linfoma primario de tiroides en Pacientes con tiroiditis de Hashimoto. [62]
Se cree que el trastorno de tiroiditis de Hashimoto es la causa más común de hipotiroidismo primario en América del Norte. [52] Dentro de las tendencias descriptivas de epidemiología de persona, lugar y tiempo, se vuelve más claro cómo la tiroiditis de Hashimoto se desarrolla e impacta en diferentes poblaciones.
En general, la tiroiditis de Hashimoto afecta hasta al 2% de la población general. [25] Alrededor del 5% de los caucásicos desarrollarán la enfermedad de Hashimoto en algún momento de sus vidas. [4] En los EE. UU., la población afroamericana lo experimenta con menos frecuencia pero tiene una mayor mortalidad asociada. [63] También es menos frecuente en las poblaciones asiáticas. [64] Aproximadamente entre 1,0 y 1,5 de cada 1.000 personas padecen esta enfermedad en cualquier momento. [52] Ocurre entre 8 y 15 veces más a menudo en mujeres que en hombres. Algunas investigaciones sugieren una conexión con el papel de la placenta como explicación de la diferencia de sexo. [65] Aunque puede ocurrir a cualquier edad, incluso en niños, se observa con mayor frecuencia en mujeres entre 30 y 60 años. [61] La prevalencia más alta de un estudio se encontró en los miembros mayores de la comunidad. [66]
Aquellos que ya padecen una enfermedad autoinmune tienen mayor riesgo de desarrollar la enfermedad de Hashimoto, ya que las enfermedades generalmente coexisten entre sí. [25] Las enfermedades comunes que se observan coexistiendo con la enfermedad de Hashimoto incluyen la enfermedad celíaca , la esclerosis múltiple , la diabetes tipo 1 , el vitíligo y la artritis reumatoide . [ cita necesaria ]
El hipotiroidismo congénito afecta a 1 de cada 3500-4000 recién nacidos al nacer y es una versión de la discapacidad intelectual que puede tratarse si se detecta a tiempo, pero puede ser difícil de diagnosticar dado que los síntomas son mínimos a una edad temprana. [66] El hipotiroidismo congénito generalmente es causado por defectos de la glándula tiroides, pero en la mayoría de los casos en Europa, Asia y África, la ingesta de yodo puede causar hipotiroidismo en los recién nacidos.
Las dietas que consisten en una ingesta baja o alta de yodo determinan el riesgo de que una población desarrolle trastornos relacionados con la tiroides. [67] Es más común en regiones con un alto consumo de yodo en la dieta y entre personas genéticamente susceptibles. [61] La geografía juega un papel importante en qué regiones tienen acceso a dietas con bajo o alto contenido de yodo. Los niveles de yodo tanto en el agua como en la sal deben controlarse estrechamente para proteger a las poblaciones en riesgo de desarrollar hipotiroidismo. [68]
Las tendencias geográficas del hipotiroidismo varían en todo el mundo, ya que los diferentes lugares tienen diferentes formas de definir la enfermedad y notificar los casos. Las poblaciones dispersas o mal definidas pueden distorsionar los datos de maneras inesperadas. [25]
El trastorno por deficiencia de yodo (IDD) se combate aumentando el contenido de yodo en la dieta de una persona. Cuando se produce un cambio dramático en la dieta de una persona, corre mayor riesgo de desarrollar hipotiroidismo y otros trastornos de la tiroides. La lucha contra los TDY con un consumo elevado de sal debe realizarse con cuidado y cautela, ya que puede aumentar el riesgo de padecer el síndrome de Hashimoto. [67] Si se realizan modificaciones en la dieta, es importante utilizar el criterio del médico para garantizar que los cambios en la dieta sean la mejor opción, ya que las recomendaciones pueden variar de persona a persona. [ cita necesaria ]
Las tendencias seculares del hipotiroidismo revelan cómo la enfermedad ha cambiado a lo largo del tiempo debido a los cambios en la tecnología y las opciones de tratamiento. Aunque la tecnología de ultrasonido y las opciones de tratamiento han mejorado, la incidencia del hipotiroidismo ha aumentado según datos centrados en Estados Unidos y Europa. Entre 1993 y 2001, por cada 1.000 mujeres, la enfermedad osciló entre 3,9 y 4,89. Entre 1994 y 2001, por cada 1.000 hombres, la enfermedad aumentó de 0,65 a 1,01. [66]
Los cambios en la definición de hipotiroidismo y las opciones de tratamiento modifican la incidencia y prevalencia de la enfermedad en general. El tratamiento con levotiroxina es individualizado y, por lo tanto, permite que la enfermedad sea más manejable con el tiempo, pero no funciona como cura para la enfermedad. [25]
También conocida como enfermedad de Hashimoto, la tiroiditis de Hashimoto lleva el nombre del médico japonés Hakaru Hashimoto (1881-1934) de la facultad de medicina de la Universidad de Kyushu , [69] quien describió por primera vez los síntomas de personas con estruma linfomatosa , una infiltración intensa de linfocitos dentro de la tiroides. , en 1912 en la revista alemana Archiv für Klinische Chirurgie . [3] [70] Este artículo consta de 30 páginas y 5 ilustraciones, todas las cuales describen los cambios histológicos en el tejido tiroideo. Además, todos los resultados de su primer estudio se obtuvieron de cuatro mujeres. Estos resultados explicaron las características patológicas observadas en estas mujeres, especialmente la infiltración de células linfoides y plasmáticas, así como la formación de folículos linfoides con centros germinales, fibrosis, células epiteliales tiroideas degeneradas y leucocitos en la luz. [3] Describió que estos rasgos son histológicamente similares a los de la enfermedad de Mikulic. Como se mencionó anteriormente, una vez que descubrió estos rasgos en esta nueva enfermedad, la llamó struma linfomatosa. Esta enfermedad enfatizó la infiltración de células linfoides y la formación de folículos linfoides con centros germinales, ninguno de los cuales había sido reportado previamente. [3]
A pesar del descubrimiento y la publicación del Dr. Hashimoto, la enfermedad no fue reconocida como distinta de la tiroiditis de Reidel , que era una enfermedad común en ese momento en Europa. Aunque otros investigadores informaron y publicaron muchos otros artículos, la estruma linfomatosa de Hashimoto solo se reconoció como una fase temprana de la tiroiditis de Reidel a principios del siglo XX. No fue hasta 1931 que la enfermedad fue reconocida como una enfermedad por derecho propio, cuando los investigadores Allen Graham et al. de Cleveland informó sus síntomas y presentación de la misma manera detallada que Hakaru. [3]
En 1956, los Dres. Rose y Witebsky pudieron demostrar cómo la inmunización de ciertos roedores con extractos de tiroides de otros roedores se parecía a la enfermedad que Hakaru y otros investigadores intentaban describir. [3] Estos médicos también pudieron describir anticuerpos anti-tiroglobulina en muestras de suero sanguíneo de estos mismos animales. [ cita necesaria ]
Más tarde, ese mismo año, investigadores del Hospital Middlesex de Londres pudieron realizar experimentos en humanos en pacientes que presentaban síntomas similares. Purificaron el anticuerpo antitiroglobulina de su suero y pudieron concluir que estos pacientes enfermos tenían una reacción inmunológica a la tiroglobulina humana. [3] A partir de estos datos, se propuso que el estruma de Hashimoto podría ser una enfermedad autoinmune de la glándula tiroides.
En 1957, fue reconocido como un trastorno autoinmune y fue el primer trastorno autoinmune específico de un órgano identificado. [14]
Tras este reconocimiento, los mismos investigadores del Hospital Middlesex publicaron un artículo en 1962 en The Lancet que incluía un retrato de Hakaru Hashimoto. [3] La enfermedad se hizo más conocida a partir de ese momento, y la enfermedad de Hashimoto comenzó a aparecer con mayor frecuencia en los libros de texto. [ cita necesaria ]
Desde esos descubrimientos, se han descubierto varias enfermedades autoinmunes, varias de las cuales tienen que ver con anticuerpos específicos de la tiroides. [ cita necesaria ]
Las mujeres embarazadas con tiroiditis de Hashimoto pueden tener una función tiroidea disminuida o la glándula puede fallar por completo. [71] Si una mujer es TPOAb positiva, los médicos pueden informarle sobre los riesgos para ella y su bebé si la enfermedad no se trata. "Los anticuerpos contra la peroxidasa tiroidea (TPOAb) se detectan en el 10% de las mujeres embarazadas", lo que presenta riesgos para esos embarazos. [71] Las mujeres que tienen una función tiroidea baja que no se ha estabilizado tienen un mayor riesgo de tener un bebé con: bajo peso al nacer, dificultad respiratoria neonatal, hidrocefalia , hipospadias , aborto espontáneo y parto prematuro. [71] [72] La tasa de trasplante de embriones y los resultados exitosos del embarazo mejoran cuando se trata la enfermedad de Hashimoto. [72] Las recomendaciones son tratar a las mujeres embarazadas solo si son TPOAb positivas durante todo el embarazo y realizar pruebas de detección de los niveles de tiroides en todas las mujeres embarazadas. [71] La estrecha cooperación entre el endocrinólogo y el obstetra beneficia a la mujer y al bebé. [71] [73] [74] La Endocrine Society recomienda realizar pruebas de detección en mujeres embarazadas que se consideran de alto riesgo de enfermedad autoinmune de la tiroides. [75]
Se recomienda la prueba de anticuerpos contra el peróxido de tiroides en mujeres que alguna vez han estado embarazadas, independientemente del resultado del embarazo. "El embarazo anterior desempeña un papel importante en el desarrollo del hipotiroidismo autoinmune manifiesto en mujeres premenopáusicas, y el número de embarazos anteriores debe tenerse en cuenta al evaluar el riesgo de hipotiroidismo en una mujer joven [sic] " . [76]
Los cambios hormonales y la expresión trofoblástica de moléculas inmunomoduladoras clave conducen a inmunosupresión y tolerancia fetal. Los principales actores en la regulación de la respuesta inmune son las Treg. Tanto la respuesta inmune humoral como la mediada por células se atenúan, lo que resulta en tolerancia inmune y supresión de la autoinmunidad. Se ha informado que durante el embarazo, los niveles de peroxidasa tiroidea y anticuerpos contra tiroglobulina disminuyen. Después del parto, las Tregs disminuyen rápidamente y se restablecen las respuestas inmunitarias. Puede provocar la aparición o el agravamiento de una enfermedad tiroidea autoinmune. [77] En hasta el 50% de las mujeres con anticuerpos contra la peroxidasa tiroidea al comienzo del embarazo, la autoinmunidad tiroidea en el período posparto se exacerba en forma de tiroiditis posparto. [78] Se ha informado una mayor secreción de IFN-γ e IL-4 y una menor concentración plasmática de cortisol durante el embarazo en mujeres con tiroiditis posparto que en mujeres sanas. Indica que una inmunosupresión más débil durante el embarazo podría contribuir a la disfunción tiroidea posparto. [79]
Varios años después del parto, las células masculinas quiméricas pueden detectarse en la sangre periférica, la tiroides, los pulmones, la piel o los ganglios linfáticos de la madre. Las células inmunes fetales en la glándula tiroides materna pueden activarse y actuar como un desencadenante que puede iniciar o exagerar la enfermedad tiroidea autoinmune. En pacientes con enfermedad de Hashimoto, se detectaron células microquiméricas fetales en la tiroides en cantidades significativamente mayores que en mujeres sanas. [80]
La enfermedad de Hashimoto también se conoce en pollos ( Gallus domesticus ), [81] [82] ratas ( Rattus rattus ), [82] ratones ( Mus musculus ), [82] perros ( Canis familiaris ), [82] y titíes (Callitrichidae) . [82]
{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )