
La neurociencia del sueño es el estudio de las bases neurocientíficas y fisiológicas de la naturaleza del sueño y sus funciones. Tradicionalmente, el sueño se ha estudiado como parte de la psicología y la medicina . [1] El estudio del sueño desde una perspectiva neurocientífica cobró importancia con los avances en la tecnología y la proliferación de la investigación neurocientífica a partir de la segunda mitad del siglo XX.
La importancia del sueño se demuestra por el hecho de que los organismos pasan diariamente horas de su tiempo durmiendo, y que la privación del sueño puede tener efectos desastrosos que en última instancia conducen a la muerte en los animales. [2] [3] Para un fenómeno tan importante, los propósitos y mecanismos del sueño solo se entienden parcialmente, tanto que tan recientemente como a fines de la década de 1990 [4] se bromeaba: "La única función conocida del sueño es curar la somnolencia". [5] Sin embargo, el desarrollo de técnicas de imagen mejoradas como EEG , PET y fMRI , junto con un alto poder computacional han llevado a una comprensión cada vez mayor de los mecanismos subyacentes al sueño.
Las preguntas fundamentales en el estudio neurocientífico del sueño son:
Otras áreas de investigación del sueño en neurociencia moderna incluyen la evolución del sueño, el sueño durante el desarrollo y el envejecimiento , el sueño animal , el mecanismo de los efectos de los fármacos sobre el sueño, los sueños y las pesadillas, y las etapas de excitación entre el sueño y la vigilia. [7]
El sueño de movimientos oculares rápidos (REM), el sueño sin movimientos oculares rápidos (NREM o no REM) y la vigilia representan los tres modos principales de conciencia, actividad neuronal y regulación fisiológica. [8] El sueño NREM en sí se divide en múltiples etapas: N1, N2 y N3. El sueño se desarrolla en ciclos de 90 minutos de REM y NREM, en el orden normal N1 → N2 → N3 → N2 → REM. A medida que los humanos se duermen, la actividad corporal se ralentiza. La temperatura corporal, la frecuencia cardíaca, la frecuencia respiratoria y el uso de energía disminuyen. Las ondas cerebrales se ralentizan. El neurotransmisor excitatorio acetilcolina se vuelve menos disponible en el cerebro. [9] Los humanos a menudo maniobran para crear un entorno térmicamente amigable, por ejemplo, acurrucándose como una bola si tienen frío. Los reflejos permanecen bastante activos.
El sueño REM se considera más cercano a la vigilia y se caracteriza por un movimiento ocular rápido y atonía muscular. El NREM se considera un sueño profundo (la parte más profunda del NREM se llama sueño de ondas lentas ), y se caracteriza por la falta de movimiento ocular prominente o parálisis muscular. Especialmente durante el sueño no REM, el cerebro utiliza significativamente menos energía durante el sueño que durante la vigilia. En áreas con actividad reducida, el cerebro restaura su suministro de trifosfato de adenosina (ATP), la molécula utilizada para el almacenamiento y transporte de energía a corto plazo. [10] (Dado que en la vigilia tranquila el cerebro es responsable del 20% del uso de energía del cuerpo, esta reducción tiene un impacto independientemente notable en el consumo total de energía). [11] Durante el sueño de ondas lentas, los humanos secretan ráfagas de hormona del crecimiento . Todo el sueño, incluso durante el día, está asociado con la secreción de prolactina . [12]
Según la hipótesis de activación-síntesis de Hobson y McCarley , propuesta en 1975-1977, la alternancia entre REM y no REM puede explicarse en términos de sistemas de neurotransmisores cíclicos que se influyen recíprocamente. [13] El tiempo de sueño está controlado por el reloj circadiano y, en los humanos, en cierta medida por el comportamiento voluntario. El término circadiano proviene del latín circa , que significa "alrededor de" (o "aproximadamente"), y diem o dies, que significa "día". El reloj circadiano se refiere a un mecanismo biológico que gobierna múltiples procesos biológicos haciendo que muestren una oscilación endógena y entrenable de aproximadamente 24 horas. Estos ritmos se han observado ampliamente en plantas, animales, hongos y cianobacterias.
Una de las cuestiones importantes en la investigación del sueño es definir claramente el estado de sueño. Este problema surge porque el sueño se definía tradicionalmente como un estado de conciencia y no como un estado fisiológico, [14] [15] por lo que no había una definición clara de qué conjunto mínimo de eventos constituye el sueño y lo distingue de otros estados de conciencia parcial o nula. El problema de hacer tal definición es complicado porque necesita incluir una variedad de modos de sueño que se encuentran en diferentes especies.
A nivel sintomático, el sueño se caracteriza por la falta de reactividad a las entradas sensoriales , baja producción motora , disminución de la conciencia y rápida reversibilidad a la vigilia . [16] Sin embargo, traducir esto a una definición biológica es difícil porque no hay una vía única en el cerebro que sea responsable de la generación y regulación del sueño. Una de las primeras propuestas fue definir el sueño como la desactivación de la corteza cerebral y el tálamo [17] debido a la casi falta de respuesta a las entradas sensoriales durante el sueño. Sin embargo, esto fue invalidado porque ambas regiones están activas en algunas fases del sueño. De hecho, parece que el tálamo solo está desactivado en el sentido de transmitir información sensorial a la corteza. [18]
Algunas de las otras observaciones sobre el sueño incluyeron una disminución de la actividad simpática y un aumento de la actividad parasimpática en el sueño no REM, y un aumento de la frecuencia cardíaca y la presión arterial acompañado de una disminución de la respuesta homeostática y el tono muscular durante el sueño REM . [19] [20] Sin embargo, estos síntomas no se limitan a las situaciones de sueño y no se corresponden con definiciones fisiológicas específicas.
Más recientemente, el problema de la definición se ha abordado observando la actividad cerebral general en forma de patrones característicos de EEG. [21] Cada etapa del sueño y la vigilia tiene un patrón característico de EEG que se puede utilizar para identificar la etapa del sueño. La vigilia suele caracterizarse por beta (12-30 Hz) y gamma (25-100 Hz) dependiendo de si hubo una actividad pacífica o estresante. [22] El inicio del sueño implica la desaceleración de esta frecuencia a la somnolencia de alfa (8-12 Hz) y finalmente a theta (4-10 Hz) de la Etapa 1 del sueño NREM. [23] Esta frecuencia disminuye aún más progresivamente a través de las etapas superiores del sueño NREM y REM. Por otro lado, la amplitud de las ondas del sueño es más baja durante la vigilia (10-30 μV) y muestra un aumento progresivo a través de las diversas etapas del sueño. La etapa 2 se caracteriza por husos de sueño (grupos intermitentes de ondas en frecuencia sigma, es decir, 12-14 Hz) y complejos K (una desviación ascendente pronunciada seguida de una desviación descendente más lenta). La etapa 3 del sueño tiene más husos de sueño. [24] [25] [26] La etapa 3 tiene ondas delta de amplitud muy alta (0-4 Hz) y se conoce como sueño de ondas lentas. [27] El sueño REM se caracteriza por ondas de frecuencia mixta de baja amplitud. A menudo se presenta un patrón de ondas en dientes de sierra. [28]

Las preguntas de cómo evolucionó el sueño en el reino animal y cómo se desarrolló en los humanos son especialmente importantes porque podrían proporcionar una pista sobre las funciones y los mecanismos del sueño respectivamente.
La evolución de los diferentes tipos de patrones de sueño está influenciada por una serie de presiones selectivas , incluyendo el tamaño corporal, la tasa metabólica relativa, la depredación, el tipo y la ubicación de las fuentes de alimento y la función inmunológica. [29] [30] [31] [32] El sueño (especialmente el sueño profundo SWS y REM ) es un comportamiento complicado porque aumenta abruptamente el riesgo de depredación . Esto significa que, para que el sueño haya evolucionado, las funciones del sueño deberían haber proporcionado una ventaja sustancial sobre el riesgo que conlleva. De hecho, estudiar el sueño en diferentes organismos muestra cómo han equilibrado este riesgo desarrollando mecanismos de sueño parcial o teniendo hábitats protectores. Por lo tanto, estudiar la evolución del sueño podría dar una pista no solo sobre los aspectos y mecanismos del desarrollo, sino también sobre una justificación adaptativa para el sueño.
Uno de los desafíos que plantea el estudio de la evolución del sueño es que solo se conoce información adecuada sobre el sueño de dos filos de animales: los cordados y los artrópodos . [7] Con los datos disponibles, se han utilizado estudios comparativos para determinar cómo podría haber evolucionado el sueño. Una pregunta que los científicos intentan responder a través de estos estudios es si el sueño evolucionó solo una vez o varias veces. Para comprender esto, observan los patrones de sueño en diferentes clases de animales cuyas historias evolutivas son bastante conocidas y estudian sus similitudes y diferencias.
Los humanos poseen tanto sueño de ondas lentas como sueño REM, en ambas fases ambos ojos están cerrados y ambos hemisferios del cerebro involucrados. También se ha registrado sueño en mamíferos distintos de los humanos. Un estudio mostró que los equidnas poseen solo sueño de ondas lentas (no REM). Esto parece indicar que el sueño REM apareció en la evolución solo después de los terios . [33] Pero esto ha sido refutado posteriormente por estudios que afirman que el sueño en equidna combina ambos modos en un solo estado de sueño. [34] Otros estudios han mostrado una forma peculiar de sueño en odontocetos (como delfines y marsopas ). Esto se llama sueño de ondas lentas unihemisférico (USWS). En cualquier momento durante este modo de sueño, el EEG de un hemisferio cerebral indica sueño mientras que el del otro es equivalente a vigilia. En algunos casos, el ojo correspondiente está abierto. Esto podría permitir al animal reducir el riesgo de depredadores y dormir mientras nada en el agua, aunque el animal también puede ser capaz de dormir en reposo. [35] [36]
Los correlatos del sueño encontrados para los mamíferos son válidos también para las aves , es decir, el sueño de las aves es muy similar al de los mamíferos e implica tanto el sueño SWS como el sueño REM con características similares, incluido el cierre de ambos ojos, tono muscular reducido, etc. [37] Sin embargo, la proporción de sueño REM en las aves es mucho menor. Además, algunas aves pueden dormir con un ojo abierto si existe un alto riesgo de depredación en el entorno. [38] [39] Esto da lugar a la posibilidad de dormir en vuelo; considerando que el sueño es muy importante y algunas especies de aves pueden volar durante semanas continuamente, este parece ser el resultado obvio. Sin embargo, el sueño en vuelo no se ha registrado y hasta ahora no está respaldado por datos de EEG. Investigaciones futuras pueden explicar si las aves duermen durante el vuelo o si existen otros mecanismos que aseguren que permanezcan saludables durante vuelos largos en ausencia de sueño.
A diferencia de lo que ocurre en las aves, se han encontrado muy pocas características uniformes del sueño entre las especies de reptiles . La única observación común es que los reptiles no tienen sueño REM. [7]
El sueño en algunos invertebrados también ha sido ampliamente estudiado, por ejemplo, el sueño en las moscas de la fruta (Drosophila) [40] y las abejas melíferas [41] . Algunos de los mecanismos del sueño en estos animales han sido descubiertos, mientras que otros siguen siendo bastante oscuros. Las características que definen el sueño han sido identificadas en su mayor parte y, al igual que en los mamíferos, esto incluye una reacción reducida a la entrada sensorial, falta de respuesta motora en forma de inmovilidad de las antenas , etc.
El hecho de que ambas formas de sueño se encuentren en mamíferos y aves, pero no en reptiles (que se consideran una etapa intermedia), indica que el sueño podría haber evolucionado por separado en ambos. Para corroborar esto, se podrían realizar más investigaciones sobre si los correlatos del sueño en el EEG están involucrados en sus funciones o si son simplemente una característica. Esto podría ayudar a comprender mejor el papel del sueño en la plasticidad a largo plazo.
Según Tsoukalas (2012), el sueño REM es una transformación evolutiva de un mecanismo defensivo bien conocido, el reflejo de inmovilidad tónica . Este reflejo, también conocido como hipnosis animal o simulación de muerte, funciona como la última línea de defensa contra un depredador atacante y consiste en la inmovilización total del animal: el animal parece muerto (cf. "hacerse el muerto"). La neurofisiología y la fenomenología de esta reacción muestran sorprendentes similitudes con el sueño REM, un hecho que delata un profundo parentesco evolutivo. Por ejemplo, ambas reacciones exhiben control del tronco encefálico, parálisis, activación simpática y cambios termorreguladores. Esta teoría integra muchos hallazgos anteriores en un marco unificado y bien fundamentado desde el punto de vista evolutivo. [42] [43]
La ontogenia del sueño es el estudio del sueño en diferentes grupos de edad de una especie, particularmente durante el desarrollo y el envejecimiento . Entre los mamíferos, los bebés duermen más tiempo. [44] Los bebés humanos tienen 8 horas de sueño REM y 8 horas de sueño NREM en promedio. El porcentaje de tiempo dedicado a cada modo de sueño varía mucho en las primeras semanas de desarrollo y algunos estudios lo han correlacionado con el grado de precocidad del niño. [45] A los pocos meses del desarrollo posnatal, hay una marcada reducción en el porcentaje de horas dedicadas al sueño REM. Cuando el niño se convierte en adulto, pasa alrededor de 6 a 7 horas en sueño NREM y solo alrededor de una hora en sueño REM. [46] [47] Esto es cierto no solo para los humanos, sino para muchos animales que dependen de sus padres para alimentarse. [48] La observación de que el porcentaje de sueño REM es muy alto en las primeras etapas del desarrollo ha llevado a la hipótesis de que el sueño REM podría facilitar el desarrollo temprano del cerebro. [45] Sin embargo, esta teoría ha sido cuestionada por otros estudios.
La conducta de sueño sufre cambios sustanciales durante la adolescencia . Algunos de estos cambios pueden ser sociales en los humanos, pero otros cambios son hormonales. Otro cambio importante es la disminución en el número de horas de sueño, en comparación con la infancia, que gradualmente se vuelve idéntica a la de un adulto. También se especula que los mecanismos de regulación homeostática pueden alterarse durante la adolescencia. Aparte de esto, el efecto del cambio de rutinas de los adolescentes en otras conductas como la cognición y la atención aún está por estudiar. [49] [50] Ohayon et al., por ejemplo, han afirmado que la disminución del tiempo total de sueño desde la infancia hasta la adolescencia parece estar más asociada con factores ambientales que con características biológicas. [51]
En la edad adulta, la arquitectura del sueño ha demostrado que la latencia del sueño y el tiempo transcurrido en las etapas NREM 1 y 2 pueden aumentar con el envejecimiento, mientras que el tiempo transcurrido en el sueño REM y SWS parece disminuir. [51] Estos cambios se han asociado con frecuencia con atrofia cerebral, deterioro cognitivo y trastornos neurodegenerativos en la vejez. [51] [52] [53] [54] [55] [56] Por ejemplo, Backhaus et al. han señalado que una disminución en la consolidación de la memoria declarativa en la mediana edad (en su experimento: 48 a 55 años) se debe a una menor cantidad de SWS, que ya podría comenzar a disminuir alrededor de los 30 años. [52] Según Mander et al., la atrofia en la materia gris de la corteza prefrontal medial (mPFC) es un predictor de la interrupción de la actividad lenta durante el sueño NREM que puede perjudicar la consolidación de la memoria en adultos mayores. [53] Y los trastornos del sueño, como la somnolencia diurna excesiva y el insomnio nocturno , se han considerado a menudo factores de riesgo de deterioro funcional progresivo en la enfermedad de Alzheimer (EA) o la enfermedad de Parkinson (EP). [54] [56]
Por lo tanto, el sueño en el envejecimiento es otra área de investigación igualmente importante. Una observación común es que muchos adultos mayores pasan tiempo despiertos en la cama después del inicio del sueño sin poder conciliar el sueño y experimentan una marcada disminución en la eficiencia del sueño. [57] También puede haber algunos cambios en los ritmos circadianos . [58] Se están realizando estudios sobre qué causa estos cambios y cómo se pueden reducir para garantizar un sueño confortable de los adultos mayores.

Comprender la actividad de las diferentes partes del cerebro durante el sueño puede darnos una pista sobre las funciones del sueño. Se ha observado que la actividad mental está presente durante todas las etapas del sueño, aunque en diferentes regiones del cerebro. Por lo tanto, contrariamente a la creencia popular, el cerebro nunca se apaga por completo durante el sueño. Además, la intensidad del sueño de una región en particular está homeostáticamente relacionada con la cantidad correspondiente de actividad antes de dormir. [59] [60] El uso de modalidades de imagen como PET, fMRI y MEG, combinadas con registros de EEG, da una pista sobre qué regiones del cerebro participan en la creación de las señales de onda características y cuáles podrían ser sus funciones. [61]
Las etapas del sueño fueron descritas por primera vez en 1937 por Alfred Lee Loomis y sus colaboradores, quienes separaron las diferentes características electroencefalográficas (EEG) del sueño en cinco niveles (A a E), que representan el espectro desde la vigilia hasta el sueño profundo. [62] En 1953, se descubrió que el sueño REM era distinto, y por lo tanto William C. Dement y Nathaniel Kleitman reclasificaron el sueño en cuatro etapas NREM y REM. [21] Los criterios de estadificación fueron estandarizados en 1968 por Allan Rechtschaffen y Anthony Kales en el "Manual de puntuación del sueño R&K". [63] [64]
En el estándar R&K, el sueño NREM se dividió en cuatro etapas, y el sueño de ondas lentas comprendía las etapas 3 y 4. En la etapa 3, las ondas delta representaban menos del 50% de los patrones de ondas totales, mientras que representaban más del 50% en la etapa 4. Además, el sueño REM a veces se denominaba etapa 5. En 2004, la AASM encargó al Grupo de trabajo de puntuación visual de la AASM que revisara el sistema de puntuación R&K. La revisión dio lugar a varios cambios, siendo el más significativo la combinación de las etapas 3 y 4 en la etapa N3. La puntuación revisada se publicó en 2007 como The AASM Manual for the Scoring of Sleep and Associated Events . [65] También se añadieron los eventos de despertares, respiratorios, cardíacos y de movimiento. [66] [67]
El sueño NREM se caracteriza por una disminución del flujo sanguíneo cerebral global y regional . Constituye aproximadamente el 80% de todo el sueño en humanos adultos. [68] Inicialmente, se esperaba que el tronco encefálico , que estaba implicado en el despertar, estuviera inactivo, pero más tarde se descubrió que esto se debía a la baja resolución de los estudios PET y se demostró que también hay cierta actividad de ondas lentas en el tronco encefálico. Sin embargo, otras partes del cerebro, incluido el precúneo , el prosencéfalo basal y los ganglios basales , se desactivan durante el sueño. Muchas áreas de la corteza también están inactivas, pero a diferentes niveles. Por ejemplo, la corteza prefrontal ventromedial se considera el área menos activa, mientras que la corteza primaria , la menos desactivada. [25] [69]
El sueño NREM se caracteriza por oscilaciones lentas, husos y ondas delta . Se ha demostrado que las oscilaciones lentas provienen de la corteza, ya que las lesiones en otras partes del cerebro no las afectan, pero las lesiones en la corteza sí. [70] Se ha demostrado que las ondas delta son generadas por conexiones recurrentes dentro de la corteza cerebral. Durante el sueño de ondas lentas, la corteza genera breves períodos de actividad e inactividad a 0,5-4 Hz, lo que resulta en la generación de las ondas delta del sueño de ondas lentas. Durante este período, el tálamo deja de transmitir información sensorial al cerebro, sin embargo, continúa produciendo señales, como ondas de huso, que se envían a sus proyecciones corticales. Los husos del sueño del sueño de ondas lentas se generan como una interacción del núcleo reticular talámico con las neuronas de relevo talámicas. [71] Se ha predicho que los husos del sueño desempeñan un papel en la desconexión de la corteza de la entrada sensorial y permiten la entrada de iones de calcio en las células, por lo que potencialmente desempeñan un papel en la plasticidad . [72] [73]
Etapa 1 NREM (N1 – sueño ligero, somnolencia , sueño somnoliento – 5–10% del sueño total en adultos): Esta es una etapa del sueño que generalmente ocurre entre el sueño y la vigilia, y a veces ocurre entre períodos de sueño más profundo y períodos de REM. Los músculos están activos y los ojos giran lentamente, abriéndose y cerrándose moderadamente. El cerebro pasa de ondas alfa con una frecuencia de 8–13 Hz (comunes en el estado de vigilia) a ondas theta con una frecuencia de 4–7 Hz. Espasmos repentinos y sacudidas hipnóticas , también conocidas como mioclonías positivas , pueden estar asociadas con el inicio del sueño durante N1. Algunas personas también pueden experimentar alucinaciones hipnagógicas durante esta etapa. Durante No-REM1, los humanos pierden algo de tono muscular y la mayor parte de la conciencia del entorno externo.
Etapa 2 NREM (N2 – 45–55% del sueño total en adultos [74] ): En esta etapa, se observa actividad theta y a los durmientes se les hace cada vez más difícil despertar; las ondas alfa de la etapa anterior se interrumpen por una actividad abrupta llamada husos del sueño (o husos talamocorticales) y complejos K. [75] Los husos del sueño varían de 11 a 16 Hz (más comúnmente 12–14 Hz). Durante esta etapa , la actividad muscular medida por EMG disminuye y la conciencia del entorno externo desaparece.
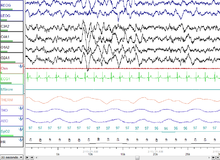
Etapa 3 del sueño NREM (N3 – 15–25% del sueño total en adultos): Anteriormente dividida en etapas 3 y 4, esta etapa se llama sueño de ondas lentas (SWS) o sueño profundo. El SWS se inicia en el área preóptica y consiste en actividad delta , ondas de gran amplitud a menos de 3,5 Hz. El durmiente responde menos al entorno; muchos estímulos ambientales ya no producen ninguna reacción. Se cree que el sueño de ondas lentas es la forma más reparadora de sueño, la fase que más alivia las sensaciones subjetivas de somnolencia y restaura el cuerpo. [76]
Esta etapa se caracteriza por la presencia de un mínimo de 20% de ondas delta que van de 0,5 a 2 Hz y tienen una amplitud pico a pico >75 μV. (Los estándares de EEG definen las ondas delta como de 0 a 4 Hz, pero los estándares de sueño tanto en el modelo original de R&K ( Allan Rechtschaffen y Anthony Kales en el "Manual de puntuación del sueño de R&K"), [63] [64] así como las nuevas directrices de la AASM de 2007 tienen un rango de 0,5 a 2 Hz). Esta es la etapa en la que se producen parasomnias como terrores nocturnos , enuresis nocturna , sonambulismo y somniloquia . Muchas ilustraciones y descripciones aún muestran una etapa N3 con 20 a 50% de ondas delta y una etapa N4 con más del 50% de ondas delta; estas se han combinado como etapa N3. [74]

Etapa REM (sueño REM: 20-25 % del sueño total en adultos [77] ): el sueño REM es cuando la mayoría de los músculos están paralizados y la frecuencia cardíaca, la respiración y la temperatura corporal se desregulan. El sueño REM se activa mediante la secreción de acetilcolina y es inhibido por neuronas que secretan monoaminas, incluida la serotonina . El REM también se conoce como sueño paradójico porque el durmiente, aunque exhibe ondas EEG de alta frecuencia similares a un estado de vigilia, es más difícil de despertar que en cualquier otra etapa del sueño. [75] Los signos vitales indican excitación y el consumo de oxígeno por parte del cerebro es mayor que cuando el durmiente está despierto. [78] El sueño REM se caracteriza por un alto flujo sanguíneo cerebral global, comparable a la vigilia. [79] De hecho, se ha registrado que muchas áreas de la corteza tienen más flujo sanguíneo durante el sueño REM que incluso la vigilia, esto incluye el hipocampo, las áreas temporooccipital , algunas partes de la corteza y el prosencéfalo basal . El sistema límbico y paralímbico , incluida la amígdala , son otras regiones activas durante el sueño REM. [79] [80] Aunque la actividad cerebral durante el sueño REM parece muy similar a la vigilia, la principal diferencia entre el sueño REM y la vigilia es que la excitación en el sueño REM se inhibe de manera más efectiva. Esto, junto con el silencio virtual de las neuronas monoaminérgicas en el cerebro, se puede decir que caracteriza al sueño REM. [81]
Un bebé recién nacido pasa de 8 a 9 horas al día sólo en sueño REM. A los cinco años aproximadamente, sólo pasa un poco más de dos horas en REM. [82] La función del sueño REM es incierta, pero su falta perjudica la capacidad de aprender tareas complejas. La parálisis funcional por atonía muscular en REM puede ser necesaria para proteger a los organismos de la autolesión mediante la representación física de escenas de los sueños a menudo vívidos que ocurren durante esta etapa.
En los registros de EEG, el sueño REM se caracteriza por una actividad de alta frecuencia y baja amplitud y la aparición espontánea de ondas beta y gamma . Los mejores candidatos para la generación de estas ondas de frecuencia rápida son las neuronas de ráfaga rítmica rápida en los circuitos corticotalámicos. A diferencia del sueño de ondas lentas, los ritmos de frecuencia rápida se sincronizan en áreas restringidas en circuitos locales específicos entre las áreas talamocorticales y neocorticales. Se dice que estos son generados por procesos colinérgicos de las estructuras del tronco encefálico.
Aparte de esto, la amígdala desempeña un papel en la modulación del sueño REM, lo que apoya la hipótesis de que el sueño REM permite el procesamiento interno de la información. La alta actividad de la amígdala también puede causar las respuestas emocionales durante los sueños. [83] De manera similar, la rareza de los sueños puede deberse a la disminución de la actividad de las regiones prefrontales , que están involucradas en la integración de la información, así como en la memoria episódica .
El sueño REM también está relacionado con la activación de ondas ponto-geniculo-occipitales (también llamadas actividad fásica u ondas PGO) y la actividad en el sistema de excitación ascendente colinérgico. Se han registrado ondas PGO en el núcleo geniculado lateral y la corteza occipital durante el período pre-REM y se cree que representan el contenido del sueño. La mayor relación señal-ruido en el canal cortical LG sugiere que las imágenes visuales en los sueños pueden aparecer antes del desarrollo completo del sueño REM, pero esto aún no se ha confirmado. Las ondas PGO también pueden desempeñar un papel en el desarrollo y la maduración estructural del cerebro, así como en la potenciación a largo plazo en animales inmaduros, basándose en el hecho de que hay una alta actividad de PGO durante el sueño en el cerebro en desarrollo. [84] [85]
La otra forma de actividad durante el sueño es la reactivación. Algunos estudios electrofisiológicos han demostrado que los patrones de actividad neuronal encontrados durante una tarea de aprendizaje antes del sueño se reactivan en el cerebro durante el sueño. [86] Esto, junto con la coincidencia de áreas activas con áreas responsables de la memoria, ha llevado a la teoría de que el sueño podría tener algunas funciones de consolidación de la memoria. En este sentido, algunos estudios han demostrado que después de una tarea motora secuencial, las áreas de la corteza premotora y visual involucradas son más activas durante el sueño REM, pero no durante el NREM. De manera similar, las áreas del hipocampo involucradas en tareas de aprendizaje espacial se reactivan en el sueño NREM, pero no en el REM. Estos estudios sugieren un papel del sueño en la consolidación de tipos específicos de memoria. Sin embargo, todavía no está claro si otros tipos de memoria también se consolidan mediante estos mecanismos. [87]
El diálogo neocortical hipocampal se refiere a las interacciones muy estructuradas durante el SWS entre grupos de neuronas llamados conjuntos en el hipocampo y el neocórtex . [88] [89] Los patrones de ondas agudas (SPW) dominan el hipocampo durante el SWS y las poblaciones de neuronas en el hipocampo participan en ráfagas organizadas durante esta fase. Esto se hace en sincronía con los cambios de estado en la corteza (estado ABAJO/ARRIBA) y coordinado por las oscilaciones lentas en la corteza. Estas observaciones, junto con el conocimiento de que el hipocampo juega un papel en la memoria de corto a mediano plazo, mientras que la corteza juega un papel en la memoria de largo plazo, han llevado a la hipótesis de que el diálogo neocortical hipocampal podría ser un mecanismo a través del cual el hipocampo transfiere información a la corteza. Por lo tanto, se dice que el diálogo neocortical hipocampal juega un papel en la consolidación de la memoria. [90]
La regulación del sueño se refiere al control de cuándo un organismo pasa del sueño al estado de vigilia. [91] Las preguntas clave aquí son identificar qué partes del cerebro están involucradas en el inicio del sueño y cuáles son sus mecanismos de acción. [92] En los humanos y la mayoría de los animales, el sueño y la vigilia parecen seguir un modelo electrónico de voltereta , es decir, ambos estados son estables, pero los estados intermedios no. [93] [94] Por supuesto, a diferencia del modelo de voltereta, en el caso del sueño, parece haber un temporizador que cuenta el minuto de vigilia, de modo que después de un cierto período uno debe dormir, y en tal caso incluso la vigilia se convierte en un estado inestable. Lo inverso también puede ser cierto en menor medida.
El inicio del sueño puede verse afectado negativamente por lesiones en el área preóptica y el hipotálamo anterior que provocan insomnio, mientras que las lesiones en el hipotálamo posterior provocan somnolencia. [95] [96] Esto se redujo aún más para demostrar que el tegmento central del mesencéfalo es la región que desempeña un papel en la activación cortical. Por lo tanto, el inicio del sueño parece surgir de la activación del hipotálamo anterior junto con la inhibición de las regiones posteriores y el tegmento central del mesencéfalo. Investigaciones posteriores han demostrado que la región hipotalámica llamada núcleo preóptico ventrolateral produce el neurotransmisor inhibidor GABA que inhibe el sistema de despertar durante el inicio del sueño. [93]
El sueño está regulado por dos mecanismos paralelos, la regulación homeostática y la regulación circadiana , controladas por el hipotálamo y el núcleo supraquiasmático (NSQ) , respectivamente. Aunque se desconoce la naturaleza exacta del impulso del sueño, la presión homeostática se acumula durante la vigilia y continúa hasta que la persona se va a dormir. Se cree que la adenosina desempeña un papel fundamental en esto y muchas personas han propuesto que la acumulación de presión se debe en parte a la acumulación de adenosina. Sin embargo, algunos investigadores han demostrado que la acumulación por sí sola no explica este fenómeno por completo. El ritmo circadiano es un ciclo de 24 horas en el cuerpo, que se ha demostrado que continúa incluso en ausencia de señales ambientales. Esto es causado por proyecciones del NSQ al tronco encefálico.
Este modelo de dos procesos fue propuesto por primera vez en 1982 por Borbely [97], quien los llamó Proceso S (homeostático) y Proceso C (circadiano) respectivamente. Demostró cómo la densidad de ondas lentas aumenta durante la noche y luego disminuye al comienzo del día, mientras que el ritmo circadiano es como una sinusoide. Propuso que la presión para dormir era máxima cuando la diferencia entre los dos era mayor.
En 1993 se propuso un modelo diferente, llamado modelo de proceso oponente [98] . Este modelo explicaba que estos dos procesos se oponían entre sí para producir el sueño, a diferencia del modelo de Borbely. Según este modelo, el SCN, que está involucrado en el ritmo circadiano, mejora la vigilia y se opone al ritmo homeostático. En oposición está el ritmo homeostático, regulado a través de una vía multisináptica compleja en el hipotálamo que actúa como un interruptor y apaga el sistema de excitación. Ambos efectos juntos producen un efecto de sube y baja entre el sueño y la vigilia. [81] Más recientemente, se ha propuesto que ambos modelos tienen cierta validez, mientras que nuevas teorías sostienen que la inhibición del sueño NREM por el REM también podría desempeñar un papel. [99] En cualquier caso, el mecanismo de dos procesos agrega flexibilidad al ritmo circadiano simple y podría haber evolucionado como una medida adaptativa.
Gran parte de la actividad cerebral durante el sueño se ha atribuido al tálamo y parece que el tálamo puede desempeñar un papel fundamental en el sueño de ondas lentas. Las dos oscilaciones principales en el sueño de ondas lentas , delta y oscilación lenta, pueden ser generadas tanto por el tálamo como por la corteza. Sin embargo, los husos del sueño solo pueden ser generados por el tálamo, lo que hace que su papel sea muy importante. La hipótesis del marcapasos talámico [100] sostiene que estas oscilaciones son generadas por el tálamo, pero la sincronización de varios grupos de neuronas talámicas que se activan simultáneamente depende de la interacción talámica con la corteza. El tálamo también desempeña un papel fundamental en el inicio del sueño cuando cambia del modo tónico al fásico, actuando así como un espejo para los elementos centrales y descentrales y conectando partes distantes de la corteza para coordinar su actividad. [101] [102] [103]
El sistema activador reticular ascendente consiste en un conjunto de subsistemas neuronales que se proyectan desde varios núcleos talámicos y una serie de núcleos cerebrales dopaminérgicos , noradrenérgicos , serotoninérgicos , histaminérgicos , colinérgicos y glutamatérgicos . [104] [105] [106] [107] Cuando está despierto, recibe todo tipo de información sensorial no específica y la transmite a la corteza. También modula las respuestas de lucha o huida y, por lo tanto, está vinculado al sistema motor. Durante el inicio del sueño, actúa a través de dos vías: una vía colinérgica que se proyecta a la corteza a través del tálamo y un conjunto de vías monoaminérgicas que se proyectan a la corteza a través del hipotálamo. Durante el sueño NREM, este sistema es inhibido por neuronas GABAérgicas en el área preóptica ventrolateral y la zona parafacial , así como otras neuronas promotoras del sueño en distintas regiones cerebrales.
Los estudios sobre la privación del sueño muestran que el sueño es particularmente importante para el funcionamiento normal del cerebro. El sueño es necesario para eliminar las especies reactivas de oxígeno causadas por el estrés oxidativo (y, en general, la autofagia ) y para reparar el ADN. El sueño REM también disminuye la concentración de noradrenalina , que, cuando se encuentra en exceso, hace que la célula sufra apoptosis .
Es probable que el sueño haya evolucionado para cumplir alguna función primordial y haya asumido múltiples funciones con el tiempo [108] (de manera análoga a la laringe , que controla el paso de los alimentos y el aire, pero que descendió con el tiempo para desarrollar capacidades de habla).
Las múltiples hipótesis propuestas para explicar la función del sueño reflejan la comprensión incompleta del tema. Si bien se conocen algunas funciones del sueño, se han propuesto otras pero no se han fundamentado o comprendido por completo. Algunas de las primeras ideas sobre la función del sueño se basaban en el hecho de que la mayor parte (si no toda) de la actividad externa se detiene durante el sueño. Inicialmente, se pensaba que el sueño era simplemente un mecanismo para que el cuerpo "se tomara un descanso" y redujera el desgaste. Observaciones posteriores de las bajas tasas metabólicas en el cerebro durante el sueño parecieron indicar algunas funciones metabólicas del sueño. [109] Esta teoría no es completamente adecuada ya que el sueño solo disminuye el metabolismo en aproximadamente un 5-10%. [110] [111] Con el desarrollo del EEG, se descubrió que el cerebro tiene una actividad interna casi continua durante el sueño, lo que llevó a la idea de que la función podría ser la de reorganización o especificación de circuitos neuronales o fortalecimiento de conexiones. [112] [113] Estas hipótesis aún se están explorando. Otras funciones propuestas del sueño incluyen: mantener el equilibrio hormonal, regular la temperatura y mantener la frecuencia cardíaca.
Según un estudio reciente sobre la alteración del sueño y el insomnio, [114] existen consecuencias negativas a corto y largo plazo en individuos sanos. Las consecuencias a corto plazo incluyen una mayor capacidad de respuesta al estrés y problemas psicosociales como deterioro del rendimiento cognitivo o académico y depresión. Los experimentos indicaron que, en niños y adultos sanos, los episodios de sueño fragmentado o insomnio aumentaron la activación simpática, lo que puede alterar el estado de ánimo y la cognición. Las consecuencias a largo plazo incluyen problemas metabólicos como la alteración de la homeostasis de la glucosa e incluso la formación de tumores y un mayor riesgo de cáncer.
La teoría de la "preservación y protección" sostiene que el sueño cumple una función adaptativa. Protege al animal durante la parte del día de 24 horas en la que estar despierto y, por lo tanto, deambular, pondría al individuo en mayor riesgo. [115] Los organismos no necesitan 24 horas para alimentarse y satisfacer otras necesidades. Desde esta perspectiva de adaptación, los organismos están más seguros si se mantienen alejados del peligro, donde potencialmente podrían ser presa de otros organismos más fuertes. Duermen en horarios que maximizan su seguridad, dadas sus capacidades físicas y sus hábitats.
Esta teoría no explica por qué el cerebro se desconecta del entorno externo durante el sueño normal. Sin embargo, el cerebro consume una gran proporción de la energía del cuerpo en un momento dado y la conservación de energía solo podría ocurrir limitando sus entradas sensoriales. Otro argumento en contra de la teoría es que el sueño no es simplemente una consecuencia pasiva de retirar al animal del entorno, sino que es un "impulso"; los animales modifican sus comportamientos para poder dormir.
Por lo tanto, la regulación circadiana es más que suficiente para explicar los períodos de actividad y quietud que son adaptativos a un organismo, pero las especializaciones más peculiares del sueño probablemente cumplen funciones diferentes y desconocidas. Además, la teoría de la preservación necesita explicar por qué los carnívoros como los leones, que están en la cima de la cadena alimentaria y por lo tanto tienen poco que temer, duermen más. Se ha sugerido que necesitan minimizar el gasto de energía cuando no están cazando.
Durante el sueño, los productos de desecho metabólicos , como las inmunoglobulinas , los fragmentos de proteínas o las proteínas intactas como la beta-amiloide , pueden eliminarse del intersticio a través de un sistema glinfático de canales similares a la linfa que recorren los espacios perivasculares y la red de astrocitos del cerebro. [116] [117] [118] Según este modelo, los tubos huecos entre los vasos sanguíneos y los astrocitos actúan como un aliviadero que permite el drenaje del líquido cefalorraquídeo que transporta desechos fuera del cerebro hacia la sangre sistémica. [117] [118] Estos mecanismos, que siguen siendo objeto de investigación preliminar a partir de 2017, indican formas potenciales en las que el sueño es un período de mantenimiento regulado para las funciones inmunes del cerebro y la eliminación de beta-amiloide, un factor de riesgo para la enfermedad de Alzheimer . [117]
Se ha demostrado que el sueño afecta la cicatrización de heridas . [119]
Se ha demostrado que la falta de sueño afecta al sistema inmunológico . [120] Ahora es posible afirmar que "la falta de sueño perjudica la función inmunológica y el desafío inmunológico altera el sueño", y se ha sugerido que el sueño aumenta el recuento de glóbulos blancos. [121] Un estudio de 2014 encontró que privar a los ratones del sueño aumentó el crecimiento del cáncer y redujo la capacidad del sistema inmunológico para controlar los cánceres. [122]
El efecto de la duración del sueño sobre el crecimiento somático no se conoce por completo. Un estudio registró el crecimiento, la altura y el peso, en correlación con el tiempo informado por los padres en la cama en 305 niños durante un período de nueve años (edad 1-10). Se encontró que "la variación de la duración del sueño entre los niños no parece tener un efecto sobre el crecimiento". [123] Está bien establecido que el sueño de ondas lentas afecta los niveles de hormona de crecimiento en hombres adultos. [12] Durante ocho horas de sueño, Van Cauter, Leproult y Plat encontraron que los hombres con un alto porcentaje de SWS (promedio 24%) también tenían una alta secreción de hormona de crecimiento, mientras que los sujetos con un bajo porcentaje de SWS (promedio 9%) tenían baja secreción de hormona de crecimiento. [46]
Existen algunas pruebas que respaldan la función restauradora del sueño. Se ha demostrado que el cerebro dormido elimina los productos de desecho metabólicos a un ritmo más rápido que durante el estado de vigilia. [124] Mientras está despierto, el metabolismo genera especies reactivas de oxígeno, que son dañinas para las células. Durante el sueño, las tasas metabólicas disminuyen y la generación de especies reactivas de oxígeno se reduce, lo que permite que los procesos restauradores tomen el control. Se teoriza que el sueño ayuda a facilitar la síntesis de moléculas que ayudan a reparar y proteger el cerebro de estos elementos dañinos generados durante la vigilia. [125] La fase metabólica durante el sueño es anabólica; las hormonas anabólicas como las hormonas de crecimiento (como se mencionó anteriormente) se secretan preferentemente durante el sueño.
La conservación de energía también podría haberse logrado descansando en estado de quietud sin desconectar al organismo del entorno, una situación potencialmente peligrosa. Un animal sedentario que no duerme tiene más probabilidades de sobrevivir a los depredadores, conservando al mismo tiempo energía. Por lo tanto, el sueño parece tener otro propósito, u otros, que simplemente conservar energía. Otro propósito potencial del sueño podría ser restaurar la intensidad de la señal en las sinapsis que se activan mientras estamos despiertos a un nivel "de referencia", debilitando las conexiones innecesarias que facilitan mejor las funciones de aprendizaje y memoria al día siguiente; esto significa que el cerebro está olvidando algunas de las cosas que aprendemos cada día. [126]
Esta teoría está relacionada con el papel restaurador del sueño , pero es lo suficientemente distinta ya que trata de una cuantificación muy específica: la entropía . [127] De una manera muy simplificada, la vigilia puede asociarse con un mayor desorden en el sistema nervioso y este desorden puede amenazar el alto orden que se necesita para el funcionamiento adecuado del sistema nervioso. La entropía está relacionada con el orden y el desorden, pero no es necesariamente lo mismo. La actividad cortical se interrumpe progresivamente durante la vigilia y el sueño restaura los niveles de actividad cortical cercanos a la criticidad . [128] El ruido de la señal afecta a muchos aspectos del sistema nervioso central. [129] La comprensión de la relación entre la vigilia y la entropía se puede abordar desde el campo de la mecánica estadística . A nivel de sustrato, las interacciones con el entorno aumentan el número de posibles microestados del sistema nervioso y esto conduce a un aumento de la entropía.
La reducción de la entropía también puede abordarse desde la perspectiva de la termodinámica clásica y de no equilibrio . El sistema nervioso central utiliza una cantidad desproporcionada del suministro de energía disponible. [130] La mayor parte del uso de energía del sistema nervioso se dedica a la actividad neuronal eléctrica y a los procesos sinápticos. [131] La bomba Na+/K+ -ATPasa utiliza energía en grandes cantidades para mover sodio y potasio en la generación de potenciales de acción ; este proceso es altamente eficiente pero aún se genera entropía.
La secreción de muchas hormonas se ve afectada por los ciclos sueño-vigilia. Por ejemplo, la melatonina , un cronometrador hormonal, se considera una hormona fuertemente circadiana , cuya secreción aumenta con luz tenue y alcanza su punto máximo durante el sueño nocturno, disminuyendo con luz brillante para los ojos. [132] En algunos organismos, la secreción de melatonina depende del sueño, pero en los humanos es independiente del sueño y depende solo del nivel de luz. Por supuesto, en los humanos, así como en otros animales, una hormona de este tipo puede facilitar la coordinación del inicio del sueño. De manera similar, el cortisol y la hormona estimulante de la tiroides (TSH) son hormonas fuertemente circadianas y diurnas, en su mayoría independientes del sueño. [133] En contraste, otras hormonas como la hormona del crecimiento (GH) y la prolactina dependen críticamente del sueño y se suprimen en ausencia de sueño. [134] La GH tiene un aumento máximo durante el sueño suave, mientras que la prolactina se secreta temprano después del inicio del sueño y aumenta durante la noche. En algunas hormonas cuya secreción está controlada por el nivel de luz, el sueño parece aumentar la secreción. En casi todos los casos, la falta de sueño tiene efectos perjudiciales. Por ejemplo, el cortisol, que es esencial para el metabolismo (es tan importante que los animales pueden morir en una semana después de su deficiencia) y afecta la capacidad de soportar estímulos nocivos, aumenta al estar despierto y durante el sueño REM. [135] De manera similar, la TSH aumenta durante el sueño nocturno y disminuye con períodos prolongados de sueño reducido, pero aumenta durante la privación total aguda del sueño. [136] [137]
Debido a que las hormonas desempeñan un papel importante en el equilibrio energético y el metabolismo, y el sueño desempeña un papel crítico en el momento y la amplitud de su secreción, el sueño tiene un efecto considerable en el metabolismo. Esto podría explicar algunas de las primeras teorías sobre la función del sueño que predijeron que el sueño tiene un papel de regulación metabólica.
Según Plihal y Born, el sueño generalmente aumenta el recuerdo de aprendizajes y experiencias previas, y su beneficio depende de la fase del sueño y del tipo de memoria. [138] Por ejemplo, estudios basados en tareas de memoria declarativa y procedimental aplicadas durante el sueño nocturno temprano y tardío, así como en condiciones controladas de vigilia, han demostrado que la memoria declarativa mejora más durante el sueño temprano (dominado por el sueño SWS) mientras que la memoria procedimental durante el sueño tardío (dominado por el sueño REM). [139] [140]
En cuanto a la memoria declarativa, el papel funcional del SWS se ha asociado con repeticiones hipocampales de patrones neuronales previamente codificados que parecen facilitar la consolidación de recuerdos a largo plazo. [139] [140] Esta suposición se basa en la hipótesis de consolidación del sistema activo, que establece que las reactivaciones repetidas de información recién codificada en el hipocampo durante las oscilaciones lentas del sueño NREM median la estabilización y la integración gradual de la memoria declarativa con redes de conocimiento preexistentes en el nivel cortical. [141] Supone que el hipocampo podría retener información solo temporalmente y a un ritmo de aprendizaje rápido, mientras que el neocórtex está relacionado con el almacenamiento a largo plazo y el ritmo de aprendizaje lento. [139] [140] [142] [143] [144] Este diálogo entre el hipocampo y el neocórtex ocurre en paralelo con las ondas agudas del hipocampo y los husos talamocorticales , sincronía que impulsa la formación del evento de onda del huso que parece ser un prerrequisito para la formación de recuerdos a largo plazo. [140] [142] [144] [145]
La reactivación de la memoria también ocurre durante la vigilia y su función está asociada con servir para actualizar la memoria reactivada con nueva información codificada, mientras que las reactivaciones durante el sueño se presentan como cruciales para la estabilización de la memoria. [140] Basándose en experimentos de reactivación de memoria dirigida (TMR) que utilizan señales de memoria asociadas para activar rastros de memoria durante el sueño, varios estudios han estado reafirmando la importancia de las reactivaciones nocturnas para la formación de recuerdos persistentes en redes neocorticales, además de destacar la posibilidad de aumentar el rendimiento de la memoria de las personas en los recuerdos declarativos. [139] [145] [143] [144] [146]
Además, la reactivación nocturna parece compartir los mismos patrones oscilatorios neuronales que la reactivación durante la vigilia, procesos que podrían estar coordinados por la actividad theta . [147] Durante la vigilia, las oscilaciones theta se han relacionado a menudo con un desempeño exitoso en tareas de memoria, y las reactivaciones de memoria con señales durante el sueño han demostrado que la actividad theta es significativamente más fuerte en el reconocimiento posterior de estímulos con señales en comparación con los no señalizados, lo que posiblemente indique un fortalecimiento de los rastros de memoria y la integración léxica mediante señales durante el sueño. [148] Sin embargo, el efecto beneficioso de la TMR para la consolidación de la memoria parece ocurrir solo si los recuerdos con señales pueden relacionarse con el conocimiento previo. [149]
Otros estudios también han analizado los efectos específicos de las diferentes etapas del sueño en diferentes tipos de memoria. Por ejemplo, se ha descubierto que la privación del sueño no afecta significativamente al reconocimiento de rostros, pero puede producir un deterioro significativo de la memoria temporal (discriminación de qué rostro pertenece a qué conjunto de rostros mostrados). También se ha descubierto que la privación del sueño aumenta las creencias de estar en lo cierto, especialmente si estaban equivocadas. Otro estudio informó que el desempeño en el recuerdo libre de una lista de sustantivos es significativamente peor cuando se está privado del sueño (un promedio de 2,8 ± 2 palabras) en comparación con tener una noche de sueño normal (4,7 ± 4 palabras). Estos resultados refuerzan el papel del sueño en la formación de la memoria declarativa . Esto ha sido confirmado además por observaciones de baja actividad metabólica en la corteza prefrontal y los lóbulos temporal y parietal para las tareas de aprendizaje temporal y aprendizaje verbal respectivamente. El análisis de datos también ha demostrado que los ensamblajes neuronales durante el sueño de estado de ánimo se correlacionaban significativamente más con las plantillas que durante las horas de vigilia o el sueño REM. Además, las reverberaciones posteriores al aprendizaje y posteriores al SWS duraron 48 horas, mucho más que la duración del aprendizaje del nuevo objeto (1 hora), lo que indica una potenciación a largo plazo .
Además, se ha observado la importancia de la siesta : mejora del rendimiento en algunos tipos de tareas tras una siesta de una hora por la tarde; estudios sobre el rendimiento de los trabajadores por turnos que demuestran que no es lo mismo dormir el mismo número de horas durante el día que por la noche. Los estudios de investigación actuales analizan la base molecular y fisiológica de la consolidación de la memoria durante el sueño. Estos, junto con los estudios de los genes que pueden desempeñar un papel en este fenómeno, prometen ofrecer una imagen más completa del papel del sueño en la memoria.
El sueño también puede contribuir a debilitar las conexiones sinápticas adquiridas a lo largo del día, pero que no son esenciales para un funcionamiento óptimo. De este modo, se pueden reducir las demandas de recursos, ya que el mantenimiento y fortalecimiento de las conexiones sinápticas constituye una gran parte del consumo de energía del cerebro y pone a prueba otros mecanismos celulares, como la síntesis de proteínas para nuevos canales. [126] [150] Si no se produjera un mecanismo como este durante el sueño, las necesidades metabólicas del cerebro aumentarían con la exposición repetida al fortalecimiento sináptico diario, hasta un punto en el que las tensiones se volverían excesivas o insostenibles.
Un enfoque para comprender el papel del sueño es estudiar la privación del mismo. [151] La privación del sueño es común y a veces incluso necesaria en las sociedades modernas debido a razones laborales y domésticas, como el servicio las 24 horas, la seguridad o la cobertura de los medios, los proyectos que cruzan zonas horarias, etc. Esto hace que comprender los efectos de la privación del sueño sea muy importante.
Desde principios del siglo XX se han realizado muchos estudios para documentar el efecto de la privación del sueño. El estudio de la privación del sueño REM comenzó con William C. Dement alrededor de 1960. Realizó un proyecto de investigación sobre el sueño y los sueños en ocho sujetos, todos varones. Durante un período de hasta 7 días, privó a los participantes del sueño REM despertándolos cada vez que comenzaban a entrar en la etapa. Monitoreó esto con pequeños electrodos adheridos a su cuero cabelludo y sienes. A medida que avanzaba el estudio, notó que cuanto más privaba a los hombres del sueño REM, más a menudo tenía que despertarlos. Después, mostraron más sueño REM de lo habitual, más tarde llamado rebote REM . [152] [153]
La base neuroconductual de estos trastornos se ha estudiado recientemente. La falta de sueño se ha correlacionado fuertemente con una mayor probabilidad de accidentes y errores industriales. [154] [155] Muchos estudios han demostrado que la actividad metabólica en el cerebro se ralentiza con muchas horas de deuda de sueño . [136] Algunos estudios también han demostrado que la red de atención en el cerebro se ve particularmente afectada por la falta de sueño, [156] y aunque algunos de los efectos sobre la atención pueden quedar enmascarados por actividades alternativas (como estar de pie o caminar) o el consumo de cafeína, [157] el déficit de atención no se puede evitar por completo.
Se ha demostrado que la falta de sueño tiene un efecto perjudicial en las tareas cognitivas, especialmente las que implican funciones divergentes o multitarea. [154] [158] [159] También tiene efectos en el estado de ánimo y la emoción, y ha habido múltiples informes de una mayor tendencia a la ira, el miedo o la depresión con la deuda de sueño. [160] [161] Sin embargo, algunas de las funciones cognitivas superiores parecen permanecer inafectadas aunque más lentas. [158] Muchos de estos efectos varían de persona a persona [162] es decir, mientras que algunas personas tienen altos grados de deterioro cognitivo con la falta de sueño, en otras, tiene efectos mínimos. Los mecanismos exactos para lo anterior aún se desconocen y las vías neuronales exactas y los mecanismos celulares de la deuda de sueño aún se están investigando.
Un trastorno del sueño, o somnipatía, es un trastorno médico de los patrones de sueño de una persona o animal. La polisomnografía es una prueba que se utiliza comúnmente para diagnosticar algunos trastornos del sueño. Los trastornos del sueño se clasifican en general en disomnias , parasomnias , trastornos del ritmo circadiano del sueño (CRSD) y otros trastornos, incluidos los causados por afecciones médicas o psicológicas y la enfermedad del sueño . Algunos trastornos del sueño comunes incluyen insomnio (incapacidad crónica para dormir), apnea del sueño (respiración anormalmente baja durante el sueño), narcolepsia (somnolencia excesiva en momentos inadecuados), cataplejía (pérdida repentina y transitoria del tono muscular) y enfermedad del sueño (interrupción del ciclo del sueño debido a una infección). Otros trastornos que se están estudiando incluyen sonambulismo , terror nocturno y enuresis .
El estudio de los trastornos del sueño es particularmente útil, ya que proporciona algunas pistas sobre qué partes del cerebro pueden estar involucradas en la función modificada. Esto se hace comparando los patrones de imagen e histológicos en sujetos normales y afectados. El tratamiento de los trastornos del sueño generalmente implica métodos conductuales y psicoterapéuticos , aunque también se pueden utilizar otras técnicas. La elección de la metodología de tratamiento para un paciente específico depende del diagnóstico del paciente, su historial médico y psiquiátrico y sus preferencias, así como de la experiencia del médico tratante. A menudo, los enfoques conductuales o psicoterapéuticos y farmacológicos son compatibles y se pueden combinar de manera efectiva para maximizar los beneficios terapéuticos.
Con frecuencia, los trastornos del sueño también se han asociado con enfermedades neurodegenerativas, principalmente cuando se caracterizan por una acumulación anormal de alfa-sinucleína , como la atrofia multisistémica (MSA), la enfermedad de Parkinson (PD) y la enfermedad de cuerpos de Lewy (LBD). [163] [54] [164] [56] [165] [166] [167] Por ejemplo, las personas diagnosticadas con EP a menudo han presentado diferentes tipos de problemas de sueño, comúnmente relacionados con insomnio (alrededor del 70% de la población con EP), hipersomnia (más del 50% de la población con EP) y trastorno de conducta del sueño REM (RBD), que puede afectar a alrededor del 40% de la población con EP y está asociado con un aumento de los síntomas motores. [163] [54] [164] [56] [165] [167] Además, el RBD también se ha destacado como un fuerte precursor del desarrollo futuro de esas enfermedades neurodegenerativas durante varios años en el pasado, lo que parece ser una gran oportunidad para mejorar los tratamientos. [54] [56]
También se han observado alteraciones del sueño en la enfermedad de Alzheimer (EA), que afecta a alrededor del 45% de su población. [54] [56] [166] Además, cuando se basa en informes de cuidadores, este porcentaje es incluso mayor, alrededor del 70%. [168] Además de en la población con EP, el insomnio y la hipersomnia se reconocen con frecuencia en pacientes con EA, que se asocian con la acumulación de beta-amiloide , trastornos del ritmo circadiano del sueño (CRSD) y alteración de la melatonina . [54] [56] [168] Además, también se observan cambios en la arquitectura del sueño en la EA. [54] [56] [166] Aunque con el envejecimiento la arquitectura del sueño parece cambiar de forma natural, en los pacientes con EA se agrava. El SWS está potencialmente disminuido (a veces totalmente ausente), los husos y el tiempo transcurrido en el sueño REM también se reducen, mientras que su latencia aumenta. [168] El inicio deficiente del sueño en la EA también se ha asociado con alucinaciones relacionadas con los sueños, mayor inquietud, deambulación y agitación, que parecen estar relacionados con el síndrome vespertino , un fenómeno cronobiológico típico que se presenta en la enfermedad. [56] [168]
Las enfermedades neurodegenerativas se relacionan comúnmente con alteraciones de las estructuras cerebrales, que pueden alterar los estados de sueño y vigilia, el ritmo circadiano, el funcionamiento motor o no motor. [54] [56] Por otro lado, las alteraciones del sueño también se relacionan frecuentemente con el empeoramiento del funcionamiento cognitivo, el estado emocional y la calidad de vida del paciente. [56] [167] [168] Además, estos síntomas conductuales anormales contribuyen negativamente a abrumar a sus familiares y cuidadores. [56] [167] [168] Por lo tanto, una comprensión más profunda de la relación entre los trastornos del sueño y las enfermedades neurodegenerativas parece ser extremadamente importante, principalmente considerando la investigación limitada relacionada con ella y la creciente expectativa de vida. [54] [168]
Un campo relacionado es el de la medicina del sueño, que implica el diagnóstico y el tratamiento de los trastornos del sueño y la privación del sueño, que es una de las principales causas de accidentes. Esto implica una variedad de métodos de diagnóstico, entre ellos la polisomnografía, el diario del sueño , la prueba de latencia múltiple del sueño , etc. De manera similar, el tratamiento puede ser conductual, como la terapia cognitiva conductual , o puede incluir medicación farmacológica o terapia con luz brillante .

Los sueños son sucesiones de imágenes, ideas, emociones y sensaciones que se producen de forma involuntaria en la mente durante ciertas fases del sueño (principalmente la fase REM). El contenido y la finalidad de los sueños aún no se entienden con claridad, aunque se han propuesto diversas teorías. El estudio científico de los sueños se denomina onirología .
Existen muchas teorías sobre la base neurológica de los sueños, entre ellas la teoría de la síntesis de activación (la teoría de que los sueños son resultado de la activación del tronco encefálico durante el sueño REM); la teoría de la activación continua (la teoría de que los sueños son resultado de la activación y la síntesis, pero los sueños y el sueño REM están controlados por diferentes estructuras del cerebro); y los sueños como excitaciones de la memoria a largo plazo (una teoría que sostiene que las excitaciones de la memoria a largo plazo también prevalecen durante las horas de vigilia, pero que suelen estar controladas y se hacen evidentes solo durante el sueño).
Existen también múltiples teorías sobre la función de los sueños. Algunos estudios afirman que los sueños fortalecen los recuerdos semánticos, basándose en el papel del diálogo neocortical hipocampal y en las conexiones generales entre el sueño y la memoria. Un estudio supone que los sueños borran datos basura del cerebro. La adaptación emocional y la regulación del estado de ánimo son otras funciones propuestas de los sueños.
Desde un punto de vista evolutivo , los sueños podrían simular y repetir eventos amenazantes, que eran comunes en el entorno ancestral del organismo, aumentando así la capacidad de una persona para enfrentar los problemas y desafíos cotidianos en el presente. Por esta razón, estos eventos amenazantes pueden haber sido transmitidos en forma de memoria genética . [169] [170] Esta teoría concuerda bien con la afirmación de que el sueño REM es una transformación evolutiva de un mecanismo defensivo bien conocido, el reflejo tónico de inmovilidad. [42] [43]
La mayoría de las teorías sobre la función del sueño parecen ser contradictorias, pero es posible que muchas funciones del sueño a corto plazo puedan actuar juntas para lograr una función mayor a largo plazo. [7] Cabe señalar que la evidencia de ninguna de estas teorías es completamente concluyente.
La incorporación de eventos de la memoria de vigilia a los sueños es otra área de investigación activa y algunos investigadores han tratado de vincularla con las funciones de consolidación de la memoria declarativa de los sueños. [171] [172]
Un área de investigación relacionada es la base neurocientífica de las pesadillas . Muchos estudios han confirmado una alta prevalencia de pesadillas y algunos las han correlacionado con altos niveles de estrés . [173] Se han propuesto múltiples modelos de producción de pesadillas, incluidos los modelos neofreudianos , así como otros modelos como el modelo de contextualización de imágenes, el modelo de espesor de límites, el modelo de simulación de amenazas, etc. [174] El desequilibrio de neurotransmisores se ha propuesto como causa de las pesadillas, así como la disfunción de la red afectiva, un modelo que afirma que la pesadilla es un producto de la disfunción de los circuitos normalmente involucrados en los sueños. [175] [176] Al igual que con los sueños, ninguno de los modelos ha arrojado resultados concluyentes y los estudios continúan sobre estas preguntas.
El investigador del sueño de Harvard
Robert Stickgold
ha recordado que su ex colaborador
J. Allan Hobson
bromeaba diciendo que la única función conocida del sueño es curar la somnolencia.
(incluye ilustraciones de "husos del sueño" y "complejos K")
El sistema de activación reticular ascendente (ARAS) es responsable de un estado de vigilia sostenido. Recibe información de receptores sensoriales de diversas modalidades, transmitida a través de vías espinorreticulares y nervios craneales (nervio trigémino - vías polimodales, nervio olfatorio, nervio óptico y nervio vestibulococlear - vías monomodales). Estas vías llegan al tálamo directa o indirectamente a través de la columna medial de núcleos de formación reticular (núcleos magnocelulares y núcleos reticulares del tegmento pontino). El sistema reticular activador comienza en la parte dorsal del mesencéfalo posterior y la protuberancia anterior, continúa hacia el diencéfalo y luego se divide en dos partes que alcanzan el tálamo y el hipotálamo, que luego se proyectan hacia la corteza cerebral (Fig. 1). La proyección talámica está dominada por neuronas colinérgicas que se originan en los núcleos tegmental pedunculopontino de la protuberancia y el mesencéfalo (PPT) y el núcleo tegmental laterodorsal de la protuberancia y el mesencéfalo (LDT) [17, 18]. La proyección hipotalámica involucra neuronas noradrenérgicas del locus coeruleus (LC) y neuronas serotoninérgicas de los núcleos del rafe dorsal y medio (DR), que pasan a través del hipotálamo lateral y alcanzan los axones del núcleo tubero-mamilar histaminérgico (TMN), formando juntos una vía que se extiende hacia el prosencéfalo, la corteza y el hipocampo. La excitación cortical también aprovecha las neuronas dopaminérgicas de la sustancia negra (SN), el área tegmental ventral (VTA) y el área gris periacueductal (PAG). Menos neuronas colinérgicas de la protuberancia y el mesencéfalo envían proyecciones al prosencéfalo a lo largo de la vía ventral, sin pasar por el tálamo [19, 20].
se originan también en los núcleos del rafe dentro del tronco encefálico; las neuronas dopaminérgicas se originan en el área tegmental ventral (VTA); y la vía histaminérgica se origina en neuronas en el núcleo tuberomamilar (TMN) del hipotálamo posterior. Como se analiza en el Capítulo 6, estas neuronas se proyectan ampliamente por todo el cerebro desde grupos restringidos de cuerpos celulares. La noradrenalina, la serotonina, la dopamina y la histamina tienen funciones moduladoras complejas y, en general, promueven la vigilia. El PT en el tronco encefálico también es un componente importante del ARAS. La actividad de las neuronas colinérgicas del PT (células REM-on) promueve el sueño REM. Durante la vigilia, las células REM activas son inhibidas por un subconjunto de neuronas de noradrenalina y serotonina ARAS llamadas células REM desactivadas.
La comprensión de las funciones de activación y mantenimiento de la vigilia del ARAS se ha complicado aún más con los descubrimientos neuroquímicos de numerosos grupos de neuronas con vías ascendentes que se originan dentro del núcleo reticular del tronco encefálico, incluidos los núcleos pontomesencefálicos, que sintetizan diferentes transmisores y los liberan en amplias áreas del cerebro y en todo el neocórtex (para una revisión, consulte Jones 2003; Lin et al. 2011). Incluían sistemas glutamatérgico, colinérgico, noradrenérgico, dopaminérgico, serotoninérgico, histaminérgico y orexinérgico (para una revisión, consulte Lin et al. 2011). ... El ARAS representaba vías difusas, no específicas que, trabajando a través de los núcleos talámicos intralaminares de la línea media, podrían cambiar la actividad de todo el neocórtex, y por lo tanto, este sistema se sugirió inicialmente como un sistema de excitación general a estímulos naturales y el sistema crítico subyacente a la vigilia (Moruzzi y Magoun 1949; Lindsley et al. 1949; Starzl et al. 1951, consulte el área punteada en la Fig. 1). ... Se encontró en un estudio reciente en la rata que el estado de vigilia se mantiene principalmente por la proyección glutamatérgica ascendente desde el núcleo parabranquial y las regiones precoeruleus hasta el prosencéfalo basal y luego se transmite a la corteza cerebral (Fuller et al. 2011). ... Estudios anatómicos han demostrado dos vías principales implicadas en la excitación y que se originan en las áreas con grupos de células colinérgicas, una a través del tálamo y la otra, viajando ventralmente a través del hipotálamo y el área preóptica, y recíprocamente conectadas con el sistema límbico (Nauta y Kuypers 1958; Siegel 2004). ... Como se cuenta en las conexiones colinérgicas con el núcleo reticular talámico ...
Este sistema de activación reticular ascendente (ARAS) está compuesto por el tegmento laterodorsal y pedunculopontino colinérgico (LDT/PPT), el locus coeruleus noradrenérgico (LC), los núcleos del rafe serotoninérgicos (5-HT) y el área tegmental ventral (VTA) dopaminérgica, la sustancia negra (SN) y las proyecciones grises periacueductales que estimulan la corteza directa e indirectamente a través del tálamo, el hipotálamo y el BF.
6, 12-18
Estas poblaciones aminérgicas y catecolaminérgicas tienen numerosas interconexiones y proyecciones paralelas que probablemente imparten redundancia funcional y resiliencia al sistema.
6, 13, 19
... Más recientemente, la zona parafacial medular (PZ) adyacente al nervio facial se identificó como un centro promotor del sueño sobre la base de estudios anatómicos, electrofisiológicos y quimio y optogenéticos.
23, 24
Las neuronas PZ GABAérgicas inhiben las neuronas parabranquiales (PB) glutamatérgicas que se proyectan al BF,
25
promoviendo así el sueño NREM a expensas de la vigilia y el sueño REM. ... Las neuronas Hcrt se proyectan ampliamente por todo el cerebro y la médula espinal
92, 96, 99, 100
incluyendo proyecciones importantes a grupos de células promotoras de la vigilia como las células HA de la TM,
101
las células 5-HT de los núcleos del rafe dorsal (DRN),
101
las células noradrenérgicas del LC,
102
y las células colinérgicas en el LDT, PPT y BF.
101, 103
... Hcrt excita directamente los sistemas celulares involucrados en la vigilia y el despertar incluyendo el LC,
102, 106, 107
DRN,
108, 109
TM,
110-112
LDT,
113, 114
BF colinérgico,
115
y neuronas dopaminérgicas (DA) y no DA en el VTA.
116, 117