Las plaquetas o trombocitos (del griego antiguo θρόμβος ( thrómbos ) 'coágulo' y κύτος ( kútos ) 'célula') son un componente de la sangre cuya función (junto con los factores de coagulación ) es reaccionar al sangrado debido a una lesión de un vaso sanguíneo agrupándose, iniciando así un coágulo de sangre . [1] Las plaquetas no tienen núcleo celular ; son fragmentos de citoplasma derivados de los megacariocitos [2] de la médula ósea o del pulmón, [3] que luego ingresan a la circulación. Las plaquetas se encuentran sólo en los mamíferos, mientras que en otros vertebrados (p. ej. , aves , anfibios ), los trombocitos circulan como células mononucleares intactas . [4] : 3
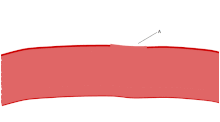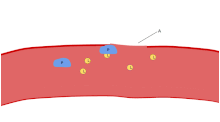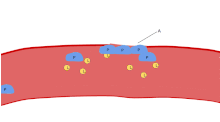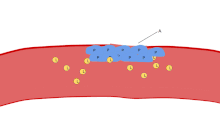
Una función importante de las plaquetas es contribuir a la hemostasia : el proceso de detener el sangrado en el lugar del endotelio interrumpido . Se reúnen en el lugar y, a menos que la interrupción sea físicamente demasiado grande, tapan el agujero. En primer lugar, las plaquetas se adhieren a sustancias fuera del endotelio interrumpido: adhesión . En segundo lugar, cambian de forma, activan receptores y secretan mensajeros químicos : activación . En tercer lugar, se conectan entre sí a través de puentes receptores: agregación . [5] La formación de este tapón de plaquetas (hemostasia primaria) se asocia con la activación de la cascada de coagulación , con el depósito y la unión de fibrina resultantes (hemostasia secundaria). Estos procesos pueden superponerse: el espectro va desde un tapón predominantemente de plaquetas, o "coágulo blanco", hasta uno predominantemente de fibrina, o "coágulo rojo", o la mezcla más típica. Algunos agregarían la retracción posterior y la inhibición plaquetaria como cuarto y quinto paso para completar el proceso [6] y otros agregarían un sexto paso, la reparación de la herida . Las plaquetas también participan en respuestas inmunes intravasculares tanto innatas [7] como adaptativas [8] .
Estructuralmente, las plaquetas se pueden dividir en cuatro zonas, desde la periférica hasta la más interna: [ cita necesaria ]
Las plaquetas inactivadas circulantes son estructuras discoides (en forma de lente) biconvexas, [9] [4] : 117–118 2–3 µm de diámetro mayor. [10] Las plaquetas activadas tienen proyecciones de membrana celular que cubren su superficie.
En una primera aproximación, la forma de las plaquetas puede considerarse similar a la de los esferoides achatados , con una relación de semieje de 2 a 8. [11] Esta aproximación se utiliza a menudo para modelar las propiedades hidrodinámicas y ópticas de una población de plaquetas, así como para restaurar los parámetros geométricos de plaquetas individuales medidas mediante citometría de flujo. [12] Modelos biofísicos más precisos de la morfología de la superficie de las plaquetas, que modelan su forma a partir de primeros principios, permiten obtener una geometría de las plaquetas más realista en un estado de calma y activación. [13]
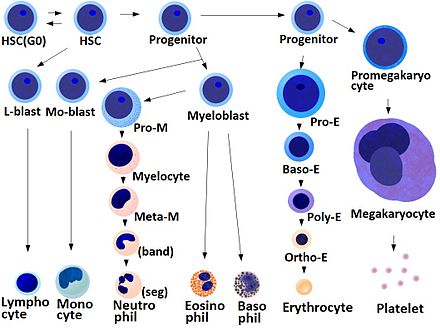
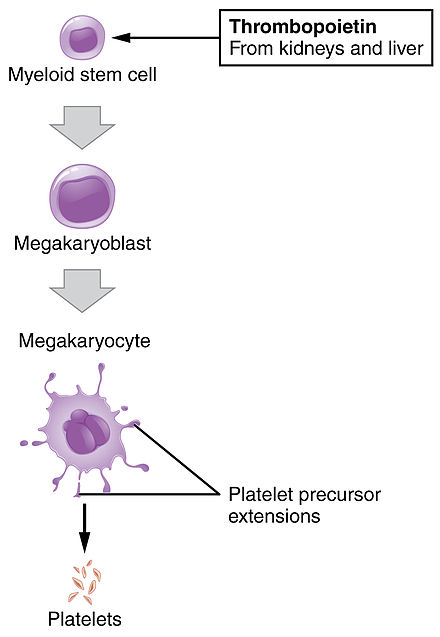

La función fundamental de las plaquetas es agruparse para detener el sangrado agudo. Este proceso es complejo, ya que se sabe que más de 193 proteínas y 301 interacciones están involucradas en la dinámica plaquetaria. [5] Si bien existe mucha superposición, la función plaquetaria se puede modelar en tres pasos:
La formación de trombos en un endotelio intacto se previene con óxido nítrico , [16] prostaciclina , [17] y CD39 . [18]
Las células endoteliales están unidas al colágeno subendotelial mediante el factor von Willebrand (VWF), que estas células producen. El VWF también se almacena en los cuerpos de Weibel-Palade de las células endoteliales y se secreta de forma constitutiva en la sangre. Las plaquetas almacenan el vWF en sus gránulos alfa.
Cuando se rompe la capa endotelial, el colágeno y el VWF anclan las plaquetas al subendotelio. El receptor plaquetario GP1b-IX-V se une al VWF; y el receptor GPVI y la integrina α2β1 se unen al colágeno. [19]

El revestimiento endotelial intacto inhibe la activación plaquetaria al producir óxido nítrico , ADPasa endotelial y PGI 2 (prostaciclina). La ADPasa endotelial degrada el activador plaquetario ADP . [ cita necesaria ]
Las plaquetas en reposo mantienen la salida activa de calcio a través de una bomba de calcio activada por AMP cíclico . La concentración de calcio intracelular determina el estado de activación plaquetaria, ya que es el segundo mensajero que impulsa el cambio conformacional y la desgranulación de las plaquetas (ver más abajo). La prostaciclina endotelial se une a los receptores de prostanoides en la superficie de las plaquetas en reposo. Este evento estimula la proteína Gs acoplada para aumentar la actividad de la adenilato ciclasa y aumenta la producción de AMPc, promoviendo aún más la salida de calcio y reduciendo la disponibilidad de calcio intracelular para la activación plaquetaria. [ cita necesaria ]
El ADP, por otro lado, se une a los receptores purinérgicos de la superficie de las plaquetas. Dado que el receptor purinérgico trombocítico P2Y12 está acoplado a proteínas Gi , el ADP reduce la actividad de la adenilato ciclasa plaquetaria y la producción de AMPc, lo que lleva a la acumulación de calcio dentro de las plaquetas al inactivar la bomba de eflujo de calcio del AMPc. El otro receptor de ADP, P2Y1, se acopla a Gq que activa la fosfolipasa C-beta 2 ( PLCB2 ), lo que da como resultado la generación de inositol 1,4,5-trifosfato (IP3) y la liberación intracelular de más calcio. Esto en conjunto induce la activación plaquetaria. La ADPasa endotelial degrada el ADP y evita que esto suceda. El clopidogrel y los medicamentos antiplaquetarios relacionados también funcionan como antagonistas del receptor purinérgico P2Y12 . [ cita necesaria ] Los datos sugieren que el ADP activa la vía PI3K/Akt durante una primera ola de agregación, lo que lleva a la generación de trombina y la activación de PAR-1 , que evoca una segunda ola de agregación. [20]
La activación plaquetaria comienza segundos después de que se produce la adhesión. Se desencadena cuando el colágeno del subendotelio se une a sus receptores ( receptor GPVI e integrina α2β1) en las plaquetas. GPVI está asociado con la cadena gamma del receptor Fc y conduce, a través de la activación de una cascada de tirosina quinasa, finalmente a la activación de PLC-gamma2 ( PLCG2 ) y a una mayor liberación de calcio. [ cita necesaria ]
El factor tisular también se une al factor VII en la sangre, lo que inicia la cascada de coagulación extrínseca para aumentar la producción de trombina . La trombina es un potente activador plaquetario que actúa a través de Gq y G12. Estos son receptores acoplados a proteína G y activan vías de señalización mediadas por calcio dentro de las plaquetas, superando la salida de calcio basal. Las familias de tres proteínas G (Gq, Gi, G12) operan juntas para una activación completa. La trombina también promueve el refuerzo secundario de fibrina del tapón plaquetario. La activación plaquetaria a su vez desgranula y libera factor V y fibrinógeno , potenciando la cascada de coagulación. Entonces, en realidad, el proceso de obstrucción plaquetaria y coagulación ocurre simultáneamente en lugar de secuencialmente, y cada uno induce al otro a formar el trombo final reticulado con fibrina. [ cita necesaria ]
La señalización de GPVI mediada por colágeno aumenta la producción plaquetaria de tromboxano A2 (TXA2) y disminuye la producción de prostaciclina . Esto ocurre alterando el flujo metabólico de la vía de síntesis de eicosanoides de las plaquetas , que involucra las enzimas fosfolipasa A2 , ciclooxigenasa 1 y tromboxano-A sintasa . Las plaquetas secretan tromboxano A2, que actúa sobre los propios receptores de tromboxano de las plaquetas en la superficie de las plaquetas (de ahí el llamado mecanismo "fuera adentro") y sobre los de otras plaquetas. Estos receptores desencadenan la señalización intraplaquetaria, que convierte los receptores GPIIb/IIIa a su forma activa para iniciar la agregación . [5]

Las plaquetas contienen gránulos densos , gránulos lambda y gránulos alfa . Las plaquetas activadas secretan el contenido de estos gránulos a través de sus sistemas canaliculares hacia el exterior. De manera simplista, las plaquetas unidas y activadas se degranulan para liberar agentes quimiotácticos plaquetarios para atraer más plaquetas al sitio de la lesión endotelial. Características del gránulo:
Como lo demuestran la citometría de flujo y la microscopía electrónica, el signo de activación más sensible cuando las plaquetas se exponen mediante ADP son los cambios morfológicos. [21] La hiperpolarización mitocondrial es un evento clave en el inicio de cambios en la morfología. [22] La concentración de calcio intraplaquetaria aumenta, estimulando la interacción entre el complejo de microtúbulos y filamentos de actina. Los cambios continuos de forma desde las plaquetas inactivadas hasta las completamente activadas se observan mejor en microscopía electrónica de barrido. Tres pasos a lo largo de este camino se denominan dendrítico temprano , propagación temprana y propagación . La superficie de las plaquetas inactivadas se parece mucho a la superficie del cerebro, con una apariencia arrugada debido a numerosos pliegues poco profundos para aumentar el área de superficie; dendrítico temprano , un pulpo con múltiples brazos y piernas; untado temprano , un huevo crudo frito en una sartén, siendo la "yema" el cuerpo central; y la pasta para untar , un huevo frito cocido con un cuerpo central más denso.
Todos estos cambios se producen por la interacción del complejo microtúbulo/actina con la membrana celular plaquetaria y el sistema canalicular abierto (OCS), que es una extensión e invaginación de esa membrana. Este complejo corre justo debajo de estas membranas y es el motor químico que literalmente saca el OCS invaginado del interior de la plaqueta, como si volviera los bolsillos de los pantalones al revés, creando las dendritas. Este proceso es similar al mecanismo de contracción de una célula muscular . [23] Por lo tanto, toda la OCS se vuelve indistinguible de la membrana plaquetaria inicial a medida que forma el "huevo frito". Este dramático aumento en el área de superficie se produce sin estirar ni agregar fosfolípidos a la membrana plaquetaria. [24]
La activación plaquetaria hace que la superficie de su membrana se cargue negativamente. Una de las vías de señalización activa la scramblasa , que mueve los fosfolípidos cargados negativamente desde la superficie interna de la membrana plaquetaria a la externa. Estos fosfolípidos luego se unen a los complejos de tenasa y protrombinasa , dos de los sitios de interacción entre las plaquetas y la cascada de coagulación. Los iones de calcio son esenciales para la unión de estos factores de coagulación.
Además de interactuar con el vWF y la fibrina, las plaquetas interactúan con la trombina, los factores X, Va, VIIa, XI, IX y la protrombina para completar su formación a través de la cascada de coagulación. [25] [26] Seis estudios sugirieron que las plaquetas expresan el factor tisular : el estudio definitivo muestra que no es así. [25] Se demostró de manera concluyente que las plaquetas de ratas expresan la proteína del factor tisular y también se demostró que las plaquetas de rata portan tanto el pre-ARNm del factor tisular como el ARNm maduro. [27]

La agregación de plaquetas comienza minutos después de su activación y ocurre como resultado de la activación del receptor GPIIb/IIIa , lo que permite que estos receptores se unan al vWF o al fibrinógeno . [5] Hay alrededor de 60.000 de estos receptores por plaqueta. [28] Cuando uno o más de al menos nueve receptores de superficie plaquetaria diferentes se activan durante la activación, las vías de señalización intraplaquetas hacen que los receptores GpIIb/IIIa existentes cambien de forma (de curvados a rectos) y, por lo tanto, se vuelvan capaces de unirse. [5]
Dado que el fibrinógeno es una proteína en forma de bastón con nódulos en cada extremo capaces de unirse a GPIIb/IIIa, las plaquetas activadas con GPIIb/IIIa expuesto pueden unir el fibrinógeno al agregado. GPIIb/IIIa también puede anclar aún más las plaquetas al vWF subendotelial para una estabilización estructural adicional.
Clásicamente se pensaba que éste era el único mecanismo implicado en la agregación, pero se han identificado tres nuevos mecanismos que pueden iniciar la agregación, dependiendo de la velocidad del flujo sanguíneo (es decir, rango de corte). [29]
Las plaquetas tienen un papel central en la inmunidad innata, iniciando y participando en múltiples procesos inflamatorios, uniéndose directamente a los patógenos e incluso destruyéndolos. Esto respalda los datos clínicos que muestran que muchas personas con infecciones bacterianas o virales graves tienen trombocitopenia, lo que reduce su contribución a la inflamación. Los agregados de plaquetas y leucocitos (PLA) que se encuentran en la circulación son típicos de la sepsis o la enfermedad inflamatoria intestinal y muestran la conexión entre los trombocitos y las células inmunitarias. [30]
La membrana celular de las plaquetas tiene receptores para el colágeno. Tras la rotura de la pared del vaso sanguíneo, las plaquetas quedan expuestas y se adhieren al colágeno del tejido conectivo circundante.
Como la hemostasia es una función básica de los trombocitos en los mamíferos, también tiene sus usos en posibles confinamientos por infección. [7] En caso de lesión, las plaquetas, junto con la cascada de coagulación, forman la primera línea de defensa formando un coágulo de sangre. Así, la hemostasia y la defensa del huésped estuvieron entrelazadas en la evolución. Por ejemplo, en el cangrejo herradura del Atlántico ( fósil viviente que se estima tiene más de 400 millones de años), el único tipo de célula sanguínea, el amebocito , facilita tanto la función hemostática como la encapsulación y fagocitosis de patógenos mediante la exocitosis de gránulos intracelulares que contienen Moléculas de defensa bactericidas . La coagulación de la sangre apoya la función inmune al atrapar las bacterias patógenas en su interior. [31]
Aunque la trombosis, la coagulación de la sangre en vasos sanguíneos intactos, generalmente se considera una respuesta inmune patológica, que conduce a la obturación de la luz del vaso sanguíneo y al posterior daño hipóxico del tejido, en algunos casos, la trombosis dirigida, llamada inmunotrombosis, puede controlar localmente la propagación de la enfermedad. infección. La trombosis se dirige en concordancia de plaquetas, neutrófilos y monocitos . El proceso lo inician las células inmunitarias mediante la activación de sus receptores de reconocimiento de patrones (PRR) o mediante la unión entre plaquetas y bacterias. Las plaquetas pueden unirse a las bacterias directamente a través de PRR trombocíticos [30] y proteínas de la superficie bacteriana, o mediante proteínas plasmáticas que se unen tanto a las plaquetas como a las bacterias. [32] Los monocitos responden a patrones moleculares asociados a patógenos bacterianos (PAMP) o patrones moleculares asociados a daños (DAMP) activando la vía extrínseca de la coagulación. Los neutrófilos facilitan la coagulación de la sangre por NETosis . A su vez, las plaquetas facilitan la NETosis de los neutrófilos. Los NET se unen al factor tisular, uniendo los centros de coagulación al lugar de la infección. También activan la vía de coagulación intrínseca proporcionando su superficie cargada negativamente al factor XII. Otras secreciones de neutrófilos, como las enzimas proteolíticas que escinden los inhibidores de la coagulación, también refuerzan el proceso. [7]
En caso de desequilibrio en la regulación de la inmunotrombosis, este proceso puede volverse aberrante rápidamente. Se sospecha que los defectos regulatorios en la inmunotrombosis son un factor importante en la causa de la trombosis patológica en muchas formas, como la coagulación intravascular diseminada (CID) o la trombosis venosa profunda . La CID en la sepsis es un excelente ejemplo tanto del proceso de coagulación desregulado como de una respuesta inflamatoria sistémica indebida, que resulta en una multitud de microtrombos de composición similar a la de la inmunotrombosis fisiológica: fibrina, plaquetas, neutrófilos y NET. [7]
Las plaquetas se despliegan rápidamente en los sitios de lesión o infección y potencialmente modulan los procesos inflamatorios al interactuar con los leucocitos y secretar citocinas , quimiocinas y otros mediadores inflamatorios. [33] [34] [35] [36] [37] Las plaquetas también secretan factor de crecimiento derivado de plaquetas (PDGF).
Las plaquetas modulan a los neutrófilos formando agregados de plaquetas y leucocitos (PLA). Estas formaciones inducen una producción regulada positiva de integrina αmβ2 ( Mac-1 ) en los neutrófilos. La interacción con los PLA también induce la desgranulación y un aumento de la fagocitosis en los neutrófilos. Las plaquetas también son la mayor fuente de CD40L soluble , que induce la producción de especies reactivas de oxígeno (ROS) y regula positivamente la expresión de moléculas de adhesión, como E-selectina, ICAM-1 y VCAM-1, en los neutrófilos, activa los macrófagos y activa la respuesta citotóxica en Linfocitos T y B. [30]
Recientemente, se ha refutado la creencia de que las plaquetas de los mamíferos que carecen de núcleo son incapaces de moverse de forma autónoma. [38] De hecho, las plaquetas son carroñeros activos, escalan las paredes de los vasos sanguíneos y reorganizan el trombo. Son capaces de reconocer y adherirse a muchas superficies, incluidas las bacterias, pudiendo envolverlas completamente en su sistema canalicular abierto (OCP), lo que llevó al nombre propuesto para el proceso como "cobercitosis", en lugar de fagocitosis, ya que el OCS es simplemente un Invaginación de la membrana plasmática externa. Estos haces de plaquetas y bacterias se utilizan luego como plataforma de interacción para los neutrófilos que destruyen las bacterias mediante NETosis y fagocitosis.
Las plaquetas también participan en enfermedades inflamatorias crónicas, como la sinovitis o la artritis reumatoide. [39] Las plaquetas son activadas por la glicoproteína IV del receptor de colágeno (GPVI). Las microvesículas plaquetarias proinflamatorias desencadenan la secreción constante de citocinas de los sinoviocitos vecinos similares a fibroblastos , sobre todo Il-6 e Il-8 . El daño inflamatorio a la matriz extracelular circundante revela continuamente más colágeno, manteniendo la producción de microvesículas.
Las plaquetas activadas pueden participar en la inmunidad adaptativa, interactuando con los anticuerpos . Son capaces de unirse específicamente a IgG a través de FcγRIIA , un receptor para el fragmento constante (Fc) de IgG. Cuando se activan y se unen a bacterias opsonizadas con IgG , las plaquetas liberan posteriormente especies reactivas de oxígeno (ROS), péptidos antimicrobianos, defensinas, kinocidinas y proteasas, matando a las bacterias directamente. [40] Las plaquetas también secretan mediadores proinflamatorios y procoagulantes, como polifosfatos inorgánicos o factor plaquetario 4 (PF4), que conectan las respuestas inmunitarias innatas y adaptativas. [40] [41]
Puede producirse sangrado espontáneo y excesivo debido a trastornos plaquetarios. Este sangrado puede ser causado por un número deficiente de plaquetas, plaquetas disfuncionales o un número muy excesivo de plaquetas: más de 1,0 millón/microlitro. (Los números excesivos crean una deficiencia relativa del factor von Willebrand debido al secuestro). [42] [43]
Se puede tener una idea de si el sangrado se debe a un trastorno plaquetario o a un trastorno del factor de coagulación por las características y la ubicación del sangrado. [4] : 815, cuadro 39-4 Todo lo siguiente sugiere sangrado de plaquetas, no sangrado de coagulación: el sangrado de un corte en la piel, como un corte con navaja, es rápido y excesivo, pero puede controlarse mediante presión; sangrado espontáneo en la piel que provoca una mancha violácea denominada por su tamaño: petequias , púrpura , equimosis ; sangrado en las membranas mucosas que causa sangrado de encías, sangrado nasal y sangrado gastrointestinal; menorragia; y hemorragia intrarretiniana e intracraneal.
Un número excesivo de plaquetas y/o plaquetas normales que responden a paredes vasculares anormales pueden provocar trombosis venosa y trombosis arterial . Los síntomas dependen del sitio de la trombosis.
La concentración de plaquetas en la sangre (es decir, el recuento de plaquetas) se mide manualmente usando un hemocitómetro o colocando la sangre en un analizador de plaquetas automatizado usando un conteo de partículas, como un contador Coulter o métodos ópticos. [44] Los métodos de análisis de sangre más comunes incluyen el recuento de plaquetas en sus mediciones, generalmente informado como (PLT) . [45]
Las concentraciones de plaquetas varían entre individuos y a lo largo del tiempo, siendo el promedio de la población entre 250.000 y 260.000 células por mm 3 (equivalente a por microlitro), pero el rango normal típico aceptado en el laboratorio es entre 150.000 y 400.000 células por mm 3 o 150-400 × 10 9 por litro. [45] [44]

En un frotis de sangre teñido , las plaquetas aparecen como manchas de color púrpura oscuro, aproximadamente el 20% del diámetro de los glóbulos rojos. El frotis se utiliza para examinar el tamaño, la forma, el número cualitativo y la agrupación de las plaquetas . Un adulto sano suele tener entre 10 y 20 veces más glóbulos rojos que plaquetas.
El tiempo de sangrado fue desarrollado por primera vez como una prueba de la función plaquetaria por Duke en 1910. [46] La prueba de Duke midió el tiempo que tardaba en detenerse el sangrado de una herida estandarizada en el lóbulo de la oreja que se secaba cada 30 segundos. El tiempo normal para que se detuviera el sangrado fue de menos de 3 minutos. [47] Actualmente se utilizan técnicas más modernas. Un tiempo de sangrado normal refleja un número y función suficientes de plaquetas, además de una microvasculatura normal .
En la agregagometría de electrodos múltiples , la sangre total anticoagulada se mezcla con solución salina y un agonista plaquetario en una cubeta de un solo uso con dos pares de electrodos. El aumento de la impedancia entre los electrodos a medida que las plaquetas se agregan a ellos se mide y se visualiza como una curva. [48] [49]
En la agregometría por transmisión de luz (LTA), se coloca plasma rico en plaquetas entre una fuente de luz y una fotocélula. El plasma no agregado deja pasar relativamente poca luz. Después de añadir un agonista, las plaquetas se agregan, lo que da como resultado una mayor transmisión de luz, que es detectada por la fotocélula. [52]
El PFA-100 (ensayo de función plaquetaria – 100) es un sistema para analizar la función plaquetaria en el que se aspira sangre entera citratada a través de un cartucho desechable que contiene una abertura dentro de una membrana recubierta con colágeno y epinefrina o colágeno y ADP. Estos agonistas inducen la adhesión, activación y agregación de las plaquetas, lo que lleva a una rápida oclusión de la apertura y al cese del flujo sanguíneo denominado tiempo de cierre (CT). Una TC elevada con EPI y colágeno puede indicar defectos intrínsecos como enfermedad de von Willebrand , uremia o inhibidores de plaquetas circulantes. La prueba de seguimiento que involucra colágeno y ADP se usa para indicar si la TC anormal con colágeno y EPI fue causada por los efectos del ácido acetil sulfosalicílico (aspirina) o medicamentos que contienen inhibidores. [53]
Adaptado de: [4] : vii
La concentración baja de plaquetas se llama trombocitopenia y se debe a una disminución de la producción o a una mayor destrucción . La concentración elevada de plaquetas se llama trombocitosis y es congénita , reactiva (a las citoquinas ) o debida a una producción no regulada : una de las neoplasias mieloproliferativas u otras neoplasias mieloides determinadas . Un trastorno de la función plaquetaria se llama trombocitopatía o trastorno de la función plaquetaria.
Las plaquetas normales pueden responder a una anomalía en la pared del vaso en lugar de a una hemorragia, lo que resulta en una adhesión/activación plaquetaria inadecuada y trombosis : la formación de un coágulo dentro de un vaso intacto. Este tipo de trombosis surge por mecanismos diferentes a los de un coágulo normal: a saber, extender la fibrina de la trombosis venosa ; extender una placa arterial inestable o rota, provocando trombosis arterial ; y trombosis microcirculatoria. Un trombo arterial puede obstruir parcialmente el flujo sanguíneo, provocando isquemia aguas abajo , o puede obstruirlo por completo, provocando la muerte del tejido aguas abajo .
Las tres categorías amplias de trastornos plaquetarios son "insuficientes", "disfuncionales" y "demasiados". [4] : vii
Algunos medicamentos utilizados para tratar la inflamación tienen el efecto secundario no deseado de suprimir la función plaquetaria normal. Estos son los medicamentos antiinflamatorios no esteroides (AINE). La aspirina altera irreversiblemente la función plaquetaria al inhibir la ciclooxigenasa -1 (COX1) y, por tanto, la hemostasia normal. Las plaquetas resultantes no pueden producir nueva ciclooxigenasa porque no tienen ADN. La función plaquetaria normal no volverá hasta que se deje de usar aspirina y se hayan reemplazado suficientes plaquetas afectadas por otras nuevas, lo que puede tardar más de una semana. El ibuprofeno , otro AINE , no tiene un efecto de tan larga duración, y la función plaquetaria generalmente regresa dentro de las 24 horas, [60] y tomar ibuprofeno antes de la aspirina previene los efectos irreversibles de la aspirina. [61]
Estos medicamentos se utilizan para prevenir la formación de trombos.
La transfusión de plaquetas se utiliza con mayor frecuencia para corregir recuentos de plaquetas inusualmente bajos, ya sea para prevenir hemorragias espontáneas (normalmente en recuentos inferiores a 10×10 9 /L) o en anticipación de procedimientos médicos que necesariamente implicarán algo de hemorragia. Por ejemplo, en pacientes sometidos a cirugía , un nivel inferior a 50 × 10 9 /L se asocia con sangrado quirúrgico anormal, y se evitan los procedimientos anestésicos regionales como la epidural para niveles inferiores a 80 × 10 9 /L. [62] Las plaquetas también se pueden transfundir cuando el recuento de plaquetas es normal pero las plaquetas son disfuncionales, como cuando una persona está tomando aspirina o clopidogrel . [63] Finalmente, las plaquetas se pueden transfundir como parte de un protocolo de transfusión masiva , en el que los tres componentes sanguíneos principales (glóbulos rojos, plasma y plaquetas) se transfunden para tratar una hemorragia grave. La transfusión de plaquetas está contraindicada en la púrpura trombocitopénica trombótica (PTT), ya que alimenta la coagulopatía .

Las plaquetas se aíslan de unidades de sangre completa recolectadas y se combinan para obtener una dosis terapéutica, o se recolectan mediante aféresis de plaquetas : se extrae sangre del donante, se pasa a través de un dispositivo que elimina las plaquetas y el resto se devuelve al donante en un bucle cerrado. El estándar de la industria es que las plaquetas se analicen en busca de bacterias antes de la transfusión para evitar reacciones sépticas, que pueden ser fatales. Recientemente, los Estándares industriales de la AABB para bancos de sangre y servicios de transfusión (5.1.5.1) han permitido el uso de tecnología de reducción de patógenos como alternativa a las pruebas de detección de bacterias en plaquetas. [64]
Las plaquetas de sangre total agrupadas, a veces denominadas plaquetas "aleatorias", se separan mediante uno de dos métodos. [65] En los EE.UU., una unidad de sangre completa se coloca en una centrífuga grande en lo que se conoce como "giro suave". En estas condiciones, las plaquetas permanecen suspendidas en el plasma. El plasma rico en plaquetas (PRP) se extrae de los glóbulos rojos y luego se centrifuga a una velocidad más rápida para recolectar las plaquetas del plasma. En otras regiones del mundo, la unidad de sangre total se centrifuga usando configuraciones que hacen que las plaquetas queden suspendidas en la capa de " capa leucocitaria ", que incluye las plaquetas y los glóbulos blancos. La "capa leucocitaria" se aísla en una bolsa estéril, se suspende en una pequeña cantidad de glóbulos rojos y plasma y luego se centrifuga nuevamente para separar las plaquetas y el plasma de los glóbulos rojos y blancos. Independientemente del método inicial de preparación, se pueden combinar múltiples donaciones en un recipiente utilizando un dispositivo de conexión estéril para fabricar un solo producto con la dosis terapéutica deseada.
Las plaquetas por aféresis se recolectan mediante un dispositivo mecánico que extrae sangre del donante y la centrifuga para separar las plaquetas y otros componentes que se van a recolectar. La sangre restante se devuelve al donante. La ventaja de este método es que una única donación proporciona al menos una dosis terapéutica, a diferencia de las donaciones múltiples de plaquetas de sangre total. Esto significa que un receptor no está expuesto a tantos donantes diferentes y tiene menos riesgo de sufrir enfermedades transmitidas por transfusiones y otras complicaciones. A veces, una persona, como un paciente con cáncer , que requiere transfusiones de plaquetas de rutina, recibirá donaciones repetidas de un donante específico para minimizar aún más el riesgo. La reducción de patógenos en las plaquetas utilizando, por ejemplo, tratamientos con riboflavina y luz ultravioleta , también se puede llevar a cabo para reducir la carga infecciosa de patógenos contenidos en los productos sanguíneos donados, reduciendo así el riesgo de transmisión de enfermedades transmitidas por transfusiones. [66] [67] Se ha desarrollado otro proceso de tratamiento fotoquímico que utiliza amotosaleno y luz UVA para la inactivación de virus, bacterias, parásitos y leucocitos que pueden contaminar los componentes sanguíneos destinados a transfusiones. [68] Además, las plaquetas por aféresis tienden a contener menos glóbulos rojos contaminantes porque el método de recolección es más eficiente que la centrifugación de "giro suave" para aislar el componente sanguíneo deseado.
Las plaquetas recolectadas mediante cualquiera de los métodos tienen una vida útil muy corta, generalmente cinco días. Esto provoca frecuentes problemas de escasez de suministro, ya que probar las donaciones suele requerir hasta un día completo. Dado que no existen soluciones conservantes eficaces para las plaquetas, pierden potencia rápidamente y son mejores cuando están frescas.
Las plaquetas se almacenan bajo agitación constante a 20–24 °C (68–75,2 °F). Las unidades no se pueden refrigerar ya que esto hace que las plaquetas cambien de forma y pierdan función. El almacenamiento a temperatura ambiente proporciona un ambiente donde cualquier bacteria que se introduzca en el componente sanguíneo durante el proceso de recolección puede proliferar y posteriormente causar bacteriemia en el paciente. En los Estados Unidos existen regulaciones que requieren que los productos sean analizados para detectar la presencia de contaminación bacteriana antes de la transfusión. [69]

No es necesario que las plaquetas pertenezcan al mismo grupo sanguíneo ABO que el receptor ni que sean compatibles para garantizar la compatibilidad inmunitaria entre el donante y el receptor, a menos que contengan una cantidad significativa de glóbulos rojos (RBC). La presencia de glóbulos rojos imparte un color naranja rojizo al producto y generalmente se asocia con plaquetas de sangre total. A veces se hace un esfuerzo para emitir plaquetas de un tipo específico, pero esto no es crítico, como lo es con los glóbulos rojos.
Antes de administrar plaquetas al receptor, se pueden irradiar para prevenir la enfermedad de injerto contra huésped asociada a la transfusión o se pueden lavar para eliminar el plasma, si está indicado.
El cambio en el recuento de plaquetas del receptor después de la transfusión se denomina "incremento" y se calcula restando el recuento de plaquetas previo a la transfusión del recuento de plaquetas posterior a la transfusión. Muchos factores afectan el incremento, incluido el tamaño corporal del receptor, la cantidad de plaquetas transfundidas y las características clínicas que pueden causar la destrucción prematura de las plaquetas transfundidas. Cuando los receptores no logran demostrar un incremento postransfusión adecuado, esto se denomina refractariedad a la transfusión de plaquetas .
Las plaquetas, ya sean derivadas de aféresis o de donantes aleatorios, se pueden procesar mediante un proceso de reducción de volumen . En este proceso, las plaquetas se centrifugan en una centrífuga y se elimina el exceso de plasma, dejando de 10 a 100 ml de concentrado de plaquetas. Estas plaquetas de volumen reducido normalmente se transfunden sólo a pacientes neonatales y pediátricos cuando un gran volumen de plasma podría sobrecargar el pequeño sistema circulatorio del niño. El menor volumen de plasma también reduce las posibilidades de una reacción transfusional adversa a las proteínas plasmáticas. [70] Las plaquetas de volumen reducido tienen una vida útil de sólo cuatro horas. [71]
El coágulo de sangre es sólo una solución temporal para detener el sangrado; Se necesita reparación de tejido. Las pequeñas interrupciones en el endotelio se tratan mediante mecanismos fisiológicos; grandes interrupciones por parte del traumatólogo. [72] La fibrina se disuelve lentamente mediante la enzima fibrinolítica, la plasmina, y las plaquetas se eliminan mediante fagocitosis . [73]
Las plaquetas liberan factor de crecimiento derivado de plaquetas (PDGF), un potente agente quimiotáctico ; y TGF beta , que estimula el depósito de matriz extracelular ; factor de crecimiento de fibroblastos , factor de crecimiento similar a la insulina 1 , factor de crecimiento epidérmico derivado de plaquetas y factor de crecimiento endotelial vascular . La aplicación local de estos factores en concentraciones aumentadas a través del plasma rico en plaquetas (PRP) se utiliza como complemento en la cicatrización de heridas. [74]
En lugar de plaquetas, los vertebrados no mamíferos tienen trombocitos nucleados, que se asemejan a los linfocitos B en morfología. Se agregan en respuesta a la trombina, pero no al ADP, la serotonina ni la adrenalina, como lo hacen las plaquetas. [75] [76]
El término trombocito (célula del coágulo) se empezó a utilizar a principios del siglo XX y, a veces, se utiliza como sinónimo de plaqueta; pero no en general en la literatura científica, excepto como raíz de otros términos relacionados con las plaquetas (por ejemplo, trombocitopenia, que significa plaquetas bajas). [4] : v3 El término trombocitos es apropiado para las células mononucleares que se encuentran en la sangre de vertebrados no mamíferos: son el equivalente funcional de las plaquetas, pero circulan como células intactas en lugar de fragmentos citoplasmáticos de megacariocitos de la médula ósea. [4] : 3
En algunos contextos, la palabra trombo se utiliza indistintamente con la palabra coágulo , independientemente de su composición (blanca, roja o mixta). En otros contextos se utiliza para contrastar un coágulo normal de uno anormal: el trombo surge de la hemostasia fisiológica, la trombosis surge de una cantidad patológica y excesiva de coágulo. [88] En un tercer contexto se utiliza para contrastar el resultado del proceso: trombo es el resultado, trombosis es el proceso.
{{cite book}}: Mantenimiento CS1: DOI inactivo a partir de febrero de 2024 ( enlace )