Un mastocito (también conocido como mastocito o labrocito [1] ) es una célula residente del tejido conectivo que contiene muchos gránulos ricos en histamina y heparina . En concreto, es un tipo de granulocito derivado de la célula madre mieloide que forma parte de los sistemas inmunitario y neuroinmunitario . Los mastocitos fueron descubiertos por Paul Ehrlich en 1877. [2] Aunque son más conocidos por su papel en la alergia y la anafilaxia , los mastocitos también desempeñan un importante papel protector, estando íntimamente implicados en la cicatrización de heridas, la angiogénesis , la tolerancia inmunitaria , la defensa contra patógenos y la permeabilidad vascular en los tumores cerebrales. [3] [4]
El mastocito es muy similar, tanto en apariencia como en función, al basófilo , otro tipo de glóbulo blanco . Aunque antes se creía que los mastocitos eran basófilos residentes en los tejidos, se ha demostrado que las dos células se desarrollan a partir de diferentes linajes hematopoyéticos y, por lo tanto, no pueden ser las mismas células. [5]

Los mastocitos son muy similares a los granulocitos basófilos (una clase de glóbulos blancos ) en la sangre , en el sentido de que ambos son células granuladas que contienen histamina y heparina , un anticoagulante . Sus núcleos se diferencian en que el núcleo del basófilo es lobulado mientras que el núcleo del mastocito es redondo. La región Fc de la inmunoglobulina E (IgE) se une a los mastocitos y basófilos, y cuando los parátopos de la IgE se unen a un antígeno, hace que las células liberen histamina y otros mediadores inflamatorios. [6] Estas similitudes han llevado a muchos a especular que los mastocitos son basófilos que se han "localizado" en los tejidos. Además, comparten un precursor común en la médula ósea que expresa la molécula CD34 . Los basófilos abandonan la médula ósea ya maduros, mientras que el mastocito circula en una forma inmadura, madurando solo una vez en un sitio de tejido. El sitio en el que se asienta un mastocito inmaduro probablemente determina sus características precisas. [7] La primera diferenciación y crecimiento in vitro de una población pura de mastocitos de ratón se llevó a cabo utilizando un medio acondicionado derivado de esplenocitos estimulados con concanavalina A. [8] Más tarde, se descubrió que la interleucina 3 derivada de células T era el componente presente en el medio acondicionado que se requería para la diferenciación y el crecimiento de los mastocitos. [9]
Los mastocitos de los roedores se dividen clásicamente en dos subtipos: mastocitos del tejido conectivo y mastocitos mucosos . Las actividades de estos últimos dependen de las células T. [10]
Los mastocitos están presentes en la mayoría de los tejidos, típicamente rodeando los vasos sanguíneos, los nervios y los vasos linfáticos, [11] y son especialmente prominentes cerca de los límites entre el mundo exterior y el medio interno, como la piel , la mucosa de los pulmones y el tracto digestivo , así como la boca , la conjuntiva y la nariz . [7]

Los mastocitos desempeñan un papel clave en el proceso inflamatorio. Cuando se activan, un mastocitos pueden liberar selectivamente ( desgranulación fragmentada ) o liberar rápidamente ( desgranulación anafiláctica ) "mediadores", o compuestos que inducen inflamación, desde los gránulos de almacenamiento al microambiente local. [3] [12] Los mastocitos pueden ser estimulados para desgranularse por alérgenos a través de la reticulación con receptores de inmunoglobulina E (p. ej., FcεRI ), lesiones físicas a través de receptores de reconocimiento de patrones para patrones moleculares asociados a daños (DAMP), patógenos microbianos a través de receptores de reconocimiento de patrones para patrones moleculares asociados a patógenos (PAMP) y varios compuestos a través de sus receptores asociados acoplados a proteína G (p. ej., morfina a través de receptores opioides ) o canales iónicos controlados por ligando . [3] [12] Las proteínas del complemento también pueden activar los receptores de membrana en los mastocitos para ejercer varias funciones. [7]
Los mastocitos expresan un receptor de alta afinidad ( FcεRI ) para la región Fc de la IgE, el miembro menos abundante de los anticuerpos. Este receptor tiene una afinidad tan alta que la unión de las moléculas de IgE es, en esencia, irreversible. Como resultado, los mastocitos están recubiertos de IgE, que es producida por las células plasmáticas (las células productoras de anticuerpos del sistema inmunitario). Los anticuerpos IgE suelen ser específicos para un antígeno en particular .
En las reacciones alérgicas, los mastocitos permanecen inactivos hasta que un alérgeno se une a la IgE que ya recubre la célula. Otros eventos de activación de la membrana pueden preparar a los mastocitos para la desgranulación posterior o actuar en sinergia con la transducción de señales de FcεRI. [13] En general, los alérgenos son proteínas o polisacáridos . El alérgeno se une a los sitios de unión del antígeno, que están situados en las regiones variables de las moléculas de IgE unidas a la superficie del mastocito. Parece que la unión de dos o más moléculas de IgE (entrecruzamiento) es necesaria para activar el mastocito. La agrupación de los dominios intracelulares de los receptores Fc unidos a la célula, que están asociados con las moléculas de IgE entrecruzadas, provoca una secuencia compleja de reacciones dentro del mastocito que conducen a su activación. Aunque esta reacción se entiende mejor en términos de alergia, parece haber evolucionado como un sistema de defensa contra parásitos y bacterias. [14]
Un conjunto único y específico de mediadores de mastocitos se libera a través de la desgranulación después de la activación de los receptores de la superficie celular en los mastocitos. [12] Los ejemplos de mediadores que se liberan al entorno extracelular durante la desgranulación de los mastocitos incluyen: [7] [12] [15]
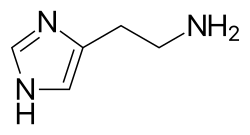
La histamina dilata las vénulas poscapilares, activa el endotelio y aumenta la permeabilidad de los vasos sanguíneos. Esto produce edema local (hinchazón), calor, enrojecimiento y la atracción de otras células inflamatorias hacia el sitio de liberación. También despolariza las terminaciones nerviosas (lo que provoca picazón o dolor ). Los signos cutáneos de la liberación de histamina son la reacción de "brote y roncha ". El bulto y el enrojecimiento inmediatamente después de una picadura de mosquito son un buen ejemplo de esta reacción, que ocurre segundos después de que el mastocito sea atacado por un alérgeno. [7]
Las demás actividades fisiológicas de los mastocitos son mucho menos conocidas. Varias líneas de evidencia sugieren que los mastocitos pueden tener un papel bastante fundamental en la inmunidad innata : son capaces de elaborar una amplia gama de citocinas importantes y otros mediadores inflamatorios como el TNF-α; expresan múltiples "receptores de reconocimiento de patrones" que se cree que participan en el reconocimiento de una amplia variedad de patógenos; y los ratones sin mastocitos parecen ser mucho más susceptibles a una variedad de infecciones. [ cita requerida ]
Los gránulos de los mastocitos contienen una variedad de sustancias químicas bioactivas. Se ha descubierto que estos gránulos se transfieren a las células adyacentes del sistema inmunitario y a las neuronas en un proceso de transgranulación a través de los pseudópodos de los mastocitos . [16]
A diferencia de otras células hematopoyéticas del sistema inmunológico , los mastocitos se producen naturalmente en el cerebro humano , donde interactúan con el sistema neuroinmunitario . [4] En el cerebro, los mastocitos se encuentran en varias estructuras que median funciones sensoriales viscerales (p. ej., dolor) o neuroendocrinas o que se encuentran a lo largo de la barrera sangre-líquido cefalorraquídeo , incluido el tallo pituitario , la glándula pineal , el tálamo y el hipotálamo , el área postrema , el plexo coroideo y en la capa dural de las meninges cerca de los nociceptores meníngeos . [4] Los mastocitos cumplen las mismas funciones generales en el cuerpo y el sistema nervioso central, como efectuar o regular las respuestas alérgicas, la inmunidad innata y adaptativa, la autoinmunidad y la inflamación. [4] [17] En todos los sistemas, los mastocitos sirven como la principal célula efectora a través de la cual los patógenos pueden afectar el eje intestino-cerebro . [18] [19]
En el tracto gastrointestinal, los mastocitos de la mucosa se encuentran muy cerca de las fibras nerviosas sensoriales, que se comunican de forma bidireccional. [20] [18] [19] Cuando estos mastocitos se desgranulan inicialmente, liberan mediadores (p. ej., histamina, triptasa y serotonina) que activan, sensibilizan y regulan positivamente la expresión de la membrana de los nociceptores (es decir, TRPV1 ) en las neuronas aferentes viscerales a través de sus receptores (respectivamente, HRH1 , HRH2 , HRH3 , PAR2 , 5-HT3 ); [20] a su vez, se produce inflamación neurogénica, hipersensibilidad visceral y dismotilidad intestinal (es decir, peristalsis alterada ). [20] La activación neuronal induce la señalización de neuropéptidos ( sustancia P y péptido relacionado con el gen de la calcitonina ) a los mastocitos, donde se unen a sus receptores asociados y desencadenan la desgranulación de un conjunto distinto de mediadores ( β-hexosaminidasa , citocinas , quimiocinas , PGD2 , leucotrienos y eoxinas ). [20] [12]

FcεR1 es un receptor de IgE de alta afinidad que se expresa en la superficie del mastocito. FcεR1 es un tetrámero formado por una cadena alfa (α), una cadena beta (β) y dos cadenas gamma (γ) idénticas unidas por disulfuro. El sitio de unión de la IgE está formado por la porción extracelular de la cadena α que contiene dos dominios similares a la Ig. Un dominio transmembrana contiene un residuo de ácido aspártico y el otro contiene una cola citoplasmática corta. [21] La cadena β contiene un único motivo de activación basado en tirosina del inmunorreceptor ITAM en la región citoplasmática. Cada cadena γ tiene un ITAM en la región citoplasmática. La cascada de señalización del receptor se inicia cuando los ITAM de las cadenas β y γ son fosforilados por una tirosina quinasa. Esta señal es necesaria para la activación de los mastocitos. [22] Las células T auxiliares de tipo 2 ( Th2 ) y muchos otros tipos de células carecen de la cadena β, por lo que la señalización está mediada solo por la cadena γ. Esto se debe a que la cadena α contiene señales de retención del retículo endoplásmico que hacen que las cadenas α permanezcan degradadas en el RE. El ensamblaje de la cadena α con las cadenas β y γ cotransfectadas enmascara la retención en el RE y permite que el complejo α β γ se exporte al aparato de Golgi a la membrana plasmática en ratas. En humanos, solo se necesita el complejo γ para contrarrestar la retención de la cadena α en el RE. [21]
Las señales de reticulación de FcεR1 mediadas por alérgenos son muy similares al evento de señalización que resulta en la unión del antígeno a los linfocitos . La tirosina quinasa Lyn está asociada con el extremo citoplasmático de la cadena β de FcεR1. El antígeno reticula las moléculas de FcεR1 y la tirosina quinasa Lyn fosforila los ITAM en la cadena β y γ de FcεR1 en el citoplasma. Tras la fosforilación , la tirosina quinasa Syk se recluta hacia los ITAM ubicados en las cadenas γ. Esto provoca la activación de la tirosina quinasa Syk, lo que hace que se fosforile. [22] Syk funciona como una actividad de quinasa amplificadora de señales debido al hecho de que se dirige a múltiples proteínas y provoca su activación. [23] Esta fosforilación estimulada por antígenos provoca la activación de otras proteínas en la cascada de señalización mediada por FcεR1. [24]
Una proteína adaptadora importante activada por el paso de fosforilación de Syk es el enlazador para la activación de células T (LAT). LAT puede ser modificado por fosforilación para crear nuevos sitios de unión. [23] La fosfolipasa C gamma (PLCγ) se fosforila una vez unida a LAT, y luego se utiliza para catalizar la degradación del fosfatidilinositol bisfosfato para producir inositol trisfosfato (IP3) y diacilglicerol (DAG). IP3 eleva los niveles de calcio y DAG activa la proteína quinasa C (PKC). Esta no es la única forma en que se produce PKC. La tirosina quinasa FYN fosforila la proteína de unión asociada a Grb2 2 (Gab2), que se une a la fosfoinosítido 3-quinasa , que activa PKC. La PKC activa los movimientos de los gránulos de fosforilación de la cadena ligera de miosina, lo que desmonta los complejos actina-miosina para permitir que los gránulos entren en contacto con la membrana plasmática. [22] El gránulo de mastocitos puede ahora fusionarse con la membrana plasmática. El complejo SNARE del receptor de la proteína de unión a la fusión sensible a la N-etilmaleimida soluble media este proceso. Diferentes proteínas SNARE interactúan para formar diferentes complejos que catalizan la fusión. Las guanosina trifosfatasas Rab3 y las quinasas y fosfatasas asociadas a Rab regulan la fusión de la membrana granular en los mastocitos en reposo.
El receptor acoplado a proteína G específico de mastocitos humanos MRGPRX2 desempeña un papel clave en el reconocimiento de patrones moleculares asociados a patógenos (PAMP) y en el inicio de una respuesta antibacteriana. MRGPRX2 es capaz de unirse al péptido estimulante de competencia (CSP) 1, una molécula de detección de quórum (QSM) producida por bacterias Gram-positivas. [25] Esto conduce a la transducción de señales a una proteína G y la activación del mastocito. La activación del mastocito induce la liberación de mediadores antibacterianos, incluidos ROS, TNF-α y PRGD2, que instituyen el reclutamiento de otras células inmunes para inhibir el crecimiento bacteriano y la formación de biopelículas .
El receptor MRGPRX2 es un posible objetivo terapéutico y puede ser activado farmacológicamente utilizando el compuesto agonista 48/80 para controlar la infección bacteriana. [26] También se plantea la hipótesis de que otros QSM e incluso señales bacterianas Gram-negativas pueden activar este receptor. Esto podría ser particularmente el caso durante las infecciones crónicas por Bartonella donde aparece claramente en la sintomatología humana que todos estos pacientes tienen un síndrome de activación de mastocitos debido a la presencia de una molécula de detección de quórum aún no definida (¿la propia histamina basal?). Esos pacientes son propensos a la intolerancia alimentaria impulsada por otra vía menos específica que la vía del receptor de IgE: ciertamente la vía MRGPRX2. Estos pacientes también muestran patergia cutánea cíclica y dermografismo, cada vez que la bacteria sale de su ubicación intracelular oculta.
Los mastocitos se activan en respuesta a una infección por parásitos patógenos, como ciertos helmintos y protozoos , a través de la señalización de IgE .
Los trastornos de activación de mastocitos ( MCAD ) son un espectro de trastornos inmunes que no están relacionados con la infección patógena e involucran síntomas similares que surgen de los intermediarios secretados por los mastocitos, pero difieren ligeramente en su fisiopatología , enfoque de tratamiento y síntomas distintivos. [27] [28] La clasificación de los trastornos de activación de mastocitos se presentó en 2010. [27] [28]
Las alergias están mediadas a través de la señalización de IgE que desencadena la desgranulación de los mastocitos. [27] Recientemente, se piensa que las reacciones " pseudoalérgicas " independientes de IgE también están mediadas a través de la activación del receptor MRGPRX2 de los mastocitos (por ejemplo, fármacos como relajantes musculares , opioides , Icatibant y fluoroquinolonas ). [29]
Muchas formas de alergia cutánea y mucosa están mediadas en gran parte por mastocitos; desempeñan un papel central en el asma , el eczema , el prurito (por diversas causas), la rinitis alérgica y la conjuntivitis alérgica . Los antihistamínicos actúan bloqueando la acción de la histamina sobre las terminaciones nerviosas. Los fármacos a base de cromoglicato (cromoglicato sódico, nedocromil) bloquean un canal de calcio esencial para la desgranulación de los mastocitos, estabilizando la célula y evitando la liberación de histamina y mediadores relacionados. Los antagonistas de los leucotrienos (como montelukast y zafirlukast ) bloquean la acción de los mediadores de los leucotrienos y se utilizan cada vez más en enfermedades alérgicas. [7]
El calcio desencadena la secreción de histamina de los mastocitos después de una exposición previa al fluoruro de sodio. El proceso secretor se puede dividir en un paso de activación del fluoruro y un paso secretor inducido por calcio. Se observó que el paso de activación del fluoruro va acompañado de una elevación de los niveles de monofosfato de adenosina cíclico (AMPc) dentro de las células. Los altos niveles alcanzados de AMPc persisten durante la liberación de histamina. Se encontró además que las catecolaminas no alteran notablemente la liberación de histamina inducida por el fluoruro. También se confirmó que el segundo paso, pero no el primero, en la secreción de histamina inducida por el fluoruro de sodio es inhibido por la teofilina. [30] La vasodilatación y el aumento de la permeabilidad de los capilares son resultado de los tipos de receptores H1 y H2. [31]
La estimulación de la histamina activa una adenilato ciclasa sensible a la histamina (H2) de las células oxínticas, y hay un aumento rápido del [AMPc] celular que participa en la activación del transporte de H+ y otros cambios asociados de las células oxínticas. [32]
En la anafilaxia (una reacción sistémica grave a alérgenos , como nueces, picaduras de abejas o medicamentos), la desgranulación de los mastocitos en todo el cuerpo produce vasodilatación y, si es grave, síntomas de shock potencialmente mortal . [ cita requerida ]
La histamina es una sustancia vasodilatadora liberada durante la anafilaxia. [31]
Los mastocitos pueden estar implicados en la patología asociada con trastornos inflamatorios autoinmunes de las articulaciones. Se ha demostrado que están involucrados en el reclutamiento de células inflamatorias a las articulaciones (p. ej., artritis reumatoide ) y la piel (p. ej., penfigoide ampolloso ), y esta actividad depende de anticuerpos y componentes del complemento. [33]
La mastocitosis es un trastorno clonal poco frecuente de los mastocitos que implica la presencia de demasiados mastocitos ( mastocitos ) y precursores de mastocitos CD34 +. [34] Las mutaciones en c-Kit están asociadas con la mastocitosis. [27] Más específicamente, la mayoría de los pacientes con mastocitosis tienen una mutación en el codón 816 en el dominio quinasa de KIT, conocida como mutación KIT D816V. [35] Los órganos más comúnmente afectados en la mastocitosis son la piel y la médula ósea. [36]
Los mastocitomas , o tumores de mastocitos, pueden secretar cantidades excesivas de productos de desgranulación. [27] [28] A menudo se observan en perros y gatos. [37] Otros trastornos neoplásicos asociados con los mastocitos incluyen el sarcoma de mastocitos y la leucemia de mastocitos .
El síndrome de activación de mastocitos (MCAS) es un trastorno inmunológico idiopático que implica una desgranulación recurrente y excesiva de mastocitos y que produce síntomas similares a otros trastornos de activación de mastocitos. [27] [28] El síndrome se diagnostica en función de cuatro conjuntos de criterios que incluyen la respuesta al tratamiento, los síntomas, un diagnóstico diferencial y biomarcadores de desgranulación de mastocitos. [27] [28]
Los mastocitos fueron descritos por primera vez por Paul Ehrlich en su tesis doctoral de 1878 basándose en sus características de tinción únicas y sus gránulos grandes. Estos gránulos también lo llevaron a la creencia incorrecta de que existían para nutrir el tejido circundante, por lo que los llamó Mastzellen (del alemán Mast 'engorde', como en el caso de los animales). [38] [39] Ahora se los considera parte del sistema inmunológico .
Las investigaciones sobre la contribución inmunológica al autismo sugieren que los niños con trastorno del espectro autista (TEA) pueden presentar problemas "similares a los alérgicos" en ausencia de niveles elevados de IgE sérica y urticaria crónica , lo que sugiere una activación no alérgica de los mastocitos en respuesta a desencadenantes ambientales y de estrés. Esta activación de los mastocitos podría contribuir a la inflamación cerebral y a los problemas de desarrollo neurológico. [40]
Azul de toluidina : una de las tinciones más comunes para los mucopolisacáridos ácidos y los glicoaminoglicanos , componentes de los gránulos de los mastocitos. [41]
Marrón Bismarck: tiñe los gránulos de los mastocitos de color marrón. [42]
Marcadores de superficie: Heneberg [43] analizó en detalle los marcadores de superficie celular de los mastocitos y afirmó que los mastocitos pueden incluirse inadvertidamente en los aislamientos de células madre o progenitoras, ya que una parte de ellos es positiva para el antígeno CD34. Los marcadores clásicos de los mastocitos incluyen el receptor de IgE de alta afinidad, CD117 (c-Kit) y CD203c (para la mayoría de las poblaciones de mastocitos). La expresión de algunas moléculas puede cambiar durante la activación de los mastocitos. [44]
Los mastocitos y las células enterocromafines son la fuente de la mayor parte de la serotonina en el estómago de los roedores . [45]
Los mastocitos pueden reconocer patógenos a través de diferentes mecanismos, incluida la unión directa de patógenos o sus componentes a receptores PAMP en la superficie de los mastocitos, la unión de anticuerpos o bacterias recubiertas de complemento a receptores de complemento o inmunoglobulina, o el reconocimiento de péptidos endógenos producidos por células infectadas o lesionadas (Hofmann y Abraham 2009). El patrón de expresión de estos receptores varía considerablemente entre los diferentes subtipos de mastocitos. Los TLR (1–7 y 9), los NLR, los RLR y los receptores del complemento son responsables de la mayoría de las respuestas innatas de los mastocitos.
Los mastocitos se originan a partir de un progenitor de la médula ósea y posteriormente desarrollan diferentes características fenotípicas localmente en los tejidos. Su gama de funciones es amplia e incluye la participación en reacciones alérgicas, inmunidad innata y adaptativa, inflamación y autoinmunidad [34]. En el cerebro humano, las MC pueden estar ubicadas en varias áreas, como el tallo hipofisario, la glándula pineal, el área postrema, el plexo coroideo, el tálamo, el hipotálamo y la eminencia media [35]. En las meninges, se encuentran dentro de la capa dural en asociación con vasos y terminales de nociceptores meníngeos [36]. Las MC tienen una característica distintiva en comparación con otras células hematopoyéticas, ya que residen en el cerebro [37]. Las MC contienen numerosos gránulos y secretan una gran cantidad de mediadores prealmacenados, como la hormona liberadora de corticotropina (CRH), la neurotensina (NT), la sustancia P (SP), la triptasa, la quimasa, el péptido intestinal vasoactivo (VIP), el factor de crecimiento endotelial vascular (VEGF), el TNF, las prostaglandinas, los leucotrienos y variedades de quimiocinas y citocinas, algunas de las cuales se sabe que alteran la integridad de la barrera hematoencefálica (BHE) [38-40].
[El] papel clave de las MC en la inflamación [34] y en la alteración de la BHE [41-43] sugiere áreas de importancia para la investigación de nuevas terapias. Cada vez hay más pruebas que indican también que las MC participan en la neuroinflamación directamente [44-46] y a través de la estimulación de la microglía [47], lo que contribuye a la patogénesis de afecciones como los dolores de cabeza [48], el autismo [49] y el síndrome de fatiga crónica [50]. De hecho, una revisión reciente indicó que los estímulos inflamatorios periféricos pueden causar activación de la microglía [51], lo que posiblemente involucre a MC fuera del cerebro.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )Se han descrito dos tipos de desgranulación para MC: desgranulación fragmentada (PMD) y desgranulación anafiláctica (AND) (Figuras 1 y 2). Tanto la PMD como la AND ocurren in vivo, ex vivo e in vitro en MC en humanos (78–82), ratones (83) y ratas (84). La PMD es la liberación selectiva de porciones del contenido de los gránulos, sin fusiones de gránulo a gránulo y/o de gránulo a membrana plasmática. ... A diferencia de la PMD, la AND es la liberación explosiva de los contenidos de los gránulos o de los gránulos enteros al exterior de las células después de las fusiones de gránulo a gránulo y/o de gránulo a membrana plasmática (Figuras 1 y 2). Los estudios ultraestructurales muestran que la AND comienza con la hinchazón de los gránulos y la alteración de la matriz después de la estimulación adecuada (por ejemplo, reticulación con FcεRI).
Los receptores P2X son canales catiónicos no selectivos controlados por ligando que se activan mediante ATP extracelular. ... Es probable que haya mayores concentraciones locales de ATP alrededor de los mastocitos en los tejidos inflamados debido a su liberación a través de la lesión o muerte celular y la activación plaquetaria [40]. Además, los propios mastocitos almacenan ATP dentro de los gránulos secretores, que se libera tras la activación [41]. Por lo tanto, existe la posibilidad de una importante afluencia de Ca2+ a los mastocitos a través de los receptores P2X. Los miembros de la familia P2X difieren tanto en la concentración de ATP que necesitan para su activación como en el grado en que se desensibilizan tras la activación del agonista [37, 38]. Esto abre la posibilidad de que, al expresar varios receptores P2X diferentes, los mastocitos puedan adaptar su respuesta al ATP de una manera dependiente de la concentración [37].
En el tejido digestivo, H. pylori puede alterar la señalización en el eje cerebro-intestino por parte de los mastocitos, el principal efector del eje cerebro-intestino.
Los trastornos gastrointestinales funcionales (TFGI) se caracterizan por molestias crónicas que surgen de interacciones desorganizadas entre el cerebro y el intestino que conducen a dismotilidad e hipersensibilidad. Los dos TFGI más prevalentes, que afectan hasta el 16-26% de la población mundial, son la dispepsia funcional y el síndrome del intestino irritable. ... Está bien establecido que la activación de los mastocitos puede generar disfunción epitelial y neuromuscular y promover hipersensibilidad visceral y patrones de motilidad alterados en los TFGI, el íleo posoperatorio, la alergia alimentaria y la enfermedad inflamatoria intestinal.
▸ Los mastocitos desempeñan un papel fisiopatológico central en el SII y posiblemente en la dispepsia funcional, aunque no está bien definido.
▸ El aumento de la activación de los mastocitos es un hallazgo común en la mucosa de pacientes con trastornos gastrointestinales funcionales. ...
▸ El tratamiento con estabilizadores de mastocitos ofrece una opción razonablemente segura y prometedora para el manejo de aquellos pacientes con SII que no responden a los enfoques convencionales, aunque se justifican estudios futuros para evaluar la eficacia y las indicaciones.
Tabla 1
Clasificación de enfermedades asociadas con la activación de mastocitos de Akin et al. [14]
1. Primaria
a. Anafilaxia con un trastorno clonal de mastocitos asociado
b. Síndrome de activación monoclonal de mastocitos (MMAS), consulte el texto para obtener una explicación
2. Secundaria
a. Trastornos alérgicos
b. Activación de mastocitos asociada con trastornos inflamatorios o neoplásicos crónicos
c. Urticarias físicas (requiere una estimulación primaria)
d. Urticaria autoinmune crónica
3. Idiopática (cuando se ha documentado la desgranulación de los mastocitos; puede ser primaria o secundaria. El angioedema puede estar asociado con angioedema hereditario o adquirido donde puede ser independiente de los mastocitos y resultar de la generación de cinina)
a. Anafilaxia
b. Angioedema
c. Urticaria
d. Síndrome de activación de mastocitos (MCAS)...
La anafilaxia idiopática recurrente se presenta con signos y síntomas alérgicos (urticaria y angioedema, que es una característica distintiva), elimina las etiologías alérgicas identificables, considera la mastocitosis y el síndrome carcinoide, y se trata con antihistamínicos H1 y H2, epinefrina y esteroides [21, 22].