Teleostei ( / ˌtɛl iˈɒs t i aɪ / ; griego teleios " completo" + osteon "hueso"), cuyos miembros son conocidos como teleósteos ( / ˈtɛl iɒs t s , ˈt iː l i - / ) , [ 4 ] es , por lejos , la infraclase más grande en la clase Actinopterygii , los peces con aletas radiadas, [a] y contiene el 96 % de todas las especies existentes de peces . Los teleósteos se organizan en alrededor de 40 órdenes y 448 familias . Se han descrito más de 26.000 especies . Los teleósteos varían desde el pez remo gigante que mide 7,6 m (25 pies) o más, y el pez luna que pesa más de 2 t (2,0 toneladas largas; 2,2 toneladas cortas), hasta el diminuto rape macho Photocorynus spiniceps , de solo 6,2 mm (0,24 pulgadas) de largo. Incluidos no solo los peces con forma de torpedo diseñados para la velocidad, los teleósteos pueden aplanarse vertical u horizontalmente, ser cilindros alargados o adoptar formas especializadas como los rapes y los caballitos de mar .
La diferencia entre los teleósteos y otros peces óseos radica principalmente en sus huesos maxilares; los teleósteos tienen un premaxilar móvil y modificaciones correspondientes en la musculatura de la mandíbula que les permiten sobresalir de la boca . Esto es de gran ventaja, ya que les permite agarrar presas y atraerlas hacia la boca . En los teleósteos más derivados , el premaxilar agrandado es el hueso principal que lleva los dientes, y el maxilar, que está unido a la mandíbula inferior, actúa como una palanca, empujando y tirando del premaxilar cuando se abre y se cierra la boca. Otros huesos más atrás en la boca sirven para triturar y tragar la comida. Otra diferencia es que los lóbulos superior e inferior de la aleta caudal son aproximadamente del mismo tamaño. La espina termina en el pedúnculo caudal , lo que distingue a este grupo de otros peces en los que la espina se extiende hasta el lóbulo superior de la aleta caudal.
Los teleósteos han adoptado una variedad de estrategias reproductivas . La mayoría utiliza la fertilización externa: la hembra pone una tanda de huevos, el macho los fertiliza y las larvas se desarrollan sin ninguna otra intervención parental. Una buena proporción de teleósteos son hermafroditas secuenciales , es decir, comienzan su vida como hembras y pasan a ser machos en algún momento, aunque algunas especies invierten este proceso. Un pequeño porcentaje de teleósteos son vivíparos y algunos proporcionan cuidados parentales, normalmente el pez macho cuida el nido y abanica los huevos para mantenerlos bien oxigenados.
Los teleósteos son económicamente importantes para los seres humanos, como lo demuestra su representación en el arte a lo largo de los siglos. La industria pesquera los captura para su alimentación y los pescadores intentan capturarlos por deporte . Algunas especies se crían con fines comerciales y es probable que este método de producción sea cada vez más importante en el futuro. Otras se mantienen en acuarios o se utilizan en la investigación, especialmente en los campos de la genética y la biología del desarrollo .
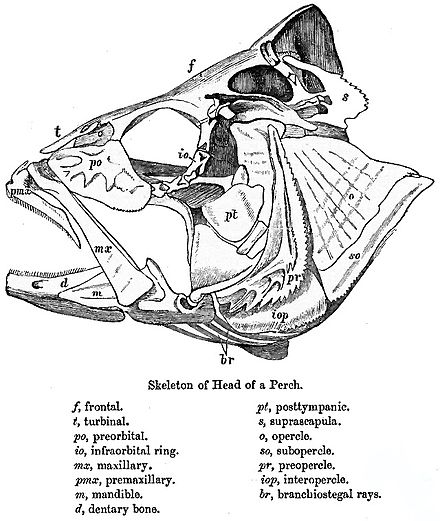
Las características distintivas de los teleósteos son la premaxila móvil , los arcos neurales alargados al final de la aleta caudal y las placas dentaria basibranquiales no apareadas . [6] La premaxila no está unida al neurocráneo (caja cerebral); desempeña un papel en la protrusión de la boca y la creación de una abertura circular. Esto reduce la presión dentro de la boca, succionando la presa hacia adentro. Luego, la mandíbula inferior y la maxila se retraen para cerrar la boca, y el pez puede agarrar la presa . Por el contrario, el mero cierre de las mandíbulas correría el riesgo de empujar la comida fuera de la boca. En los teleósteos más avanzados, la premaxila está agrandada y tiene dientes, mientras que la maxila no tiene dientes. La maxila funciona para empujar tanto la premaxila como la mandíbula inferior hacia adelante. Para abrir la boca, un músculo aductor tira hacia atrás la parte superior de la maxila, empujando la mandíbula inferior hacia adelante. Además, la maxila gira ligeramente, lo que empuja hacia adelante un proceso óseo que se entrelaza con la premaxila. [5]

Las mandíbulas faríngeas de los teleósteos, un segundo conjunto de mandíbulas contenidas dentro de la garganta, están compuestas por cinco arcos branquiales , bucles de hueso que sostienen las branquias . Los primeros tres arcos incluyen un solo basibranquial rodeado por dos hipobranquiales, ceratobranquiales, epibranquiales y faringobranquiales. El basibranquial medio está cubierto por una placa dentaria. El cuarto arco está compuesto por pares de ceratobranquiales y epibranquiales, y a veces además, algunos faringobranquiales y un basibranquial. La base de las mandíbulas faríngeas inferiores está formada por los quintos ceratobranquiales mientras que el segundo, tercero y cuarto faringobranquiales crean la base de la superior. En los teleósteos más basales , las mandíbulas faríngeas constan de partes delgadas bien separadas que se unen al neurocráneo, la cintura escapular y la barra hioidea . Su función se limita al mero transporte de alimentos y dependen principalmente de la actividad de la mandíbula faríngea inferior. En los teleósteos más evolucionados, las mandíbulas son más potentes, con los ceratobranquiales izquierdo y derecho fusionándose para formar una mandíbula inferior; los faringobranquiales se fusionan para crear una gran mandíbula superior que se articula con el neurocráneo. También han desarrollado un músculo que permite que las mandíbulas faríngeas tengan la función de triturar los alimentos además de transportarlos. [7]
La aleta caudal es homocerca , lo que significa que los lóbulos superior e inferior tienen aproximadamente el mismo tamaño. La espina termina en el pedúnculo caudal, la base de la aleta caudal, lo que distingue a este grupo de aquellos en los que la espina se extiende hasta el lóbulo superior de la aleta caudal, como la mayoría de los peces del Paleozoico (hace 541 a 252 millones de años). Los arcos neurales se alargan para formar uroneurales que brindan soporte a este lóbulo superior. [5] Además, los hipurales , huesos que forman una placa aplanada en el extremo posterior de la columna vertebral, se agrandan para brindar mayor soporte a la aleta caudal. [8]
En general, los teleósteos tienden a ser más rápidos y más flexibles que los peces óseos más basales. Su estructura esquelética ha evolucionado hacia una mayor ligereza. Si bien los huesos de los teleósteos están bien calcificados , están construidos a partir de un andamiaje de puntales, en lugar de los densos huesos esponjosos de los peces holosteos . Además, la mandíbula inferior del teleósteo se reduce a solo tres huesos: el dentario , el hueso angular y el hueso articular . [9]
Los teleósteos fueron reconocidos por primera vez como un grupo distinto por el ictiólogo alemán Johannes Peter Müller en 1845. [10] El nombre proviene del griego teleios , "completo" + osteon , "hueso". [11] Müller basó esta clasificación en ciertas características de los tejidos blandos, lo que resultaría problemático, ya que no tuvo en cuenta las características distintivas de los teleósteos fósiles. En 1966, Greenwood et al. proporcionaron una clasificación más sólida. [10] [12] Los fósiles más antiguos de teleosteomorfos (el grupo madre del que evolucionaron más tarde los teleósteos) datan del período Triásico ( Prohalecites , Pholidophorus ). [13] [14] Sin embargo, se ha sugerido que los teleósteos probablemente evolucionaron por primera vez ya durante la era Paleozoica . [15] Durante las eras Mesozoica y Cenozoica se diversificaron ampliamente y, como resultado, el 96% de todas las especies de peces vivientes son teleósteos. [16]
El cladograma a continuación muestra las relaciones evolutivas de los teleósteos con otros clados existentes de peces óseos, [15] y con los vertebrados de cuatro extremidades ( tetrápodos ) que evolucionaron a partir de un grupo relacionado de peces óseos durante el período Devónico . [17] [18] Las fechas de divergencia aproximadas (en millones de años, mya ) son de Near et al., 2012. [15]
La filogenia de los teleósteos ha sido objeto de un largo debate, sin consenso ni sobre su filogenia ni sobre el momento de la aparición de los grupos principales antes de la aplicación del análisis cladístico moderno basado en el ADN . Near et al. (2012) exploraron la filogenia y los tiempos de divergencia de cada linaje principal, analizando las secuencias de ADN de 9 genes no vinculados en 232 especies. Obtuvieron filogenias bien resueltas con un fuerte apoyo a los nodos (por lo que es probable que el patrón de ramificación mostrado sea correcto). Calibraron (establecieron valores reales para) los tiempos de ramificación en este árbol a partir de 36 mediciones confiables de tiempo absoluto del registro fósil. [15] Los teleósteos se dividen en los clados principales que se muestran en el cladograma, [19] con fechas, siguiendo a Near et al. [15] Investigaciones más recientes dividen a los teleósteos en dos grupos principales: Eloposteoglossocephala (Elopomorpha + Osteoglossomorpha) y Clupeocephala (el resto de los teleósteos). [20] [21]
El grupo más diverso de peces teleósteos en la actualidad son los percomorfos, que incluyen, entre otros, al atún , los caballitos de mar , los gobios , los cíclidos , los peces planos , los lábridos , las percas , los rapes y los peces globo . [22] Los teleósteos, y los percomorfos en particular, prosperaron durante la era Cenozoica . La evidencia fósil muestra que hubo un aumento importante en el tamaño y la abundancia de teleósteos inmediatamente después del evento de extinción masiva en el límite Cretácico-Paleógeno ca. 66 millones de años . [23]


Los primeros fósiles asignables a este diverso grupo aparecen en el Triásico Temprano , [24] después del cual los teleósteos acumularon nuevas formas corporales de manera predominantemente gradual durante los primeros 150 millones de años de su evolución [24] ( Triásico Temprano hasta Cretácico Temprano ).
Los teleósteos más basales de la actualidad son los elopomorfos (anguilas y afines) y los osteoglosomorfos (peces elefante y afines). Hay 800 especies de elopomorfos. Tienen larvas delgadas en forma de hoja conocidas como leptocéfalos , especializadas para un entorno marino. Entre los elopomorfos, las anguilas tienen cuerpos alargados con cinturas pélvicas y costillas perdidas y elementos fusionados en la mandíbula superior. Las 200 especies de osteoglosomorfos se definen por un elemento óseo en la lengua. Este elemento tiene un basibranquial detrás, y ambas estructuras tienen dientes grandes que están emparejados con los dientes del parasfenoides en el techo de la boca. El clado Otocephala incluye los clupeiformes (arenques) y los ostariofisis (carpas, bagres y afines). Los clupeiformes consisten en 350 especies actuales de arenques y peces similares. Este grupo se caracteriza por una placa abdominal inusual y una disposición diferente de los hipurales. En la mayoría de las especies, la vejiga natatoria se extiende hasta la caja craneana y desempeña un papel en la audición. Ostariophysis, que incluye a la mayoría de los peces de agua dulce, incluye especies que han desarrollado algunas adaptaciones únicas. [5] Una es el aparato de Weber , una disposición de huesos (huesecillos de Weber) que conecta la vejiga natatoria con el oído interno. Esto mejora su audición, ya que las ondas sonoras hacen vibrar la vejiga y los huesos transportan las vibraciones al oído interno. También tienen un sistema de alarma química ; cuando un pez se lastima, la sustancia de advertencia entra en el agua, alarmando a los peces cercanos. [25]
La mayoría de las especies de teleósteos pertenecen al clado Euteleostei , que consta de 17.419 especies clasificadas en 2.935 géneros y 346 familias. Los rasgos compartidos de los euteleósteos incluyen similitudes en el desarrollo embrionario de las estructuras óseas o cartilaginosas ubicadas entre la cabeza y la aleta dorsal (huesos supraneurales), un crecimiento en el hueso estegural (un hueso ubicado cerca de los arcos neurales de la cola) y cartílagos medianos caudales ubicados entre los hipurales de la base caudal. La mayoría de los euteleósteos están en el clado Neoteleostei . Un rasgo derivado de los neoteleósteos es un músculo que controla las mandíbulas faríngeas, lo que les da un papel en la molienda de alimentos. Dentro de los neoteleósteos, los miembros de Acanthopterygii tienen una aleta dorsal espinosa que está delante de la aleta dorsal de radios blandos. [26] Esta aleta ayuda a proporcionar empuje en la locomoción [27] y también puede desempeñar un papel en la defensa. Los acantomorfos han desarrollado escamas ctenoides espinosas (a diferencia de las escamas cicloides de otros grupos), premaxilas con dientes y mayores adaptaciones para nadar a alta velocidad. [5]
A menudo se piensa que la aleta adiposa , presente en más de 6000 especies de teleósteos, evolucionó una vez en el linaje y se perdió varias veces debido a su función limitada. Un estudio de 2014 desafía esta idea y sugiere que la aleta adiposa es un ejemplo de evolución convergente . En Characiformes , la aleta adiposa se desarrolla a partir de un crecimiento posterior a la reducción del pliegue de la aleta larvaria, mientras que en Salmoniformes , la aleta parece ser un remanente del pliegue. [28]

Hay más de 26.000 especies de teleósteos, en unos 40 órdenes y 448 familias , [29] lo que representa el 96% de todas las especies de peces existentes . [16] Aproximadamente 12.000 del total de 26.000 especies se encuentran en hábitats de agua dulce. [30] Los teleósteos se encuentran en casi todos los entornos acuáticos y han desarrollado especializaciones para alimentarse de diversas formas como carnívoros, herbívoros, filtradores y parásitos . [31] El teleósteo más largo es el pez remo gigante , reportado en 7,6 m (25 pies) y más, [32] pero este es eclipsado por el extinto Leedsichthys , un individuo del cual se ha estimado que tiene una longitud de 27,6 m (91 pies). [33] Se cree que el teleósteo más pesado es el pez luna , con un espécimen capturado en 2003 con un peso estimado de 2,3 t (2,3 toneladas largas; 2,5 toneladas cortas), [34] mientras que el adulto completamente maduro más pequeño es el rape macho Photocorynus spiniceps que puede medir solo 6,2 mm (0,24 pulgadas), aunque la hembra, de 50 mm (2 pulgadas), es mucho más grande. [32] El pez infante robusto es el pez adulto más pequeño y liviano y, de hecho, es el vertebrado más pequeño del mundo; las hembras miden 8,4 mm (0,33 pulgadas) y el macho solo 7 mm (0,28 pulgadas). [35]

Los peces de aguas abiertas suelen tener una forma aerodinámica similar a la de los torpedos para minimizar las turbulencias a medida que se desplazan por el agua. Los peces de arrecife viven en un paisaje submarino complejo y relativamente confinado y, para ellos, la maniobrabilidad es más importante que la velocidad, y muchos de ellos han desarrollado cuerpos que optimizan su capacidad para lanzarse y cambiar de dirección. Muchos tienen cuerpos comprimidos lateralmente (aplanados de lado a lado), lo que les permite encajar en fisuras y nadar a través de espacios estrechos; algunos utilizan sus aletas pectorales para desplazarse y otros ondulan sus aletas dorsal y anal. [36] Algunos peces han desarrollado apéndices dérmicos (piel) para camuflarse ; la chaqueta de cuero espinosa es casi invisible entre las algas a las que se parece y el pez escorpión con borlas acecha invisiblemente en el fondo marino listo para emboscar a sus presas . Algunos, como el pez mariposa de cuatro ojos, tienen manchas oculares para asustar o engañar, mientras que otros, como el pez león, tienen una coloración aposemática para advertir que son tóxicos o tienen espinas venenosas . [37]
Los peces planos son peces demersales (que se alimentan en el fondo) que muestran un mayor grado de asimetría que cualquier otro vertebrado. Las larvas son al principio simétricas bilateralmente, pero sufren una metamorfosis durante el curso de su desarrollo, con un ojo migrando al otro lado de la cabeza, y simultáneamente comienzan a nadar de lado. Esto tiene la ventaja de que, cuando se encuentran en el fondo marino, ambos ojos están arriba, lo que les da un amplio campo de visión. La parte superior suele estar moteada y moteada para camuflarse, mientras que la parte inferior es pálida. [38]


Algunos teleósteos son parásitos. Las rémoras tienen sus aletas dorsales delanteras modificadas en grandes ventosas con las que se aferran a un animal huésped como una ballena , una tortuga marina , un tiburón o una raya , pero esto es probablemente una disposición comensal en lugar de parasitaria porque tanto la rémora como el huésped se benefician de la eliminación de ectoparásitos y escamas sueltas de piel. [39] Más dañinos son los bagres que entran en las cámaras branquiales de los peces y se alimentan de su sangre y tejidos. [40] La anguila chata , aunque generalmente es carroñera , a veces perfora la carne de un pez, y se ha encontrado dentro del corazón de un tiburón mako de aleta corta . [41]

Algunas especies, como las anguilas eléctricas , pueden producir corrientes eléctricas potentes, lo suficientemente fuertes como para aturdir a sus presas. Otros peces, como el pez cuchillo , generan y detectan campos eléctricos débiles para detectar a sus presas; nadan con el lomo recto para evitar distorsionar sus campos eléctricos. Estas corrientes son producidas por células musculares o nerviosas modificadas. [25]
Los teleósteos se encuentran en todo el mundo y en la mayoría de los ambientes acuáticos, incluidos mares cálidos y fríos, agua dulce fluida y estancada , e incluso, en el caso del pez cachorrito del desierto , cuerpos de agua aislados y a veces calientes y salinos en los desiertos. [42] [43] La diversidad de teleósteos se vuelve baja en latitudes extremadamente altas; en la Tierra de Francisco José , hasta 82° N , la cubierta de hielo y las temperaturas del agua por debajo de 0 °C (32 °F) durante gran parte del año limitan el número de especies; el 75 por ciento de las especies que se encuentran allí son endémicas del Ártico. [44]

De los principales grupos de teleósteos, los Elopomorpha, Clupeomorpha y Percomorpha (percas, atunes y muchos otros) tienen una distribución mundial y son principalmente marinos ; los Ostariophysi y Osteoglossomorpha son mundiales pero principalmente de agua dulce , estos últimos principalmente en los trópicos; los Atherinomorpha (guppies, etc.) tienen una distribución mundial, tanto dulce como salada, pero son habitantes de la superficie. Por el contrario, los Esociformes (lucios) se limitan a agua dulce en el hemisferio norte, mientras que los Salmoniformes ( salmón , trucha) se encuentran en zonas templadas del norte y del sur en agua dulce, algunas especies migran hacia y desde el mar. Los Paracanthopterygii (bacalaos, etc.) son peces del hemisferio norte, con especies tanto de agua salada como dulce. [43]
Algunos teleósteos son migratorios; ciertas especies de agua dulce se mueven dentro de los sistemas fluviales anualmente; otras especies son anádromas, pasan su vida en el mar y se desplazan hacia el interior para desovar , siendo el salmón y la lubina rayada algunos ejemplos. Otras, ejemplificadas por la anguila , son catádromas , haciendo lo contrario. [45] La anguila europea de agua dulce migra a través del océano Atlántico como adulta para reproducirse en algas flotantes en el mar de los Sargazos . Los adultos desovan aquí y luego mueren, pero las crías en desarrollo son arrastradas por la Corriente del Golfo hacia Europa. Para cuando llegan, son peces pequeños y entran en estuarios y ascienden ríos, superando obstáculos en su camino para llegar a los arroyos y estanques donde pasan su vida adulta. [46]
Los teleósteos, incluida la trucha marrón y el osmán escamoso, se encuentran en lagos de montaña en Cachemira a altitudes de hasta 3819 m (12 530 pies). [47] Los teleósteos se encuentran en profundidades extremas en los océanos; el pez caracol hadal se ha visto a una profundidad de 7700 m (25 300 pies), y una especie relacionada (sin nombre) se ha visto a 8145 m (26 720 pies). [48] [49]

El principal medio de respiración de los teleósteos, como en la mayoría de los demás peces, es la transferencia de gases a través de la superficie de las branquias, a medida que el agua entra por la boca y se bombea hacia el exterior a través de las branquias. Aparte de la vejiga natatoria , que contiene una pequeña cantidad de aire, el cuerpo no tiene reservas de oxígeno y la respiración debe ser continua durante toda la vida del pez. Algunos teleósteos explotan hábitats donde la disponibilidad de oxígeno es baja, como el agua estancada o el barro húmedo; han desarrollado tejidos y órganos accesorios para apoyar el intercambio de gases en estos hábitats. [50]
Varios géneros de teleósteos han desarrollado independientemente la capacidad de respirar aire, y algunos se han vuelto anfibios . Algunos blénidos dentados emergen para alimentarse en la tierra, y las anguilas de agua dulce pueden absorber oxígeno a través de la piel húmeda. Los saltarines del fango pueden permanecer fuera del agua durante períodos considerables, intercambiando gases a través de la piel y las membranas mucosas de la boca y la faringe. Las anguilas de pantano tienen revestimientos bucales bien vascularizados similares, y pueden permanecer fuera del agua durante días y entrar en un estado de reposo ( estivación ) en el barro. [51] Los anabantoides han desarrollado una estructura respiratoria accesoria conocida como órgano laberíntico en el primer arco branquial y esto se utiliza para la respiración en el aire, y los bagres que respiran aire tienen un órgano suprabranquial similar. Algunos otros bagres, como los Loricariidae , pueden respirar a través del aire retenido en sus tractos digestivos. [52]

Los teleósteos poseen órganos sensoriales altamente desarrollados. Casi todos los peces diurnos tienen una visión del color al menos tan buena como la de un humano normal. Muchos peces también tienen quimiorreceptores responsables de los sentidos agudos del gusto y el olfato. La mayoría de los peces tienen receptores sensibles que forman el sistema de la línea lateral , que detecta corrientes suaves y vibraciones, y percibe el movimiento de los peces y presas cercanas. [53] Los peces perciben los sonidos de diversas formas, utilizando la línea lateral, la vejiga natatoria y, en algunas especies, el aparato weberiano. Los peces se orientan utilizando puntos de referencia y pueden utilizar mapas mentales basados en múltiples puntos de referencia o símbolos. Los experimentos con laberintos muestran que los peces poseen la memoria espacial necesaria para hacer un mapa mental de este tipo. [54]

La piel de un teleósteo es en gran parte impermeable al agua, y la principal interfaz entre el cuerpo del pez y su entorno son las branquias. En agua dulce, los peces teleósteos ganan agua a través de sus branquias por ósmosis , mientras que en agua de mar la pierden. De manera similar, las sales se difunden hacia afuera a través de las branquias en agua dulce y hacia adentro en agua salada. La platija europea pasa la mayor parte de su vida en el mar, pero a menudo migra a estuarios y ríos. En el mar, en una hora, puede ganar iones Na + equivalentes al cuarenta por ciento de su contenido total de sodio libre , con el 75 por ciento de este entrando a través de las branquias y el resto a través de la bebida. Por el contrario, en los ríos hay un intercambio de solo el dos por ciento del contenido corporal de Na + por hora. Además de ser capaz de limitar selectivamente la sal y el agua intercambiadas por difusión, existe un mecanismo activo a través de las branquias para la eliminación de sal en agua de mar y su absorción en agua dulce. [55]
Los peces son animales de sangre fría y, en general, su temperatura corporal es la misma que la de su entorno. Ganan y pierden calor a través de la piel y regulan su circulación en respuesta a los cambios de temperatura del agua aumentando o reduciendo el flujo sanguíneo a las branquias. El calor metabólico generado en los músculos o el intestino se disipa rápidamente a través de las branquias, y la sangre se desvía de las branquias durante la exposición al frío. [56] Debido a su relativa incapacidad para controlar la temperatura de su sangre, la mayoría de los teleósteos solo pueden sobrevivir en un pequeño rango de temperaturas del agua. [57]
Las especies de teleósteos que habitan en aguas más frías tienen una mayor proporción de ácidos grasos insaturados en las membranas de las células cerebrales en comparación con los peces de aguas más cálidas, lo que les permite mantener una fluidez de membrana adecuada en los entornos en los que viven. [58] Cuando se aclimatan al frío, los peces teleósteos muestran cambios fisiológicos en el músculo esquelético que incluyen una mayor densidad mitocondrial y capilar. [59] Esto reduce las distancias de difusión y ayuda en la producción de ATP aeróbico , lo que ayuda a compensar la caída de la tasa metabólica asociada con temperaturas más frías.
El atún y otros peces oceánicos que nadan rápido mantienen sus músculos a temperaturas más altas que su entorno para una locomoción eficiente. [60] El atún alcanza temperaturas musculares de 11 °C (19 °F) o incluso más altas que las del entorno al tener un sistema de contraflujo en el que el calor metabólico producido por los músculos y presente en la sangre venosa, precalienta la sangre arterial antes de que llegue a los músculos. Otras adaptaciones del atún para la velocidad incluyen un cuerpo aerodinámico y en forma de huso, aletas diseñadas para reducir la resistencia , [60] y músculos con un contenido elevado de mioglobina , que les da un color rojizo y permite un uso más eficiente del oxígeno. [61] En las regiones polares y en las profundidades del océano , donde la temperatura está unos pocos grados por encima del punto de congelación, algunos peces grandes, como el pez espada , el marlín y el atún, tienen un mecanismo de calentamiento que eleva la temperatura del cerebro y los ojos, lo que les permite una visión significativamente mejor que sus presas de sangre fría. [62]

El cuerpo de un teleósteo es más denso que el agua, por lo que los peces deben compensar la diferencia o se hundirán. Una característica definitoria de Actinopteri (Chondrostei, Holostei y teleósteos) es la vejiga natatoria . [63] [64] Originalmente presente en el último ancestro común de los teleósteos, desde entonces se ha perdido de forma independiente al menos 30-32 veces en al menos 79 de 425 familias de teleósteos donde la vejiga natatoria está ausente en una o más especies. Esta ausencia es a menudo el caso de peces que nadan rápido como el atún y la caballa . [65] La vejiga natatoria ayuda a los peces a ajustar su flotabilidad a través de la manipulación de los gases, lo que les permite permanecer en la profundidad actual del agua, o ascender o descender sin tener que desperdiciar energía en la natación. En los grupos más primitivos como algunos pececillos , la vejiga natatoria está abierta (fisóstoma) al esófago . En los peces en los que la vejiga natatoria está cerrada (fisoclistos), el contenido de gas se controla a través de la rete mirabilis , una red de vasos sanguíneos que actúa como intercambiador de gases a contracorriente entre la vejiga natatoria y la sangre. [66]

Un pez teleósteo típico tiene un cuerpo aerodinámico para nadar rápido, y la locomoción generalmente se proporciona mediante una ondulación lateral de la parte más posterior del tronco y la cola, impulsando al pez a través del agua. [67] Hay muchas excepciones a este método de locomoción, especialmente donde la velocidad no es el objetivo principal; entre rocas y arrecifes de coral , la natación lenta con gran maniobrabilidad puede ser un atributo deseable. [68] Las anguilas se mueven moviendo todo su cuerpo. Viviendo entre pastos marinos y algas , el caballito de mar adopta una postura erguida y se mueve agitando sus aletas pectorales, y el pez pipa, estrechamente relacionado , se mueve ondulando su aleta dorsal alargada. Los gobios "saltan" a lo largo del sustrato, sosteniéndose y propulsándose con sus aletas pectorales. [69] Los saltarines del fango se mueven de la misma manera en suelo terrestre. [70] En algunas especies, una ventosa pélvica les permite trepar, y el gobio de agua dulce hawaiano trepa cascadas mientras migra. [69] Los rubios tienen tres pares de radios libres en sus aletas pectorales que tienen una función sensorial pero sobre los cuales pueden caminar a lo largo del sustrato. [71] Los peces voladores se lanzan al aire y pueden planear sobre sus aletas pectorales agrandadas por cientos de metros. [72]
La capacidad de producir sonidos para comunicarse parece haber evolucionado de forma independiente en varios linajes de teleósteos. [73] Los sonidos se producen por estridulación o por la vibración de la vejiga natatoria. En los Sciaenidae , los músculos que se adhieren a la vejiga natatoria hacen que oscile rápidamente, creando sonidos de tambor. Los bagres marinos, los caballitos de mar y los roncadores estridulan frotando partes del esqueleto, dientes o espinas. En estos peces, la vejiga natatoria puede actuar como un resonador . Los sonidos de estridulación son predominantemente de 1000 a 4000 Hz , aunque los sonidos modificados por la vejiga natatoria tienen frecuencias inferiores a 1000 Hz. [74] [75]
La mayoría de las especies de teleósteos son ovíparas , es decir, tienen fecundación externa , en la que tanto los óvulos como los espermatozoides se liberan en el agua para su fecundación. La fecundación interna se produce en 500 a 600 especies de teleósteos, pero es más típica de los condrictios y muchos tetrápodos. En esta, el macho insemina a la hembra con un órgano intromitente . [76] Menos de uno de cada millón de huevos fecundados externamente sobrevive para convertirse en un pez maduro, pero hay muchas más posibilidades de supervivencia entre las crías de los miembros de alrededor de una docena de familias que son vivíparas . En estas, los huevos se fecundan internamente y se retienen en la hembra durante el desarrollo. Algunas de estas especies, como los peces de acuario vivíparos de la familia Poeciliidae , son ovovivíparas ; cada huevo tiene un saco vitelino que nutre al embrión en desarrollo y, cuando este se agota, el huevo eclosiona y la larva se expulsa a la columna de agua . Otras especies, como los peces de aletas partidas de la familia Goodeidae , son completamente vivíparas, y el embrión en desarrollo se nutre del suministro de sangre materna a través de una estructura similar a la placenta que se desarrolla en el útero . Algunas especies, como Nomorhamphus ebrardtii , practican la oofagia ; la madre pone huevos no fertilizados de los que se alimentan las larvas en desarrollo en el útero, y se ha informado de canibalismo intrauterino en algunos peces de pico medio . [77]
Existen dos estrategias reproductivas principales de los teleósteos: la semelparidad y la iteroparidad . En la primera, un individuo se reproduce una vez después de alcanzar la madurez y luego muere. Esto se debe a que los cambios fisiológicos que vienen con la reproducción eventualmente conducen a la muerte. [78] Los salmones del género Oncorhynchus son bien conocidos por esta característica; eclosionan en agua dulce y luego migran al mar durante hasta cuatro años antes de viajar de regreso a su lugar de nacimiento donde desovan y mueren. También se sabe que la semelparidad ocurre en algunas anguilas y eperlanos. La mayoría de las especies de teleósteos tienen iteroparidad, donde los individuos maduros pueden reproducirse varias veces durante sus vidas. [79]

El 88 por ciento de las especies de teleósteos son gonocoristas , es decir, tienen individuos que permanecen como machos o hembras durante toda su vida adulta. El sexo de un individuo puede determinarse genéticamente, como en las aves y los mamíferos, o ambientalmente, como en los reptiles. En algunos teleósteos, tanto la genética como el medio ambiente juegan un papel en la determinación del sexo. [80] Para las especies cuyo sexo está determinado por la genética, puede presentarse de tres formas. En la determinación sexual monofactorial, un solo locus determina la herencia sexual. Tanto el sistema de determinación sexual XY como el sistema de determinación sexual ZW existen en las especies de teleósteos. Algunas especies, como el pez platy del sur , tienen ambos sistemas y un macho puede determinarse por XY o ZZ dependiendo de la población. [81]
La determinación sexual multifactorial ocurre en numerosas especies neotropicales e involucra tanto sistemas XY como ZW. Los sistemas multifactoriales involucran reordenamientos de cromosomas sexuales y autosomas. Por ejemplo, el characino darter tiene un sistema multifactorial ZW donde la hembra está determinada por ZW 1 W 2 y el macho por ZZ. El pez lobo tiene un sistema multifactorial XY donde las hembras están determinadas por X 1 X 1 X 2 X 2 y el macho por X 1 X 2 Y. [82] Algunos teleósteos, como el pez cebra , tienen un sistema polifactorial, donde hay varios genes que juegan un papel en la determinación del sexo. [83] La determinación sexual dependiente del ambiente ha sido documentada en al menos 70 especies de teleósteos. La temperatura es el factor principal, pero los niveles de pH, la tasa de crecimiento, la densidad y el entorno social también pueden jugar un papel. Para el pejerrey del Atlántico , el desove en aguas más frías crea más hembras, mientras que las aguas más cálidas crean más machos. [84]
Algunas especies de teleósteos son hermafroditas , lo que puede ocurrir de dos formas: simultánea y secuencial. En la primera, tanto los espermatozoides como los huevos están presentes en las gónadas. El hermafroditismo simultáneo ocurre típicamente en especies que viven en las profundidades del océano, donde las parejas potenciales están escasamente dispersas. [85] [86] La autofecundación es rara y solo se ha registrado en dos especies, Kryptolebias marmoratus y Kryptolebias hermaphroditus . [86] Con el hermafroditismo secuencial, los individuos pueden funcionar como un sexo temprano en su vida adulta y cambiar más tarde en la vida. Las especies con esta condición incluyen peces loro , lábridos , lubinas , pez plano , besugos y peces claros . [85]
La protandria es cuando un individuo comienza siendo macho y se convierte en hembra, mientras que la condición inversa se conoce como protoginia, siendo esta última más común. El cambio de sexo puede ocurrir en varios contextos. En el pez limpiador azul , donde los machos tienen harenes de hasta diez hembras, si se elimina al macho, la hembra más grande y dominante desarrolla un comportamiento similar al masculino y finalmente testifica. Si se la elimina, la siguiente hembra en orden ocupa su lugar. En la especie Anthias squamipinnis , donde los individuos se reúnen en grandes grupos y las hembras superan en gran medida a los machos, si se elimina una cierta cantidad de machos de un grupo, la misma cantidad de hembras cambian de sexo y los reemplazan. En el pez payaso , los individuos viven en grupos y solo los dos más grandes de un grupo se reproducen: la hembra más grande y el macho más grande. Si la hembra muere, el macho cambia de sexo y el siguiente macho más grande ocupa su lugar. [87]
En el rape de aguas profundas (suborden Ceratioidei), el macho, mucho más pequeño, se adhiere permanentemente a la hembra y degenera en un apéndice productor de esperma. La hembra y el macho unido a ella se convierten en una "unidad semihermafrodita". [88]

Existen varios sistemas de apareamiento diferentes entre los teleósteos. Algunas especies son promiscuas , donde tanto los machos como las hembras se reproducen con múltiples parejas y no hay elecciones obvias de pareja. Esto se ha registrado en guppies , arenques del Báltico , meros de Nassau , damisela humbug , cíclidos y lábridos criollos . La poligamia , donde un sexo tiene múltiples parejas, puede presentarse en muchas formas. La poliandria consiste en una hembra adulta que se reproduce con múltiples machos, que solo se reproducen con esa hembra. Esto es raro entre los teleósteos y los peces en general, pero se encuentra en el pez payaso. Además, también puede existir en cierta medida entre los rapes, donde algunas hembras tienen más de un macho unido a ellas. La poligamia , donde un macho se reproduce con múltiples hembras, es mucho más común. Esto se registra en peces luna , esculpinos , dardos , damisela y cíclidos, donde varias hembras pueden visitar a un macho territorial que protege y cuida los huevos y las crías. La poligamia también puede implicar que un macho cuide un harén de varias hembras. Esto ocurre en especies de arrecifes de coral, como los peces damisela, los lábridos, los peces loro, los peces cirujano , los peces ballesta y los blanquillos . [79]
La cría en lek , donde los machos se congregan para exhibirse ante las hembras, se ha registrado en al menos una especie Cyrtocara eucinostomus . También se han registrado sistemas de reproducción similares a los leks en varias otras especies. En las especies monógamas , los machos y las hembras pueden formar vínculos de pareja y reproducirse exclusivamente con sus parejas. Esto ocurre en los bagres de agua dulce de América del Norte, muchos peces mariposa , caballitos de mar y varias otras especies. [79] El cortejo en los teleósteos juega un papel en el reconocimiento de especies, el fortalecimiento de los vínculos de pareja, la posición del sitio de desove y la sincronización de la liberación de gametos. Esto incluye cambios de color, producción de sonidos y exhibiciones visuales (erección de aletas, natación rápida, saltos), que a menudo realiza el macho. El cortejo puede ser realizado por una hembra para vencer a un macho territorial que de otra manera la alejaría. [89]

El dimorfismo sexual existe en algunas especies. Los individuos de un sexo, generalmente los machos, desarrollan características sexuales secundarias que aumentan sus posibilidades de éxito reproductivo . En el pez dorado , los machos tienen cabezas más grandes y romas que las hembras. En varias especies de pececillos, los machos desarrollan cabezas hinchadas y pequeñas protuberancias conocidas como tubérculos reproductivos durante la temporada de reproducción. [90] El pez loro jorobado verde macho tiene una frente mejor desarrollada con una " cresta osificada " que juega un papel en el cabezazo ritualizado. [91] El dimorfismo también puede tomar la forma de diferencias en la coloración. Nuevamente, generalmente son los machos los que tienen colores brillantes; en los peces killi , arcoíris y lábridos, los colores son permanentes, mientras que en especies como los pececillos, espinosos, dardos y peces luna, el color cambia con las estaciones. Dicha coloración puede ser muy visible para los depredadores, lo que demuestra que el impulso de reproducirse puede ser más fuerte que el de evitar la depredación. [90]
Los machos que no han podido cortejar con éxito a una hembra pueden intentar lograr el éxito reproductivo de otras formas. En especies de pez luna, como el pez luna , los machos más grandes y viejos, conocidos como machos parentales, que han cortejado con éxito a una hembra, construyen nidos para los huevos que fertilizan. Los machos satélites más pequeños imitan el comportamiento y la coloración de la hembra para acceder a un nido y fertilizar los huevos. Otros machos, conocidos como machos furtivos, acechan cerca y luego corren rápidamente al nido, fecundando en la carrera. Estos machos son más pequeños que los machos satélite. Los machos furtivos también existen en el salmón Oncorhynchus , donde los machos pequeños que no pudieron establecer una posición cerca de una hembra se lanzan mientras el macho dominante grande está desovando con la hembra. [92]

Los teleósteos pueden desovar en la columna de agua o, más comúnmente, en el sustrato. Los desoves en la columna de agua se limitan principalmente a los arrecifes de coral; los peces se precipitarán hacia la superficie y liberarán sus gametos. Esto parece proteger a los huevos de algunos depredadores y permitirles dispersarse ampliamente a través de las corrientes. No reciben cuidado parental . Los desoves en la columna de agua tienen más probabilidades que los desoves en el sustrato de desovar en grupos. El desove en el sustrato ocurre comúnmente en nidos, grietas de rocas o incluso madrigueras. Algunos huevos pueden adherirse a varias superficies como rocas, plantas, madera o conchas. [93]

De los teleósteos ovíparos, la mayoría (79 por ciento) no proporciona cuidado parental. [94] El cuidado masculino es mucho más común que el femenino. [94] [95] La territorialidad masculina "preadapta" una especie para desarrollar el cuidado parental masculino. [96] [97] Un ejemplo inusual de cuidado parental femenino es en los discos , que proporcionan nutrientes para sus crías en desarrollo en forma de moco. [98] Algunas especies de teleósteos tienen sus huevos o crías adheridas a sus cuerpos o transportadas en ellos. En el caso de los bagres marinos , los peces cardenal , los peces mandíbula y algunos otros, el huevo puede incubarse o transportarse en la boca, una práctica conocida como incubación bucal . En algunos cíclidos africanos, los huevos pueden fertilizarse allí. En especies como el ácara bandeado, las crías son incubadas después de que nacen y esto puede ser realizado por ambos padres. El momento de la liberación de las crías varía entre especies; algunos incubadores bucales liberan a las crías recién nacidas mientras que otros pueden mantenerlas hasta que son juveniles. Además de la incubación bucal, algunos teleósteos también han desarrollado estructuras para transportar a sus crías. Los peces vivero machos tienen un gancho óseo en la frente para transportar los huevos fertilizados; permanecen en el anzuelo hasta que eclosionan. En el caso de los caballitos de mar, el macho tiene una bolsa de incubación donde la hembra deposita los huevos fertilizados y estos permanecen allí hasta que se convierten en juveniles que nadan libremente. Las hembras de los bagres banjo tienen estructuras en el vientre a las que se adhieren los huevos. [99]
En algunas especies reproductoras, las crías de una camada de desove anterior pueden permanecer con sus padres y ayudar a cuidar a las nuevas crías. Se sabe que esto ocurre en alrededor de 19 especies de cíclidos en el lago Tanganyika . Estos ayudantes participan en la limpieza y abanicado de huevos y larvas, limpiando el agujero de cría y protegiendo el territorio. Tienen una tasa de crecimiento reducida pero obtienen protección contra los depredadores. El parasitismo de cría también existe entre los teleósteos; los pececillos pueden desovar en nidos de peces luna, así como en nidos de otras especies de pececillos. El bagre cuco es conocido por poner huevos en el sustrato mientras los cíclidos que incuban bucalmente recogen los suyos y los bagres jóvenes se comerán las larvas de cíclidos. El canibalismo filial ocurre en algunas familias de teleósteos y puede haber evolucionado para combatir la inanición. [100]

Los teleósteos tienen cuatro etapas de vida principales: el huevo, la larva, el juvenil y el adulto. Las especies pueden comenzar su vida en un entorno pelágico o en un entorno demersal (cerca del lecho marino). La mayoría de los teleósteos marinos tienen huevos pelágicos, que son ligeros, transparentes y flotantes con envolturas delgadas. Los huevos pelágicos dependen de las corrientes oceánicas para dispersarse y no reciben cuidado parental. Cuando eclosionan, las larvas son planctónicas y no pueden nadar. Tienen un saco vitelino adherido a ellas que les proporciona nutrientes. La mayoría de las especies de agua dulce producen huevos demersales que son gruesos, pigmentados, relativamente pesados y capaces de adherirse a los sustratos. El cuidado parental es mucho más común entre los peces de agua dulce. A diferencia de sus contrapartes pelágicas, las larvas demersales pueden nadar y alimentarse tan pronto como eclosionan. [85] Los teleósteos larvarios a menudo se ven muy diferentes de los adultos, particularmente en las especies marinas. Algunas larvas incluso se consideraban especies diferentes de los adultos. Las larvas tienen altas tasas de mortalidad, la mayoría muere de hambre o depredación durante su primera semana. A medida que crecen, aumentan las tasas de supervivencia y hay mayor tolerancia y sensibilidad fisiológica, competencia ecológica y conductual. [101]
En la etapa juvenil, un teleósteo se parece más a su forma adulta. En esta etapa, su esqueleto axial , órganos internos, escamas, pigmentación y aletas están completamente desarrollados. La transición de larva a juvenil puede ser corta y bastante simple, durando minutos u horas como en algunos peces damisela, mientras que en otras especies, como el salmón, el pez ardilla , los gobios y los peces planos, la transición es más compleja y tarda varias semanas en completarse. [102] En la etapa adulta, un teleósteo puede producir gametos viables para la reproducción. Como muchos peces, los teleósteos continúan creciendo durante toda su vida. La longevidad depende de la especie, y algunos peces de caza como la perca europea y la lubina negra viven hasta 25 años. Los peces roca parecen ser los teleósteos más longevos, y algunas especies viven más de 100 años. [103]

Muchos teleósteos forman cardúmenes , que cumplen múltiples propósitos en diferentes especies. La formación de cardúmenes es a veces una adaptación antidepredadora , que ofrece una mejor vigilancia contra los depredadores. A menudo es más eficiente recolectar alimentos trabajando en grupo, y los peces individuales optimizan sus estrategias al elegir unirse o abandonar un cardumen. Cuando se detecta un depredador, los peces presa responden a la defensiva, lo que da lugar a comportamientos colectivos de cardumen, como movimientos sincronizados. Las respuestas no consisten solo en intentar esconderse o huir; las tácticas antidepredadoras incluyen, por ejemplo, dispersarse y reunirse. Los peces también se agrupan en cardúmenes para desovar. [104]

Los teleósteos son económicamente importantes de diferentes maneras. Se capturan para consumo humano en todo el mundo. Un pequeño número de especies, como el arenque , el bacalao , el abadejo , la anchoa , el atún y la caballa, proporcionan a la población millones de toneladas de alimentos al año, mientras que muchas otras especies se pescan en cantidades más pequeñas. [105] Proporcionan una gran proporción de los peces capturados para deporte . [106] La pesca comercial y recreativa en conjunto proporcionan empleo a millones de personas. [107]
Un pequeño número de especies productivas, entre ellas la carpa, el salmón, [108] la tilapia y el bagre, se crían con fines comerciales y producen millones de toneladas de alimentos ricos en proteínas al año. La Organización de las Naciones Unidas para la Agricultura y la Alimentación espera que la producción aumente drásticamente, de modo que para 2030, tal vez el sesenta y dos por ciento de los peces destinados al consumo humano se criarán en granjas. [109]
El pescado se consume fresco o se puede conservar mediante métodos tradicionales, que incluyen combinaciones de secado, ahumado y salazón , o fermentación . [110] Los métodos modernos de conservación incluyen la congelación, la liofilización y el procesamiento térmico (como en el enlatado ). Los productos de pescado congelados incluyen filetes empanados o rebozados , palitos de pescado y croquetas de pescado . La harina de pescado se utiliza como complemento alimenticio para los peces de piscifactoría y para el ganado. Los aceites de pescado se elaboran a partir del hígado de pescado, especialmente rico en vitaminas A y D , o de los cuerpos de pescados grasos como la sardina y el arenque, y se utilizan como complementos alimenticios y para tratar deficiencias vitamínicas. [111]
Algunas especies más pequeñas y coloridas sirven como especímenes de acuario y mascotas . Los lobos marinos se utilizan en la industria del cuero. La cola de pescado se obtiene a partir de peces hilo y peces tambor. [106]

Las actividades humanas han afectado a las poblaciones de muchas especies de teleósteos, a través de la sobrepesca , [112] la contaminación y el calentamiento global . Entre muchos casos registrados, la sobrepesca causó el colapso total de la población de bacalao del Atlántico frente a Terranova en 1992, lo que llevó al cierre indefinido de la pesquería de Canadá. [113] La contaminación, especialmente en los ríos y a lo largo de las costas, ha dañado a los teleósteos ya que las aguas residuales, los pesticidas y los herbicidas han ingresado al agua. Muchos contaminantes, como los metales pesados , los organoclorados y los carbamatos , interfieren con la reproducción de los teleósteos, a menudo al alterar sus sistemas endocrinos . En la cucaracha , la contaminación del río ha causado la condición intersexual, en la que las gónadas de un individuo contienen células que pueden producir gametos masculinos (como las espermatogonias ) y células que pueden producir gametos femeninos (como las ovogonias ). Dado que la alteración endocrina también afecta a los humanos, los teleósteos se utilizan para indicar la presencia de tales sustancias químicas en el agua. La contaminación del agua provocó la extinción local de poblaciones de teleósteos en muchos lagos del norte de Europa en la segunda mitad del siglo XX. [114]
Los efectos del cambio climático sobre los teleósteos pueden ser poderosos, pero complejos. Por ejemplo, el aumento de las precipitaciones invernales (lluvia y nieve) podría dañar las poblaciones de peces de agua dulce en Noruega, mientras que los veranos más cálidos podrían aumentar el crecimiento de los peces adultos. [115] En los océanos, los teleósteos pueden ser capaces de hacer frente al calentamiento, ya que es simplemente una extensión de la variación natural del clima. [116] No se sabe con certeza cómo la acidificación de los océanos , causada por el aumento de los niveles de dióxido de carbono, podría afectar a los teleósteos. [117]

Algunos teleósteos son peligrosos. Algunos, como el bagre cola de anguila ( Plotosidae ), el pez escorpión ( Scorpaenidae ) o el pez piedra ( Synanceiidae ) tienen espinas venenosas que pueden herir gravemente o matar a los humanos. Algunos, como la anguila eléctrica y el bagre eléctrico , pueden dar una descarga eléctrica severa . Otros, como la piraña y la barracuda , tienen una mordedura poderosa y a veces han atacado a bañistas humanos. [106] Los informes indican que algunos de la familia de los bagres pueden ser lo suficientemente grandes como para atacar a bañistas humanos .
El pez medaka y el pez cebra se utilizan como modelos de investigación para estudios de genética y biología del desarrollo . El pez cebra es el vertebrado de laboratorio más utilizado, [106] ofreciendo las ventajas de similitud genética con los mamíferos, tamaño pequeño, necesidades ambientales simples, larvas transparentes que permiten imágenes no invasivas, abundante descendencia, crecimiento rápido y la capacidad de absorber mutágenos agregados a su agua. [118]
Los peces teleósteos han sido temas frecuentes en el arte, lo que refleja su importancia económica, durante al menos 14.000 años. Se trabajaron comúnmente en patrones en el Antiguo Egipto , adquiriendo significado mitológico en la Antigua Grecia y Roma , y de allí en el cristianismo como símbolo religioso ; los artistas de China y Japón también usan imágenes de peces simbólicamente. Los teleósteos se volvieron comunes en el arte renacentista , y las pinturas de naturalezas muertas alcanzaron un pico de popularidad en los Países Bajos en el siglo XVII . En el siglo XX, diferentes artistas como Klee , Magritte , Matisse y Picasso utilizaron representaciones de teleósteos para expresar temas radicalmente diferentes, desde atractivos hasta violentos. [119] El zoólogo y artista Ernst Haeckel pintó teleósteos y otros animales en su Kunstformen der Natur de 1904 . Haeckel había sido convencido por Goethe y Alexander von Humboldt de que al hacer representaciones precisas de formas naturales desconocidas, como las de los océanos profundos, no sólo podría descubrir "las leyes de su origen y evolución, sino también llegar a las partes secretas de su belleza mediante bocetos y pinturas". [120]
{{cite book}}: CS1 maint: multiple names: authors list (link)