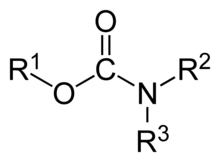
En química orgánica , un carbamato es una categoría de compuestos orgánicos con la fórmula general R 2 NC(O)OR y estructura >N−C(=O)−O− , que se derivan formalmente del ácido carbámico ( NH 2 COOH ). El término incluye compuestos orgánicos (por ejemplo, el éster carbamato de etilo ), obtenidos formalmente reemplazando uno o más átomos de hidrógeno por otros grupos funcionales orgánicos ; así como sales con el anión carbamato H 2 NCOO − (p. ej. carbamato de amonio ). [1]
Los polímeros cuyas unidades repetidas están unidas por grupos similares a carbamato −NH−C(=O)−O− son una importante familia de plásticos , los poliuretanos . Ver Etimología para mayor aclaración.
Si bien los ácidos carbámicos son inestables, muchos ésteres y sales de carbamato son estables y bien conocidos. [2]
En soluciones acuosas, el anión carbamato se equilibra lentamente con el NH3 de amonio. +
4catión y el carbonato CO2-3
_o bicarbonato HCO−
3aniones: [3] [4] [5]
El carbamato de calcio es soluble en agua, mientras que el carbonato de calcio no lo es. Agregar una sal de calcio a una solución de carbamato/carbonato de amonio precipitará algo de carbonato de calcio inmediatamente y luego precipitará lentamente más a medida que el carbamato se hidroliza. [3]
La sal carbamato de amonio se genera mediante el tratamiento de amoníaco con dióxido de carbono : [6]
Los ésteres de carbamato también surgen mediante alcohólisis de cloruros de carbamoilo : [1]
Alternativamente, se pueden formar carbamatos a partir de cloroformiatos y aminas : [7]
Los carbamatos pueden formarse a partir del reordenamiento de Curtius , donde los isocianatos formados reaccionan con un alcohol. [7]
En la naturaleza, el dióxido de carbono puede unirse con grupos amina neutros para formar un carbamato; esta modificación postraduccional se conoce como carbamilación. Se sabe que esta modificación ocurre en varias proteínas importantes; vea los ejemplos a continuación. [8]
Los grupos amino N-terminales de los residuos de valina en las cadenas α y β de la desoxihemoglobina existen como carbamatos. Ayudan a estabilizar la proteína cuando se convierte en desoxihemoglobina y aumentan la probabilidad de liberación de las moléculas de oxígeno restantes unidas a la proteína. Este efecto estabilizador no debe confundirse con el efecto Bohr (un efecto indirecto provocado por el dióxido de carbono). [9]
Los grupos ε-amino de los residuos de lisina en la ureasa y la fosfotriesterasa también contienen carbamato. El carbamato derivado del aminoimidazol es un intermediario en la biosíntesis de la inosina . El carbamoil fosfato se genera a partir de carboxifosfato en lugar de CO 2 . [10]
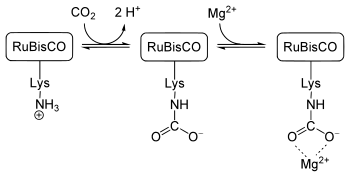
Quizás el carbamato más frecuente sea el que interviene en la captura de CO 2 por las plantas. Este proceso es necesario para su crecimiento. La enzima ribulosa 1,5-bisfosfato carboxilasa/oxigenasa (RuBisCO) fija una molécula de dióxido de carbono en forma de fosfoglicerato en el ciclo de Calvin . En el sitio activo de la enzima, un ion Mg 2+ está unido a residuos de glutamato y aspartato , así como a un carbamato de lisina. El carbamato se forma cuando una cadena lateral de lisina descargada cerca del ion reacciona con una molécula de dióxido de carbono del aire ( no la molécula de dióxido de carbono del sustrato), lo que luego la vuelve cargada y, por lo tanto, capaz de unirse al ion Mg 2+ . [11]
Aunque no suele aislarse como tal, la sal carbamato de amonio se produce a gran escala como intermediario en la producción del producto químico urea a partir de amoníaco y dióxido de carbono . [1]
Los poliuretanos contienen múltiples grupos carbamato como parte de su estructura. El "uretano" en el nombre "poliuretano" se refiere a estos grupos carbamato; El término "enlaces de uretano" describe cómo se polimerizan los carbamatos . [Requiere citación] Por el contrario, la sustancia comúnmente llamada "uretano", carbamato de etilo , no es un componente de los poliuretanos ni se utiliza en su fabricación. [Requiere citación] Los uretanos generalmente se forman mediante la reacción de un alcohol con un isocianato . [Requiere citación] Comúnmente, los uretanos producidos por una ruta sin isocianatos se denominan carbamatos . [Requiere citación]
Los polímeros de poliuretano tienen una amplia gama de propiedades y están disponibles comercialmente como espumas, elastómeros y sólidos. Normalmente, los polímeros de poliuretano se obtienen combinando diisocianatos, por ejemplo, diisocianato de tolueno , y dioles , donde los grupos carbamato se forman por reacción de los alcoholes con los isocianatos : [12]

Los insecticidas denominados carbamatos presentan el grupo funcional éster carbamato. Se incluyen en este grupo el aldicarb ( Temik ), el carbofurano (Furadan), el carbarilo (Sevin), el etienocarb , el fenobucarb , el oxamil y el metomilo . Estos insecticidas matan insectos al inactivar reversiblemente la enzima acetilcolinesterasa (inhibición de la AChE) [13] ( modo de acción IRAC 1a). [14] Los pesticidas organofosforados también inhiben esta enzima, aunque de forma irreversible, y causan una forma más grave de intoxicación colinérgica [15] (el similar IRAC MoA 1b). [14]
El fenoxicarb tiene un grupo carbamato pero actúa como un imitador de la hormona juvenil , en lugar de inactivar la acetilcolinesterasa. [dieciséis]
El repelente de insectos icaridina es un carbamato sustituido. [17]
Además de su uso común como artropodocidas/insecticidas, también son nematicidas . [18] Uno de ellos es Oxamil . [18]
Las ventas han disminuido drásticamente en las últimas décadas. [18]
Entre las mutaciones en esterasas , la resistencia a los carbamatos más comúnmente implica la desensibilización a la acetilcolinesterasa (AChE), mientras que la resistencia a los organofosforados más comúnmente es la metabolización de la carboxilesterasa . [19]
Si bien los inhibidores de carbamato acetilcolinesterasa se conocen comúnmente como "insecticidas de carbamato" debido a su generalmente alta selectividad por las enzimas acetilcolinesterasa de insectos en comparación con las versiones de mamíferos, los compuestos más potentes como el aldicarb y el carbofurano todavía son capaces de inhibir las enzimas acetilcolinesterasa de mamíferos en concentraciones suficientemente bajas. que representan un riesgo significativo de envenenamiento para los humanos, especialmente cuando se usan en grandes cantidades para aplicaciones agrícolas. Se sabe que otros inhibidores de la acetilcolinesterasa a base de carbamato tienen una toxicidad aún mayor para los humanos, y algunos, como el T-1123 y el EA-3990, fueron investigados para su posible uso militar como agentes nerviosos . Sin embargo, dado que todos los compuestos de este tipo tienen un grupo amonio cuaternario con una carga positiva permanente, tienen una mala penetración en la barrera hematoencefálica y además sólo son estables como sales cristalinas o soluciones acuosas, por lo que no se consideró que tuvieran propiedades adecuadas para armamentismo. [20] [21]
El butilcarbamato de yodopropinilo es un conservante de madera y pinturas y se utiliza en cosmética. [22]
Algunos de los grupos protectores de aminas más comunes, como BOC , [23] FMOC , [24] cloroformiato de bencilo [25] y cloroformiato de tricloroetilo [26] son carbamatos.
El uretano ( carbamato de etilo ) alguna vez se produjo comercialmente en los Estados Unidos como agente de quimioterapia y para otros fines medicinales. Se descubrió que era tóxico y en gran medida ineficaz. [27] Ocasionalmente se utiliza en medicina veterinaria en combinación con otros medicamentos para producir anestesia . [28]
Además, algunos carbamatos se utilizan en farmacoterapia humana , por ejemplo, los inhibidores de la acetilcolinesterasa neostigmina y rivastigmina , cuya estructura química se basa en el alcaloide natural fisostigmina . Otros ejemplos son el meprobamato y sus derivados como carisoprodol , felbamato , mebutamato , fenprobamato y tibamato , una clase de fármacos ansiolíticos y relajantes musculares ampliamente utilizados en la década de 1960 antes del auge de las benzodiacepinas, y que todavía se utilizan hoy en día en algunos casos. El carbacol se utiliza principalmente para diversos fines oftálmicos. [29]
El inhibidor de la proteasa darunavir para el tratamiento del VIH también contiene un grupo funcional carbamato. [30]
El efedroxano , un análogo del aminorex utilizado como estimulante , también entra en la categoría de carbamato. [31]
Además de inhibir la acetilcolinesterasa humana [32] (aunque en menor grado que la enzima de los insectos), los insecticidas carbamato también atacan a los receptores de melatonina humanos. [33] Los efectos de los carbamatos sobre la salud humana están bien documentados en la lista de compuestos disruptores endocrinos conocidos. [34] Los efectos clínicos de la exposición a carbamatos pueden variar desde ligeramente tóxicos hasta altamente tóxicos dependiendo de una variedad de factores que incluyen la dosis y la vía de exposición con ingestión e inhalación, lo que da como resultado los efectos clínicos más rápidos. [34] Estas manifestaciones clínicas de la intoxicación por carbamato son signos muscarínicos, signos nicotínicos y, en casos raros, signos del sistema nervioso central. [34]
Hay dos átomos de oxígeno en un carbamato ( 1 ), ROC(=O)NR 2 , y uno o ambos de ellos pueden ser reemplazados conceptualmente por azufre . Los análogos de los carbamatos en los que solo uno de los oxígenos es reemplazado por azufre se denominan tiocarbamatos ( 2 y 3 ). Los carbamatos con ambos oxígenos reemplazados por azufre se llaman ditiocarbamatos ( 4 ), RSC(=S)NR 2 . [35]
Hay dos tipos diferentes de tiocarbamato estructuralmente isoméricos :
Los O -tiocarbamatos pueden isomerizarse a S -tiocarbamatos, por ejemplo en el reordenamiento de Newman-Kwart . [37]
La etimología de las palabras "uretano" y "carbamato" son muy similares pero no iguales. La palabra "uretano" fue acuñada por primera vez en 1833 por el químico francés Jean-Baptiste Dumas. [38] [39] Dumas afirma: "Uretano. El nuevo éter, puesto en contacto con amoníaco líquido y concentrado, ejerce sobre esta sustancia una reacción tan fuerte que la mezcla hierve y, a veces, incluso produce una especie de explosión. Si el amoníaco se en exceso, todo el éter desaparece. Se forma clorhidrato de amonio y una nueva sustancia dotada de interesantes propiedades." [39] Dumas parece estar nombrando a este compuesto uretano. Sin embargo, Dumas afirma más tarde: "A la espera de que se decida la opinión sobre la naturaleza de este cuerpo, propongo designar con los nombres de uretano y oxametano los dos materiales que acabo de estudiar y que considero como tipos de una nueva familia. entre las sustancias nitrogenadas ... Estos nombres, que a mi juicio no prejuzgan nada en la cuestión del alcohol y de los éteres, tendrán al menos la ventaja de satisfacer a los químicos que todavía se niegan a aceptar nuestra teoría." [39] La palabra uretano se deriva de las palabras "urea" y "éter" con el sufijo "-ane" como sufijo químico genérico, lo que la hace específica para R2NC(=O)OR' (R' not = H) estructura de unión. [40]
El uso de la palabra "carbamato" parece venir más tarde y sólo se remonta al menos a 1849, en una descripción del trabajo de Dumas realizada por Henry Medlock. [41] Medlock afirma: "Es bien sabido que la acción del amoníaco sobre el clorocarbonato (fosgeno) de etilo da lugar a la formación de la sustancia que Dumas, el descubridor, llamó uretano, y que ahora tenemos la costumbre de considerando como el éter del ácido carbámico." [41] Esto sugiere que en lugar de continuar con la convención de nomenclatura de la familia de uretanos que acuñó Dumas, alteraron la convención de nomenclatura a éter etílico de ácido carbámico. El carbamato se deriva de las palabras "carbamida", también conocida como urea, y "-ate", un sufijo que indica la sal o éster de un ácido. [42] [43]
Ambas palabras tienen raíces derivadas de la urea. El carbamato es menos específico porque el sufijo -ato es ambiguo para la sal o el éster de un ácido carbámico. Sin embargo, el sufijo -ate también es más específico porque sugiere que los carbamatos deben derivarse del ácido carbamato o ácidos carbámicos . Aunque un uretano tiene la misma estructura química que un resto de éster carbamato, un uretano que no deriva de un ácido carbámico no es un éster carbamato. En otras palabras, cualquier síntesis del resto R2NC(=O)OR' (R' no = H) que no derive de ácidos carbámicos no es un éster carbamato sino un uretano. Además, los ésteres de carbamato son uretanos, pero no todos los uretanos son ésteres de carbamato. Esto sugiere además que los poliuretanos no son simplemente ésteres de policarbamato porque los poliuretanos normalmente no se sintetizan utilizando ácidos carbámicos.
La IUPAC afirma que "los ésteres a menudo se denominan uretanos o uretanos, un uso que es estrictamente correcto sólo para los ésteres etílicos". [44] Pero también establece: "Un término alternativo para los compuestos R2NC(=O)OR' (R' not = H), ésteres de ácidos carbámicos, R,NC(=O)OH, en uso estricto limitado al grupo etílico ésteres, pero ampliamente utilizados en el sentido general". [45] La IUPAC proporciona estas declaraciones sin citarlas.
{{cite book}}: Mantenimiento CS1: otros ( enlace )