Los moduladores selectivos del receptor de estrógeno ( SERM ), también conocidos como agonistas/antagonistas del receptor de estrógeno ( ERAA ), [1] [2] son una clase de fármacos que actúan sobre los receptores de estrógeno (ER). [3] En comparación con los agonistas - antagonistas puros del ER (p. ej., agonistas completos y antagonistas silenciosos ), los SERM son más específicos del tejido, lo que les permite inhibir o estimular selectivamente la acción similar al estrógeno en varios tejidos.
Los SERM se utilizan para diversas enfermedades relacionadas con los estrógenos, incluido el tratamiento de la disfunción ovulatoria en el tratamiento de la infertilidad , la prevención de la osteoporosis posmenopáusica , el tratamiento y la reducción del riesgo de cáncer de mama [4] y el tratamiento de la dispareunia debido a la menopausia . Los SERM también se utilizan en combinación con estrógenos conjugados indicados para el tratamiento de los síntomas de deficiencia de estrógenos y de los síntomas vasomotores asociados con la menopausia. [5]

El tamoxifeno es un tratamiento hormonal de primera línea para el cáncer de mama metastásico con receptores de estrógenos positivos . Se utiliza para reducir el riesgo de cáncer de mama en mujeres con alto riesgo y como tratamiento adyuvante para el carcinoma ductal in situ con ganglios linfáticos negativos y con ganglios linfáticos positivos . [5] [6] El tratamiento con tamoxifeno también se utiliza para el tratamiento de la osteoporosis y los lípidos sanguíneos en mujeres posmenopáusicas. Los efectos adversos del tamoxifeno incluyen sofocos y un aumento del riesgo de desarrollar cáncer de endometrio en comparación con mujeres de edad similar. [6] [4]
El toremifeno , un derivado clorado del tamoxifeno desarrollado para evitar carcinomas hepáticos , se asoció con menos aductos de ADN en el hígado que el tamoxifeno en estudios preclínicos . Se utiliza como terapia endocrina para mujeres con cáncer de mama metastásico en estadio 4 o recurrente, positivo para receptores de estrógeno o progesterona [7] y ha demostrado una eficacia similar en comparación con el tamoxifeno como tratamiento adyuvante del cáncer de mama y en el tratamiento del cáncer de mama metastásico. [6]
El raloxifeno se utiliza para la prevención y el tratamiento de la osteoporosis posmenopáusica y la prevención del cáncer de mama en mujeres posmenopáusicas de alto riesgo con osteoporosis. [5] Los informes preclínicos y clínicos sugieren que es considerablemente menos potente que el estrógeno para el tratamiento de la osteoporosis. Se asocia con un perfil endometrial aceptable y no ha demostrado efectos similares al tamoxifeno en el útero, pero se ha asociado con efectos adversos como tromboembolia venosa y síntomas vasomotores, incluidos sofocos. [4]
El ospemifeno es un metabolito análogo del toremifeno. A diferencia del tamoxifeno, el toremifeno no es un hepatocarcinógeno en ratas y, por lo tanto, el ospemifeno también sería un SERM más seguro que el tamoxifeno. [4] Se utiliza para el tratamiento de la dispareunia moderada a grave, un síntoma de atrofia vulvar y vaginal asociada con la menopausia. No se dispone de datos clínicos sobre el cáncer de mama, pero tanto los datos in vitro como in vivo sugieren que el ospemifeno puede tener actividad quimiopreventiva en el tejido mamario. [6]
El bazedoxifeno se utiliza para el tratamiento de la osteoporosis en mujeres posmenopáusicas con mayor riesgo de fractura . Se ha demostrado que es relativamente seguro y bien tolerado. No muestra estimulación mamaria ni endometrial y en los primeros dos años el pequeño aumento es mejor en la tromboembolia venosa y similar a largo plazo a otros SERM. La ventaja del bazedoxifeno sobre el raloxifeno es que aumenta la actividad de la óxido nítrico sintasa endotelial y no antagoniza el efecto del 17β-estradiol sobre los síntomas vasomotores. [5]
El primer complejo estrogénico selectivo de tejidos (TSEC) combina estrógenos conjugados y el SERM bazedoxifeno para combinar sus actividades. La terapia combinada se utiliza en el tratamiento de síntomas vasomotores moderados a severos asociados con la menopausia, la prevención de la osteoporosis posmenopáusica, así como el tratamiento de los síntomas de deficiencia de estrógeno en mujeres posmenopáusicas no histerectomizadas . La combinación permite aprovechar los beneficios del estrógeno con respecto al alivio de los síntomas vasomotores sin estimulación estrogénica del endometrio . [5] [6]
Los SERM también han sido utilizados en la terapia de reemplazo hormonal por algunas personas transgénero . [8]
Los SERM son agonistas parciales competitivos del RE. [9] Diferentes tejidos tienen diferentes grados de sensibilidad a la actividad de los estrógenos endógenos, por lo que los SERM producen efectos estrogénicos o antiestrogénicos dependiendo del tejido en cuestión, así como del porcentaje de actividad intrínseca (IA) del SERM. [10] Un ejemplo de un SERM con alta IA y por lo tanto efectos principalmente estrogénicos es el clorotrianiseno , mientras que un ejemplo de un SERM con baja IA y por lo tanto efectos principalmente antiestrogénicos es el etamoxitrifetol . Los SERM como el clomifeno y el tamoxifeno están comparativamente más en el medio en su IA y su equilibrio de actividad estrogénica y antiestrogénica. El raloxifeno es un SERM que es más antiestrogénico que el tamoxifeno; ambos son estrogénicos en el hueso, pero el raloxifeno es antiestrogénico en el útero mientras que el tamoxifeno es estrogénico en esta parte del cuerpo. [10]
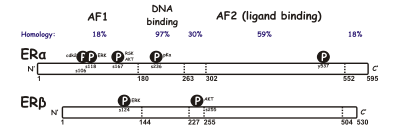
Los SERM actúan sobre el receptor de estrógeno (ER), que es un activador transcripcional intracelular dependiente de ligando y pertenece a la familia de receptores nucleares . [11] Se han identificado dos subtipos diferentes de ER, ERα y ERβ . ERα se considera el medio principal donde se transducen las señales de estrógeno a nivel transcripcional y es el ER predominante en el tracto reproductivo femenino y las glándulas mamarias, mientras que ERβ se encuentra principalmente en las células endoteliales vasculares , los huesos y el tejido prostático masculino. [12] Se sabe que la concentración de ERα y ERβ es diferente en los tejidos durante el desarrollo, el envejecimiento o el estado de enfermedad. [13] Muchas características son similares entre estos dos tipos, como el tamaño (~600 y 530 aminoácidos ) y la estructura. ERα y ERβ comparten aproximadamente el 97% de la identidad de secuencia de aminoácidos en el dominio de unión al ADN y aproximadamente el 56% en el dominio de unión al ligando . [11] [13] La principal diferencia de los dominios de unión del ligando está determinada por Leu -384 y Met -421 en ERα, que son reemplazados por Met-336 e Ile -373, respectivamente, en ERβ. [14] La variación es mayor en el extremo N entre ERα y ERβ. [15]
El dominio de unión al ADN consta de dos subdominios. Uno con una caja proximal que está involucrada en el reconocimiento del ADN mientras que el otro contiene una caja distal responsable de la dimerización del dominio de unión al ADN dependiente del ADN . La secuencia de la caja proximal es idéntica entre ERα y ERβ, lo que indica una especificidad y afinidad similares entre los dos subgrupos. Las proteínas globulares del dominio de unión al ADN contienen ocho cisteínas y permiten una coordinación tetraédrica de dos iones de zinc . Esta coordinación hace posible la unión de ER a los elementos de respuesta al estrógeno. [12] El dominio de unión al ligando es una estructura globular de tres capas formada por 11 hélices y contiene un bolsillo para el ligando natural o sintético. [12] [11] Los factores que influyen en la afinidad de unión son principalmente la presencia de una fracción fenólica , el tamaño y la forma molecular, los dobles enlaces y la hidrofobicidad . [16]
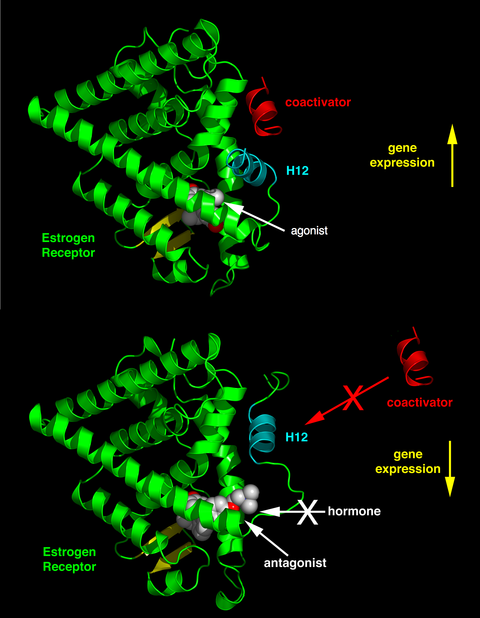
La posición diferencial de la hélice 12 de la función activadora 2 (AF-2) en el dominio de unión del ligando por el ligando unido determina si el ligando tiene un efecto agonista y antagonista. En los receptores unidos a agonistas, la hélice 12 se coloca adyacente a las hélices 3 y 5. Las hélices 3, 5 y 12 juntas forman una superficie de unión para un motivo de caja NR contenido en coactivadores con la secuencia canónica LXXLL (donde L representa leucina o isoleucina y X es cualquier aminoácido). Los receptores no ligados (apo) o los receptores unidos a ligandos antagonistas alejan la hélice 12 de la superficie de unión de LXXLL, lo que conduce a la unión preferencial de un motivo más largo rico en leucina, LXXXIXXX(I/L), presente en los correpresores NCoR1 o SMRT. Además, algunos cofactores se unen al RE a través de las terminales, el sitio de unión del ADN u otros sitios de unión. Por lo tanto, un compuesto puede ser un agonista de ER en un tejido rico en coactivadores pero un antagonista de ER en tejidos ricos en correpresores . [11]
Los compuestos estrogénicos abarcan un espectro de actividad que incluye:
Se sabe que los SERM estimulan las acciones estrogénicas en tejidos como el hígado, los huesos y el sistema cardiovascular, pero se sabe que bloquean la acción del estrógeno donde la estimulación no es deseable, como en la mama y el útero. [19] Esta actividad agonista o antagonista causa diversos cambios estructurales de los receptores, lo que da como resultado la activación o represión de los genes diana del estrógeno. [3] [19] [4] [20] Los SERM interactúan con los receptores difundiéndose en las células y su unión a las subunidades ERα o ERβ, lo que da como resultado la dimerización y los cambios estructurales de los receptores. Esto hace que sea más fácil para los SERM interactuar con los elementos de respuesta al estrógeno, lo que conduce a la activación de genes inducibles por estrógeno y mediar los efectos del estrógeno. [19]
La característica única de los SERM es su actividad selectiva de tejidos y células. Cada vez hay más pruebas que respaldan que la actividad de los SERM está determinada principalmente por el reclutamiento selectivo de correpresores y coactivadores a los genes diana del RE en tipos específicos de tejidos y células. [4] [20] [21] Los SERM pueden afectar la estabilidad de la proteína coactivadora y también pueden regular la actividad del coactivador a través de modificaciones postraduccionales como la fosforilación . Múltiples vías de señalización del crecimiento, como HER2 , PKC , PI3K y más, se regulan a la baja en respuesta al tratamiento antiestrógeno. El coactivador del receptor de esteroides 3 (SRC-3) es fosforilado por quinasas activadas que también mejoran su actividad coactivadora, afectan el crecimiento celular y, en última instancia, contribuyen a la resistencia a los fármacos. [21]
La proporción de ERα y ERβ en un sitio diana puede ser otra forma de determinar la actividad de los SERM. Los altos niveles de proliferación celular se correlacionan bien con una alta proporción de ERα:ERβ, pero la represión de la proliferación celular se correlaciona con el predominio de ERβ sobre ERα. La proporción de ER en el tejido mamario neoplásico y normal podría ser importante al considerar la quimioprevención con SERM. [3] [19] [4] [20]
Al observar las diferencias entre ERα y ERβ, la Función Activadora 1 (AF-1) y la AF-2 son importantes. Juntas desempeñan un papel importante en la interacción con otras proteínas correguladoras que controlan la transcripción genética . [19] [4] La AF-1 se encuentra en el extremo amino del ER y solo es un 20% homóloga en ERα y ERβ. Por otro lado, la AF-2 es muy similar en ERα y ERβ, y solo un aminoácido es diferente. [4] Los estudios han demostrado que al cambiar las regiones AF-1 en ERα y ERβ, existen diferencias específicas en la actividad de transcripción. En general, los SERM pueden activar parcialmente genes diseñados a través de ERα por un elemento receptor de estrógeno, pero no a través de ERβ. [19] [4] [20] Aunque el raloxifeno y la forma activa del tamoxifeno pueden estimular los genes reporteros regulados por AF-1 tanto en ERα como en ERβ. [4]
Debido al descubrimiento de que existen dos subtipos de ER, se ha producido la síntesis de una variedad de ligandos específicos de receptores que pueden activar o desactivar un receptor en particular. [4] Sin embargo, la forma externa del complejo resultante es lo que se convierte en el catalizador para cambiar la respuesta en un objetivo tisular a un SERM. [3] [19] [4] [20]
La cristalografía de rayos X de estrógenos o antiestrógenos ha demostrado cómo los ligandos programan el complejo receptor para interactuar con otras proteínas. El dominio de unión al ligando del ER demuestra cómo los ligandos promueven y previenen la unión del coactivador según la forma del complejo de estrógeno o antiestrógeno. La amplia gama de ligandos que se unen al ER puede crear un espectro de complejos de ER que son completamente estrogénicos o antiestrogénicos en un sitio objetivo específico. [3] [4] [20] El resultado principal de una unión de ligando al ER es una reorganización estructural del bolsillo de unión del ligando , principalmente en el AF-2 de la región C-terminal. La unión de ligandos al ER conduce a la formación de un bolsillo hidrofóbico que regula los cofactores y la farmacología del receptor. El plegamiento correcto del dominio de unión del ligando es necesario para la activación de la transcripción y para que el ER interactúe con varios coactivadores. [4]
Los coactivadores no son solo proteínas asociadas que conectan sitios entre sí en un complejo. Los coactivadores desempeñan un papel activo en la modificación de la actividad de un complejo. La modificación posterior a la traducción de los coactivadores puede dar como resultado un modelo dinámico de la acción de la hormona esteroidea a través de múltiples vías de quinasas iniciadas por los receptores del factor de crecimiento de la superficie celular . Bajo la guía de una multitud de remodeladores de proteínas para formar un complejo coactivador multiproteico que puede interactuar con el ER fosforilado en un sitio promotor de genes específico, el coactivador central primero tiene que reclutar un conjunto específico de cocoactivadores. Las proteínas que el coactivador central ensambla como el complejo coactivado central tienen actividades enzimáticas individuales para metilar o acetilar proteínas adyacentes. Los sustratos del ER o la coenzima A pueden ser poliubiquitinados por múltiples ciclos de la reacción o, dependiendo de las proteínas de enlace, pueden ser activados aún más o degradados por el proteasoma 26S . [4]
En consecuencia, para tener una transcripción genética efectiva que esté programada y dirigida por la estructura y el estado de fosforilación del RE y los coactivadores, se requiere tener un proceso dinámico y cíclico de capacidad de remodelación para el ensamblaje transcripcional, después del cual el complejo de transcripción es destruido instantáneamente de manera rutinaria por el proteasoma. [4]
La estructura central de los SERM simula la plantilla del 17β-estradiol . Tienen dos anillos aromáticos separados por 1-3 átomos (a menudo una disposición de tipo estilbeno ). Entre los dos fenilos del núcleo, los SERM suelen tener un grupo fenilo 4-sustituido que, cuando se une al ER, se proyecta desde una posición de un núcleo de estratrieno de modo que la hélice 12 se mueve desde la apertura del receptor y bloquea el espacio donde las proteínas coactivadoras normalmente se unirían y causarían actividad agonista del ER. Ha habido muchas variaciones en la porción central de los SERM, mientras que ha habido menos flexibilidad con lo que se tolera en la cadena lateral . [7] Los SERM se pueden clasificar por su estructura central.

La primera clase estructural principal de moléculas de tipo SERM descrita son los trifeniletilenos . El núcleo de estilbeno (similar al estrógeno no esteroide, dietilestilbestrol) imita esencialmente a los estrógenos esteroides como el 17β-estradiol, mientras que la cadena lateral se superpone con la posición 11 del núcleo esteroide. [7] Los derivados de trifeniletileno tienen un grupo fenilo adicional unido al grupo puente de etileno . La capacidad de los fenoles para formar enlaces de hidrógeno en la posición 3 es un requisito importante para la unión al ER. [22]

El primer fármaco, el clomifeno, [23] tiene un sustituyente cloro en la cadena lateral de etileno que produce afinidades de unión similares a las del fármaco descubierto posteriormente, el tamoxifeno. El clomifeno es una mezcla de isómeros estrogénicos ( forma cis ) y antiestrogénicos ( forma trans ). [22] Cis y trans se definen en términos de las relaciones geométricas de los dos anillos de fenilo no sustituidos. [23] Los dos isómeros del clomifeno tienen perfiles diferentes, donde la forma trans tiene una actividad más similar al tamoxifeno mientras que la forma cis se comporta más como el 17β-estradiol. [7] El cis es aproximadamente diez veces más potente que el trans. Sin embargo, el isómero trans es el estimulador más potente de la hipertrofia de las células epiteliales, ya que el clomifeno es antagonista a dosis bajas y agonista a dosis altas. [23] Los isómeros antagonistas pueden causar efectos estrogénicos inhibidores en el útero y los cánceres mamarios, pero el isómero estrogénico podría combinarse con nuevos receptores para producir efectos similares al estrógeno en los huesos. [24]

El tamoxifeno se ha convertido en el tratamiento de elección para las mujeres diagnosticadas con todas las etapas de cáncer de mama sensible a las hormonas, es decir, cáncer de mama que es tanto ER y/o progesterona positivo. En los EE. UU., también se administra para la quimioprevención profiláctica en mujeres identificadas como de alto riesgo de cáncer de mama. [25] El tamoxifeno es un trans-isómero antiestrogénico puro y tiene acciones diferenciales en los tejidos diana del estrógeno en todo el cuerpo. El tamoxifeno es selectivamente antiestrogénico en la mama, pero similar al estrógeno en los huesos y el cáncer de endometrio. [24] El tamoxifeno experimenta un metabolismo de fase I en el hígado por las enzimas del citocromo P450 (CYP) microsomal . Los principales metabolitos del tamoxifeno son N -desmetiltamoxifeno y 4-hidroxitamoxifeno .
La estructura cristalográfica del 4-hidroxitamoxifeno [26] interactúa con los aminoácidos del RE dentro del dominio de unión al ligando. [27] El contacto entre el grupo fenólico, la molécula de agua y el glutamato y la arginina en el receptor (REα; Glu 353/Arg 394) se resuelve en una unión de alta afinidad, de modo que el 4-hidroxitamoxifeno, con un anillo fenólico que se asemeja al anillo A del 17β-estradiol, tiene una afinidad de unión relativa más de 100 veces mayor que el tamoxifeno, que no tiene fenol. Si se elimina su grupo OH o se cambia su posición, la afinidad de unión se reduce. [7] [22]
La fracción trifeniletileno y la cadena lateral son necesarias para la unión del tamoxifeno al RE, mientras que para el 4-hidroxitamoxifeno, la cadena lateral y el fenilpropeno no parecen ser elementos estructurales cruciales para la unión al RE. La basicidad y la longitud de la cadena lateral no parecen desempeñar un papel crucial para la afinidad de unión del tamoxifeno al RE ni para el anillo β del tamoxifeno, pero la fracción estilbeno del tamoxifeno es necesaria para la unión al RE. El grupo hidroxilo es de particular importancia para la unión al RE del 4-hidroxitamoxifeno, y la cadena lateral etilo del tamoxifeno sobresale del dominio de unión al ligando del RE. [27]
Algunas usuarias de tamoxifeno han presentado tasas mayores de cáncer de útero, sofocos y tromboembolias. El fármaco también puede causar hepatocarcinomas en ratas. Esto probablemente se deba al grupo etilo del núcleo de estilbeno del tamoxifeno, que está sujeto a activación oxidativa alílica, lo que provoca la alquilación del ADN y la escisión de la cadena. Este problema se corrige posteriormente con el toremifeno. [7] El tamoxifeno es más promiscuo que el raloxifeno en los sitios diana debido a la relación entre el aminoácido del ER en Asp-351 y la cadena lateral antiestrogénica del SERM. La cadena lateral del tamoxifeno no puede neutralizar el Asp-351, por lo que el sitio influye alostéricamente en el AF-1 en el extremo proximal del ER. Este problema se soluciona con el fármaco de segunda generación raloxifeno. [24]

El toremifeno es un derivado clorado del antiestrógeno trifeniletilenado no esteroide tamoxifeno [7] con un sustituyente de cloro en la cadena lateral de etileno que produce afinidades de unión similares a las del tamoxifeno. [22] La relación entre la estructura y la actividad del toremifeno es similar a la del tamoxifeno, pero tiene una mejora sustancial con respecto al fármaco anterior en lo que respecta a la alquilación del ADN. La presencia del átomo de cloro añadido reduce la estabilidad de los cationes formados a partir de metabolitos alílicos activados y, por tanto, disminuye el potencial de alquilación y, de hecho, el toremifeno no muestra formación de aductos de ADN en los hepatocitos de roedores . El toremifeno protege contra la pérdida ósea en modelos de ratas ovariectomizadas y afecta a los marcadores de resorción ósea clínicamente de forma similar al tamoxifeno. [7] El toremifeno sufre un metabolismo de fase I por las enzimas del citocromo P450 microsomal, como el tamoxifeno, pero principalmente por la isoforma CYP3A4. El toremifeno forma sus dos metabolitos principales, N-desmetiltoremifeno y desaminohidroxi-toremifeno (ospemifeno), mediante N-desmetilación y desaminación-hidroxilación. El N-desmetiltoremifeno tiene una eficacia similar a la del toremifeno, mientras que el 4-hidroxi-toremifeno tiene una mayor afinidad de unión al ER que el toremifeno. [26] El 4-hidroxi-toremifeno tiene una función similar a la del 4-hidroxi-tamoxifeno. [28]

El raloxifeno pertenece a los fármacos SERM de benzotiofeno de segunda generación . Tiene una alta afinidad por el ER con una potente actividad antiestrogénica y efectos específicos de tejido distintos del estradiol. [19] El raloxifeno es un agonista del ER en los huesos y el sistema cardiovascular, pero en el tejido mamario y el endometrio actúa como un antagonista del ER. Se metaboliza ampliamente por conjugación de glucurónido en el intestino y debido a eso tiene una biodisponibilidad baja de solo el 2%, mientras que la del tamoxifeno y el toremifeno es aproximadamente del 100%. [26]
La ventaja del raloxifeno sobre el tamoxifeno trifeniletilénico es que tiene un efecto reducido sobre el útero. El grupo bisagra flexible, así como la cadena lateral antiestrogénica fenil 4-piperidinoetoxi, son importantes para minimizar los efectos uterinos. Debido a su flexibilidad, la cadena lateral puede obtener una disposición ortogonal con respecto al núcleo [7], de modo que la amina de la cadena lateral del raloxifeno está 1 Å más cerca que los tamoxifenos del aminoácido Asp-351 en el dominio de unión al ligando del ERα. [24] [29]
El papel crítico de la relación íntima entre la cadena lateral hidrofóbica del raloxifeno y el residuo hidrofóbico del receptor para cambiar tanto la forma como la carga de la superficie externa de un complejo SERM-ER se ha confirmado con derivados de raloxifeno. Cuando la distancia interactiva entre raloxifeno y Asp-351 aumenta de 2,7 Å a 3,5-5 Å, provoca un aumento de la acción similar a la del estrógeno del complejo raloxifeno-ERα. Cuando el anillo de piperidina del raloxifeno se reemplaza por ciclohexano , el ligando pierde propiedades antiestrogénicas y se convierte en un agonista completo. La interacción entre la cadena lateral antiestrogénica del SERM y el aminoácido Asp-351 es el primer paso importante para silenciar AF-2. Reubica la hélice 12 lejos del bolsillo de unión del ligando, evitando así que los coactivadores se unan al complejo SERM-ER. [24] [29]

Los compuestos de tercera generación no muestran estimulación uterina, mejoran la potencia, no aumentan significativamente los sofocos o presentan una combinación de estos atributos. [7]
El primer SERM de dihidronaftaleno, la nafoxidina , fue un candidato clínico para el tratamiento del cáncer de mama, pero tuvo efectos secundarios, incluida una fototoxicidad grave. La nafoxidina tiene los tres fenilos restringidos en una disposición coplanar como el tamoxifeno. Pero con la hidrogenación, el doble enlace de la nafoxidina se redujo y ambos fenilos están orientados en cis. La cadena lateral que contiene amina puede adoptar entonces una conformación axial y ubicar este grupo ortogonalmente al plano del núcleo, como el ralofoxifeno y otros SERM menos uterotrópicos.

Las modificaciones de la nafoxidina dieron como resultado el lasofoxifeno. El lasofoxifeno es uno de los SERM más potentes que se ha descrito para la protección contra la pérdida ósea y la reducción del colesterol. La excelente potencia oral del lasofoxifeno se ha atribuido a la reducción de la glucuronidación intestinal del fenol. [7] A diferencia del raloxifeno, el lasofoxifeno satisface el requisito de un modelo de farmacóforo que predice la resistencia a la glucuronidación de la pared intestinal. El requisito estructural es una topología no plana con el volumen estérico cerca del plano de un sistema aromático bicíclico fusionado. [30] Las interacciones entre el ER y el lasofoxifeno son coherentes con las características generales del reconocimiento SERM-ER. La gran cadena lateral flexible del lasofoxifeno termina en un grupo de cabeza de pirrolidina y se abre camino hacia la superficie de la proteína, donde interfiere directamente con el posicionamiento de la hélice AF-2. Se forma un puente salino entre el lasofoxifeno y el Asp-351. La neutralización de la carga en esta región ER puede explicar algunos efectos antiestrogénicos ejercidos por el lasofoxifeno. [12]

El sistema indol ha servido como unidad central en los SERM, y cuando una amina se une al indol con un benciloxietilo, se ha demostrado que los compuestos resultantes no tienen actividad uterina preclínica, al tiempo que respetan el hueso de la rata con plena eficacia en dosis bajas. El bazedoxifeno es uno de esos compuestos. El dominio de unión central consiste en un 2-fenil-3-metil indol y un anillo de hexametilenamina en la región afectiva de la cadena lateral. Se metaboliza por glucuronidación, con una biodisponibilidad absoluta del 6,2 %, tres veces mayor que la del raloxifeno. Tiene efectos agonistas sobre el metabolismo óseo y lipídico, pero no sobre el endometrio mamario y uterino. [31] Es bien tolerado y no muestra un aumento en la incidencia de sofocos, hipertrofia uterina o dolor mamario. [7]

El ospemifeno es un trifeniletileno y un metabolito conocido del toremifeno. Es estructuralmente muy similar al tamoxifeno y al toremifeno. El ospemifeno no tiene un grupo 2-(dimetilamino)etoxi como el tamoxifeno. Los estudios de relación estructura-actividad mostraron que al eliminar ese grupo del tamoxifeno, la actividad agonista en el útero se redujo significativamente, pero no en los huesos ni en el sistema cardiovascular. Los datos preclínicos y clínicos muestran que el ospemifeno es bien tolerado y no tiene efectos secundarios importantes. Los beneficios que el ospemifeno puede tener sobre otros SERM son su efecto neutro sobre los sofocos y su efecto agonista de ER en la vagina, mejorando los síntomas de sequedad vaginal. [32]

Se sabe que los SERM presentan cuatro modos distintivos de unión al ER. Una de esas características son los fuertes enlaces de hidrógeno entre el ligando y el Arg-394 y el Glu-353 del ERα que recubren el "bolsillo del anillo A" y ayudan al ligando a permanecer en el bolsillo de unión del ER. Esto es diferente del 17β-estradiol que está unido por hidrógeno a His-524 en el "bolsillo del anillo D". [13] Otras uniones distintivas al bolsillo de unión del ligando son con una estructura de "núcleo" casi plana compuesta típicamente de un heterociclo de biarilo , equivalente al anillo A y al anillo B del 17β-estradiol, al sitio de unión correspondiente; una cadena lateral voluminosa de la estructura de biarilo , análoga al anillo B del 17β-estradiol y finalmente un segundo grupo lateral que es el equivalente de los anillos C y D y generalmente aromático, llena el volumen restante del bolsillo de unión del ligando. [30]
Las pequeñas diferencias entre los dos subtipos de ER se han utilizado para desarrollar moduladores de ER selectivos de subtipo, pero la alta similitud entre los dos receptores hace que el desarrollo sea muy desafiante. Los aminoácidos en los dominios de unión del ligando difieren en dos posiciones, Leu-384 y Met-421 en ERα y Met-336 e Ile-373 en ERβ, pero tienen hidrofobicidad y volúmenes de ocupación similares. Sin embargo, las formas y la barrera rotacional de los residuos de aminoácidos no son las mismas, lo que lleva a distinguir la cara α y β de la cavidad de unión entre ERα y ERβ. Esto causa la unión preferencial de ERα de los sustituyentes del ligando que están alineados hacia abajo mirando hacia Met-336, mientras que los sustituyentes del ligando alineados hacia arriba mirando hacia Met-336 tienen más probabilidades de unirse a ERβ. Otra diferencia está en Val-392 en ERα, que es reemplazado por Met-344 en ERβ. El volumen del bolsillo de unión de ERβ es ligeramente más pequeño y la forma un poco diferente de la de ERα. Muchos ligandos selectivos de ERβ tienen una disposición en gran parte plana ya que la cavidad de unión de ERβ es ligeramente más estrecha que la de ERα, sin embargo, esto por sí mismo conduce a una selectividad modesta. Para lograr una selectividad fuerte, el ligando debe colocar sustituyentes muy cerca de una o más de las diferencias de aminoácidos entre ERα y ERβ para crear una fuerte fuerza repulsiva hacia el otro subtipo de receptor. Además, la estructura del ligando debe ser rígida. De lo contrario, las interacciones repulsivas pueden conducir al cambio conformacional del ligando y, por lo tanto, crear modos de unión alternativos. [13]
El tamoxifeno es convertido por el citocromo P450 del hígado en 4-hidroxitamoxifeno [12] y es un antagonista más selectivo del subtipo ERα que ERβ. [33] El 4-hidroxitamoxifeno se une a los ER dentro del mismo bolsillo de unión que reconoce al 17β-estradiol. El reconocimiento del receptor de 4-hidroxitamoxifeno parece estar controlado por dos características estructurales del 4-hidroxitamoxifeno, el anillo A fenólico y la voluminosa cadena lateral. El anillo A fenólico forma enlaces de hidrógeno con los grupos laterales de los ER Arg-394, Glu-354 y con agua conservada estructuralmente. La voluminosa cadena lateral, que sobresale de la cavidad de unión, desplaza la hélice 12 del bolsillo de unión del ligando para cubrir parte del bolsillo de unión del coactivador. La formación del complejo ER-4-hidroxitamoxifeno recluta proteínas correpresoras. Esto conduce a una disminución de la síntesis de ADN y a la inhibición de la actividad del estrógeno. [12] El clomifeno y el torimefeno producen afinidades de unión similares a las del tamoxifeno. [22] Por lo tanto, estos dos fármacos son antagonistas más selectivos del subtipo ERα que del ERβ. [33]

El raloxifeno, al igual que el 4-hidroxitamoxifeno, se une al ERα con el grupo hidroxilo de su "anillo A" fenólico a través de enlaces de hidrógeno con Arg-394 y Glu-353. Además de estos enlaces, el raloxifeno forma un segundo enlace de hidrógeno con el ER a través del grupo lateral de His-524 debido a la presencia de un segundo grupo hidroxilo en el "anillo D". Este enlace de hidrógeno también es diferente al que existe entre el 17β-estradiol y el His-524, ya que el anillo de imidazol del His-524 está rotado para contrarrestar la diferencia de la posición del oxígeno en el raloxifeno y en el 17β-estradiol. Al igual que en el 4-hidroxitamoxifeno, la voluminosa cadena lateral del raloxifeno desplaza la hélice 12. [12]
La interacción del lasofoxifeno con ERα es típica de aquellas entre SERM-ERα, como una topología casi plana (el carbociclo tetrahidronaftaleno), enlaces de hidrógeno con Arg-394 y Glu-353 y las cadenas laterales de fenilo del lasofoxifeno que llenan el volumen del anillo C y del anillo D del bolsillo de unión del ligando. El lasofoxifeno desvía la hélice 12 y evita la unión de proteínas coactivadoras con motivos LXXLL. Esto se logra al ocupar el lasofoxifeno el espacio normalmente lleno por el grupo lateral de Leu-540 y modular la conformación de los residuos de la hélice 11 (His-524, Leu-525). Además, el lasofoxifeno también interfiere directamente con el posicionamiento de la hélice 12 por el grupo etilpirrolidina del fármaco . [12] Los estudios in vitro indican que el bazedoxifeno bloquea competitivamente el 17β-estradiol mediante una unión alta y similar tanto a ERα como a ERβ. [34] El dominio de unión principal del bazedoxifeno consiste en el 2-fenil-3-metilindol y un anillo de hexametilenamina en la región afectada de la cadena lateral. [31]
El ospemifeno es un metabolito desaminado oxidativo del toremifeno y tiene una unión al ER similar a la del toremifeno y el tamoxifeno. La unión competitiva al ERα y al ERβ de los tres metabolitos 4-hidroxi-ospemifeno, 4'-hidroxi-ospemifeno y el ácido carboxílico de cadena lateral 4-hidroxi-ospemifeno es al menos tan alta como la del compuesto original. [35]

El descubrimiento de los SERM fue el resultado de los intentos de desarrollar nuevos anticonceptivos. El clomifeno y el tamoxifeno impidieron la concepción en ratas, pero hicieron lo contrario en humanos. El clomifeno indujo con éxito la ovulación en mujeres subfértiles y el 1 de febrero de 1967, fue aprobado en los EE. UU. para el tratamiento de la disfunción ovárica en mujeres que estaban tratando de concebir. [5] Los problemas toxicológicos impidieron el uso a largo plazo del clomifeno y el desarrollo de fármacos para otras aplicaciones potenciales, como el tratamiento y la prevención del cáncer de mama . [6]
Pasaron otros diez años antes de que el tamoxifeno fuera aprobado en diciembre de 1977, no como anticonceptivo sino como tratamiento hormonal para tratar y prevenir el cáncer de mama. [6] El descubrimiento en 1987 de que los SERM tamoxifeno y raloxifeno , entonces considerados antiestrógenos debido a sus efectos antagonistas en el tejido mamario, mostraron efectos estrogénicos en la prevención de la pérdida ósea en ratas ovariectomizadas tuvo un gran efecto en nuestra comprensión de la función de los receptores de estrógeno y los receptores nucleares en general. [7] El término SERM se introdujo para describir estos compuestos que tienen una combinación de actividades agonistas de estrógeno , agonistas parciales o antagonistas según el tejido. [5] Se ha demostrado que el toremifeno es compatible con el tamoxifeno, y en 1996 fue aprobado para su uso en el tratamiento del cáncer de mama en mujeres posmenopáusicas. [36]
El raloxifeno fracasó originalmente como fármaco contra el cáncer de mama debido a su pobre rendimiento en comparación con el tamoxifeno en el laboratorio [19] pero los efectos estrogénicos del raloxifeno sobre los huesos llevaron a su redescubrimiento y aprobación en 1997. [6] Fue aprobado para la prevención y el tratamiento de la osteoporosis y fue el primer SERM clínicamente disponible para prevenir tanto la osteoporosis como el cáncer de mama. [7] El ospemifeno fue aprobado el 26 de febrero de 2013 para el tratamiento de la dispareunia moderada a severa , que es un síntoma, debido a la menopausia , de atrofia vulvar y vaginal . La terapia combinada con estrógenos conjugados y el SERM bazedoxifeno , fue aprobada el 3 de octubre de 2013 para el tratamiento de los síntomas vasomotores relacionados con la menopausia. El bazedoxifeno también se utiliza en la prevención de la osteoporosis posmenopáusica. [6] La búsqueda de un SERM potente con eficacia ósea y mejor biodisponibilidad que el raloxifeno condujo al descubrimiento del lasofoxifeno. [12] Aunque el lasofoxifeno fue aprobado en 2009, no se comercializó durante los tres años siguientes a su aprobación, por lo que su autorización de comercialización ha expirado. [37] En Europa, el bazedoxifeno está indicado para el tratamiento de la osteoporosis en mujeres posmenopáusicas con mayor riesgo de fractura. En la India, el ormeloxifeno se ha utilizado para el sangrado uterino disfuncional y el control de la natalidad. [6]