Un hemograma completo ( CSC ), también conocido como hemograma completo ( FBC ), es un conjunto de pruebas de laboratorio médico que proporcionan información sobre las células en la sangre de una persona . El CSC indica los recuentos de glóbulos blancos , glóbulos rojos y plaquetas , la concentración de hemoglobina y el hematocrito (el porcentaje de volumen de glóbulos rojos). También se informan los índices de glóbulos rojos , que indican el tamaño promedio y el contenido de hemoglobina de los glóbulos rojos, y puede incluirse un diferencial de glóbulos blancos , que cuenta los diferentes tipos de glóbulos blancos.
El hemograma completo se realiza a menudo como parte de una evaluación médica y se puede utilizar para controlar la salud o diagnosticar enfermedades. Los resultados se interpretan comparándolos con los rangos de referencia , que varían según el sexo y la edad. Afecciones como la anemia y la trombocitopenia se definen por resultados anormales del hemograma completo. Los índices de glóbulos rojos pueden proporcionar información sobre la causa de la anemia de una persona, como la deficiencia de hierro y la deficiencia de vitamina B12 , y los resultados del diferencial de glóbulos blancos pueden ayudar a diagnosticar infecciones virales , bacterianas y parasitarias y trastornos sanguíneos como la leucemia . No todos los resultados que quedan fuera del rango de referencia requieren intervención médica.
El hemograma completo suele realizarse mediante un analizador hematológico automatizado , que cuenta las células y recoge información sobre su tamaño y estructura. Se mide la concentración de hemoglobina y se calculan los índices de glóbulos rojos a partir de las mediciones de glóbulos rojos y hemoglobina. Se pueden utilizar pruebas manuales para confirmar de forma independiente los resultados anormales. Aproximadamente entre el 10 y el 25 % de las muestras requieren una revisión manual del frotis de sangre , [5] en la que la sangre se tiñe y se observa bajo un microscopio para verificar que los resultados del analizador sean coherentes con la apariencia de las células y para buscar anomalías. El hematocrito se puede determinar manualmente centrifugando la muestra y midiendo la proporción de glóbulos rojos, y en los laboratorios sin acceso a instrumentos automatizados, las células sanguíneas se cuentan bajo el microscopio utilizando un hemocitómetro .
En 1852, Karl Vierordt publicó el primer procedimiento para realizar un hemograma, que implicaba extender un volumen conocido de sangre en un portaobjetos de microscopio y contar cada célula. La invención del hemocitómetro en 1874 por Louis-Charles Malassez simplificó el análisis microscópico de las células sanguíneas, y a finales del siglo XIX, Paul Ehrlich y Dmitri Leonidovich Romanowsky desarrollaron técnicas para teñir glóbulos blancos y rojos que todavía se utilizan para examinar frotis de sangre. Los métodos automatizados para medir la hemoglobina se desarrollaron en la década de 1920, y Maxwell Wintrobe introdujo el método del hematocrito de Wintrobe en 1929, que a su vez le permitió definir los índices de glóbulos rojos. Un hito en la automatización de los recuentos de células sanguíneas fue el principio de Coulter , que fue patentado por Wallace H. Coulter en 1953. El principio de Coulter utiliza mediciones de impedancia eléctrica para contar las células sanguíneas y determinar sus tamaños; Se trata de una tecnología que sigue utilizándose en muchos analizadores automáticos. En la década de 1970, se realizaron más investigaciones que incluyeron el uso de mediciones ópticas para contar e identificar células, lo que permitió automatizar el recuento diferencial de glóbulos blancos.

La sangre se compone de una porción líquida, llamada plasma , y una porción celular que contiene glóbulos rojos , glóbulos blancos y plaquetas . [nota 1] [7] El hemograma completo evalúa los tres componentes celulares de la sangre. Algunas afecciones médicas, como la anemia o la trombocitopenia , se definen por aumentos o disminuciones marcados en los recuentos de células sanguíneas. [8] Los cambios en muchos sistemas orgánicos pueden afectar la sangre, por lo que los resultados del hemograma completo son útiles para investigar una amplia gama de afecciones. Debido a la cantidad de información que proporciona, el hemograma completo es una de las pruebas de laboratorio médicas que se realizan con más frecuencia . [9] [10] [11]
El hemograma completo se utiliza a menudo para detectar enfermedades como parte de una evaluación médica. [12] También se solicita cuando un proveedor de atención médica sospecha que una persona tiene una enfermedad que afecta a las células sanguíneas, como una infección , un trastorno hemorrágico o algunos tipos de cáncer . Las personas a las que se les ha diagnosticado trastornos que pueden causar resultados anormales en el hemograma completo o que están recibiendo tratamientos que pueden afectar los recuentos de células sanguíneas pueden realizarse un hemograma completo con regularidad para controlar su salud, [4] [12] y la prueba a menudo se realiza todos los días en personas que están hospitalizadas. [13] Los resultados pueden indicar la necesidad de una transfusión de sangre o plaquetas . [14]
El hemograma completo tiene aplicaciones específicas en muchas especialidades médicas . A menudo se realiza antes de que una persona se someta a una cirugía para detectar anemia, garantizar que los niveles de plaquetas sean suficientes y detectar infecciones, [15] [16] así como después de la cirugía, para que se pueda controlar la pérdida de sangre . [12] [17] En medicina de emergencia , el hemograma completo se utiliza para investigar numerosos síntomas, como fiebre , dolor abdominal y dificultad para respirar , [18] [19] [20] y para evaluar sangrado y traumatismo . [21] [22] Los hemogramas se controlan de cerca en personas sometidas a quimioterapia o radioterapia para el cáncer, porque estos tratamientos suprimen la producción de células sanguíneas en la médula ósea y pueden producir niveles gravemente bajos de glóbulos blancos, plaquetas y hemoglobina . [23] Los hemogramas completos regulares son necesarios para las personas que toman algunos medicamentos psiquiátricos , como la clozapina y la carbamazepina , que en casos raros pueden causar una caída potencialmente mortal en el número de glóbulos blancos ( agranulocitosis ). [24] [25] Debido a que la anemia durante el embarazo puede resultar en peores resultados para la madre y su bebé, el hemograma completo es una parte rutinaria de la atención prenatal ; [26] y en los recién nacidos , puede ser necesario un hemograma completo para investigar la ictericia o para contar el número de células inmaduras en el diferencial de glóbulos blancos , que puede ser un indicador de sepsis . [27] [28]
El hemograma completo es una herramienta esencial de la hematología , que es el estudio de la causa, el pronóstico, el tratamiento y la prevención de las enfermedades relacionadas con la sangre. [29] Los resultados del hemograma completo y del examen de frotis reflejan el funcionamiento del sistema hematopoyético : los órganos y tejidos involucrados en la producción y el desarrollo de las células sanguíneas, en particular la médula ósea . [9] [30] Por ejemplo, un recuento bajo de los tres tipos de células ( pancitopenia ) puede indicar que la producción de células sanguíneas se está viendo afectada por un trastorno de la médula ósea, y un examen de médula ósea puede investigar más a fondo la causa. [31] Las células anormales en el frotis de sangre pueden indicar leucemia aguda o linfoma , [30] mientras que un recuento anormalmente alto de neutrófilos o linfocitos, en combinación con síntomas indicativos y hallazgos del frotis de sangre, puede generar sospechas de un trastorno mieloproliferativo o un trastorno linfoproliferativo . El examen de los resultados del hemograma completo y del frotis de sangre puede ayudar a distinguir entre las causas de la anemia, como deficiencias nutricionales , trastornos de la médula ósea , anemias hemolíticas adquiridas y enfermedades hereditarias como la anemia de células falciformes y la talasemia . [32] [33]
Los rangos de referencia para el hemograma completo representan el rango de resultados encontrados en el 95% de las personas aparentemente sanas. [nota 2] [35] Por definición, el 5% de los resultados siempre quedarán fuera de este rango, por lo que algunos resultados anormales pueden reflejar una variación natural en lugar de significar un problema médico. [36] Esto es particularmente probable si dichos resultados están solo ligeramente fuera del rango de referencia, si son consistentes con resultados anteriores o si no hay otras anormalidades relacionadas mostradas por el hemograma completo. [37] Cuando la prueba se realiza en una población relativamente sana, el número de anormalidades clínicamente insignificantes puede exceder el número de resultados que representan una enfermedad. [38] Por esta razón, las organizaciones profesionales en los Estados Unidos, el Reino Unido y Canadá recomiendan no realizar pruebas de hemograma completo preoperatorio para cirugías de bajo riesgo en individuos sin condiciones médicas relevantes. [15] [39] [40] Las extracciones de sangre repetidas para pruebas hematológicas en pacientes hospitalizados pueden contribuir a la anemia adquirida en el hospital y pueden resultar en transfusiones innecesarias. [38]
La muestra se recoge extrayendo sangre en un tubo que contiene un anticoagulante (normalmente EDTA ) para detener su coagulación natural . [41] La sangre se suele extraer de una vena , pero cuando esto resulta difícil se puede recoger de los capilares mediante una punción en el dedo o en el talón en los bebés. [42] [43] Las pruebas se realizan normalmente en un analizador automático, pero se pueden utilizar técnicas manuales como un examen de frotis de sangre o una prueba de hematocrito manual para investigar resultados anormales. [44] Los recuentos de células y las mediciones de hemoglobina se realizan manualmente en laboratorios que carecen de acceso a instrumentos automatizados. [45]
A bordo del analizador, la muestra se agita para distribuir uniformemente las células, luego se diluye y se divide en al menos dos canales, uno de los cuales se utiliza para contar glóbulos rojos y plaquetas, el otro para contar glóbulos blancos y determinar la concentración de hemoglobina. Algunos instrumentos miden la hemoglobina en un canal separado, y se pueden utilizar canales adicionales para recuentos diferenciales de glóbulos blancos, recuentos de reticulocitos y mediciones especializadas de plaquetas. [46] [47] [48] Las células se suspenden en una corriente de fluido y se miden sus propiedades a medida que fluyen más allá de los sensores en una técnica conocida como citometría de flujo . [nota 3] [49] [52] El enfoque hidrodinámico se puede utilizar para aislar células individuales de modo que se puedan obtener resultados más precisos: la muestra diluida se inyecta en una corriente de fluido a baja presión, lo que hace que las células de la muestra se alineen en una sola fila a través del flujo laminar . [53] [54]


Para medir la concentración de hemoglobina, se añade un reactivo químico a la muestra para destruir ( lisar ) los glóbulos rojos en un canal separado del que se utiliza para el recuento de glóbulos rojos. En los analizadores que realizan recuentos de glóbulos blancos en el mismo canal que la medición de hemoglobina, esto permite contar los glóbulos blancos más fácilmente. [55] Los analizadores hematológicos miden la hemoglobina mediante espectrofotometría y se basan en la relación lineal entre la absorbancia de la luz y la cantidad de hemoglobina presente. Se utilizan productos químicos para convertir diferentes formas de hemoglobina, como la oxihemoglobina y la carboxihemoglobina , en una forma estable, normalmente cianmetahemoglobina , y para crear un cambio de color permanente. La absorbancia del color resultante, cuando se mide a una longitud de onda específica (normalmente 540 nanómetros ), corresponde a la concentración de hemoglobina. [56] [57]
Los sensores cuentan e identifican las células en la muestra utilizando dos principios principales: impedancia eléctrica y dispersión de la luz . [58] El conteo de células basado en impedancia funciona según el principio de Coulter : las células están suspendidas en un fluido que transporta una corriente eléctrica y, a medida que pasan a través de una pequeña abertura (una apertura), causan disminuciones en la corriente debido a su mala conductividad eléctrica . La amplitud del pulso de voltaje generado cuando una célula cruza la abertura se correlaciona con la cantidad de fluido desplazado por la célula y, por lo tanto, el volumen de la célula, [59] [60] mientras que el número total de pulsos se correlaciona con el número de células en la muestra. La distribución de los volúmenes celulares se traza en un histograma y, al establecer umbrales de volumen basados en los tamaños típicos de cada tipo de célula, se pueden identificar y contar las diferentes poblaciones de células. [61]
En las técnicas de dispersión de luz, la luz de un láser o una lámpara de tungsteno-halógeno se dirige a la corriente de células para recopilar información sobre su tamaño y estructura. Las células dispersan la luz en diferentes ángulos a medida que pasan a través del haz, lo que se detecta utilizando fotómetros . [62] La dispersión frontal, que se refiere a la cantidad de luz dispersada a lo largo del eje del haz, es causada principalmente por la difracción de la luz y se correlaciona con el tamaño celular, mientras que la dispersión lateral (luz dispersada en un ángulo de 90 grados) es causada por la reflexión y la refracción y proporciona información sobre la complejidad celular. [62] [63]
Los métodos basados en radiofrecuencia se pueden utilizar en combinación con la impedancia. Estas técnicas funcionan según el mismo principio de medición de la interrupción de la corriente cuando las células pasan a través de una abertura, pero dado que la corriente de RF de alta frecuencia penetra en las células, la amplitud del pulso resultante se relaciona con factores como el tamaño relativo del núcleo , la estructura del núcleo y la cantidad de gránulos en el citoplasma . [64] [65] Los glóbulos rojos pequeños y los restos celulares, que son similares en tamaño a las plaquetas, pueden interferir con el recuento de plaquetas, y las plaquetas grandes pueden no contarse con precisión, por lo que algunos analizadores utilizan técnicas adicionales para medir las plaquetas, como la tinción fluorescente , la dispersión de luz multiángulo y el marcado con anticuerpos monoclonales . [48]
La mayoría de los analizadores miden directamente el tamaño promedio de los glóbulos rojos, que se denomina volumen celular medio (VCM), y calculan el hematocrito multiplicando el recuento de glóbulos rojos por el VCM. Algunos miden el hematocrito comparando el volumen total de glóbulos rojos con el volumen de sangre muestreada y derivan el VCM a partir del hematocrito y el recuento de glóbulos rojos. [66] La concentración de hemoglobina, el recuento de glóbulos rojos y el hematocrito se utilizan para calcular la cantidad promedio de hemoglobina dentro de cada glóbulo rojo, la hemoglobina corpuscular media (HCM); y su concentración, la concentración de hemoglobina corpuscular media (HCCM). [67] Otro cálculo, el ancho de distribución de glóbulos rojos (RDW), se deriva de la desviación estándar del volumen celular medio y refleja la variación en el tamaño celular. [68]

Después de ser tratados con reactivos, los glóbulos blancos forman tres picos distintos cuando sus volúmenes se grafican en un histograma. Estos picos corresponden aproximadamente a poblaciones de granulocitos , linfocitos y otras células mononucleares , lo que permite realizar un diferencial de tres partes basándose solo en el volumen celular. [69] [70] Los analizadores más avanzados utilizan técnicas adicionales para proporcionar un diferencial de cinco a siete partes, como dispersión de luz o análisis de radiofrecuencia, [70] o utilizando tintes para teñir sustancias químicas específicas dentro de las células, por ejemplo, ácidos nucleicos , que se encuentran en concentraciones más altas en células inmaduras [71] o mieloperoxidasa , una enzima que se encuentra en células del linaje mieloide . [72] [73] Los basófilos se pueden contar en un canal separado donde un reactivo destruye otros glóbulos blancos y deja intactos a los basófilos. Los datos recopilados de estas mediciones se analizan y se grafican en un diagrama de dispersión , donde forman grupos que se correlacionan con cada tipo de glóbulo blanco. [70] [72] Otro enfoque para automatizar el recuento diferencial es el uso de software de microscopía digital, [74] que utiliza inteligencia artificial para clasificar los glóbulos blancos a partir de fotomicrografías del frotis de sangre. Las imágenes de las células se muestran a un operador humano, que puede reclasificar manualmente las células si es necesario. [75]
La mayoría de los analizadores tardan menos de un minuto en realizar todas las pruebas del hemograma completo. [58] Debido a que los analizadores toman muestras y cuentan muchas células individuales, los resultados son muy precisos. [76] Sin embargo, es posible que algunas células anormales no se identifiquen correctamente, lo que requiere una revisión manual de los resultados del instrumento y la identificación por otros medios de células anormales que el instrumento no pudo categorizar. [5] [77]
Las pruebas en el punto de atención se refieren a pruebas realizadas fuera del entorno de laboratorio, como en la cama de una persona o en una clínica. [78] [79] Este método de prueba es más rápido y utiliza menos sangre que los métodos convencionales, y no requiere personal especialmente capacitado, por lo que es útil en situaciones de emergencia y en áreas con acceso limitado a los recursos. Los dispositivos comúnmente utilizados para las pruebas de hematología en el punto de atención incluyen el HemoCue , un analizador portátil que utiliza espectrofotometría para medir la concentración de hemoglobina de la muestra, y el i-STAT , que deriva una lectura de hemoglobina estimando la concentración de glóbulos rojos a partir de la conductividad de la sangre. [79] La hemoglobina y el hematocrito se pueden medir en dispositivos de punto de atención diseñados para pruebas de gases en sangre , pero estas mediciones a veces se correlacionan mal con las obtenidas a través de métodos estándar. [78] Existen versiones simplificadas de analizadores de hematología diseñados para su uso en clínicas que pueden proporcionar un hemograma completo y diferencial. [80]
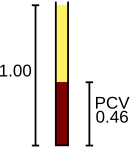
Las pruebas se pueden realizar manualmente cuando no se dispone de equipo automatizado o cuando los resultados del analizador indican que se necesita más investigación. [45] Los resultados automatizados se marcan para la revisión manual del frotis de sangre en el 10-25% de los casos, lo que puede deberse a poblaciones de células anormales que el analizador no puede contar correctamente, [5] banderas internas generadas por el analizador que sugieren que los resultados podrían ser inexactos, [81] o resultados numéricos que caen fuera de los umbrales establecidos. [77] Para investigar estos problemas, la sangre se extiende en un portaobjetos de microscopio, se tiñe con una tinción de Romanowsky y se examina bajo un microscopio . [82] Se evalúa la apariencia de los glóbulos rojos y blancos y las plaquetas, y se informan las anomalías cualitativas si están presentes. [83] Los cambios en la apariencia de los glóbulos rojos pueden tener una importancia diagnóstica considerable; por ejemplo, la presencia de células falciformes es indicativa de enfermedad de células falciformes , y una gran cantidad de glóbulos rojos fragmentados ( esquistocitos ) requiere una investigación urgente, ya que puede sugerir una anemia hemolítica microangiopática . [84] En algunas condiciones inflamatorias y en trastornos paraproteicos como el mieloma múltiple , los altos niveles de proteína en la sangre pueden hacer que los glóbulos rojos aparezcan apilados juntos en el frotis, lo que se denomina rouleaux . [85] Algunas enfermedades parasitarias , como la malaria y la babesiosis , se pueden detectar al encontrar los organismos causantes en el frotis de sangre, [86] y el recuento de plaquetas se puede estimar a partir del frotis de sangre, lo que es útil si el recuento de plaquetas automatizado es inexacto. [77]
Para realizar un diferencial manual de glóbulos blancos, el microscopista cuenta 100 células en el frotis de sangre y las clasifica según su apariencia; a veces se cuentan 200 células. [87] Esto da el porcentaje de cada tipo de glóbulo blanco, y al multiplicar estos porcentajes por el número total de glóbulos blancos, se puede obtener el número absoluto de cada tipo de glóbulo blanco. [88] El recuento manual está sujeto a errores de muestreo porque se cuentan tan pocas células en comparación con el análisis automatizado, [76] pero puede identificar células anormales que los analizadores no pueden, [72] [77] como las células blásticas que se ven en la leucemia aguda. [89] Las características clínicamente significativas como la granulación tóxica y la vacuolización también se pueden determinar a partir del examen microscópico de los glóbulos blancos. [90]
El hematocrito se puede realizar manualmente llenando un tubo capilar con sangre, centrifugándolo y midiendo el porcentaje de sangre que consiste en glóbulos rojos. [66] Esto es útil en algunas condiciones que pueden causar que los resultados automatizados del hematocrito sean incorrectos, como la policitemia (un recuento de glóbulos rojos muy elevado) [66] o la leucocitosis grave (un recuento de glóbulos blancos muy elevado, que interfiere con las mediciones de glóbulos rojos al hacer que los glóbulos blancos se cuenten como glóbulos rojos). [91]
Los glóbulos rojos y blancos y las plaquetas se pueden contar utilizando un hemocitómetro , un portaobjetos de microscopio que contiene una cámara que contiene un volumen específico de sangre diluida. La cámara del hemocitómetro está grabada con una cuadrícula calibrada para ayudar en el recuento de células. Las células que se ven en la cuadrícula se cuentan y se dividen por el volumen de sangre examinado, que se determina a partir del número de cuadrados contados en la cuadrícula, para obtener la concentración de células en la muestra. [45] [92] Los recuentos de células manuales requieren mucha mano de obra e inexactos en comparación con los métodos automatizados, por lo que rara vez se utilizan excepto en laboratorios que no tienen acceso a analizadores automatizados. [45] [92] Para contar los glóbulos blancos, la muestra se diluye utilizando un fluido que contiene un compuesto que lisa los glóbulos rojos, como el oxalato de amonio , el ácido acético o el ácido clorhídrico . [93] A veces se agrega un tinte al diluyente que resalta los núcleos de los glóbulos blancos, lo que facilita su identificación. Los recuentos de plaquetas manuales se realizan de manera similar, aunque algunos métodos dejan intactos los glóbulos rojos. El uso de un microscopio de contraste de fases , en lugar de un microscopio óptico , puede facilitar la identificación de las plaquetas. [94] El recuento manual de glóbulos rojos rara vez se realiza, ya que es inexacto y hay otros métodos como la hemoglobinometría y el hematocrito manual para evaluar los glóbulos rojos; pero si es necesario hacerlo, los glóbulos rojos se pueden contar en sangre que se ha diluido con solución salina. [95]
La hemoglobina se puede medir manualmente utilizando un espectrofotómetro o un colorímetro . Para medir la hemoglobina manualmente, la muestra se diluye utilizando reactivos que destruyen los glóbulos rojos para liberar la hemoglobina. Se utilizan otros productos químicos para convertir diferentes tipos de hemoglobina en una forma, lo que permite medirla fácilmente. Luego, la solución se coloca en una cubeta de medición y se mide la absorbancia a una longitud de onda específica, que depende del tipo de reactivo utilizado. Se utiliza un estándar de referencia que contiene una cantidad conocida de hemoglobina para determinar la relación entre la absorbancia y la concentración de hemoglobina, lo que permite medir el nivel de hemoglobina de la muestra. [96]
En las zonas rurales y económicamente desfavorecidas, la disponibilidad de pruebas está limitada por el acceso a equipos y personal. En los centros de atención primaria de estas regiones, las pruebas pueden limitarse al examen de la morfología de los glóbulos rojos y la medición manual de la hemoglobina, mientras que las técnicas más complejas, como los recuentos celulares manuales y diferenciales, y a veces los recuentos celulares automatizados, se realizan en los laboratorios de distrito. Los hospitales regionales y provinciales y los centros académicos suelen tener acceso a analizadores automatizados. Cuando no se dispone de instalaciones de laboratorio, se puede obtener una estimación de la concentración de hemoglobina colocando una gota de sangre en un tipo estandarizado de papel absorbente y comparándola con una escala de colores. [97]
Los analizadores automáticos deben calibrarse periódicamente . La mayoría de los fabricantes proporcionan sangre conservada con parámetros definidos y los analizadores se ajustan si los resultados están fuera de los umbrales definidos. [98] Para garantizar que los resultados sigan siendo precisos, las muestras de control de calidad, que normalmente proporciona el fabricante del instrumento, se analizan al menos una vez al día. Las muestras se formulan para proporcionar resultados específicos y los laboratorios comparan sus resultados con los valores conocidos para garantizar que el instrumento funciona correctamente. [99] [100] Para los laboratorios sin acceso a material de control de calidad comercial, una organización reguladora india recomienda ejecutar muestras de pacientes por duplicado y comparar los resultados. [101] Una medición de promedio móvil , en la que los resultados promedio de las muestras de pacientes se miden a intervalos establecidos, se puede utilizar como una técnica de control de calidad adicional. Suponiendo que las características de la población de pacientes permanecen aproximadamente iguales a lo largo del tiempo, el promedio debe permanecer constante; grandes cambios en el valor promedio pueden indicar problemas en el instrumento. [99] [100] Los valores de MCHC son particularmente útiles en este sentido. [102]
Además de analizar muestras de control de calidad interno con resultados conocidos, los laboratorios pueden recibir muestras de evaluación de calidad externa de organizaciones reguladoras. Si bien el propósito del control de calidad interno es garantizar que los resultados del analizador sean reproducibles dentro de un laboratorio determinado, la evaluación de calidad externa verifica que los resultados de diferentes laboratorios sean consistentes entre sí y con los valores objetivo. [103] Los resultados esperados para las muestras de evaluación de calidad externa no se revelan al laboratorio. [104] Los programas de evaluación de calidad externa se han adoptado ampliamente en América del Norte y Europa occidental, [99] y a menudo se requiere que los laboratorios participen en estos programas para mantener la acreditación . [105] Los problemas logísticos pueden dificultar que los laboratorios en áreas con pocos recursos implementen esquemas de evaluación de calidad externa. [106]
El hemograma mide la cantidad de plaquetas y glóbulos rojos y blancos, junto con los valores de hemoglobina y hematocrito. Los índices de glóbulos rojos (MCV, MCH y MCHC), que describen el tamaño de los glóbulos rojos y su contenido de hemoglobina, se informan junto con el ancho de distribución de glóbulos rojos (RDW), que mide la cantidad de variación en los tamaños de los glóbulos rojos. Se puede realizar un diferencial de glóbulos blancos, que enumera los diferentes tipos de glóbulos blancos, y a veces se incluye un recuento de glóbulos rojos inmaduros (reticulocitos). [4] [107]
Los glóbulos rojos transportan oxígeno desde los pulmones a los tejidos y, a su regreso, llevan dióxido de carbono de vuelta a los pulmones, donde se exhala. Estas funciones están mediadas por la hemoglobina de las células. [109] El analizador cuenta los glóbulos rojos, informando el resultado en unidades de 10 6 células por microlitro de sangre (× 10 6 /μL) o 10 12 células por litro (× 10 12 /L), y mide su tamaño promedio, que se denomina volumen celular medio y se expresa en femtolitros o micrómetros cúbicos. [4] Al multiplicar el volumen celular medio por el recuento de glóbulos rojos, se puede derivar el hematocrito (HCT) o el volumen celular empaquetado (PCV), una medida del porcentaje de sangre que está compuesta de glóbulos rojos; [66] y cuando el hematocrito se realiza directamente, el volumen celular medio se puede calcular a partir del hematocrito y el recuento de glóbulos rojos. [110] [111] La hemoglobina, medida después de la lisis de los glóbulos rojos, se expresa generalmente en gramos por litro (g/L) o gramos por decilitro (g/dL). [112] Suponiendo que los glóbulos rojos son normales, existe una relación constante entre la hemoglobina y el hematocrito: el porcentaje del hematocrito es aproximadamente tres veces mayor que el valor de la hemoglobina en g/dL, más o menos tres. Esta relación, llamada regla de tres , se puede utilizar para confirmar que los resultados del hemograma completo son correctos. [113]
Otras dos mediciones se calculan a partir del recuento de glóbulos rojos, la concentración de hemoglobina y el hematocrito: la hemoglobina corpuscular media y la concentración de hemoglobina corpuscular media . [114] [115] Estos parámetros describen el contenido de hemoglobina de cada glóbulo rojo. El MCH y el MCHC pueden ser confusos; en esencia, el MCH es una medida de la cantidad promedio de hemoglobina por glóbulo rojo. El MCHC da la proporción promedio de la célula que es hemoglobina. El MCH no tiene en cuenta el tamaño de los glóbulos rojos, mientras que el MCHC sí. [116] En conjunto, el MCV, el MCH y el MCHC se denominan índices de glóbulos rojos . [114] [115] Los cambios en estos índices son visibles en el frotis de sangre: los glóbulos rojos que son anormalmente grandes o pequeños se pueden identificar por comparación con los tamaños de los glóbulos blancos, y las células con una baja concentración de hemoglobina aparecen pálidas. [117] Otro parámetro se calcula a partir de las mediciones iniciales de los glóbulos rojos: el ancho de distribución de glóbulos rojos o RDW, que refleja el grado de variación en el tamaño de las células. [118]
.jpg/440px-Iron-deficiency_Anemia,_Peripheral_Blood_Smear_(4422704616).jpg)
Un nivel anormalmente bajo de hemoglobina, hematocrito o recuento de glóbulos rojos indica anemia. [119] La anemia no es un diagnóstico en sí misma, pero apunta a una condición subyacente que afecta a los glóbulos rojos de la persona. [88] Las causas generales de anemia incluyen pérdida de sangre, producción de glóbulos rojos defectuosos ( eritropoyesis ineficaz ), disminución de la producción de glóbulos rojos (eritropoyesis insuficiente) y mayor destrucción de glóbulos rojos ( anemia hemolítica ). [120] La anemia reduce la capacidad de la sangre para transportar oxígeno, lo que causa síntomas como cansancio y dificultad para respirar. [121] Si el nivel de hemoglobina cae por debajo de los umbrales basados en la condición clínica de la persona, puede ser necesaria una transfusión de sangre. [122]
Un aumento en el número de glóbulos rojos, que conduce a un aumento en la hemoglobina y el hematocrito, [nota 4] se llama policitemia . [126] La deshidratación o el uso de diuréticos pueden causar una policitemia "relativa" al disminuir la cantidad de plasma en comparación con los glóbulos rojos. Un verdadero aumento en el número de glóbulos rojos, llamado policitemia absoluta, puede ocurrir cuando el cuerpo produce más glóbulos rojos para compensar los niveles crónicamente bajos de oxígeno en condiciones como enfermedad pulmonar o cardíaca , o cuando una persona tiene niveles anormalmente altos de eritropoyetina , una hormona que estimula la producción de glóbulos rojos. En la policitemia vera , la médula ósea produce glóbulos rojos y otras células sanguíneas a una tasa excesivamente alta. [127]
La evaluación de los índices de glóbulos rojos es útil para determinar la causa de la anemia. Si el VCM es bajo, la anemia se denomina microcítica , mientras que la anemia con un VCM alto se llama anemia macrocítica . La anemia con una CHCM baja se llama anemia hipocrómica . Si hay anemia pero los índices de glóbulos rojos son normales, la anemia se considera normocrómica y normocítica . [117] El término hipercromía , que se refiere a una CHCM alta, generalmente no se utiliza. La elevación de la CHCM por encima del valor de referencia superior es rara y ocurre principalmente en afecciones como esferocitosis , anemia de células falciformes y enfermedad de la hemoglobina C. [ 115] [128] Una CHCM elevada también puede ser un resultado falso de afecciones como la aglutinación de glóbulos rojos (que causa una disminución falsa en el recuento de glóbulos rojos, elevando la CHCM) [129] [130] o cantidades altamente elevadas de lípidos en la sangre (que causa un aumento falso en el resultado de hemoglobina). [128] [131]
La anemia microcítica se asocia típicamente con deficiencia de hierro, talasemia y anemia de enfermedad crónica , mientras que la anemia macrocítica se asocia con alcoholismo , deficiencia de folato y B12 , uso de algunos medicamentos y algunas enfermedades de la médula ósea. La pérdida aguda de sangre, la anemia hemolítica, los trastornos de la médula ósea y varias enfermedades crónicas pueden dar lugar a anemia con un cuadro sanguíneo normocítico. [115] [132] El MCV tiene un propósito adicional en el control de calidad de laboratorio. Es relativamente estable en el tiempo en comparación con otros parámetros del hemograma completo, por lo que un gran cambio en el MCV puede indicar que la muestra se extrajo del paciente equivocado. [133]
Un RDW bajo no tiene importancia clínica, pero un RDW elevado representa una mayor variación en el tamaño de los glóbulos rojos, una condición conocida como anisocitosis . [118] La anisocitosis es común en anemias nutricionales como la anemia por deficiencia de hierro y la anemia debido a la deficiencia de vitamina B12 o folato, mientras que las personas con talasemia pueden tener un RDW normal. [118] Con base en los resultados del hemograma completo, se pueden tomar medidas adicionales para investigar la anemia, como una prueba de ferritina para confirmar la presencia de deficiencia de hierro, o una electroforesis de hemoglobina para diagnosticar una hemoglobinopatía como la talasemia o la enfermedad de células falciformes. [134]
Los glóbulos blancos defienden contra las infecciones y están involucrados en la respuesta inflamatoria . [136] Un recuento alto de glóbulos blancos, que se llama leucocitosis, a menudo ocurre en infecciones, inflamación y estados de estrés fisiológico . También puede ser causado por enfermedades que implican una producción anormal de células sanguíneas, como trastornos mieloproliferativos y linfoproliferativos . [137] Un recuento disminuido de glóbulos blancos, llamado leucopenia , puede conducir a un mayor riesgo de contraer infecciones, [138] y ocurre en tratamientos como la quimioterapia y la radioterapia y muchas afecciones que inhiben la producción de células sanguíneas. [139] La sepsis se asocia tanto con leucocitosis como con leucopenia. [140] El recuento total de glóbulos blancos generalmente se informa en células por microlitro de sangre (/μL) o 10 9 células por litro (× 10 9 /L). [4]
En el diferencial de glóbulos blancos, se identifican y cuentan los diferentes tipos de glóbulos blancos. Los resultados se informan como un porcentaje y como un número absoluto por unidad de volumen. Por lo general, se miden cinco tipos de glóbulos blancos: neutrófilos , linfocitos , monocitos , eosinófilos y basófilos . [141] Algunos instrumentos informan el número de granulocitos inmaduros, que es una clasificación que consiste en precursores de neutrófilos; específicamente, promielocitos , mielocitos y metamielocitos . [nota 5] [144] Se informan otros tipos de células si se identifican en el diferencial manual. [145]
Los resultados diferenciales son útiles para diagnosticar y controlar muchas afecciones médicas. Por ejemplo, un recuento elevado de neutrófilos ( neutrofilia ) se asocia con infecciones bacterianas, inflamación y trastornos mieloproliferativos, [146] [147] mientras que un recuento disminuido ( neutropenia ) puede ocurrir en personas que están recibiendo quimioterapia o tomando ciertos medicamentos, o que tienen enfermedades que afectan la médula ósea. [148] [149] La neutropenia también puede ser causada por algunos trastornos congénitos y puede ocurrir transitoriamente después de infecciones virales o bacterianas en niños. [150] Las personas con neutropenia grave y signos clínicos de infección son tratadas con antibióticos para prevenir enfermedades potencialmente mortales. [151]

Un mayor número de neutrófilos en banda (neutrófilos jóvenes que carecen de núcleos segmentados) o granulocitos inmaduros se denomina desplazamiento a la izquierda y ocurre en la sepsis y algunos trastornos sanguíneos, pero es normal en el embarazo. [152] [153] Un recuento elevado de linfocitos ( linfocitosis ) se asocia con infección viral [6] y trastornos linfoproliferativos como la leucemia linfocítica crónica ; [154] los recuentos elevados de monocitos ( monocitosis ) se asocian con estados inflamatorios crónicos; [155] y el recuento de eosinófilos a menudo aumenta ( eosinofilia ) en infecciones parasitarias y condiciones alérgicas. [156] Un mayor número de basófilos, denominado basofilia , puede ocurrir en trastornos mieloproliferativos como la leucemia mieloide crónica y la policitemia vera. [147] La presencia de algunos tipos de células anormales, como células blásticas o linfocitos con características neoplásicas, es sugestiva de una neoplasia maligna hematológica . [89] [157]
.jpg/440px-Essential_Thrombocythemia,_Peripheral_Blood_(10189570483).jpg)
Las plaquetas desempeñan un papel esencial en la coagulación. Cuando la pared de un vaso sanguíneo está dañada, las plaquetas se adhieren a la superficie expuesta en el sitio de la lesión y tapan el hueco. La activación simultánea de la cascada de coagulación da como resultado la formación de fibrina , que refuerza el tapón plaquetario para crear un coágulo estable . [158] Un recuento bajo de plaquetas, conocido como trombocitopenia, puede causar sangrado si es grave. [159] Puede ocurrir en personas que se someten a tratamientos que suprimen la médula ósea, como quimioterapia o radioterapia, o que toman ciertos medicamentos, como heparina, que pueden inducir al sistema inmunológico a destruir las plaquetas. La trombocitopenia es una característica de muchos trastornos sanguíneos, como la leucemia aguda y la anemia aplásica , así como algunas enfermedades autoinmunes . [160] [161] Si el recuento de plaquetas es extremadamente bajo, se puede realizar una transfusión de plaquetas. [162] La trombocitosis , es decir, un recuento elevado de plaquetas, puede ocurrir en estados de inflamación o trauma, [163] así como en la deficiencia de hierro, [164] y el recuento de plaquetas puede alcanzar niveles excepcionalmente altos en personas con trombocitemia esencial , una enfermedad sanguínea rara. [163] El recuento de plaquetas se puede informar en unidades de células por microlitro de sangre (/μL), [165] 10 3 células por microlitro (× 10 3 /μL) o 10 9 células por litro (× 10 9 /L). [4]
El volumen plaquetario medio (VPM) mide el tamaño promedio de las plaquetas en femtolitros. Puede ayudar a determinar la causa de la trombocitopenia; un VPM elevado puede ocurrir cuando se liberan plaquetas jóvenes en el torrente sanguíneo para compensar la mayor destrucción de plaquetas, mientras que la producción reducida de plaquetas debido a la disfunción de la médula ósea puede resultar en un VPM bajo. El VPM también es útil para diferenciar entre enfermedades congénitas que causan trombocitopenia. [118] [166] Algunos analizadores informan la fracción de plaquetas inmaduras (FPI) o el recuento de plaquetas reticuladas y brindan información sobre la tasa de producción de plaquetas midiendo la cantidad de plaquetas inmaduras en la sangre. [167]
Los reticulocitos son glóbulos rojos inmaduros que, a diferencia de las células maduras, contienen ARN . A veces se realiza un recuento de reticulocitos como parte de un hemograma completo, generalmente para investigar la causa de la anemia de una persona o evaluar su respuesta al tratamiento. La anemia con un recuento alto de reticulocitos puede indicar que la médula ósea está produciendo glóbulos rojos a un ritmo mayor para compensar la pérdida de sangre o la hemólisis, [74] mientras que la anemia con un recuento bajo de reticulocitos puede sugerir que la persona tiene una afección que reduce la capacidad del cuerpo para producir glóbulos rojos. [168] Cuando a las personas con anemia nutricional se les administran suplementos nutricionales, un aumento en el recuento de reticulocitos indica que su cuerpo está respondiendo al tratamiento produciendo más glóbulos rojos. [169] Los analizadores hematológicos realizan recuentos de reticulocitos tiñendo los glóbulos rojos con un tinte que se une al ARN y midiendo la cantidad de reticulocitos a través del análisis de dispersión de luz o fluorescencia. La prueba se puede realizar manualmente tiñendo la sangre con azul de metileno nuevo y contando el porcentaje de glóbulos rojos que contienen ARN bajo el microscopio. El recuento de reticulocitos se expresa como un número absoluto [168] o como un porcentaje de glóbulos rojos. [170]
Algunos instrumentos miden la cantidad promedio de hemoglobina en cada reticulocito; un parámetro que se ha estudiado como un indicador de deficiencia de hierro en personas que tienen afecciones que interfieren con las pruebas estándar. [171] La fracción de reticulocitos inmaduros (FRI) es otra medición producida por algunos analizadores que cuantifica la madurez de los reticulocitos: las células que son menos maduras contienen más ARN y, por lo tanto, producen una señal fluorescente más fuerte. Esta información puede ser útil para diagnosticar anemias y evaluar la producción de glóbulos rojos después del tratamiento de la anemia o el trasplante de médula ósea . [172]

Durante su formación en la médula ósea, el hígado y el bazo de los fetos, [173] los glóbulos rojos contienen un núcleo celular, que suele estar ausente en las células maduras que circulan en el torrente sanguíneo. Los glóbulos rojos nucleados son normales en los recién nacidos, [174] pero cuando se detectan en niños y adultos, indican una mayor demanda de glóbulos rojos, que puede ser causada por hemorragias, algunos cánceres y anemia. [118] La mayoría de los analizadores pueden detectar estas células como parte del recuento diferencial de células. Un número elevado de glóbulos rojos nucleados puede provocar un recuento de glóbulos blancos falsamente alto, que requerirá un ajuste. [175]
Los analizadores hematológicos avanzados generan nuevas mediciones de células sanguíneas que han demostrado importancia diagnóstica en estudios de investigación pero que aún no han encontrado un uso clínico generalizado. [171] Por ejemplo, algunos tipos de analizadores producen lecturas de coordenadas que indican el tamaño y la posición de cada grupo de glóbulos blancos. Estos parámetros (denominados datos de población celular) [176] se han estudiado como marcadores potenciales para trastornos sanguíneos, infecciones bacterianas y malaria. Los analizadores que utilizan tinción de mieloperoxidasa para producir recuentos diferenciales pueden medir la expresión de la enzima en los glóbulos blancos, que se altera en varios trastornos. [75] Algunos instrumentos pueden informar el porcentaje de glóbulos rojos que son hipocrómicos además de informar el valor promedio de MCHC, o proporcionar un recuento de glóbulos rojos fragmentados ( esquistocitos ), [171] que ocurren en algunos tipos de anemia hemolítica. [177] Debido a que estos parámetros a menudo son específicos de marcas particulares de analizadores, es difícil para los laboratorios interpretar y comparar los resultados. [171]
El hemograma completo se interpreta comparando el resultado con los rangos de referencia, que representan los resultados encontrados en el 95% de personas aparentemente sanas. [35] Con base en una distribución normal estadística , los rangos de las muestras analizadas varían con el sexo y la edad. [179]
En promedio, las mujeres adultas tienen valores más bajos de hemoglobina, hematocrito y recuento de glóbulos rojos que los hombres; la diferencia disminuye, pero todavía está presente, después de la menopausia . [180] Los resultados del hemograma completo para niños y recién nacidos difieren de los de los adultos. La hemoglobina, el hematocrito y el recuento de glóbulos rojos de los recién nacidos son extremadamente altos para compensar los bajos niveles de oxígeno en el útero y la alta proporción de hemoglobina fetal , que es menos eficaz para transportar oxígeno a los tejidos que las formas maduras de hemoglobina, dentro de sus glóbulos rojos. [181] [182] El VCM también aumenta y el recuento de glóbulos blancos se eleva con una preponderancia de neutrófilos. [181] [183] El recuento de glóbulos rojos y los valores relacionados comienzan a disminuir poco después del nacimiento, alcanzando su punto más bajo aproximadamente a los dos meses de edad y aumentando a partir de entonces. [184] [185] Los glóbulos rojos de los bebés mayores y los niños son más pequeños, con un MCH más bajo, que los de los adultos. En el diferencial de glóbulos blancos pediátricos, los linfocitos a menudo superan en número a los neutrófilos, mientras que en los adultos predominan los neutrófilos. [181]
Otras diferencias entre poblaciones pueden afectar los rangos de referencia: por ejemplo, las personas que viven a mayores altitudes tienen valores más altos de hemoglobina, hematocrito y glóbulos rojos, y las personas de ascendencia africana tienen recuentos de glóbulos blancos más bajos en promedio. [186] El tipo de analizador utilizado para realizar el hemograma completo también afecta los rangos de referencia. Por lo tanto, los rangos de referencia son establecidos por laboratorios individuales en función de sus propias poblaciones de pacientes y equipos. [187] [188]
Algunas condiciones médicas o problemas con la muestra de sangre pueden producir resultados inexactos. Si la muestra está visiblemente coagulada, lo que puede ser causado por una mala técnica de flebotomía , no es adecuada para la prueba, porque el recuento de plaquetas disminuirá falsamente y otros resultados pueden ser anormales. [189] [190] Las muestras almacenadas a temperatura ambiente durante varias horas pueden dar lecturas falsamente altas para MCV ( volumen corpuscular medio ), [191] porque los glóbulos rojos se hinchan a medida que absorben agua del plasma; y los resultados diferenciales de plaquetas y glóbulos blancos pueden ser inexactos en muestras antiguas, ya que las células se degradan con el tiempo. [91]

Las muestras extraídas de individuos con niveles muy altos de bilirrubina o lípidos en el plasma (denominadas muestra ictérica o muestra lipémica, respectivamente) [192] pueden mostrar lecturas falsamente altas de hemoglobina, porque estas sustancias cambian el color y la opacidad de la muestra, lo que interfiere en la medición de la hemoglobina. [193] Este efecto se puede mitigar reemplazando el plasma con solución salina. [91]
Algunas personas producen un anticuerpo que hace que sus plaquetas formen grumos cuando se les extrae sangre en tubos que contienen EDTA, el anticoagulante que se utiliza normalmente para recoger muestras de hemograma completo. Los grumos de plaquetas pueden contarse como plaquetas individuales mediante analizadores automáticos, lo que da lugar a un recuento de plaquetas falsamente disminuido. Esto se puede evitar utilizando un anticoagulante alternativo como el citrato de sodio o la heparina . [194] [195]
Otra afección mediada por anticuerpos que puede afectar los resultados del hemograma completo es la aglutinación de glóbulos rojos . Este fenómeno hace que los glóbulos rojos se agrupen debido a los anticuerpos unidos a la superficie celular. [196] El analizador cuenta los agregados de glóbulos rojos como células individuales, lo que lleva a una disminución notable del recuento de glóbulos rojos y del hematocrito, y a una elevación notable del VCM y la HCM ( concentración de hemoglobina corpuscular media ). [53] A menudo, estos anticuerpos solo son activos a temperatura ambiente (en cuyo caso se denominan aglutininas frías ) y la aglutinación se puede revertir calentando la muestra a 37 °C (99 °F). Las muestras de personas con anemia hemolítica autoinmune caliente pueden presentar aglutinación de glóbulos rojos que no se resuelve con el calentamiento. [130]
Si bien las células blásticas y linfomatosas pueden identificarse en el diagnóstico diferencial manual, el examen microscópico no puede determinar de manera confiable el linaje hematopoyético de las células. Esta información suele ser necesaria para diagnosticar cánceres de la sangre. Una vez identificadas las células anormales, se pueden utilizar técnicas adicionales, como la inmunofenotipificación por citometría de flujo, para identificar marcadores que brinden información adicional sobre las células. [197] [198]
,_United_Kingdom,_1850-1950.jpg/440px-Haemoglobinometer_(hemoglobinometer),_United_Kingdom,_1850-1950.jpg)
Antes de que se introdujeran los contadores de células automatizados , los análisis de hemograma completo se realizaban manualmente: los glóbulos blancos, rojos y plaquetas se contaban utilizando microscopios. [200] La primera persona en publicar observaciones microscópicas de células sanguíneas fue Antonie van Leeuwenhoek , [201] quien informó sobre la apariencia de los glóbulos rojos en una carta de 1674 a las Actas de la Royal Society de Londres . [202] Jan Swammerdam había descrito los glóbulos rojos algunos años antes, pero no publicó sus hallazgos en ese momento. A lo largo de los siglos XVIII y XIX, las mejoras en la tecnología de los microscopios, como las lentes acromáticas, permitieron contar los glóbulos blancos y las plaquetas en muestras no teñidas. [203]
Al fisiólogo Karl Vierordt se le atribuye la realización del primer hemograma. [8] [204] [205] Su técnica, publicada en 1852, implicaba aspirar un volumen de sangre cuidadosamente medido en un tubo capilar y extenderlo sobre un portaobjetos de microscopio cubierto con clara de huevo . Después de que la sangre se secó, contó cada célula en el portaobjetos; este proceso podía tardar más de tres horas en completarse. [206] El hemocitómetro, introducido en 1874 por Louis-Charles Malassez , simplificó el recuento microscópico de células sanguíneas. [207] El hemocitómetro de Malassez consistía en un portaobjetos de microscopio que contenía un tubo capilar aplanado. La sangre diluida se introducía en la cámara capilar por medio de un tubo de goma unido a un extremo, y se adjuntaba un ocular con una rejilla escalada al microscopio, lo que permitía al microscopista contar el número de células por volumen de sangre. En 1877, William Gowers inventó un hemocitómetro con una rejilla de conteo incorporada, eliminando la necesidad de producir oculares especialmente calibrados para cada microscopio. [208]
.jpg/440px-Portrait_of_Dimitriy_Leonidovitch_Romanovsky_Wellcome_L0002501_(cropped).jpg)
En la década de 1870, Paul Ehrlich desarrolló una técnica de tinción que utilizaba una combinación de un colorante ácido y básico que podía distinguir diferentes tipos de glóbulos blancos y permitir examinar la morfología de los glóbulos rojos. [203] Dmitri Leonidovich Romanowsky mejoró esta técnica en la década de 1890, utilizando una mezcla de eosina y azul de metileno envejecido para producir una amplia gama de tonos que no estaban presentes cuando se utilizaba cualquiera de los colorantes por separado. Esto se convirtió en la base de la tinción de Romanowsky, la técnica que todavía se utiliza para teñir frotis de sangre para su revisión manual. [209]
Las primeras técnicas para medir la hemoglobina se idearon a finales del siglo XIX e implicaban comparaciones visuales del color de la sangre diluida con un estándar conocido. [205] Los intentos de automatizar este proceso mediante espectrofotometría y colorimetría se vieron limitados por el hecho de que la hemoglobina está presente en la sangre en muchas formas diferentes, lo que significa que no se podía medir en una única longitud de onda . En 1920, se introdujo un método para convertir las diferentes formas de hemoglobina en una forma estable (cianmetahemoglobina o cianuro de hemoglobina), lo que permitió medir automáticamente los niveles de hemoglobina. El método de la cianmetahemoglobina sigue siendo el método de referencia para la medición de la hemoglobina y todavía se utiliza en muchos analizadores hematológicos automatizados. [57] [210] [211]
A Maxwell Wintrobe se le atribuye la invención de la prueba del hematocrito. [66] [212] En 1929, emprendió un proyecto de doctorado en la Universidad de Tulane para determinar los rangos normales de los parámetros de los glóbulos rojos e inventó un método conocido como el hematocrito de Wintrobe. Las mediciones del hematocrito ya se habían descrito en la literatura, pero el método de Wintrobe se diferenciaba en que utilizaba un tubo grande que podía producirse en masa según especificaciones precisas, con una escala incorporada. La fracción de glóbulos rojos en el tubo se medía después de la centrifugación para determinar el hematocrito. La invención de un método reproducible para determinar los valores del hematocrito permitió a Wintrobe definir los índices de glóbulos rojos. [205]

La investigación sobre el recuento automático de células comenzó a principios del siglo XX. [211] Un método desarrollado en 1928 utilizó la cantidad de luz transmitida a través de una muestra de sangre diluida, medida por fotometría, para estimar el recuento de glóbulos rojos, pero esto resultó inexacto para muestras con glóbulos rojos anormales. [8] Otros intentos fallidos, en las décadas de 1930 y 1940, involucraron detectores fotoeléctricos conectados a microscopios, que contarían las células a medida que eran escaneadas. [211] A fines de la década de 1940, Wallace H. Coulter , motivado por la necesidad de mejores métodos de recuento de glóbulos rojos después del bombardeo de Hiroshima y Nagasaki , [213] intentó mejorar las técnicas de recuento de células fotoeléctricas. [nota 7] Su investigación fue ayudada por su hermano, Joseph R. Coulter, en un laboratorio del sótano en Chicago. [60] Sus resultados usando métodos fotoeléctricos fueron decepcionantes, y en 1948, después de leer un artículo que relacionaba la conductividad de la sangre con su concentración de glóbulos rojos, Wallace ideó el principio de Coulter, la teoría de que una célula suspendida en un medio conductor genera una caída de corriente proporcional a su tamaño a medida que pasa a través de una abertura. [213]
En octubre de ese mismo año, Wallace construyó un contador para demostrar el principio. Debido a limitaciones financieras, la abertura se hizo quemando un agujero en un trozo de celofán de un paquete de cigarrillos. [60] [213] Wallace presentó una patente para la técnica en 1949, y en 1951 solicitó a la Oficina de Investigación Naval que financiara el desarrollo del contador Coulter . [213] La solicitud de patente de Wallace fue concedida en 1953, y después de las mejoras en la abertura y la introducción de un manómetro de mercurio para proporcionar un control preciso sobre el tamaño de la muestra, los hermanos fundaron Coulter Electronics Inc. en 1958 para comercializar sus instrumentos. El contador Coulter fue diseñado inicialmente para contar glóbulos rojos, pero con modificaciones posteriores demostró ser eficaz para contar glóbulos blancos. [60] Los contadores Coulter fueron ampliamente adoptados por los laboratorios médicos. [211]
El primer analizador capaz de producir múltiples recuentos de células simultáneamente fue el Technicon SMA 4A−7A , lanzado en 1965. Lo logró dividiendo las muestras de sangre en dos canales: uno para contar glóbulos rojos y blancos y otro para medir la hemoglobina. Sin embargo, el instrumento no era confiable y era difícil de mantener. En 1968, se lanzó el analizador Coulter Model S y ganó un uso generalizado. De manera similar al instrumento Technicon, utilizaba dos cámaras de reacción diferentes, una de las cuales se usaba para el recuento de glóbulos rojos y otra para el recuento de glóbulos blancos y la determinación de hemoglobina. El Model S también determinaba el volumen celular medio utilizando mediciones de impedancia, lo que permitía derivar los índices de glóbulos rojos y el hematocrito. Los recuentos de plaquetas automatizados se introdujeron en 1970 con el instrumento Hemalog-8 de Technicon y fueron adoptados por los analizadores de la serie S Plus de Coulter en 1980. [214]
Después de que se automatizara el recuento celular básico, el diferencial de glóbulos blancos siguió siendo un desafío. A lo largo de la década de 1970, los investigadores exploraron dos métodos para automatizar el recuento diferencial: el procesamiento de imágenes digitales y la citometría de flujo. Utilizando la tecnología desarrollada en las décadas de 1950 y 1960 para automatizar la lectura de los frotis de Papanicolaou , se produjeron varios modelos de analizadores de procesamiento de imágenes. [215] Estos instrumentos escanearían un frotis de sangre teñido para encontrar núcleos celulares, luego tomarían una instantánea de mayor resolución de la célula para analizarla a través de densitometría . [216] Eran caros, lentos y hacían poco para reducir la carga de trabajo en el laboratorio porque todavía requerían que se prepararan y tiñeran los frotis de sangre, por lo que los sistemas basados en citometría de flujo se hicieron más populares, [217] [218] y para 1990, no había analizadores de imágenes digitales disponibles comercialmente en los Estados Unidos o Europa occidental. [219] Estas técnicas experimentaron un resurgimiento en la década de 2000 con la introducción de plataformas de análisis de imágenes más avanzadas que utilizan redes neuronales artificiales . [220] [221] [222]
Los primeros dispositivos de citometría de flujo disparaban haces de luz a las células en longitudes de onda específicas y medían la absorbancia, la fluorescencia o la dispersión de la luz resultantes, recopilando información sobre las características de las células y permitiendo cuantificar contenidos celulares como el ADN . [223] Uno de estos instrumentos, el Rapid Cell Spectrophotometer, desarrollado por Louis Kamentsky en 1965 para automatizar la citología cervical, podía generar diagramas de dispersión de células sanguíneas utilizando técnicas de tinción citoquímica. Leonard Ornstein, que había ayudado a desarrollar el sistema de tinción en el Rapid Cell Spectrophotometer, y sus colegas crearon más tarde el primer analizador diferencial de glóbulos blancos por citometría de flujo comercial, el Hemalog D. [224] [225] Introducido en 1974, [226] [227] este analizador utilizaba dispersión de luz, absorbancia y tinción celular para identificar los cinco tipos normales de glóbulos blancos además de las "células grandes no identificadas", una clasificación que generalmente consistía en linfocitos atípicos o células blásticas. El Hemalog D podía contar 10.000 células en una sola pasada, una mejora notable respecto del diferencial manual. [225] [228] En 1981, Technicon combinó el Hemalog D con el analizador Hemalog-8 para producir el Technicon H6000, el primer analizador combinado de hemograma completo y diferencial. Este analizador no era muy popular entre los laboratorios de hematología porque su funcionamiento requería mucha mano de obra, pero a finales de los años 1980 y principios de los años 1990 otros fabricantes, como Sysmex , Abbott , Roche y Beckman Coulter , produjeron ampliamente sistemas similares . [229]