La energía (del griego antiguo ἐνέργεια ( enérgeia ) 'actividad') es la propiedad cuantitativa que se transfiere a un cuerpo o a un sistema físico , reconocible en la realización de trabajo y en forma de calor y luz . La energía es una cantidad conservada : la ley de conservación de la energía establece que la energía puede convertirse en forma, pero no crearse ni destruirse; la materia y la energía también pueden convertirse entre sí. La unidad de medida de la energía en el Sistema Internacional de Unidades (SI) es el julio (J).
Las formas de energía incluyen la energía cinética de un objeto en movimiento, la energía potencial almacenada por un objeto (por ejemplo, debido a su posición en un campo ), la energía elástica almacenada en un objeto sólido, la energía química asociada con las reacciones químicas , la energía radiante transportada por la radiación electromagnética , la energía interna contenida dentro de un sistema termodinámico y la energía en reposo asociada con la masa en reposo de un objeto .
Todos los organismos vivos absorben y liberan energía constantemente. Los procesos climáticos y ecosistémicos de la Tierra son impulsados principalmente por la energía radiante del sol . [1] La industria energética proporciona la energía necesaria para el funcionamiento de la civilización humana, que obtiene de recursos energéticos como los combustibles fósiles , el combustible nuclear , la energía renovable y la energía geotérmica .


La energía total de un sistema se puede subdividir y clasificar en energía potencial , energía cinética o combinaciones de las dos de diversas maneras. La energía cinética está determinada por el movimiento de un objeto (o el movimiento compuesto de los componentes del objeto), mientras que la energía potencial refleja el potencial de un objeto para tener movimiento, generalmente en función de la posición del objeto dentro de un campo o de lo que está almacenado dentro del propio campo. [2]
Si bien estas dos categorías son suficientes para describir todas las formas de energía, a menudo resulta conveniente referirse a combinaciones particulares de energía potencial y cinética como su propia forma. Por ejemplo, la suma de la energía cinética y potencial traslacional y rotacional dentro de un sistema se denomina energía mecánica , mientras que la energía nuclear se refiere a los potenciales combinados dentro de un núcleo atómico provenientes de la fuerza nuclear o de la fuerza débil , entre otros ejemplos. [3]
.jpg/440px-Thomas_Young_(scientist).jpg)
La palabra energía deriva del griego antiguo ἐνέργεια , romanizado energeia , lit. ' actividad, operación', [4] que posiblemente aparece por primera vez en la obra de Aristóteles en el siglo IV a. C. En contraste con la definición moderna, energeia era un concepto filosófico cualitativo, lo suficientemente amplio como para incluir ideas como la felicidad y el placer.
A finales del siglo XVII, Gottfried Leibniz propuso la idea de la vis viva , o fuerza viva, que se define como el producto de la masa de un objeto por su velocidad al cuadrado; creía que la vis viva total se conservaba. Para explicar la desaceleración debida a la fricción, Leibniz teorizó que la energía térmica consistía en los movimientos de las partes constituyentes de la materia, aunque pasaría más de un siglo hasta que esto fuera aceptado de forma generalizada. El análogo moderno de esta propiedad, la energía cinética , difiere de la vis viva solo por un factor de dos. A principios del siglo XVIII, Émilie du Châtelet propuso el concepto de conservación de la energía en los márgenes de su traducción al francés de los Principia Mathematica de Newton , que representaba la primera formulación de una cantidad medible conservada que era distinta del momento y que más tarde se llamaría "energía".
En 1807, Thomas Young fue posiblemente el primero en utilizar el término "energía" en lugar de vis viva , en su sentido moderno. [5] Gustave-Gaspard Coriolis describió la " energía cinética " en 1829 en su sentido moderno, y en 1853, William Rankine acuñó el término " energía potencial ". La ley de conservación de la energía también se postuló por primera vez a principios del siglo XIX, y se aplica a cualquier sistema aislado . Se discutió durante algunos años si el calor era una sustancia física, denominada calórico , o simplemente una cantidad física, como el momento . En 1845, James Prescott Joule descubrió el vínculo entre el trabajo mecánico y la generación de calor.
Estos desarrollos condujeron a la teoría de la conservación de la energía, formalizada en gran parte por William Thomson ( Lord Kelvin ) como el campo de la termodinámica . La termodinámica ayudó al rápido desarrollo de las explicaciones de los procesos químicos por parte de Rudolf Clausius , Josiah Willard Gibbs y Walther Nernst . También condujo a una formulación matemática del concepto de entropía por Clausius y a la introducción de las leyes de la energía radiante por Jožef Stefan . Según el teorema de Noether , la conservación de la energía es una consecuencia del hecho de que las leyes de la física no cambian con el tiempo. [6] Así, desde 1918, los teóricos han entendido que la ley de conservación de la energía es la consecuencia matemática directa de la simetría traslacional de la cantidad conjugada a la energía, es decir, el tiempo.

En el Sistema Internacional de Unidades (SI), la unidad de energía es el julio . Es una unidad derivada que equivale a la energía gastada, o trabajo realizado, al aplicar una fuerza de un newton a lo largo de una distancia de un metro. Sin embargo, la energía también se puede expresar en muchas otras unidades que no forman parte del SI, como ergios , calorías , unidades térmicas británicas , kilovatios-hora y kilocalorías , que requieren un factor de conversión cuando se expresan en unidades del SI.
La unidad de potencia del SI , definida como energía por unidad de tiempo, es el vatio , que es un julio por segundo. Por lo tanto, un julio es un vatio-segundo y 3600 julios equivalen a un vatio-hora. La unidad de energía del CGS es el erg y la unidad imperial y habitual en EE. UU. es el pie-libra . Otras unidades de energía como el electronvoltio , la caloría alimentaria o la kcal termodinámica (basada en el cambio de temperatura del agua en un proceso de calentamiento) y la BTU se utilizan en áreas específicas de la ciencia y el comercio.
En 1843, el físico francés James Prescott Joule , homónimo de la unidad de medida, descubrió que la energía potencial gravitatoria perdida por un peso descendente atado a una cuerda era igual a la energía interna ganada por el agua a través de la fricción con el remo.
En la mecánica clásica, la energía es una propiedad conceptual y matemáticamente útil, ya que es una cantidad que se conserva . Se han desarrollado varias formulaciones de la mecánica utilizando la energía como concepto central.
El trabajo , una función de la energía, es la fuerza multiplicada por la distancia.
Esto dice que el trabajo ( ) es igual a la integral lineal de la fuerza F a lo largo de una trayectoria C ; para más detalles, consulte el artículo sobre el trabajo mecánico . El trabajo y, por lo tanto, la energía dependen del marco . Por ejemplo, considere una pelota golpeada por un bate. En el marco de referencia del centro de masa, el bate no realiza trabajo sobre la pelota. Pero, en el marco de referencia de la persona que balancea el bate, se realiza un trabajo considerable sobre la pelota.
La energía total de un sistema se denomina a veces hamiltoniano , en honor a William Rowan Hamilton . Las ecuaciones clásicas de movimiento se pueden escribir en términos del hamiltoniano, incluso para sistemas sumamente complejos o abstractos. Estas ecuaciones clásicas tienen análogos directos en la mecánica cuántica no relativista. [7]
Otro concepto relacionado con la energía es el llamado lagrangiano , en honor a Joseph-Louis Lagrange . Este formalismo es tan fundamental como el hamiltoniano, y ambos pueden utilizarse para derivar las ecuaciones de movimiento o derivarse de ellas. Fue inventado en el contexto de la mecánica clásica , pero es generalmente útil en la física moderna. El lagrangiano se define como la energía cinética menos la energía potencial. Por lo general, el formalismo de Lagrange es matemáticamente más conveniente que el hamiltoniano para sistemas no conservativos (como los sistemas con fricción).
El teorema de Noether (1918) establece que cualquier simetría diferenciable de la acción de un sistema físico tiene una ley de conservación correspondiente. El teorema de Noether se ha convertido en una herramienta fundamental de la física teórica moderna y del cálculo de variaciones. Se trata de una generalización de las formulaciones fundamentales sobre las constantes de movimiento en la mecánica lagrangiana y hamiltoniana (1788 y 1833, respectivamente), pero no se aplica a sistemas que no se pueden modelar con una lagrangiana; por ejemplo, los sistemas disipativos con simetrías continuas no necesitan tener una ley de conservación correspondiente.
En el contexto de la química , la energía es un atributo de una sustancia como consecuencia de su estructura atómica, molecular o agregada. Dado que una transformación química va acompañada de un cambio en uno o más de estos tipos de estructura, suele ir acompañada de una disminución, y a veces de un aumento, de la energía total de las sustancias implicadas. Es posible que se transfiera algo de energía entre el entorno y los reactivos en forma de calor o luz; por tanto, los productos de una reacción a veces tienen más energía que los reactivos, pero normalmente menos. Se dice que una reacción es exotérmica o exergónica si el estado final es inferior en la escala de energía al estado inicial; en el caso menos común de las reacciones endotérmicas , la situación es la inversa.
Las reacciones químicas no suelen ser posibles a menos que los reactivos superen una barrera energética conocida como energía de activación . La velocidad de una reacción química (a una temperatura dada T ) está relacionada con la energía de activación E por el factor de población de Boltzmann e − E / kT ; es decir, la probabilidad de que una molécula tenga una energía mayor o igual a E a una temperatura dada T. Esta dependencia exponencial de la velocidad de una reacción con respecto a la temperatura se conoce como ecuación de Arrhenius . La energía de activación necesaria para una reacción química se puede proporcionar en forma de energía térmica.
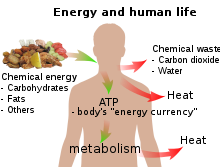
En biología , la energía es un atributo de todos los sistemas biológicos, desde la biosfera hasta el organismo vivo más pequeño. Dentro de un organismo es responsable del crecimiento y desarrollo de una célula biológica u orgánulo de un organismo biológico. La energía utilizada en la respiración se almacena en sustancias como carbohidratos (incluidos los azúcares), lípidos y proteínas almacenadas por las células . En términos humanos, el equivalente humano (He) (conversión de energía humana) indica, para una cantidad dada de gasto energético, la cantidad relativa de energía necesaria para el metabolismo humano , utilizando como estándar un gasto energético humano promedio de 12.500 kJ por día y una tasa metabólica basal de 80 vatios.
Por ejemplo, si nuestro cuerpo funciona (en promedio) a 80 vatios, entonces una bombilla que funcione a 100 vatios está funcionando a 1,25 equivalentes humanos (100 ÷ 80), es decir, 1,25 He. Para una tarea difícil de sólo unos segundos de duración, una persona puede producir miles de vatios, muchas veces los 746 vatios de un caballo de fuerza oficial. Para tareas que duran unos minutos, un humano en forma puede generar quizás 1.000 vatios. Para una actividad que debe mantenerse durante una hora, la producción cae a alrededor de 300; para una actividad que se mantiene durante todo el día, 150 vatios es aproximadamente el máximo. [8] El equivalente humano ayuda a comprender los flujos de energía en los sistemas físicos y biológicos al expresar las unidades de energía en términos humanos: proporciona una "sensación" del uso de una cantidad dada de energía. [9]
La energía radiante de la luz solar también es captada por las plantas como energía potencial química en la fotosíntesis , cuando el dióxido de carbono y el agua (dos compuestos de baja energía) se convierten en carbohidratos, lípidos, proteínas y oxígeno. La liberación de la energía almacenada durante la fotosíntesis en forma de calor o luz puede ser provocada repentinamente por una chispa en un incendio forestal, o puede estar disponible más lentamente para el metabolismo animal o humano cuando se ingieren moléculas orgánicas y el catabolismo se desencadena por la acción de las enzimas .
Todos los seres vivos dependen de una fuente externa de energía para poder crecer y reproducirse: la energía radiante del sol en el caso de las plantas verdes y la energía química (en alguna forma) en el caso de los animales. Las 1500–2000 calorías diarias (6–8 MJ) recomendadas para un adulto humano se toman en forma de moléculas alimenticias, principalmente carbohidratos y grasas, de las cuales la glucosa (C 6 H 12 O 6 ) y la estearina (C 57 H 110 O 6 ) son ejemplos convenientes. Las moléculas alimenticias se oxidan a dióxido de carbono y agua en las mitocondrias y parte de la energía se utiliza para convertir ADP en ATP :
El resto de la energía química de los carbohidratos o grasas se convierte en calor: el ATP se utiliza como una especie de "moneda energética", y parte de la energía química que contiene se utiliza para otros procesos metabólicos cuando el ATP reacciona con los grupos OH y finalmente se divide en ADP y fosfato (en cada etapa de una ruta metabólica , parte de la energía química se convierte en calor). Solo una pequeña fracción de la energía química original se utiliza para el trabajo : [nota 1]
Parecería que los organismos vivos son notablemente ineficientes (en el sentido físico) en su uso de la energía que reciben (energía química o radiante); la mayoría de las máquinas logran eficiencias más altas. En los organismos en crecimiento, la energía que se convierte en calor cumple una función vital, ya que permite que el tejido del organismo esté altamente ordenado con respecto a las moléculas que lo componen. La segunda ley de la termodinámica establece que la energía (y la materia) tiende a distribuirse de manera más uniforme en todo el universo: para concentrar la energía (o la materia) en un lugar específico, es necesario distribuir una mayor cantidad de energía (en forma de calor) en el resto del universo ("los alrededores"). [nota 2] Los organismos más simples pueden lograr eficiencias energéticas más altas que los más complejos, pero los organismos complejos pueden ocupar nichos ecológicos que no están disponibles para sus hermanos más simples. La conversión de una parte de la energía química en calor en cada paso de una ruta metabólica es la razón física detrás de la pirámide de biomasa observada en ecología . A modo de ejemplo, para tomar sólo el primer paso en la cadena alimentaria : de los 124,7 Pg/a de carbono estimados que se fijan mediante la fotosíntesis , 64,3 Pg/a (52%) se utilizan para el metabolismo de las plantas verdes, [10] es decir, se reconvierten en dióxido de carbono y calor.
En geología , la deriva continental , las cadenas montañosas , los volcanes y los terremotos son fenómenos que pueden explicarse en términos de transformaciones energéticas en el interior de la Tierra, [11] mientras que los fenómenos meteorológicos como el viento, la lluvia, el granizo , la nieve, los rayos, los tornados y los huracanes son todos resultado de transformaciones energéticas en nuestra atmósfera provocadas por la energía solar .
La luz solar es el principal insumo del balance energético de la Tierra , responsable de su temperatura y de la estabilidad climática. La luz solar puede almacenarse como energía potencial gravitatoria después de que llega a la Tierra, ya que (por ejemplo) el agua se evapora de los océanos y se deposita en las montañas (donde, después de ser liberada en una presa hidroeléctrica, puede usarse para impulsar turbinas o generadores para producir electricidad). La luz solar también impulsa la mayoría de los fenómenos meteorológicos, salvo algunas excepciones, como los generados por eventos volcánicos, por ejemplo. Un ejemplo de un evento meteorológico mediado por el sol es un huracán, que ocurre cuando grandes áreas inestables de océano cálido, calentadas durante meses, de repente ceden parte de su energía térmica para alimentar unos pocos días de violento movimiento de aire.
En un proceso más lento, la desintegración radiactiva de los átomos en el núcleo de la Tierra libera calor. Esta energía térmica impulsa la tectónica de placas y puede levantar montañas, a través de la orogénesis . Este levantamiento lento representa una especie de almacenamiento de energía potencial gravitatoria de la energía térmica, que luego puede transformarse en energía cinética activa durante los deslizamientos de tierra, después de un evento desencadenante. Los terremotos también liberan energía potencial elástica almacenada en las rocas, un almacenamiento que se ha producido en última instancia a partir de las mismas fuentes de calor radiactivo. Por lo tanto, según la comprensión actual, los eventos familiares como los deslizamientos de tierra y los terremotos liberan energía que se ha almacenado como energía potencial en el campo gravitatorio de la Tierra o tensión elástica (energía potencial mecánica) en las rocas. Antes de esto, representan la liberación de energía que se ha almacenado en átomos pesados desde el colapso de estrellas supernova destruidas hace mucho tiempo (que crearon estos átomos).
En cosmología y astronomía, los fenómenos de estrellas , novas , supernovas , cuásares y explosiones de rayos gamma son las transformaciones energéticas de materia de mayor producción del universo. Todos los fenómenos estelares (incluida la actividad solar) están impulsados por diversos tipos de transformaciones energéticas. La energía en dichas transformaciones proviene del colapso gravitacional de la materia (generalmente hidrógeno molecular) en varias clases de objetos astronómicos (estrellas, agujeros negros, etc.), o de la fusión nuclear (de elementos más ligeros, principalmente hidrógeno).
La fusión nuclear del hidrógeno en el Sol también libera otra reserva de energía potencial que se creó en el momento del Big Bang . En ese momento, según la teoría, el espacio se expandió y el universo se enfrió demasiado rápido para que el hidrógeno se fusionara completamente en elementos más pesados. Esto significa que el hidrógeno representa una reserva de energía potencial que puede liberarse mediante la fusión. Este proceso de fusión se desencadena por el calor y la presión generados por el colapso gravitacional de las nubes de hidrógeno cuando producen estrellas, y parte de la energía de fusión se transforma luego en luz solar.
En mecánica cuántica , la energía se define en términos del operador de energía (hamiltoniano) como una derivada temporal de la función de onda . La ecuación de Schrödinger equipara el operador de energía a la energía total de una partícula o un sistema. Sus resultados pueden considerarse como una definición de medición de energía en mecánica cuántica. La ecuación de Schrödinger describe la dependencia del espacio y el tiempo de una función de onda de sistemas cuánticos que cambia lentamente (no relativista). La solución de esta ecuación para un sistema acotado es discreta (un conjunto de estados permitidos, cada uno caracterizado por un nivel de energía ) lo que da como resultado el concepto de cuantos . En la solución de la ecuación de Schrödinger para cualquier oscilador (vibrador) y para ondas electromagnéticas en el vacío, los estados de energía resultantes están relacionados con la frecuencia mediante la relación de Planck : (donde es la constante de Planck y la frecuencia). En el caso de una onda electromagnética, estos estados de energía se denominan cuantos de luz o fotones .
Al calcular la energía cinética ( el trabajo necesario para acelerar un cuerpo masivo desde una velocidad cero hasta una velocidad finita) de manera relativista (utilizando transformaciones de Lorentz en lugar de la mecánica newtoniana ), Einstein descubrió un subproducto inesperado de estos cálculos: un término de energía que no desaparece a velocidad cero. Lo llamó energía en reposo : energía que todo cuerpo masivo debe poseer incluso cuando está en reposo. La cantidad de energía es directamente proporcional a la masa del cuerpo:
dónde
Por ejemplo, consideremos la aniquilación electrón - positrón , en la que la energía en reposo de estas dos partículas individuales (equivalente a su masa en reposo) se convierte en la energía radiante de los fotones producidos en el proceso. En este sistema, la materia y la antimateria (electrones y positrones) se destruyen y se transforman en no materia (los fotones). Sin embargo, la masa total y la energía total no cambian durante esta interacción. Los fotones no tienen masa en reposo, pero tienen, no obstante, energía radiante que exhibe la misma inercia que las dos partículas originales. Este es un proceso reversible – el proceso inverso se llama creación de pares – en el que la masa en reposo de las partículas se crea a partir de la energía radiante de dos (o más) fotones que se aniquilan.
En la relatividad general, el tensor de tensión-energía sirve como término fuente para el campo gravitacional, en una analogía aproximada con la forma en que la masa sirve como término fuente en la aproximación newtoniana no relativista. [12]
La energía y la masa son manifestaciones de una misma propiedad física subyacente de un sistema. Esta propiedad es responsable de la inercia y la fuerza de la interacción gravitatoria del sistema ("manifestaciones de masa"), y también es responsable de la capacidad potencial del sistema para realizar trabajo o calentar ("manifestaciones de energía"), sujeta a las limitaciones de otras leyes físicas.
En física clásica , la energía es una cantidad escalar, el conjugado canónico del tiempo. En la relatividad especial, la energía también es un escalar (aunque no un escalar de Lorentz, sino un componente temporal del 4-vector energía-momento ). [12] En otras palabras, la energía es invariante con respecto a las rotaciones del espacio , pero no invariante con respecto a las rotaciones del espacio-tiempo (= impulsos ).

La energía puede transformarse entre distintas formas con distintas eficiencias . Los elementos que se transforman entre estas formas se denominan transductores . Algunos ejemplos de transductores son una batería (de energía química a energía eléctrica ), una presa (de energía potencial gravitatoria a energía cinética del agua en movimiento (y de las aspas de una turbina ) y, en última instancia, a energía eléctrica a través de un generador eléctrico ) y un motor térmico (de calor a trabajo).
Algunos ejemplos de transformación de energía incluyen la generación de energía eléctrica a partir de energía térmica mediante una turbina de vapor, o la elevación de un objeto contra la gravedad utilizando energía eléctrica que impulsa el motor de una grúa. La elevación contra la gravedad realiza un trabajo mecánico sobre el objeto y almacena energía potencial gravitatoria en el objeto. Si el objeto cae al suelo, la gravedad realiza un trabajo mecánico sobre el objeto que transforma la energía potencial del campo gravitatorio en energía cinética liberada como calor al impactar con el suelo. El Sol transforma la energía potencial nuclear en otras formas de energía; su masa total no disminuye debido a eso en sí (ya que todavía contiene la misma energía total incluso en diferentes formas), pero su masa disminuye cuando la energía escapa a su entorno, principalmente como energía radiante .
Existen límites estrictos a la eficiencia con la que el calor puede convertirse en trabajo en un proceso cíclico, por ejemplo en un motor térmico, como se describe en el teorema de Carnot y la segunda ley de la termodinámica . Sin embargo, algunas transformaciones de energía pueden ser bastante eficientes. La dirección de las transformaciones de energía (qué tipo de energía se transforma en qué otro tipo) a menudo está determinada por consideraciones de entropía (igualdad de energía distribuida entre todos los grados de libertad disponibles ). En la práctica, todas las transformaciones de energía están permitidas a pequeña escala, pero ciertas transformaciones más grandes no están permitidas porque es estadísticamente improbable que la energía o la materia se muevan aleatoriamente hacia formas más concentradas o espacios más pequeños.
Las transformaciones de energía en el universo a lo largo del tiempo se caracterizan por varios tipos de energía potencial, que ha estado disponible desde el Big Bang , que se "libera" (transforma en tipos de energía más activos, como energía cinética o radiante) cuando está disponible un mecanismo desencadenante. Ejemplos conocidos de tales procesos incluyen la nucleosíntesis , un proceso que en última instancia utiliza la energía potencial gravitatoria liberada del colapso gravitacional de las supernovas para "almacenar" energía en la creación de isótopos pesados (como el uranio y el torio ), y la desintegración nuclear , un proceso en el que se libera energía que originalmente estaba almacenada en estos elementos pesados, antes de que se incorporaran al Sistema Solar y la Tierra. Esta energía se desencadena y libera en bombas de fisión nuclear o en la generación de energía nuclear civil. De manera similar, en el caso de una explosión química , la energía potencial química se transforma en energía cinética y térmica en un tiempo muy corto.
Otro ejemplo es el de un péndulo . En sus puntos más altos, la energía cinética es cero y la energía potencial gravitatoria es máxima. En su punto más bajo, la energía cinética es máxima y es igual a la disminución de la energía potencial . Si uno supone (de manera poco realista) que no hay fricción ni otras pérdidas, la conversión de energía entre estos procesos sería perfecta y el péndulo continuaría oscilando eternamente.
La energía también se transfiere de energía potencial ( ) a energía cinética ( ) y luego de nuevo a energía potencial de manera constante. Esto se conoce como conservación de la energía. En este sistema aislado , la energía no se puede crear ni destruir; por lo tanto, la energía inicial y la energía final serán iguales entre sí. Esto se puede demostrar de la siguiente manera:
La ecuación se puede simplificar aún más, ya que (masa por aceleración de la gravedad por altura) y (mitad de la masa por velocidad al cuadrado). Luego, la cantidad total de energía se puede hallar sumando .
La energía da lugar al peso cuando está atrapada en un sistema con momento cero, donde puede pesarse. También es equivalente a la masa, y esta masa siempre está asociada a ella. La masa también es equivalente a una cierta cantidad de energía, y asimismo siempre aparece asociada a ella, como se describe en la equivalencia masa-energía . La fórmula E = mc ², derivada por Albert Einstein (1905) cuantifica la relación entre la masa relativista y la energía dentro del concepto de relatividad especial. En diferentes marcos teóricos, fórmulas similares fueron derivadas por JJ Thomson (1881), Henri Poincaré (1900), Friedrich Hasenöhrl (1904) y otros (ver Equivalencia masa-energía#Historia para más información).
Parte de la energía en reposo (equivalente a la masa en reposo) de la materia puede convertirse en otras formas de energía (que aún exhiben masa), pero ni la energía ni la masa pueden destruirse; más bien, ambas permanecen constantes durante cualquier proceso. Sin embargo, dado que es extremadamente grande en relación con las escalas humanas ordinarias, la conversión de una cantidad cotidiana de masa en reposo (por ejemplo, 1 kg) de energía en reposo a otras formas de energía (como energía cinética, energía térmica o la energía radiante transportada por la luz y otras radiaciones) puede liberar enormes cantidades de energía (~ julios = 21 megatones de TNT), como se puede ver en los reactores nucleares y las armas nucleares.
Por el contrario, el equivalente en masa de una cantidad cotidiana de energía es minúsculo, por lo que una pérdida de energía (pérdida de masa) de la mayoría de los sistemas es difícil de medir en una balanza, a menos que la pérdida de energía sea muy grande. Ejemplos de grandes transformaciones entre energía en reposo (de materia) y otras formas de energía (por ejemplo, energía cinética en partículas con masa en reposo) se encuentran en la física nuclear y la física de partículas . A menudo, sin embargo, la conversión completa de materia (como átomos) en no materia (como fotones) está prohibida por las leyes de conservación .
La termodinámica divide la transformación de la energía en dos tipos: procesos reversibles y procesos irreversibles . Un proceso irreversible es aquel en el que la energía se disipa (se distribuye) en estados de energía vacíos disponibles en un volumen, del que no se puede recuperar en formas más concentradas (menos estados cuánticos), sin la degradación de aún más energía. Un proceso reversible es aquel en el que este tipo de disipación no ocurre. Por ejemplo, la conversión de energía de un tipo de campo potencial a otro es reversible, como en el sistema del péndulo descrito anteriormente.
En los procesos en los que se genera calor, los estados cuánticos de menor energía, presentes como posibles excitaciones en los campos entre átomos, actúan como depósito de una parte de la energía, de la que no se puede recuperar, para ser convertida con un 100% de eficiencia en otras formas de energía. En este caso, la energía debe permanecer en parte como energía térmica y no puede ser recuperada completamente como energía utilizable, salvo al precio de un aumento de algún otro tipo de desorden, similar al calor, en los estados cuánticos del universo (como una expansión de la materia o una aleatorización en un cristal).
A medida que el universo evoluciona con el tiempo, cada vez más energía queda atrapada en estados irreversibles (es decir, en forma de calor o de otros tipos de aumentos del desorden). Esto ha llevado a la hipótesis de la inevitable muerte térmica termodinámica del universo . En esta muerte térmica, la energía del universo no cambia, pero la fracción de energía que está disponible para realizar trabajo a través de un motor térmico , o para transformarse en otras formas utilizables de energía (mediante el uso de generadores conectados a los motores térmicos), continúa disminuyendo.
El hecho de que la energía no se crea ni se destruye se denomina ley de conservación de la energía . En forma de primera ley de la termodinámica , establece que la energía de un sistema cerrado es constante a menos que se transfiera energía hacia adentro o hacia afuera como trabajo o calor , y que no se pierde energía en la transferencia. La entrada total de energía en un sistema debe ser igual a la salida total de energía del sistema, más el cambio en la energía contenida dentro del sistema. Siempre que se mide (o calcula) la energía total de un sistema de partículas cuyas interacciones no dependen explícitamente del tiempo, se encuentra que la energía total del sistema siempre permanece constante. [13]
Si bien el calor siempre se puede convertir completamente en trabajo en una expansión isotérmica reversible de un gas ideal, para los procesos cíclicos de interés práctico en los motores térmicos, la segunda ley de la termodinámica establece que el sistema que realiza el trabajo siempre pierde algo de energía como calor residual . Esto crea un límite a la cantidad de energía térmica que puede realizar trabajo en un proceso cíclico, un límite llamado energía disponible . La energía mecánica y otras formas de energía se pueden transformar en la otra dirección en energía térmica sin tales limitaciones. [14] La energía total de un sistema se puede calcular sumando todas las formas de energía en el sistema.
Richard Feynman dijo durante una conferencia en 1961: [15]
Existe un hecho, o si se prefiere, una ley , que rige todos los fenómenos naturales conocidos hasta la fecha. No se conoce ninguna excepción a esta ley; es exacta hasta donde sabemos. La ley se llama conservación de la energía . Establece que hay una cierta cantidad, que llamamos energía, que no cambia en los múltiples cambios que sufre la naturaleza. Se trata de una idea sumamente abstracta, porque es un principio matemático; dice que hay una cantidad numérica que no cambia cuando sucede algo. No es la descripción de un mecanismo ni de nada concreto; es simplemente un hecho extraño que podemos calcular un número y que, cuando terminamos de observar cómo la naturaleza hace sus trucos y calculamos el número de nuevo, es el mismo.
La mayoría de los tipos de energía (con la notable excepción de la energía gravitacional) [16] también están sujetos a estrictas leyes de conservación locales. En este caso, la energía solo puede intercambiarse entre regiones adyacentes del espacio, y todos los observadores están de acuerdo en cuanto a la densidad volumétrica de energía en cualquier espacio dado. También existe una ley global de conservación de la energía, que establece que la energía total del universo no puede cambiar; esto es un corolario de la ley local, pero no viceversa. [14] [15]
Esta ley es un principio fundamental de la física. Como lo demuestra rigurosamente el teorema de Noether , la conservación de la energía es una consecuencia matemática de la simetría traslacional del tiempo, [17] una propiedad de la mayoría de los fenómenos por debajo de la escala cósmica que los hace independientes de sus ubicaciones en la coordenada temporal. Dicho de otro modo, ayer, hoy y mañana son físicamente indistinguibles. Esto se debe a que la energía es la cantidad que es conjugada canónicamente con el tiempo. Este entrelazamiento matemático de la energía y el tiempo también da como resultado el principio de incertidumbre: es imposible definir la cantidad exacta de energía durante cualquier intervalo de tiempo definido (aunque esto es prácticamente significativo solo para intervalos de tiempo muy cortos). El principio de incertidumbre no debe confundirse con la conservación de la energía ; más bien, proporciona límites matemáticos con los que, en principio, la energía puede definirse y medirse.
Cada una de las fuerzas básicas de la naturaleza está asociada a un tipo diferente de energía potencial, y todos los tipos de energía potencial (como todos los demás tipos de energía) aparecen como masa del sistema , siempre que estén presentes. Por ejemplo, un resorte comprimido tendrá una masa ligeramente mayor que antes de ser comprimido. De la misma manera, siempre que se transfiere energía entre sistemas mediante cualquier mecanismo, se transfiere con ella una masa asociada.
En mecánica cuántica, la energía se expresa mediante el operador hamiltoniano . En cualquier escala de tiempo, la incertidumbre en la energía es
que es similar en forma al Principio de Incertidumbre de Heisenberg (pero no realmente matemáticamente equivalente, ya que H y t no son variables dinámicamente conjugadas, ni en la mecánica clásica ni en la cuántica).
En física de partículas , esta desigualdad permite una comprensión cualitativa de las partículas virtuales , que llevan momento . El intercambio de partículas virtuales con partículas reales es responsable de la creación de todas las fuerzas fundamentales conocidas (conocidas con más precisión como interacciones fundamentales ). Los fotones virtuales también son responsables de la interacción electrostática entre cargas eléctricas (que da lugar a la ley de Coulomb ), de la desintegración radiativa espontánea de estados atómicos y nucleares excitados, de la fuerza de Casimir , de la fuerza de Van der Waals y de algunos otros fenómenos observables.
La transferencia de energía puede considerarse para el caso especial de sistemas que están cerrados a las transferencias de materia. La parte de la energía que se transfiere mediante fuerzas conservativas a lo largo de una distancia se mide como el trabajo que el sistema fuente realiza sobre el sistema receptor. La parte de la energía que no realiza trabajo durante la transferencia se denomina calor . [nota 3] La energía se puede transferir entre sistemas de diversas formas. Los ejemplos incluyen la transmisión de energía electromagnética a través de fotones, colisiones físicas que transfieren energía cinética , [nota 4] interacciones de marea , [18] y la transferencia conductiva de energía térmica .
La energía se conserva estrictamente y también localmente donde sea que pueda definirse. En termodinámica, para sistemas cerrados, el proceso de transferencia de energía se describe mediante la primera ley : [nota 5]
donde es la cantidad de energía transferida, representa el trabajo realizado sobre o por el sistema, y representa el flujo de calor hacia dentro o hacia fuera del sistema. Como simplificación, el término de calor, , a veces se puede ignorar, especialmente para procesos rápidos que involucran gases, que son malos conductores de calor, o cuando la eficiencia térmica de la transferencia es alta. Para tales procesos adiabáticos ,
Esta ecuación simplificada es la que se utiliza para definir el julio , por ejemplo.
Más allá de las limitaciones de los sistemas cerrados, los sistemas abiertos pueden ganar o perder energía en asociación con la transferencia de materia (este proceso se ilustra con la inyección de una mezcla de aire y combustible en el motor de un automóvil, un sistema que gana energía de ese modo, sin agregar trabajo ni calor). Al representar esta energía con , se puede escribir
La energía interna es la suma de todas las formas microscópicas de energía de un sistema. Es la energía necesaria para crear el sistema. Está relacionada con la energía potencial, por ejemplo, la estructura molecular, la estructura cristalina y otros aspectos geométricos, así como con el movimiento de las partículas, en forma de energía cinética. La termodinámica se ocupa principalmente de los cambios en la energía interna y no de su valor absoluto, que es imposible de determinar únicamente con la termodinámica. [19]
La primera ley de la termodinámica afirma que la energía total de un sistema y sus alrededores (pero no necesariamente la energía libre termodinámica ) siempre se conserva [20] y que el flujo de calor es una forma de transferencia de energía. Para sistemas homogéneos, con una temperatura y presión bien definidas, un corolario de la primera ley que se usa comúnmente es que, para un sistema sujeto únicamente a fuerzas de presión y transferencia de calor (por ejemplo, un cilindro lleno de gas) sin cambios químicos, el cambio diferencial en la energía interna del sistema (con una ganancia de energía indicada por una cantidad positiva) se da como
donde el primer término a la derecha es el calor transferido al sistema, expresado en términos de temperatura T y entropía S (en la que la entropía aumenta y su cambio d S es positivo cuando se agrega calor al sistema), y el último término en el lado derecho se identifica como el trabajo realizado en el sistema, donde la presión es P y el volumen V (el signo negativo resulta ya que la compresión del sistema requiere que se realice trabajo sobre él y, por lo tanto, el cambio de volumen, d V , es negativo cuando se realiza trabajo sobre el sistema).
Esta ecuación es muy específica, ignorando todas las fuerzas químicas, eléctricas, nucleares y gravitacionales, efectos como la advección de cualquier forma de energía distinta del calor y el trabajo fotovoltaico . La formulación general de la primera ley (es decir, la conservación de la energía) es válida incluso en situaciones en las que el sistema no es homogéneo. Para estos casos, el cambio en la energía interna de un sistema cerrado se expresa en una forma general mediante
donde es el calor suministrado al sistema y es el trabajo aplicado al sistema.
La energía de un oscilador armónico mecánico (una masa sobre un resorte) es alternativamente energía cinética y potencial . En dos puntos del ciclo de oscilación es completamente cinética y en dos puntos es completamente potencial. A lo largo de un ciclo completo, o de muchos ciclos, la energía promedio se divide equitativamente entre energía cinética y potencial. Este es un ejemplo del principio de equipartición : la energía total de un sistema con muchos grados de libertad se divide equitativamente entre todos los grados de libertad disponibles, en promedio.
Este principio es de vital importancia para entender el comportamiento de una cantidad estrechamente relacionada con la energía, llamada entropía . La entropía es una medida de la uniformidad de una distribución de energía entre las partes de un sistema. Cuando a un sistema aislado se le dan más grados de libertad (es decir, se le dan nuevos estados de energía disponibles que son los mismos que los estados existentes), entonces la energía total se distribuye por todos los grados disponibles de manera igualitaria sin distinción entre grados "nuevos" y "antiguos". Este resultado matemático es parte de la segunda ley de la termodinámica . La segunda ley de la termodinámica es simple solo para sistemas que están cerca o en un estado de equilibrio físico . Para los sistemas que no están en equilibrio, las leyes que gobiernan el comportamiento de los sistemas aún son discutibles. Uno de los principios rectores para estos sistemas es el principio de máxima producción de entropía . [21] [22] Afirma que los sistemas que no están en equilibrio se comportan de tal manera que maximizan su producción de entropía. [23]