
Un sistema o partícula de mecánica cuántica que está ligado , es decir, confinado espacialmente, sólo puede adquirir ciertos valores discretos de energía, llamados niveles de energía . Esto contrasta con las partículas clásicas , que pueden tener cualquier cantidad de energía. El término se usa comúnmente para los niveles de energía de los electrones en átomos , iones o moléculas , que están unidos por el campo eléctrico del núcleo , pero también puede referirse a los niveles de energía de los núcleos o niveles de energía vibratorios o rotacionales en las moléculas. Se dice que el espectro de energía de un sistema con niveles de energía tan discretos está cuantificado .
En química y física atómica , una capa de electrones, o nivel de energía principal, puede considerarse como la órbita de uno o más electrones alrededor del núcleo de un átomo . La capa más cercana al núcleo se llama " capa 1 " (también llamada "capa K"), seguida de la " capa 2 " (o "capa L"), luego la " capa 3 " (o "capa M") , y así sucesivamente alejándose cada vez más del núcleo. Las capas se corresponden con los números cuánticos principales ( n = 1, 2, 3, 4...) o están etiquetadas alfabéticamente con letras utilizadas en la notación de rayos X (K, L, M, N...).
Cada capa puede contener solo un número fijo de electrones: la primera capa puede contener hasta dos electrones, la segunda capa puede contener hasta ocho (2 + 6) electrones, la tercera capa puede contener hasta 18 (2 + 6 + 10). ) etcétera. La fórmula general es que la n- ésima capa puede, en principio, contener hasta 2 n 2 electrones. [1] Dado que los electrones son atraídos eléctricamente hacia el núcleo, los electrones de un átomo generalmente ocuparán las capas externas solo si las capas más internas ya han sido completamente llenas por otros electrones. Sin embargo, esto no es un requisito estricto: los átomos pueden tener dos o incluso tres capas exteriores incompletas. (Consulte la regla de Madelung para obtener más detalles). Para obtener una explicación de por qué existen electrones en estas capas, consulte configuración electrónica . [2]
Si la energía potencial se establece en cero a una distancia infinita del núcleo atómico o de la molécula, la convención habitual, entonces los estados de electrones ligados tienen energía potencial negativa.
Si un átomo, ion o molécula se encuentra en el nivel de energía más bajo posible, se dice que él y sus electrones están en el estado fundamental . Si está en un nivel de energía superior, se dice que está excitado , o se excita cualquier electrón que tenga una energía superior a la del estado fundamental . Un nivel de energía se considera degenerado si hay más de un estado mecánico cuántico mensurable asociado a él.
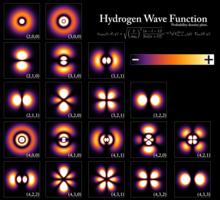
Los niveles de energía cuantificados resultan del comportamiento ondulatorio de las partículas, lo que proporciona una relación entre la energía de una partícula y su longitud de onda . Para una partícula confinada como un electrón en un átomo , las funciones de onda que tienen energías bien definidas tienen la forma de una onda estacionaria . [3] Los estados que tienen energías bien definidas se denominan estados estacionarios porque son los estados que no cambian en el tiempo. Informalmente, estos estados corresponden a un número entero de longitudes de onda de la función de onda a lo largo de un camino cerrado (un camino que termina donde comenzó), como una órbita circular alrededor de un átomo, donde el número de longitudes de onda da el tipo de orbital atómico (0 para orbitales s, 1 para orbitales p, etc.). Ejemplos elementales que muestran matemáticamente cómo se producen los niveles de energía son la partícula en una caja y el oscilador armónico cuántico .
Cualquier superposición ( combinación lineal ) de estados energéticos también es un estado cuántico, pero dichos estados cambian con el tiempo y no tienen energías bien definidas. Una medición de la energía da como resultado el colapso de la función de onda, lo que da como resultado un nuevo estado que consta de un solo estado de energía. La medición de los posibles niveles de energía de un objeto se llama espectroscopia .
La primera evidencia de cuantificación en átomos fue la observación de líneas espectrales en la luz del sol a principios del siglo XIX por Joseph von Fraunhofer y William Hyde Wollaston . La noción de niveles de energía fue propuesta en 1913 por el físico danés Niels Bohr en la teoría del átomo de Bohr. La moderna teoría de la mecánica cuántica que explica estos niveles de energía en términos de la ecuación de Schrödinger fue propuesta por Erwin Schrödinger y Werner Heisenberg en 1926.
En las fórmulas para la energía de los electrones en varios niveles que se dan a continuación en un átomo, el punto cero de la energía se establece cuando el electrón en cuestión ha abandonado completamente el átomo; es decir, cuando el número cuántico principal del electrón n = ∞ . Cuando el electrón está unido al átomo en cualquier valor más cercano de n , la energía del electrón es menor y se considera negativa.
Supongamos que hay un electrón en un orbital atómico dado en un átomo (ion) similar al hidrógeno . La energía de su estado está determinada principalmente por la interacción electrostática del electrón (negativo) con el núcleo (positivo). Los niveles de energía de un electrón alrededor de un núcleo están dados por:
(normalmente entre 1 eV y 10 3 eV),
donde R ∞ es la constante de Rydberg , Z es el número atómico , n es el número cuántico principal , h es la constante de Planck y c es la velocidad de la luz . Sólo para átomos (iones) similares al hidrógeno, los niveles de Rydberg dependen únicamente del número cuántico principal n .
Esta ecuación se obtiene combinando la fórmula de Rydberg para cualquier elemento similar al hidrógeno (que se muestra a continuación) con E = h ν = h c / λ asumiendo que el número cuántico principal n arriba = n 1 en la fórmula de Rydberg y n 2 = ∞ (principal número cuántico del nivel de energía del que desciende el electrón al emitir un fotón ). La fórmula de Rydberg se derivó de datos empíricos de emisiones espectroscópicas .
Se puede derivar una fórmula equivalente en mecánica cuántica a partir de la ecuación de Schrödinger independiente del tiempo con un operador hamiltoniano de energía cinética utilizando una función de onda como función propia para obtener los niveles de energía como valores propios , pero la constante de Rydberg sería reemplazada por otras constantes físicas fundamentales.
Si hay más de un electrón alrededor del átomo, las interacciones electrón-electrón aumentan el nivel de energía. Estas interacciones a menudo se desprecian si la superposición espacial de las funciones de onda de los electrones es baja.
Para átomos de múltiples electrones, las interacciones entre electrones hacen que la ecuación anterior ya no sea precisa como se indica simplemente con Z como número atómico . Una forma sencilla (aunque no completa) de entender esto es como un efecto de blindaje , donde los electrones externos ven un núcleo efectivo de carga reducida, ya que los electrones internos están fuertemente unidos al núcleo y cancelan parcialmente su carga. Esto conduce a una corrección aproximada donde Z se sustituye por una carga nuclear efectiva simbolizada como Z eff que depende en gran medida del número cuántico principal.
En tales casos, los tipos de orbitales (determinados por el número cuántico azimutal ℓ ), así como sus niveles dentro de la molécula, afectan a Z eff y, por lo tanto, también afectan a los distintos niveles de energía de los electrones atómicos. El principio de Aufbau de llenar un átomo con electrones para una configuración electrónica tiene en cuenta estos diferentes niveles de energía. Para llenar un átomo con electrones en el estado fundamental , los niveles de energía más bajos se llenan primero y son consistentes con el principio de exclusión de Pauli , el principio de Aufbau y la regla de Hund .
La estructura fina surge de las correcciones relativistas de la energía cinética, el acoplamiento espín-órbita (una interacción electrodinámica entre el espín y el movimiento del electrón y el campo eléctrico del núcleo) y el término de Darwin (término de contacto de interacción de los electrones de la capa s [ ¿cuáles? ] dentro del núcleo). Estos afectan los niveles en un orden de magnitud típico de 10 −3 eV.
Esta estructura aún más fina se debe a la interacción electrón-núcleo espín-espín , lo que resulta en un cambio típico en los niveles de energía en un orden de magnitud típico de 10 −4 eV.
Hay una energía de interacción asociada con el momento dipolar magnético, μ L , que surge del momento angular orbital electrónico, L , dado por
con
Además, teniendo en cuenta el momento magnético que surge del espín del electrón.
Debido a efectos relativistas ( ecuación de Dirac ), existe un momento magnético, μ S , que surge del espín del electrón.
con g S el factor g del espín del electrón (aproximadamente 2), lo que da como resultado un momento magnético total, μ ,
Por lo tanto, la energía de interacción se convierte en
Los enlaces químicos entre átomos en una molécula se forman porque hacen que la situación sea más estable para los átomos involucrados, lo que generalmente significa que el nivel de energía total para los átomos involucrados en la molécula es menor que si los átomos no estuvieran tan unidos. A medida que los átomos separados se acercan entre sí para unirse covalentemente , sus orbitales afectan los niveles de energía de cada uno para formar orbitales moleculares enlazantes y antienlazantes . El nivel de energía de los orbitales enlazantes es menor y el nivel de energía de los orbitales antienlazantes es mayor. Para que el enlace en la molécula sea estable, los electrones del enlace covalente ocupan el orbital de enlace de menor energía, que puede indicarse mediante símbolos como σ o π, según la situación. Los orbitales antienlazantes correspondientes se pueden representar agregando un asterisco para obtener los orbitales σ* o π*. Un orbital no enlazante en una molécula es un orbital con electrones en capas externas que no participan en el enlace y su nivel de energía es el mismo que el del átomo constituyente. Estos orbitales pueden denominarse orbitales n . Los electrones en un orbital n suelen ser pares libres . [4] En las moléculas poliatómicas también intervienen diferentes niveles de energía vibratoria y rotacional.
En términos generales, un estado de energía molecular (es decir, un estado propio del hamiltoniano molecular ) es la suma de los componentes electrónico, vibratorio, rotacional, nuclear y traslacional, tal que:
donde E electrónica es un valor propio del hamiltoniano molecular electrónico (el valor de la superficie de energía potencial ) en la geometría de equilibrio de la molécula .
Los niveles de energía molecular están etiquetados con los símbolos de términos moleculares . Las energías específicas de estos componentes varían según el estado energético específico y la sustancia.
Existen varios tipos de diagramas de niveles de energía para los enlaces entre átomos de una molécula.
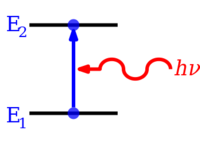

Los electrones de los átomos y las moléculas pueden cambiar (realizar transiciones en) los niveles de energía emitiendo o absorbiendo un fotón (de radiación electromagnética ), cuya energía debe ser exactamente igual a la diferencia de energía entre los dos niveles.
Los electrones también se pueden eliminar por completo de una especie química como un átomo, molécula o ion . La eliminación completa de un electrón de un átomo puede ser una forma de ionización , que consiste efectivamente en mover el electrón a un orbital con un número cuántico principal infinito , de hecho tan lejos que prácticamente no tiene más efecto sobre el átomo restante ( ion). Para varios tipos de átomos, existen energías de ionización primera, segunda, tercera, etc. para eliminar el primero, luego el segundo, luego el tercero, etc. de los electrones de mayor energía, respectivamente, del átomo originalmente en el estado fundamental . También se puede liberar energía en cantidades opuestas correspondientes, a veces en forma de energía fotónica , cuando se añaden electrones a iones cargados positivamente o, a veces, a átomos. Las moléculas también pueden sufrir transiciones en sus niveles de energía vibratorios o rotacionales. Las transiciones de niveles de energía también pueden ser no radiativas, lo que significa que no interviene la emisión o absorción de un fotón.
Si un átomo, ion o molécula se encuentra en el nivel de energía más bajo posible, se dice que él y sus electrones están en el estado fundamental . Si está en un nivel de energía superior, se dice que está excitado , o se excita cualquier electrón que tenga una energía superior a la del estado fundamental . Una especie así puede excitarse a un nivel de energía más alto absorbiendo un fotón cuya energía sea igual a la diferencia de energía entre los niveles. Por el contrario, una especie excitada puede pasar a un nivel de energía más bajo emitiendo espontáneamente un fotón igual a la diferencia de energía. La energía de un fotón es igual a la constante de Planck ( h ) multiplicada por su frecuencia ( f ) y, por tanto, es proporcional a su frecuencia, o inversamente a su longitud de onda ( λ ). [4]
ya que c , la velocidad de la luz, es igual a f λ [4]
En consecuencia, muchos tipos de espectroscopia se basan en detectar la frecuencia o longitud de onda de los fotones emitidos o absorbidos para proporcionar información sobre el material analizado, incluida información sobre los niveles de energía y la estructura electrónica de los materiales obtenida al analizar el espectro .
Generalmente se utiliza un asterisco para designar un estado excitado. Una transición electrónica en el enlace de una molécula desde un estado fundamental a un estado excitado puede tener una designación como σ → σ*, π → π*, o n → π*, lo que significa excitación de un electrón desde un enlace σ a un orbital antienlazante σ. , de un orbital π enlazante a un orbital π antienlazante, o de un orbital n no enlazante a un orbital π antienlazante. [4] [5] Las transiciones electrónicas inversas para todos estos tipos de moléculas excitadas también son posibles para regresar a sus estados fundamentales, que pueden designarse como σ* → σ, π* → π o π* → n.
Una transición en un nivel de energía de un electrón en una molécula puede combinarse con una transición vibratoria y denominarse transición vibrónica . Se puede combinar una transición vibratoria y rotacional mediante un acoplamiento rovibracional . En el acoplamiento rovibrónico , las transiciones electrónicas se combinan simultáneamente con transiciones vibratorias y rotacionales. Los fotones involucrados en las transiciones pueden tener energía de varios rangos en el espectro electromagnético, como radiación de rayos X , ultravioleta , luz visible , infrarroja o microondas , según el tipo de transición. De manera muy general, las diferencias de niveles de energía entre estados electrónicos son mayores, las diferencias entre niveles vibratorios son intermedias y las diferencias entre niveles rotacionales son menores, aunque pueden haber superposiciones. Los niveles de energía de traslación son prácticamente continuos y pueden calcularse como energía cinética utilizando la mecánica clásica .
Una temperatura más alta hace que los átomos y moléculas fluidos se muevan más rápido, aumentando su energía de traslación, y excita térmicamente las moléculas a amplitudes promedio más altas de modos vibratorios y rotacionales (excita las moléculas a niveles de energía interna más altos). Esto significa que a medida que aumenta la temperatura, las contribuciones traslacionales, vibratorias y rotacionales a la capacidad calorífica molecular permiten que las moléculas absorban calor y retengan más energía interna . La conducción de calor generalmente ocurre cuando moléculas o átomos chocan y transfieren calor entre sí. A temperaturas aún más altas, los electrones pueden excitarse térmicamente a orbitales de mayor energía en átomos o moléculas. Una caída posterior de un electrón a un nivel de energía más bajo puede liberar un fotón, provocando un brillo posiblemente coloreado.
Un electrón más alejado del núcleo tiene mayor energía potencial que un electrón más cercano al núcleo, por lo que queda menos unido al núcleo, ya que su energía potencial es negativa e inversamente dependiente de su distancia al núcleo. [6]
Se ha descubierto que los sólidos cristalinos tienen bandas de energía , en lugar de o además de los niveles de energía. Los electrones pueden absorber cualquier energía dentro de una banda vacía. A primera vista esto parece ser una excepción a la exigencia de niveles de energía. Sin embargo, como se muestra en la teoría de bandas , las bandas de energía en realidad están formadas por muchos niveles de energía discretos que están demasiado juntos para resolverse. Dentro de una banda, el número de niveles es del orden del número de átomos en el cristal, por lo que, aunque los electrones en realidad están restringidos a estas energías, parecen ser capaces de adoptar un continuo de valores. Los niveles de energía importantes en un cristal son la parte superior de la banda de valencia , la parte inferior de la banda de conducción , el nivel de Fermi , el nivel de vacío y los niveles de energía de cualquier estado defectuoso en el cristal.