El colesterol es el principal esterol de todos los animales superiores , distribuido en los tejidos corporales , especialmente el cerebro y la médula espinal , y en las grasas y aceites animales . [3] [4]
El colesterol es biosintetizado por todas las células animales y es un componente estructural esencial de las membranas celulares animales . En los vertebrados , las células hepáticas suelen producir las mayores cantidades. En el cerebro, los astrocitos producen colesterol y lo transportan a las neuronas . [5] Está ausente entre los procariotas ( bacterias y arqueas ), aunque hay algunas excepciones, como Mycoplasma , que requieren colesterol para crecer. [6] El colesterol también sirve como precursor para la biosíntesis de hormonas esteroides , ácido biliar [7] y vitamina D.
Los niveles elevados de colesterol en la sangre, especialmente cuando está unido a lipoproteínas de baja densidad (LDL, a menudo denominadas "colesterol malo"), pueden aumentar el riesgo de enfermedad cardiovascular . [8]
En 1769, François Poulletier de la Salle fue el primero en identificar el colesterol en forma sólida en los cálculos biliares. En 1815, el químico Michel Eugène Chevreul denominó al compuesto "colesterina". [9] [10]
La palabra colesterol proviene del griego antiguo chole- , ' bilis ', y stereos , 'sólido', seguido del sufijo químico -ol para un alcohol .
El colesterol es esencial para toda la vida animal. Aunque la mayoría de las células son capaces de sintetizarlo, la mayor parte del colesterol es ingerido o sintetizado por los hepatocitos y transportado en la sangre a las células periféricas. Los niveles de colesterol en los tejidos periféricos están determinados por un equilibrio entre la absorción y la exportación. [11] En condiciones normales, el colesterol cerebral está separado del colesterol periférico, es decir, el colesterol dietético y hepático no cruzan la barrera hematoencefálica. En cambio, los astrocitos producen y distribuyen el colesterol en el cerebro. [12]
La síntesis de novo, tanto en astrocitos como en hepatocitos, se produce mediante un proceso complejo de 37 pasos. Este comienza con la vía del mevalonato o HMG-CoA reductasa , el objetivo de los medicamentos con estatinas , que abarca los primeros 18 pasos. A esto le siguen 19 pasos adicionales para convertir el lanosterol resultante en colesterol. [13] Un hombre humano que pesa 68 kg (150 lb) normalmente sintetiza alrededor de 1 gramo (1000 mg) de colesterol por día, y su cuerpo contiene alrededor de 35 g, principalmente contenidos dentro de las membranas celulares.
La ingesta diaria típica de colesterol en la dieta de un hombre en los Estados Unidos es de 307 mg. [14] La mayor parte del colesterol ingerido está esterificado , lo que hace que el intestino lo absorba mal. El cuerpo también compensa la absorción del colesterol ingerido reduciendo su propia síntesis de colesterol. [15] Por estas razones, el colesterol en los alimentos, de siete a diez horas después de la ingestión, tiene poco o ningún efecto sobre las concentraciones de colesterol en la sangre. Sorprendentemente, en ratas, el colesterol en sangre está inversamente correlacionado con el consumo de colesterol. Cuanto más colesterol come una rata, menor es el colesterol en sangre. [16] Durante las primeras siete horas después de la ingestión de colesterol, a medida que las grasas absorbidas se distribuyen por el cuerpo dentro del agua extracelular por las diversas lipoproteínas (que transportan todas las grasas en el agua fuera de las células), las concentraciones aumentan. [17]
Las plantas producen colesterol en cantidades muy pequeñas. [18] En cantidades mayores producen fitoesteroles , sustancias químicamente similares que pueden competir con el colesterol para su reabsorción en el tracto intestinal, reduciendo así potencialmente la reabsorción de colesterol. [19] Cuando las células del revestimiento intestinal absorben fitoesteroles, en lugar de colesterol, generalmente excretan las moléculas de fitoesteroles nuevamente en el tracto gastrointestinal , un importante mecanismo de protección. La ingesta de fitoesteroles naturales, que abarcan esteroles y estanoles vegetales , varía entre ≈200–300 mg/día dependiendo de los hábitos alimenticios. [20] Se han producido dietas experimentales vegetarianas especialmente diseñadas que producen más de 700 mg/día. [21]
El colesterol está presente en diversos grados en todas las membranas celulares animales , pero está ausente en los procariotas. [22] Es necesario para construir y mantener las membranas y modula la fluidez de la membrana en el rango de temperaturas fisiológicas. El grupo hidroxilo de cada molécula de colesterol interactúa con las moléculas de agua que rodean la membrana, al igual que las cabezas polares de los fosfolípidos y esfingolípidos de la membrana , mientras que el esteroide voluminoso y la cadena de hidrocarburos están incrustados en la membrana, junto con la cadena de ácidos grasos no polares de los otros lípidos. A través de la interacción con las cadenas de ácidos grasos de fosfolípidos, el colesterol aumenta el empaquetamiento de la membrana, lo que altera la fluidez de la membrana [23] y mantiene la integridad de la membrana para que las células animales no necesiten construir paredes celulares (como las plantas y la mayoría de las bacterias). La membrana permanece estable y duradera sin ser rígida, lo que permite que las células animales cambien de forma y que los animales se muevan.
La estructura del anillo tetracíclico del colesterol contribuye a la fluidez de la membrana celular, ya que la molécula está en una conformación trans que hace que todas las cadenas de colesterol, excepto la lateral, sean rígidas y planas. [24] En esta función estructural, el colesterol también reduce la permeabilidad de la membrana plasmática a los solutos neutros, [25] iones de hidrógeno e iones de sodio . [26]
El colesterol regula el proceso biológico de presentación de sustrato y las enzimas que utilizan la presentación de sustrato como mecanismo de su activación. La fosfolipasa D2 ( PLD2 ) es un ejemplo bien definido de una enzima activada por la presentación de sustrato. [27] La enzima se palmitoila, lo que hace que la enzima se dirija a los dominios lipídicos dependientes del colesterol, a veces llamados " balsas lipídicas ". El sustrato de la fosfolipasa D es la fosfatidilcolina (PC), que es insaturada y tiene una baja abundancia en las balsas lipídicas. La PC se localiza en la región desordenada de la célula junto con el lípido poliinsaturado fosfatidilinositol 4,5-bisfosfato (PIP2). La PLD2 tiene un dominio de unión a PIP2 . Cuando la concentración de PIP2 en la membrana aumenta, la PLD2 abandona los dominios dependientes del colesterol y se une a PIP2, donde luego obtiene acceso a su sustrato PC y comienza la catálisis basada en la presentación de sustrato.

El colesterol también está implicado en los procesos de señalización celular, ayudando a la formación de balsas lipídicas en la membrana plasmática , lo que acerca las proteínas receptoras a altas concentraciones de moléculas de segundo mensajero. [28] En múltiples capas, el colesterol y los fosfolípidos, ambos aislantes eléctricos, pueden facilitar la velocidad de transmisión de los impulsos eléctricos a lo largo del tejido nervioso. Para muchas fibras neuronales, una vaina de mielina , rica en colesterol ya que se deriva de capas compactadas de membranas de células de Schwann u oligodendrocitos, proporciona aislamiento para una conducción más eficiente de los impulsos. [29] Se cree que la desmielinización (pérdida de mielina) es parte de la base de la esclerosis múltiple .
El colesterol se une a una serie de canales iónicos , como el receptor nicotínico de acetilcolina , el receptor GABA A y el canal de potasio rectificador de entrada , y afecta su activación . [30] El colesterol también activa el receptor alfa relacionado con el estrógeno (ERRα) y puede ser el ligando endógeno del receptor . [31] [32] La naturaleza constitutivamente activa del receptor puede explicarse por el hecho de que el colesterol es omnipresente en el cuerpo. [32] La inhibición de la señalización de ERRα mediante la reducción de la producción de colesterol se ha identificado como un mediador clave de los efectos de las estatinas y los bifosfonatos en los huesos , los músculos y los macrófagos . [31] [32] Sobre la base de estos hallazgos, se ha sugerido que el ERRα debería desorfanizarse y clasificarse como un receptor para el colesterol. [31] [32]
Dentro de las células, el colesterol también es una molécula precursora de varias vías bioquímicas . Por ejemplo, es la molécula precursora de la síntesis de vitamina D en el metabolismo del calcio y de todas las hormonas esteroides , incluidas las hormonas de la glándula suprarrenal cortisol y aldosterona , así como las hormonas sexuales progesterona , estrógenos y testosterona , y sus derivados. [7] [33]
El estrato córneo es la capa más externa de la epidermis. [34] [35] Está compuesto de corneocitos diferenciados terminalmente y enucleados que residen dentro de una matriz lipídica, como "ladrillos y mortero". [34] [35] Junto con las ceramidas y los ácidos grasos libres, el colesterol forma el mortero lipídico, una barrera impermeable al agua que evita la pérdida de agua por evaporación. Como regla general, la matriz lipídica epidérmica está compuesta por una mezcla equimolar de ceramidas (≈50% en peso), colesterol (≈25% en peso) y ácidos grasos libres (≈15% en peso), con cantidades más pequeñas de otros lípidos también presentes. [34] [35] El sulfato de colesterol alcanza su concentración más alta en la capa granular de la epidermis. La sulfato sulfatasa esteroidea luego disminuye su concentración en el estrato córneo, la capa más externa de la epidermis. [36] La abundancia relativa de sulfato de colesterol en la epidermis varía según las diferentes partes del cuerpo, siendo el talón del pie el que tiene la concentración más baja. [35]
El colesterol se recicla en el cuerpo. El hígado excreta el colesterol en los líquidos biliares , que luego se almacenan en la vesícula biliar , que luego los excreta en una forma no esterificada (a través de la bilis) en el tracto digestivo. Por lo general, alrededor del 50% del colesterol excretado es reabsorbido por el intestino delgado y devuelto al torrente sanguíneo.
Casi todos los tejidos animales sintetizan colesterol a partir de acetil-CoA . Todas las células animales (existen excepciones en los invertebrados) fabrican colesterol, tanto para la estructura de la membrana como para otros usos, con tasas de producción relativas que varían según el tipo de célula y la función del órgano. Alrededor del 80% de la producción diaria total de colesterol se produce en el hígado y los intestinos ; [37] otros sitios de tasas de síntesis más altas incluyen el cerebro , las glándulas suprarrenales y los órganos reproductivos .
La síntesis en el organismo comienza con la vía del mevalonato , donde dos moléculas de acetil CoA se condensan para formar acetoacetil-CoA . A esto le sigue una segunda condensación entre acetil CoA y acetoacetil-CoA para formar 3-hidroxi-3-metilglutaril CoA ( HMG-CoA ). [38]

Esta molécula luego se reduce a mevalonato por acción de la enzima HMG-CoA reductasa . La producción de mevalonato es el paso irreversible y limitante de la velocidad en la síntesis de colesterol y es el sitio de acción de las estatinas (una clase de medicamentos para reducir el colesterol).
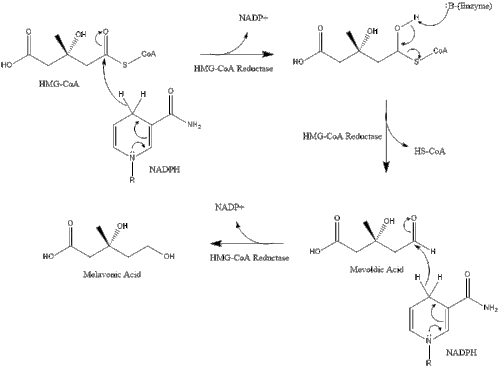
El mevalonato finalmente se convierte en pirofosfato de isopentenilo (IPP) a través de dos pasos de fosforilación y un paso de descarboxilación que requiere ATP .
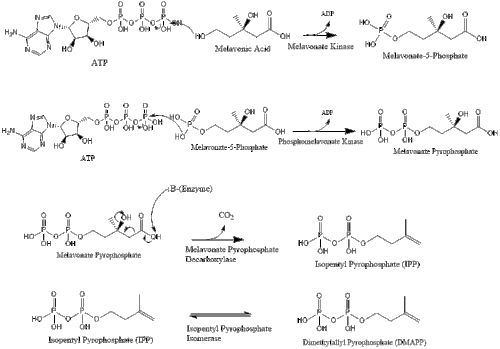
Tres moléculas de pirofosfato de isopentenilo se condensan para formar pirofosfato de farnesilo mediante la acción de la geranil transferasa.

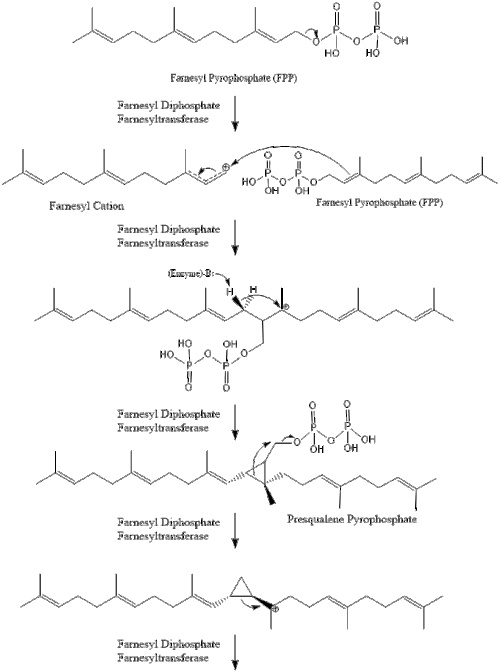
Luego, dos moléculas de pirofosfato de farnesilo se condensan para formar escualeno mediante la acción de la escualeno sintasa en el retículo endoplásmico . [38]
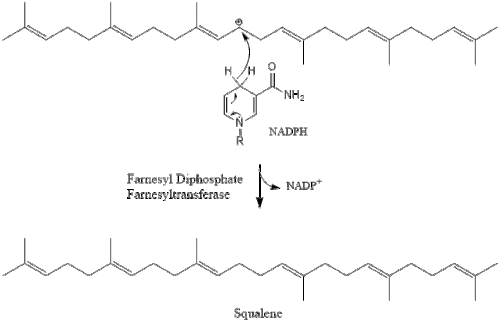
Luego, la oxidoscualeno ciclasa cicla el escualeno para formar lanosterol .
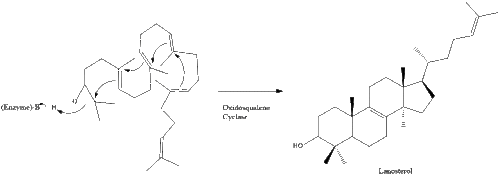
Finalmente, el lanosterol se convierte en colesterol a través de una de dos vías, la vía de Bloch o la vía de Kandutsch-Russell. [39] [40] [41] [42] [43] Los 19 pasos finales hacia el colesterol contienen NADPH y oxígeno para ayudar a oxidar los grupos metilo para la eliminación de carbonos, mutasas para mover los grupos alqueno y NADH para ayudar a reducir las cetonas .
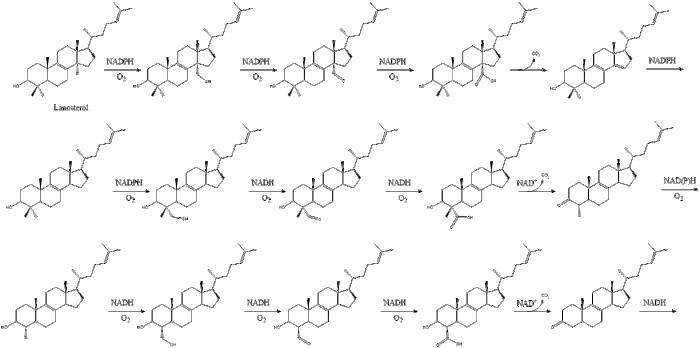

Konrad Bloch y Feodor Lynen compartieron el Premio Nobel de Fisiología o Medicina en 1964 por sus descubrimientos sobre algunos de los mecanismos y métodos de regulación del metabolismo del colesterol y los ácidos grasos . [44]
La biosíntesis del colesterol está regulada directamente por los niveles de colesterol presentes, aunque los mecanismos homeostáticos involucrados solo se comprenden parcialmente. Una mayor ingesta de alimentos conduce a una disminución neta en la producción endógena, mientras que una menor ingesta de alimentos tiene el efecto opuesto. El principal mecanismo regulador es la detección del colesterol intracelular en el retículo endoplasmático por la proteína SREBP (proteína de unión al elemento regulador de esterol 1 y 2). [45] En presencia de colesterol, SREBP se une a otras dos proteínas: SCAP (proteína activadora de escisión de SREBP) e INSIG-1 . Cuando los niveles de colesterol caen, INSIG-1 se disocia del complejo SREBP-SCAP, lo que permite que el complejo migre al aparato de Golgi . Aquí SREBP es escindido por S1P y S2P (proteasa del sitio 1 y proteasa del sitio 2), dos enzimas que son activadas por SCAP cuando los niveles de colesterol son bajos.
El SREBP escindido luego migra al núcleo y actúa como un factor de transcripción para unirse al elemento regulador de esteroles (SRE), que estimula la transcripción de muchos genes. Entre estos se encuentran el receptor de lipoproteína de baja densidad ( LDL ) y la HMG-CoA reductasa . El receptor de LDL elimina las LDL circulantes del torrente sanguíneo, mientras que la HMG-CoA reductasa conduce a un aumento en la producción endógena de colesterol. [46] Una gran parte de esta vía de señalización fue aclarada por el Dr. Michael S. Brown y el Dr. Joseph L. Goldstein en la década de 1970. En 1985, recibieron el Premio Nobel de Fisiología o Medicina por su trabajo. Su trabajo posterior muestra cómo la vía SREBP regula la expresión de muchos genes que controlan la formación y el metabolismo de lípidos y la asignación de combustible corporal.
La síntesis de colesterol también puede desactivarse cuando los niveles de colesterol son altos. La HMG-CoA reductasa contiene tanto un dominio citosólico (responsable de su función catalítica) como un dominio de membrana. El dominio de membrana detecta señales para su degradación. El aumento de las concentraciones de colesterol (y otros esteroles) provoca un cambio en el estado de oligomerización de este dominio, lo que lo hace más susceptible a la destrucción por el proteasoma . La actividad de esta enzima también puede reducirse por fosforilación por una proteína quinasa activada por AMP . Debido a que esta quinasa es activada por AMP, que se produce cuando se hidroliza el ATP, se deduce que la síntesis de colesterol se detiene cuando los niveles de ATP son bajos. [47]

Como molécula aislada, el colesterol es mínimamente soluble en agua o hidrófilo . Por ello, se disuelve en la sangre en concentraciones extremadamente pequeñas. Para transportarse eficazmente, el colesterol se empaqueta en lipoproteínas , partículas discoidales complejas con proteínas y lípidos anfifílicos exteriores , cuyas superficies externas son solubles en agua y las superficies internas son solubles en lípidos. Esto le permite viajar a través de la sangre mediante emulsión . El colesterol no unido, al ser anfipático, se transporta en la superficie de la monocapa de la partícula de lipoproteína junto con fosfolípidos y proteínas. Los ésteres de colesterol unidos a ácidos grasos, por otro lado, se transportan dentro del núcleo hidrófobo graso de la lipoproteína, junto con los triglicéridos. [48]
Existen varios tipos de lipoproteínas en la sangre. En orden de densidad creciente, son quilomicrones , lipoproteínas de muy baja densidad (VLDL), lipoproteínas de densidad intermedia (IDL), lipoproteínas de baja densidad (LDL) y lipoproteínas de alta densidad (HDL). Las proporciones proteína/lípido más bajas dan lugar a lipoproteínas menos densas. El colesterol dentro de las diferentes lipoproteínas es idéntico, aunque una parte se transporta como su forma de alcohol "libre" nativa (el grupo colesterol-OH que mira hacia el agua que rodea las partículas), mientras que otra parte se transporta como ésteres de acilo graso, también conocidos como ésteres de colesterol, dentro de las partículas. [48]
Las partículas de lipoproteínas están organizadas por apolipoproteínas complejas , típicamente 80-100 proteínas diferentes por partícula, que pueden ser reconocidas y unidas por receptores específicos en las membranas celulares, dirigiendo su carga lipídica a células y tejidos específicos que actualmente ingieren estas partículas transportadoras de grasa. Estos receptores de superficie sirven como firmas moleculares únicas, que luego ayudan a determinar la distribución de la grasa en todo el cuerpo. [48]
Los quilomicrones, las partículas transportadoras de colesterol menos densas, contienen apolipoproteína B-48 , apolipoproteína C y apolipoproteína E (el principal transportador de colesterol en el cerebro [49] ) en sus capas. Los quilomicrones transportan grasas desde el intestino hasta los músculos y otros tejidos que necesitan ácidos grasos para la producción de energía o grasa. El colesterol no utilizado permanece en los restos de quilomicrones más ricos en colesterol y desde allí es absorbido por el hígado hasta el torrente sanguíneo. [48]
Las partículas VLDL son producidas por el hígado a partir de triacilglicerol y colesterol que no se utilizaron en la síntesis de ácidos biliares. Estas partículas contienen apolipoproteína B100 y apolipoproteína E en sus envolturas y pueden ser degradadas por la lipoproteína lipasa en la pared arterial a IDL. Esta escisión de la pared arterial permite la absorción de triacilglicerol y aumenta la concentración de colesterol circulante. Las partículas IDL luego se consumen en dos procesos: la mitad es metabolizada por HTGL y captada por el receptor de LDL en las superficies de las células hepáticas, mientras que la otra mitad continúa perdiendo triacilglicerol en el torrente sanguíneo hasta que se convierten en partículas LDL cargadas de colesterol. [48]
Las partículas LDL son los principales transportadores de colesterol en la sangre. Cada una contiene aproximadamente 1.500 moléculas de ésteres de colesterol. Las capas de partículas LDL contienen solo una molécula de apolipoproteína B100 , reconocida por los receptores LDL en los tejidos periféricos. Tras la unión de la apolipoproteína B100 , muchos receptores LDL se concentran en fosas recubiertas de clatrina . Tanto las LDL como sus receptores forman vesículas dentro de una célula mediante endocitosis . Estas vesículas luego se fusionan con un lisosoma , donde la enzima lipasa ácida lisosómica hidroliza los ésteres de colesterol. El colesterol puede entonces usarse para la biosíntesis de la membrana o esterificarse y almacenarse dentro de la célula, de modo que no interfiera con las membranas celulares. [48]
Los receptores de LDL se agotan durante la absorción del colesterol, y su síntesis está regulada por SREBP , la misma proteína que controla la síntesis de colesterol de novo , según su presencia dentro de la célula. Una célula con colesterol abundante tendrá bloqueada la síntesis de su receptor de LDL, para evitar que se absorba colesterol nuevo en partículas de LDL. Por el contrario, la síntesis del receptor de LDL se produce cuando una célula tiene deficiencia de colesterol. [48]
Cuando este proceso se desregula, comienzan a aparecer en la sangre partículas LDL sin receptores. Estas partículas LDL son oxidadas y captadas por los macrófagos , que se congestionan y forman células espumosas. Estas células espumosas a menudo quedan atrapadas en las paredes de los vasos sanguíneos y contribuyen a la formación de placa aterosclerótica . Las diferencias en la homeostasis del colesterol afectan el desarrollo de la aterosclerosis temprana (espesor de la íntima-media carotídea). [50] Estas placas son las principales causas de ataques cardíacos, accidentes cerebrovasculares y otros problemas médicos graves, lo que lleva a la asociación del llamado colesterol LDL (en realidad una lipoproteína ) con el colesterol "malo". [47]
Se cree que las partículas HDL transportan el colesterol de regreso al hígado, ya sea para su excreción o para otros tejidos que sintetizan hormonas, en un proceso conocido como transporte inverso de colesterol (RCT). [51] Una gran cantidad de partículas HDL se correlaciona con mejores resultados de salud, [52] mientras que una cantidad baja de partículas HDL se asocia con la progresión de la enfermedad ateromatosa en las arterias. [53]
El colesterol es susceptible a la oxidación y forma fácilmente derivados oxigenados llamados oxiesteroles . Estos pueden formarse por tres mecanismos diferentes: autooxidación, oxidación secundaria a peroxidación lipídica y oxidación de enzimas que metabolizan el colesterol. Surgió un gran interés en los oxiesteroles cuando se demostró que ejercían acciones inhibidoras sobre la biosíntesis del colesterol. [54] Este hallazgo se conoció como la "hipótesis del oxiesterol". Otras funciones de los oxiesteroles en la fisiología humana incluyen su participación en la biosíntesis de ácidos biliares, su función como formas de transporte del colesterol y la regulación de la transcripción genética. [55]
En los experimentos bioquímicos se utilizan formas radiomarcadas del colesterol, como el colesterol tritiado. Estos derivados sufren una degradación durante el almacenamiento y es esencial purificar el colesterol antes de su uso. El colesterol se puede purificar utilizando pequeñas columnas Sephadex LH-20. [56]
El colesterol es oxidado por el hígado en una variedad de ácidos biliares . [57] Estos, a su vez, se conjugan con glicina , taurina , ácido glucurónico o sulfato . Una mezcla de ácidos biliares conjugados y no conjugados, junto con el propio colesterol, se excreta desde el hígado hacia la bilis . Aproximadamente el 95% de los ácidos biliares se reabsorben en los intestinos y el resto se pierde en las heces. [58] La excreción y reabsorción de los ácidos biliares forma la base de la circulación enterohepática , que es esencial para la digestión y absorción de las grasas de la dieta. En determinadas circunstancias, cuando está más concentrado, como en la vesícula biliar , el colesterol se cristaliza y es el componente principal de la mayoría de los cálculos biliares ( también se producen cálculos biliares de lecitina y bilirrubina , pero con menor frecuencia). [59] Cada día, hasta 1 g de colesterol ingresa al colon. Este colesterol proviene de la dieta, la bilis y las células intestinales descamadas, y puede ser metabolizado por las bacterias del colon. El colesterol se convierte principalmente en coprostanol , un esterol no absorbible que se excreta en las heces. [ cita requerida ]
Aunque el colesterol es un esteroide generalmente asociado con los mamíferos, el patógeno humano Mycobacterium tuberculosis es capaz de degradar completamente esta molécula y contiene una gran cantidad de genes que están regulados por su presencia. [60] Muchos de estos genes regulados por el colesterol son homólogos de los genes de β-oxidación de ácidos grasos , pero han evolucionado de tal manera que se unen a grandes sustratos esteroides como el colesterol. [61] [62]
Las grasas animales son mezclas complejas de triglicéridos , con cantidades menores tanto de fosfolípidos como de moléculas de colesterol a partir de las cuales se construyen todas las membranas celulares animales (y humanas). Dado que todas las células animales fabrican colesterol, todos los alimentos de origen animal contienen colesterol en cantidades variables. [63] Las principales fuentes dietéticas de colesterol incluyen la carne roja , las yemas de huevo y los huevos enteros , el hígado , los riñones , los menudillos , el aceite de pescado y la mantequilla . [64] La leche materna humana también contiene cantidades significativas de colesterol. [65]
Las células vegetales sintetizan colesterol como precursor de otros compuestos, como los fitoesteroles y los glicoalcaloides esteroidales , y el colesterol permanece en los alimentos vegetales solo en cantidades menores o ausente. [64] [66] Algunos alimentos vegetales, como el aguacate , las semillas de lino y los cacahuetes , contienen fitoesteroles, que compiten con el colesterol por la absorción en los intestinos y reducen la absorción tanto del colesterol dietético como del biliar. [67] Una dieta típica contribuye con alrededor de 0,2 gramos de fitoesteroles, lo que no es suficiente para tener un impacto significativo en el bloqueo de la absorción del colesterol. La ingesta de fitoesteroles se puede complementar mediante el uso de alimentos funcionales que contengan fitoesteroles o suplementos dietéticos que se reconocen por tener potencial para reducir los niveles de colesterol LDL . [68]
En 2015, el panel asesor científico del Departamento de Salud y Servicios Humanos de los EE. UU. y el Departamento de Agricultura de los EE. UU. para la iteración de 2015 de las Guías Alimentarias para los Estadounidenses redujo el límite previamente recomendado de consumo de colesterol en la dieta a 300 mg por día con una nueva recomendación de "comer la menor cantidad posible de colesterol en la dieta", reconociendo así una asociación entre una dieta baja en colesterol y un menor riesgo de enfermedad cardiovascular. [69]
Un informe de 2013 de la Asociación Estadounidense del Corazón y el Colegio Estadounidense de Cardiología recomendó centrarse en patrones dietéticos saludables en lugar de límites específicos de colesterol, ya que son difíciles de implementar para los médicos y los consumidores. Recomiendan la dieta DASH y la dieta mediterránea , que son bajas en colesterol. [70] Una revisión de 2017 de la Asociación Estadounidense del Corazón recomienda cambiar las grasas saturadas por grasas poliinsaturadas para reducir el riesgo de enfermedades cardiovasculares . [71]
Algunas guías complementarias han recomendado dosis de fitoesteroles en el rango de 1,6 a 3,0 gramos por día (Health Canada, EFSA, ATP III, FDA). Un metaanálisis demostró una reducción del 12% en el colesterol LDL con una dosis media de 2,1 gramos por día. [72] También se han cuestionado los beneficios de una dieta suplementada con fitoesteroles. [73]

Según la hipótesis de los lípidos , los niveles elevados de colesterol en la sangre conducen a la aterosclerosis , que puede aumentar el riesgo de ataque cardíaco , accidente cerebrovascular y enfermedad arterial periférica . Dado que un nivel elevado de LDL en sangre (especialmente concentraciones más altas de LDL y un tamaño de partícula de LDL más pequeño) contribuye a este proceso más que el contenido de colesterol de las partículas de HDL, [8] las partículas de LDL a menudo se denominan "colesterol malo". Las altas concentraciones de HDL funcional, que pueden eliminar el colesterol de las células y los ateromas, ofrecen protección y se conocen comúnmente como "colesterol bueno". Estos equilibrios están determinados principalmente por la genética, pero pueden modificarse por la composición corporal, los medicamentos , la dieta [74] y otros factores. [75] Un estudio de 2007 demostró que los niveles de colesterol total en sangre tienen un efecto exponencial en la mortalidad cardiovascular y total, con una asociación más pronunciada en sujetos más jóvenes. Debido a que la enfermedad cardiovascular es relativamente rara en la población más joven, el impacto del colesterol alto en la salud es mayor en las personas mayores. [76]
Los niveles elevados de las fracciones de lipoproteínas, LDL, IDL y VLDL, en lugar del nivel de colesterol total, se correlacionan con la extensión y el progreso de la aterosclerosis. [77] Por el contrario, el colesterol total puede estar dentro de los límites normales, pero estar compuesto principalmente de partículas pequeñas de LDL y HDL, en cuyas condiciones las tasas de crecimiento de los ateromas son altas. Un análisis post hoc de los estudios prospectivos IDEAL y EPIC encontró una asociación entre los niveles altos de colesterol HDL (ajustado para la apolipoproteína AI y la apolipoproteína B) y un mayor riesgo de enfermedad cardiovascular, lo que pone en duda el papel cardioprotector del "colesterol bueno". [78] [79]
Aproximadamente una de cada 250 personas puede tener una mutación genética en el receptor de colesterol LDL que provoca hipercolesterolemia familiar. [80] El colesterol alto hereditario también puede incluir mutaciones genéticas en el gen PCSK9 y el gen de la apolipoproteína B. [81]
Los niveles elevados de colesterol se pueden tratar con una dieta que reduzca o elimine las grasas saturadas, las grasas trans y los alimentos ricos en colesterol, [82] [83] a menudo seguida de uno de varios agentes hipolipidémicos , como estatinas , fibratos , inhibidores de la absorción de colesterol, terapia con anticuerpos monoclonales ( inhibidores de PCSK9 ), derivados del ácido nicotínico o secuestradores de ácidos biliares. [84] Existen varias pautas internacionales sobre el tratamiento de la hipercolesterolemia. [85]
Los ensayos en humanos que utilizan inhibidores de la HMG-CoA reductasa , conocidos como estatinas , han confirmado repetidamente que cambiar los patrones de transporte de lipoproteínas de patrones no saludables a patrones más saludables reduce significativamente las tasas de eventos de enfermedad cardiovascular, incluso para personas con valores de colesterol que actualmente se consideran bajos para adultos. [86] Los estudios han demostrado que la reducción de los niveles de colesterol LDL en aproximadamente 38,7 mg/dl con el uso de estatinas puede reducir el riesgo de enfermedad cardiovascular y accidente cerebrovascular en aproximadamente un 21%. [87] Los estudios también han encontrado que las estatinas reducen la progresión del ateroma. [88] Como resultado, las personas con antecedentes de enfermedad cardiovascular pueden obtener beneficios de las estatinas independientemente de sus niveles de colesterol (colesterol total por debajo de 5,0 mmol/l [193 mg/dl]), [89] y en hombres sin enfermedad cardiovascular, existe un beneficio al reducir los niveles de colesterol anormalmente altos ("prevención primaria"). [90] La prevención primaria en mujeres se practicó originalmente sólo por extensión de los hallazgos de estudios en hombres, [91] ya que, en mujeres, ninguno de los grandes ensayos con estatinas realizados antes de 2007 demostró una reducción significativa en la mortalidad general o en los puntos finales cardiovasculares. [92] Los metanálisis han demostrado reducciones significativas en la mortalidad por todas las causas y cardiovascular, sin heterogeneidad significativa por sexo. [93]
El informe de 1987 del Programa Nacional de Educación sobre el Colesterol , Paneles de Tratamiento para Adultos sugiere que el nivel total de colesterol en sangre debe ser: < 200 mg/dL de colesterol en sangre normal, 200–239 mg/dL de colesterol limítrofe-alto, > 240 mg/dL de colesterol alto. [94] La Asociación Estadounidense del Corazón proporciona un conjunto similar de pautas para los niveles totales de colesterol en sangre (en ayunas) y el riesgo de enfermedad cardíaca: [82] Las estatinas son efectivas para reducir el colesterol LDL y se usan ampliamente para la prevención primaria en personas con alto riesgo de enfermedad cardiovascular, así como en la prevención secundaria para quienes han desarrollado enfermedad cardiovascular. [95] El colesterol total medio global promedio para humanos se ha mantenido en aproximadamente 4,6 mmol/L (178 mg/dL) para hombres y mujeres, tanto crudo como estandarizado por edad, durante casi 40 años desde 1980 hasta 2018, con algunas variaciones regionales y reducción del colesterol total en las naciones occidentales. [96]
Los métodos de análisis más actuales determinan el colesterol LDL ("malo") y el HDL ("bueno") por separado, lo que permite un análisis del colesterol más matizado. Se considera que el nivel deseable de LDL es inferior a 100 mg/dl (2,6 mmol /l). [97] [98]

El colesterol total se define como la suma de HDL, LDL y VLDL. Por lo general, solo se miden el total, HDL y triglicéridos. Por razones de costo, el VLDL se estima generalmente como una quinta parte de los triglicéridos y el LDL se estima utilizando la fórmula de Friedewald (o una variante ): LDL estimado = [colesterol total] − [HDL total] − [VLDL estimado]. Las mediciones directas de LDL se utilizan cuando los triglicéridos superan los 400 mg/dl. Las VLDL y LDL estimadas tienen más error cuando los triglicéridos están por encima de 400 mg/dl. [99]
En el Framingham Heart Study , cada aumento de 10 mg/dL (0,6 mmol /L) en los niveles de colesterol total aumentó la mortalidad general a 30 años en un 5% y la mortalidad por ECV en un 9%. Mientras que los sujetos mayores de 50 años tuvieron un aumento del 11% en la mortalidad general y un aumento del 14% en la mortalidad por enfermedad cardiovascular por cada caída de 1 mg/dL (0,06 mmol /L) al año en los niveles de colesterol total. Los investigadores atribuyeron este fenómeno a una correlación diferente , por la cual la enfermedad en sí misma aumenta el riesgo de muerte, así como cambia una miríada de factores, como la pérdida de peso y la incapacidad de comer, que reducen el colesterol sérico. [100] Este efecto también se mostró en hombres de todas las edades y mujeres mayores de 50 años en el Programa de Monitoreo y Promoción de la Salud de Vorarlberg. Estos grupos tenían más probabilidades de morir de cáncer, enfermedades hepáticas y enfermedades mentales con colesterol total muy bajo, de 186 mg/dL (10,3 mmol /L) y menos. Este resultado indica que el efecto del colesterol bajo ocurre incluso entre los encuestados más jóvenes, lo que contradice la evaluación previa entre cohortes de personas mayores de que este es un marcador de fragilidad que ocurre con la edad. [101]
Los niveles anormalmente bajos de colesterol se denominan hipocolesterolemia . La investigación sobre las causas de este estado es relativamente limitada, pero algunos estudios sugieren un vínculo con la depresión , el cáncer y la hemorragia cerebral . En general, los niveles bajos de colesterol parecen ser una consecuencia, más que una causa, de una enfermedad subyacente. [76] Un defecto genético en la síntesis de colesterol causa el síndrome de Smith-Lemli-Opitz , que a menudo se asocia con niveles bajos de colesterol plasmático. El hipertiroidismo , o cualquier otro trastorno endocrino que provoque una regulación positiva del receptor de LDL , puede provocar hipocolesterolemia. [102]
La Asociación Estadounidense del Corazón recomienda que las personas de 20 años o más se hagan una prueba de colesterol cada 4 a 6 años. [103] Un conjunto independiente de pautas de la Asociación Estadounidense del Corazón emitidas en 2013 indica que las personas que toman estatinas deben hacerse una prueba de colesterol entre 4 y 12 semanas después de su primera dosis y luego cada 3 a 12 meses a partir de entonces. [104] [105] En el caso de los hombres de 45 a 65 años y las mujeres de 55 a 65 años, se debe realizar una prueba de colesterol cada 1 o 2 años, y en el caso de las personas mayores de 65 años, se debe realizar una prueba anual. [104]
Un profesional de la salud toma una muestra de sangre de una vena del brazo después de 12 horas de ayuno para medir un perfil lipídico para a) colesterol total, b) colesterol HDL, c) colesterol LDL y d) triglicéridos . [3] [104] Los resultados pueden expresarse como "calculados", lo que indica un cálculo de colesterol total, HDL y triglicéridos. [ 3]
El colesterol se analiza para determinar los niveles "normales" o "deseables" si una persona tiene un colesterol total de 5,2 mmol/L o menos (200 mg/dL), un valor de HDL de más de 1 mmol/L (40 mg/dL, "cuanto más alto, mejor"), un valor de LDL de menos de 2,6 mmol/L (100 mg/dL) y un nivel de triglicéridos de menos de 1,7 mmol/L (150 mg/dL). [104] [3] El colesterol en sangre en personas con factores de riesgo cardiovascular, relacionados con el estilo de vida o el envejecimiento, como diabetes mellitus , hipertensión , antecedentes familiares de enfermedad de la arteria coronaria o angina de pecho , se evalúa en diferentes niveles. [104]
Haga clic en los genes, proteínas y metabolitos que aparecen a continuación para acceder a los artículos correspondientes. [§ 1]
Se sabe que algunos derivados del colesterol (entre otros lípidos colestéricos simples) generan la "fase colestérica" cristalina líquida . La fase colestérica es, de hecho, una fase nemática quiral y cambia de color cuando cambia su temperatura. Esto hace que los derivados del colesterol sean útiles para indicar la temperatura en termómetros con pantalla de cristal líquido y en pinturas sensibles a la temperatura. [ cita requerida ]
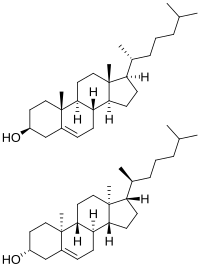
El colesterol tiene 256 estereoisómeros que surgen de sus ocho estereocentros, aunque sólo dos de los estereoisómeros tienen importancia bioquímica ( nat -colesterol y ent -colesterol, para natural y enantiómero , respectivamente), [106] [107] y sólo uno se produce de forma natural ( nat -colesterol).
Je nommerai
cholesterine
, de χολη, bilis, et στερεος, solide, la sustancia cristallisée des calculs biliares humains, ...[Nombraré colesterina – de χολη (bilis) y στερεος (sólido) – la sustancia cristalizada de los cálculos biliares humanos.. .]