
En biología molecular , la presentación del sustrato es un proceso biológico que activa una proteína . La proteína se separa de su sustrato y luego se activa mediante la liberación y exposición a su sustrato. [1] [2] Un sustrato es típicamente la sustancia sobre la que actúa una enzima , pero también puede ser una superficie proteica a la que se une un ligando . En el caso de una interacción con una enzima, la proteína o el sustrato orgánico generalmente cambia de forma química. La presentación del sustrato se diferencia de la regulación alostérica en que la enzima no necesita cambiar su conformación para comenzar la catálisis . La presentación del sustrato se describe mejor para la partición de dominios a distancias nanoscópicas (<100 nm). [3]
La proteína precursora amiloide (APP) es escindida por la beta y la gamma secretasa para producir un péptido de 40-42 aminoácidos responsable de las placas amiloides asociadas con la enfermedad de Alzheimer . Las enzimas secretasas están reguladas por la presentación del sustrato. [4] El sustrato APP es palmitoilado y se mueve dentro y fuera de las balsas lipídicas GM1 en respuesta al colesterol de los astrocitos. El colesterol entregado por la apolipoproteína E (ApoE) impulsa a la APP a asociarse con las balsas lipídicas GM1. Cuando el colesterol es bajo, la proteína se desplaza a la región desordenada y es escindida por la alfa secretasa para producir un producto no amilogénico. Las enzimas no parecen responder al colesterol, solo se mueve el sustrato.
La hidrofobicidad impulsa la partición de las moléculas. En la célula, esto da lugar a la compartimentación dentro de la célula y dentro de las membranas celulares . En el caso de las balsas lipídicas, la palmitoilación regula la afinidad de las balsas por la mayoría de las proteínas integrales de las balsas. [5] La regulación de las balsas está regulada por la señalización del colesterol y la biología espacial.
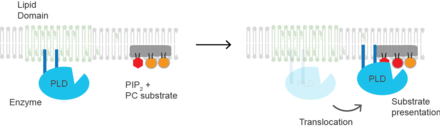
( PLD2 ) es un ejemplo bien definido de una enzima activada por la presentación del sustrato. [6] La enzima se palmitoila, lo que hace que la enzima se dirija a los dominios lipídicos GM1 o " balsas lipídicas ". El sustrato de la fosfolipasa D es la fosfatidilcolina (PC), que es insaturada y tiene una baja abundancia en las balsas lipídicas. La PC se localiza en la región desordenada de la célula junto con el lípido poliinsaturado fosfatidilinositol 4,5-bisfosfato ( PIP2 ). PLD2 tiene un dominio de unión a PIP2 . Cuando aumenta la concentración de PIP2 en la membrana, PLD2 abandona los dominios GM1 y se asocia con los dominios PIP2 donde luego obtiene acceso a su sustrato PC y comienza la catálisis basada en la presentación del sustrato. Presumiblemente, la enzima es capaz de catalizar una reacción en una balsa lipídica pero carece de un sustrato para la actividad.
( ADAM17 ), también llamado TACE, es secuestrado en balsas lipídicas lejos de su sustrato, el factor de necrosis tumoral unido a la membrana (mTNF). [7] El colesterol hace que el mTNF se agrupe con ADAM17 en balsas lipídicas y libere TNF soluble (sTNF), que es una citocina inflamatoria.
Las tirosina quinasas receptoras son receptores de la superficie celular que se unen a diversos factores de crecimiento polipeptídicos, citocinas y hormonas. La activación de las RTK es impulsada por la palmitoilación y la dimerización, un proceso facilitado por el colesterol dentro de las balsas lipídicas. [8] [9] Una vez dimerizado, el receptor sufre una autofosforilación, que desencadena una cascada de fosforilación posterior. Este es un caso específico en el que el sustrato y la enzima son la misma molécula.
La proteína quinasa C (PKC) es una clase de enzimas que fosforilan proteínas. Sus sustratos se encuentran típicamente en la superficie de la membrana, donde la enzima es reclutada por el lípido diacilglicerol. Por lo tanto, una parte de la activación de la PKC se produce a través de la presentación del sustrato, es decir, por localización con su sustrato en la membrana.
( Furina ) (célula productora, replicación). Cuando las células están cargadas de colesterol, la furina se dirige a las balsas lipídicas GM1, donde se localiza con la proteína de pico palmitoilada del SARS-CoV-2 y la prepara para la entrada del virus. [10]
( ACE2 ) (célula diana, entrada viral), el receptor para el SARS-CoV-2 ACE2 transporta el SARS-CoV-2 a las balsas lipídicas GM1 donde es endocitado y expuesto a la catepsina para la escisión y la fusión celular óptima. [11] [12] En niveles bajos de colesterol, ACE2 transporta el virus a TMPRSS2 que también lo escinde y permite la entrada viral pero a través de un supuesto mecanismo de superficie que es mucho menos eficiente. Se cree que la sensibilidad de ACE2 al colesterol contribuye a que los síntomas de COVID-19 sean menos graves en los niños.
El secuestro es el proceso de mover una molécula a una balsa lipídica. Dentro de la membrana plasmática, el secuestro es impulsado principalmente por el empaquetamiento de lípidos saturados con colesterol o la separación de fases a distancias muy pequeñas (<100 nm). A nivel macroscópico, los orgánulos y las vesículas pueden limitar el acceso de una enzima al sustrato.
El secuestro puede tanto aumentar como reducir la concentración de una proteína en la proximidad de su sustrato. Cuando el sustrato está presente dentro de una balsa lipídica, el secuestro conduce a una mayor concentración de la proteína cerca del sustrato. Por el contrario, si el sustrato se excluye de una balsa lipídica, el secuestro da como resultado una menor interacción entre la proteína y el sustrato, como se observa con PLD2.
El sustrato de la enzima puede moverse. El movimiento es típicamente la interrupción de la localización mediada por palmitato o el tráfico de orgánulos . Para las proteínas que están palmitoiladas y se unen a PIP2, aumentar la concentración de PIP2 favorece el tráfico de la enzima fuera de las balsas lipídicas hacia PIP2. PIP2 es principalmente poliinsaturado, lo que hace que el lípido se localice lejos de las balsas lipídicas y permite que PIP2 se oponga a la localización mediada por palmitato. [13]
El colesterol y los ácidos grasos poliinsaturados (PUFA) regulan la formación de balsas lipídicas, de ahí la función biológica de las balsas. Cuando los lípidos saturados y el colesterol aumentan en la membrana, las balsas lipídicas aumentan su afinidad por las proteínas palmitoiladas. [14] Los PUFA tienen el efecto opuesto: fluidifican la membrana.
Los PUFA también pueden aumentar la concentración de lípidos de señalización. El ácido araquidónico, un PUFA muy común en el cerebro, se incorpora a PC y PIP2. [15] El araquidonil PC es un sustrato preferido de PLD, probablemente aumentando la cantidad de PA en una célula. La regulación de la función de balsa por el colesterol regula eficazmente la presentación del sustrato y las muchas proteínas palmitoiladas que utilizan la presentación del sustrato como un mecanismo de activación. Si bien es especulativo, el profundo efecto del colesterol y los PUFA en la salud humana probablemente se deba a la regulación fisiológica de la función de balsa lipídica en las células.
La fuerza mecánica (de cizallamiento o de hinchamiento) puede alterar de forma independiente el empaquetamiento y la afinidad resultante del palmitato con las balsas lipídicas. Esta alteración también hace que PLD2 favorezca el tráfico hacia los dominios PIP2. [16] El canal iónico mecanosensible TREK-1 se libera de las balsas lipídicas dependientes del colesterol en respuesta a la fuerza mecánica. Esto tiene el efecto de amortiguar el dolor. [17]
La anestesia mediada por membrana emplea la presentación del sustrato. Los anestésicos generales propofol y los anestésicos inhalados xenón , cloroformo , isoflurano y éter dietílico alteran la función de las balsas lipídicas y la localización mediada por palmitato de PLD2 en las balsas lipídicas. [18] [19] La activación de PLD luego activa los canales TREK-1. La activación de PLD2 mediada por membrana podría transferirse a un homólogo insensible a los anestésicos, TRAAK, lo que hace que el canal sea sensible a los anestésicos.