
La síntesis total de oseltamivir se refiere a la síntesis total del fármaco antigripal oseltamivir [1] comercializado por Hoffmann-La Roche con el nombre comercial Tamiflu . Su producción comercial comienza a partir de la biomolécula ácido shikímico extraída del anís estrellado chino y de E. coli recombinante . [2] [3] El control de la estereoquímica es importante: la molécula tiene tres estereocentros y el isómero buscado es solo 1 de los 8 estereoisómeros. [ cita requerida ]
El método de producción actual se basa en la primera síntesis escalable desarrollada por Gilead Sciences [4] a partir de ácido quínico o ácido shikímico de origen natural . Debido a los menores rendimientos y a los pasos adicionales necesarios (debido a la deshidratación adicional), se abandonó la ruta del ácido quínico en favor de la basada en ácido shikímico, que recibió mejoras adicionales por parte de Hoffmann-La Roche . [5] [6] La síntesis industrial actual se resume a continuación:
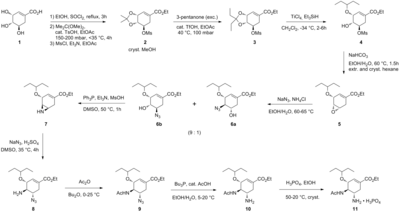
El método de producción actual incluye dos pasos de reacción con azidas potencialmente peligrosas . A continuación se presenta un resumen gráfico de una síntesis de Tamiflu sin azidas realizada por Roche: [7]
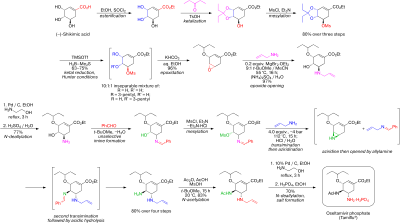
La síntesis comienza a partir de ácido (−)- shikímico disponible de forma natural . El mesilato de acetal de 3,4-pentilideno se prepara en tres pasos: esterificación con etanol y cloruro de tionilo ; cetalización con ácido p -toluenosulfónico y 3-pentanona ; y mesilación con trietilamina y cloruro de metanosulfonilo . La apertura reductiva del cetal en condiciones de Hunter modificadas [8] en diclorometano produce una mezcla inseparable de mesilatos isoméricos . El epóxido correspondiente se forma en condiciones básicas con bicarbonato de potasio . Utilizando el económico ácido de Lewis bromuro de magnesio eterato de dietilo (comúnmente preparado fresco mediante la adición de virutas de magnesio a 1,2-dibromoetano en benceno : éter dietílico ), el epóxido se abre con alilamina para producir el correspondiente 1,2-aminoalcohol. Los disolventes inmiscibles en agua metil tert-butil éter y acetonitrilo se utilizan para simplificar el procedimiento de elaboración, que implicaba agitar con sulfato de amonio acuoso 1 M. La reducción en paladio , promovida por etanolamina , seguida de una elaboración ácida produjo el 1,2-aminoalcohol desprotegido. El aminoalcohol se convirtió directamente en la alil-diamina correspondiente en una secuencia en cascada interesante que comienza con la iminación no selectiva de benzaldehído con eliminación azeotrópica de agua en metil tert-butil éter. La mesilación, seguida de la eliminación del subproducto sólido clorhidrato de trietilamina , da como resultado un intermedio que estaba listo para sufrir aziridinación tras la transiminación con otro equivalente de alilamina. Con el ácido metanosulfónico liberado , la aziridina se abre limpiamente para producir una diamina que sufre inmediatamente una segunda transiminación. La hidrólisis ácida luego eliminó la imina . Acilación selectiva con anhídrido acético (en condiciones tamponadas , el grupo 5-amino se protona debido a una diferencia considerable en p K a, 4,2 frente a 7,9, evitando la acetilación ) produce el producto N -acetilado deseado en forma cristalina tras el tratamiento extractivo. Finalmente, la desalilación como se ha indicado anteriormente produjo la base libre de oseltamivir, que se convirtió en el fosfato de oseltamivir deseado mediante tratamiento con ácido fosfórico . El producto final se obtiene con una alta pureza (99,7%) y un rendimiento global del 17-22% a partir del ácido (−)-shikímico. Se observa que la síntesis evita el uso de reactivos e intermedios de azida potencialmente explosivos ; sin embargo, la síntesis realmente utilizada por Roche utiliza azidas. Roche tiene otras rutas para el oseltamivir que no implican el uso de ácido (−)-shikímico como material de partida del pool quiral, como una ruta de Diels-Alder que implica furano y acrilato de etilo o una ruta de ácido isoftálico , que implica hidrogenación catalítica y desimetrización enzimática. [ cita requerida ]
En 2006, el grupo de EJ Corey publicó una nueva ruta que evita el ácido shikímico a partir de butadieno y ácido acrílico . [9] Los inventores decidieron no patentar este procedimiento que se describe a continuación.

El butadieno 1 reacciona en una reacción asimétrica de Diels-Alder con el producto de esterificación del ácido acrílico y 2,2,2-trifluoroetanol 2 catalizada por el catalizador CBS . El éster 3 se convierte en una amida en 4 por reacción con amoníaco y el siguiente paso para la lactama 5 es una yodolactaminación con yodo iniciada por trimetilsililtriflato. El grupo amida se equipa con un grupo protector BOC por reacción con anhídrido Boc en 6 y el sustituyente de yodo se elimina en una reacción de eliminación con DBU al alqueno 7. El bromo se introduce en 8 por una bromación alílica con NBS y el grupo amida se escinde con etanol y carbonato de cesio acompañado de la eliminación del bromuro al éster etílico de dieno 9 . El doble enlace recién formado se funcionaliza con N -bromoacetamida 10 catalizada con bromuro de estaño(IV) con control completo de la estereoquímica . En el siguiente paso, el átomo de bromo en 11 es desplazado por el átomo de nitrógeno en el grupo amida con la base fuerte KHMDS a la aziridina 12 que a su vez se abre por reacción con 3-pentanol 13 al éter 14. En el paso final, el grupo BOC se elimina con ácido fosfórico y se forma el fosfato de oseltamivir 15 .
También en 2006, el grupo de Masakatsu Shibasaki de la Universidad de Tokio publicó una síntesis que nuevamente prescindía del ácido shikímico. [10] [11]
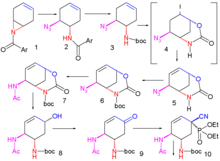

Un método mejorado publicado en 2007 comienza con la desimetrización enantioselectiva de la aziridina 1 con trimetilsilil azida (TMSN 3 ) y un catalizador quiral para la azida 2 . El grupo amida se protege como un grupo BOC con anhídrido Boc y DMAP en 3 y la yodolactamina con yodo y carbonato de potasio primero da el intermedio inestable 4 y luego el carbamato cíclico estable 5 después de la eliminación de yoduro de hidrógeno con DBU .
El grupo amida se vuelve a proteger como BOC 6 y el grupo azida se convierte en la amida 7 mediante acilación reductora con ácido tioacético y 2,6-lutidina . El carbonato de cesio logra la hidrólisis del grupo carbamato al alcohol 8 que posteriormente se oxida a cetona 9 con peryodinano de Dess-Martin . La cianofosforilación con fosfocianidato de dietilo (DEPC) modifica el grupo cetona al cianofosfato 10 allanando el camino para una reorganización alílica intramolecular al fosfato β-alílico inestable 11 (tolueno, tubo sellado) que se hidroliza al alcohol 12 con cloruro de amonio . Este grupo hidroxilo tiene la estereoquímica incorrecta y, por lo tanto, se invierte en una reacción de Mitsunobu con ácido p-nitrobenzoico seguida de la hidrólisis del p-nitrobenzoato a 13 .
Una segunda reacción de Mitsunobu forma la aziridina 14 disponible para la reacción de apertura de anillo con 3-pentanol catalizada por trifluoruro de boro para formar el éter 15. En el paso final, se elimina el grupo BOC (HCl) y se agrega ácido fosfórico al objetivo 16 .
Un enfoque publicado en 2007 [12] como el de Corey comienza con una reacción asimétrica de Diels-Alder, esta vez con materiales de partida piridina y acroleína .


La piridina ( 1 ) se reduce con borohidruro de sodio en presencia de cloroformiato de bencilo a la dihidropiridina protegida con Cbz 2. La reacción asimétrica de Diels-Alder con acroleína 3 se lleva a cabo con el catalizador McMillan al aldehído 4 como isómero endo que se oxida al ácido carboxílico 5 con clorito de sodio , fosfato monopotásico y 2-metil-2-buteno . La adición de bromo da el producto de halolactonización 6 y después de la sustitución del grupo protector Cbz por un grupo protector BOC en 7 ( hidrogenolisis en presencia de dicarbonato de di- terc -butilo ), se introduce un grupo carbonilo en el intermedio 8 mediante óxido de rutenio(IV) catalítico y peryodato de sodio como catalizador de sacrificio . La adición de amoniaco escinde el grupo éster para formar la amida 9, cuyo grupo alcohol está mesilado al compuesto 10 . En el siguiente paso se añade diacetato de yodobenceno , convirtiendo la amida en un reordenamiento de Hofmann al carbamato de alilo 12 después de capturar el isocianato intermedio con alcohol alílico 11. Al añadir etóxido de sodio en etanol, tienen lugar tres reacciones simultáneamente: escisión de la amida para formar un nuevo grupo éster etílico , desplazamiento del grupo mesilo por la amina protegida con BOC recién formada a un grupo aziridina y una reacción de eliminación que forma el grupo alqueno en 13 con liberación de HBr. En los dos pasos finales, el anillo de aziridina se abre con 3-pentanol 14 y trifluoruro de boro al aminoéter 15 con el grupo BOC reemplazado por un grupo acilo y al eliminar el otro grupo protector de amina ( Pd/C , Ph 3 P y ácido 1,3-dimetilbarbitúrico en etanol) y la adición de ácido fosfórico obtiene oseltamivir 16 .

En 2008, el grupo de Barry M. Trost de la Universidad de Stanford publicó la ruta sintética más corta hasta la fecha. [13]
En 2009, Hayashi et al. produjeron con éxito una ruta sintética eficiente y de bajo costo para preparar (-)-oseltamivir ( 1 ). Su objetivo era diseñar un procedimiento que fuera adecuado para la producción a gran escala. Teniendo en cuenta el costo, el rendimiento y la cantidad de pasos sintéticos, se logró una síntesis total enantioselectiva de ( 1 ) a través de tres operaciones de un solo recipiente. [14] [5] El uso de operaciones de un solo recipiente por parte de Hayashi et al. les permitió realizar varios pasos de reacción en un solo recipiente, lo que en última instancia minimizó la cantidad de pasos de purificación necesarios, el desperdicio y el ahorro de tiempo.

En la primera operación de un solo recipiente , Hayashi et al. comienzan utilizando éter silílico de difenilprolinol ( 4 ) [6] como organocatalizador , junto con alcoxialdehído ( 2 ) y nitroalqueno ( 3 ) para realizar una reacción de Michael asimétrica , proporcionando un aducto de Michael enantioselectivo . Tras la adición de un derivado de fosfato de dietilo y vinilo ( 5 ) al aducto de Michael , se produce una reacción de Michael en dominó y una reacción de Horner-Wadsworth-Emmons debido al grupo fosfonato producido a partir de ( 5 ) para dar un derivado de ciclohexenocarboxilato de etilo junto con dos subproductos no deseados. Para transformar los subproductos no deseados en el derivado de ciclohexenocarboxilato de etilo deseado, la mezcla del producto y los subproductos se trató con Cs2CO3 en etanol . Esto indujo una reacción retro-Michael en un subproducto y una reacción retro-aldólica acompañada de una reacción de Horner-Wadsworth-Emmons para el otro. Ambos subproductos se convirtieron con éxito en el derivado deseado. Finalmente, la adición de p - toluenotiol con Cs2CO3 da ( 6 ) con un rendimiento del 70% después de ser purificado por cromatografía en columna , con el isómero deseado dominando. [14]

En la segunda operación en un solo recipiente , se emplea primero ácido trifluoroacético para desproteger el éster terc -butílico de ( 6 ); cualquier exceso de reactivo se eliminó mediante evaporación. El ácido carboxílico producido como resultado de la desprotección se convirtió luego en un cloruro de acilo mediante cloruro de oxalilo y una cantidad catalítica de DMF . Finalmente, la adición de azida de sodio, en la última reacción de la segunda operación en un solo recipiente, produce la azida de acilo ( 7 ) sin necesidad de purificación. [14]
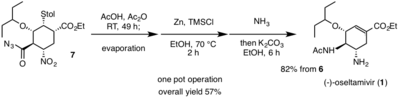
La operación final en un solo recipiente comienza con un reordenamiento de Curtius de la azida de acilo ( 7 ) para producir un grupo funcional isocianato a temperatura ambiente. El derivado de isocianato luego reacciona con ácido acético para producir la fracción acetilamino deseada que se encuentra en ( 1 ). Este reordenamiento de Curtius en dominó y la formación de amida ocurren en ausencia de calor, lo que es extremadamente beneficioso para reducir cualquier posible peligro. La fracción nitro de ( 7 ) se reduce a la amina deseada observada en ( 1 ) con Zn/HCl. Debido a las duras condiciones de la reducción de nitro, se utilizó amoníaco para neutralizar la reacción. Luego se agregó carbonato de potasio para dar ( 1 ), a través de una reacción retro-Michael del tiol . Luego, ( 1 ) se purificó mediante una extracción ácido/base. El rendimiento general para la síntesis total de (-)-oseltamivir es del 57%. [14] Hayashi et al. El uso de reactivos económicos y no peligrosos ha permitido una ruta sintética eficiente y de alto rendimiento que puede permitir producir una gran cantidad de derivados nuevos con la esperanza de combatir los virus resistentes al (-)-oseltamivir.