La reacción de Horner-Wadsworth-Emmons (HWE) es una reacción química utilizada en química orgánica de carbaniones fosfonato estabilizados con aldehídos (o cetonas ) para producir predominantemente E- alquenos . [1]
En 1958, Leopold Horner publicó una reacción de Wittig modificada utilizando carbaniones estabilizados con fosfonato. [2] [3] William S. Wadsworth y William D. Emmons definieron con más detalle la reacción. [4] [5]
A diferencia de los iluros de fosfonio utilizados en la reacción de Wittig , los carbaniones estabilizados con fosfonato son más nucleofílicos pero menos básicos. Asimismo, se pueden alquilar carbaniones estabilizados con fosfonato. A diferencia de los iluros de fosfonio, el subproducto de la sal de dialquilfosfato se elimina fácilmente mediante extracción acuosa .
Se han publicado varias reseñas. [6] [7] [8] [9] [10] [11]

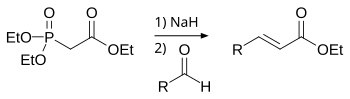
La reacción de Horner-Wadsworth-Emmons comienza con la desprotonación del fosfonato para dar el carbanión fosfonato 1 . La adición nucleófila del carbanión al aldehído 2 (o cetona) que produce 3a o 3b es el paso limitante de la velocidad . [12] Si R 2 = H, entonces los intermedios 3a y 4a y los intermedios 3b y 4b pueden interconvertirse entre sí. [13] La eliminación final de los oxafosfetanos 4a y 4b produce ( E )-alqueno 5 y ( Z )-alqueno 6 , siendo el subproducto un dialquilfosfato .

La proporción de los isómeros de alqueno 5 y 6 no depende del resultado estereoquímico de la adición inicial del carbanión ni de la capacidad de los intermedios para equilibrarse .
El grupo aceptor de electrones (EWG) alfa del fosfonato es necesario para que se produzca la eliminación final. En ausencia de un grupo aceptor de electrones, el producto final es el β-hidroxifosfonato 3a y 3b . [14] Sin embargo, estos β-hidroxifosfonatos se pueden transformar en alquenos mediante reacción con diisopropilcarbodiimida . [15]
La reacción de Horner-Wadsworth-Emmons favorece la formación de ( E )-alquenos. En general, cuanto mayor sea el equilibrio entre los intermedios, mayor será la selectividad para la formación de ( E )-alqueno.
Thompson y Heathcock han realizado un estudio sistemático de la reacción del 2-(dimetilfosfono)acetato de metilo con varios aldehídos. [16] Si bien cada efecto fue pequeño, tuvieron un efecto acumulativo que permitió modificar el resultado estereoquímico sin modificar la estructura del fosfonato. Encontraron una mayor ( E ) -estereoselectividad con las siguientes condiciones:
En un estudio separado, se encontró que el fosfonato voluminoso y los grupos aceptores de electrones voluminosos mejoran la selectividad del E-alqueno.
La masa estérica de los grupos fosfonato y aceptores de electrones juega un papel crítico en la reacción de los fosfonatos ramificados en α con aldehídos alifáticos. [17]
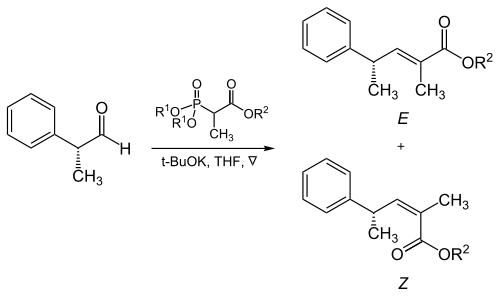
Los aldehídos aromáticos producen casi exclusivamente ( E )-alquenos. En caso de que se necesiten ( Z ) -alquenos de aldehídos aromáticos, se puede utilizar la modificación Still-Gennari (ver más abajo).
La estereoselectividad de la reacción de las cetonas de Horner-Wadsworth-Emmons es de pobre a modesta.
Dado que muchos sustratos no son estables al hidruro de sodio , se han desarrollado varios procedimientos utilizando bases más suaves. Masamune y Roush han desarrollado condiciones leves utilizando cloruro de litio y DBU . [18] Rathke amplió esto a haluros de litio o magnesio con trietilamina . [19] Se ha encontrado que varias otras bases son efectivas. [20] [21] [22]
W. Clark Still y C. Gennari han desarrollado condiciones que dan a los alquenos Z una excelente estereoselectividad. [23] [24] Utilizando fosfonatos con grupos aceptores de electrones (trifluoroetilo [25] ) junto con condiciones de fuerte disociación ( KHMDS y 18-corona-6 en THF ) se puede lograr una producción casi exclusiva de Z-alqueno.
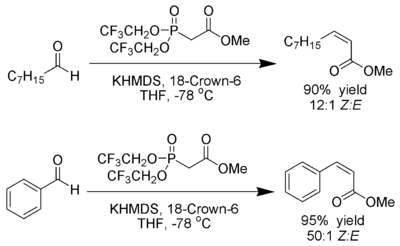
Ando ha sugerido que el uso de fosfonatos deficientes en electrones acelera la eliminación de los intermedios de oxafosfetano. [26]