La reacción de Wittig o olefinación de Wittig es una reacción química de un aldehído o cetona con un iluro de trifenilfosfonio llamado reactivo de Wittig . Las reacciones de Wittig se utilizan con mayor frecuencia para convertir aldehídos y cetonas en alquenos. [1] [2] [3] Muy a menudo, la reacción de Wittig se utiliza para introducir un grupo metileno utilizando metilentrifenilfosforano (Ph 3 P=CH 2 ). Usando este reactivo, incluso una cetona estéricamente impedida como el alcanfor se puede convertir en su derivado metileno.

Los estudios mecanicistas se han centrado en iluros no estabilizados, porque los intermedios pueden seguirse mediante espectroscopia de RMN . La existencia y la interconversión de la betaína ( 3a y 3b ) es objeto de investigación en curso. [4] Para las reacciones de Wittig sin litio, los estudios apoyan una formación concertada de oxafosfetano sin intervención de betaína. En particular, los iluros de fosfonio 1 reaccionan con compuestos carbonílicos 2 mediante una cicloadición [2+2] que a veces se describe como de topología [ π 2 s + π 2 a ] para formar directamente los oxafosfetanos 4a y 4b . En condiciones sin litio, la estereoquímica del producto 5 se debe a la adición cinéticamente controlada del iluro 1 al carbonilo 2 . Cuando hay litio presente, puede haber equilibrio de los intermedios, posiblemente a través de las especies de betaína 3a y 3b . [5] [6] [7] Bruce E. Maryanoff y AB Reitz identificaron el problema sobre el equilibrio de los intermedios de Wittig y denominaron el proceso "deriva estereoquímica". Durante muchos años, se había asumido que la estereoquímica de la reacción de Wittig, en términos de formación de enlaces carbono-carbono, se correspondía directamente con la estereoquímica Z/E de los productos alquenos. Sin embargo, ciertos reactivos no siguen este patrón simple. Las sales de litio también pueden ejercer un efecto profundo sobre el resultado estereoquímico. [8]

Los mecanismos difieren para los aldehídos alifáticos y aromáticos y para los iluros de fosfonio aromáticos y alifáticos . La evidencia sugiere que la reacción de Wittig de los aldehídos no ramificados en condiciones sin sal de litio no se equilibra y, por lo tanto, están bajo control de reacción cinética . [9] [10] E. Vedejs ha propuesto una teoría para explicar la estereoselectividad de las reacciones de Wittig estabilizadas y no estabilizadas. [11]
Evidencia sólida indicó que, en condiciones libres de Li, las reacciones de Wittig que involucran reactivos de Wittig no estabilizados (R 1 = alquilo, H), semiestabilizados (R 1 = arilo) y estabilizados (R 1 = EWG) proceden a través de un [2+2] Mecanismo /retro-[2+2] bajo control cinético, con oxafosfetano como único intermediario. [12]
Los reactivos de Wittig generalmente toleran compuestos carbonílicos que contienen varios tipos de grupos funcionales como OH , OR , nitroarenos , epóxidos y, a veces, ésteres y amidas . [13] Incluso los grupos cetona , aldehído y nitrilo pueden estar presentes si se conjugan con el iluro; estos son los iluros estabilizados mencionados anteriormente. También se han fabricado y utilizado con éxito bis-iliros (que contienen dos enlaces P=C). [14] Puede haber un problema con las cetonas estéricamente impedidas , donde la reacción puede ser lenta y dar rendimientos bajos, particularmente con iluros estabilizados, y en tales casos se prefiere la reacción de Horner-Wadsworth-Emmons (HWE) (usando ésteres de fosfonato). . Otra limitación reportada es la naturaleza a menudo lábil de los aldehídos , que pueden oxidarse, polimerizarse o descomponerse. En el llamado proceso de oxidación en tándem-Wittig, el aldehído se forma in situ mediante oxidación del alcohol correspondiente. [15]
Para la reacción con aldehídos, la geometría del doble enlace se predice fácilmente en función de la naturaleza del iluro. Con iluros no estabilizados (R 3 = alquilo), esto da como resultado un producto ( Z )-alqueno con una selectividad de moderada a alta. Si la reacción se realiza en dimetilformamida en presencia de yoduro de litio o yoduro de sodio , el producto es casi exclusivamente el isómero Z. [16] Con iluros estabilizados (R 3 = éster o cetona), el ( E )-alqueno se forma con alta selectividad. La selectividad ( E )/( Z ) es a menudo pobre con iluros semiestabilizados (R 3 = arilo). [17]
Para obtener el ( E )-alqueno para iluros no estabilizados, se puede utilizar la modificación de Schlosser de la reacción de Wittig. Alternativamente, la olefinación de Julia y sus variantes también proporcionan el alqueno ( E ) de forma selectiva. Normalmente, la reacción de Horner-Wadsworth-Emmons proporciona el ( E )-enoato (éster α,β-insaturado), tal como lo hace la reacción de Wittig. Para obtener el enolato ( Z ) se puede utilizar la modificación de Still-Gennari de la reacción de Horner-Wadsworth-Emmons.
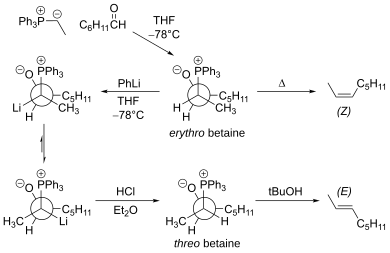
La principal limitación de la reacción tradicional de Wittig es que la reacción se produce principalmente a través del intermediario eritrobetaína , que conduce al Z-alqueno. La eritro betaína se puede convertir en treo betaína utilizando fenillitio a baja temperatura. [18] Esta modificación proporciona el E-alqueno.
Los alcoholes alílicos se pueden preparar mediante la reacción del iluro de betaína con un segundo aldehído. [19] Por ejemplo:

Un ejemplo de su uso es en la síntesis del éster metílico del leucotrieno A. [20] [21] El primer paso utiliza un iluro estabilizado, donde el grupo carbonilo se conjuga con el iluro evitando la autocondensación, aunque inesperadamente esto da principalmente el producto cis . La segunda reacción de Wittig utiliza un reactivo de Wittig no estabilizado y, como se esperaba, esto da principalmente el producto cis .

La reacción de Wittig fue informada en 1954 por Georg Wittig y su compañero de trabajo Ulrich Schöllkopf . En parte por esta contribución, Wittig recibió el Premio Nobel de Química en 1979. [22] [23]
{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ).{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )