La yodolactonización (o, más generalmente, halolactonización ) es una reacción orgánica que forma un anillo (la lactona ) mediante la adición de oxígeno y yodo a través de un doble enlace carbono-carbono. Es una variante intramolecular de la reacción de síntesis de halohidrina . La reacción fue descrita por primera vez por MJ Bougalt en 1904 y desde entonces se ha convertido en una de las formas más efectivas de sintetizar lactonas. [1] Los puntos fuertes de la reacción incluyen las condiciones suaves y la incorporación del versátil átomo de yodo al producto.
La yodolactonización se ha utilizado en la síntesis de muchos productos naturales, incluidos aquellos con aplicaciones medicinales como la vernolepina y la vernomenina, [2] dos compuestos utilizados en la inhibición del crecimiento tumoral y la vibralactona , un inhibidor de la lipasa pancreática . [3] Elias James Corey también ha utilizado la yodolactonización para sintetizar numerosas prostaglandinas . [4]
El informe de Bougalt sobre la yodolactonización representó el primer ejemplo de una lactonización fiable que podría utilizarse en muchos sistemas diferentes. En realidad, la bromolactonización se desarrolló veinte años antes de la publicación de la yodolactonización por parte de Bougalt. [1] Sin embargo, la bromolactonización se usa mucho menos comúnmente porque la simple adición electrófila de bromo a un alqueno , como se ve a continuación, puede competir con la reacción de bromolactonización y reducir el rendimiento de la lactona deseada. [5]

Los métodos de clorolactonización aparecieron por primera vez en la década de 1950 [1] , pero se emplean incluso con menos frecuencia que la bromolactonización. El uso de cloro elemental es difícil desde el punto de vista procesal porque es un gas a temperatura ambiente y el producto de adición electrofílica se puede producir rápidamente como en la bromolactonización. [6]
El mecanismo de reacción implica la formación de un ion halonio cargado positivamente en una molécula que también contiene un ácido carboxílico (u otro grupo funcional que sea su precursor). El oxígeno del carboxilo actúa como nucleófilo , atacando para abrir el anillo de halonio y en su lugar forma un anillo de lactona. La reacción suele realizarse en condiciones ligeramente básicas para aumentar la nucleofilicidad del grupo carboxilo.
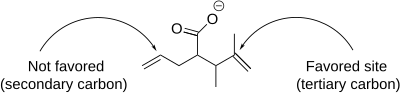
La reacción de yodolactonización incluye una serie de matices que afectan la formación del producto, incluida la regioselectividad , la preferencia del tamaño del anillo y el control termodinámico y cinético . En términos de regioselectividad, la yodolactonización ocurre preferentemente en el átomo de carbono más impedido adyacente al catión yodonio . Esto se debe al hecho de que el carbono más sustituido es más capaz de mantener una carga positiva parcial y, por tanto, es más electrófilo y susceptible al ataque nucleofílico. Cuando múltiples dobles enlaces en una molécula son igualmente reactivos, dominan las preferencias conformacionales. Sin embargo, cuando un doble enlace es más reactivo, esa reactividad siempre domina independientemente de la preferencia conformacional. [7]
En la yodolactonización que se muestra a continuación se podrían formar anillos de cinco y seis miembros, pero el anillo de cinco miembros se forma preferentemente como lo predicen las reglas de Baldwin para el cierre de anillos. [8] De acuerdo con las reglas, se favorecen los cierres de anillos de 5-exo-tet mientras que los cierres de anillos de 6-endo-tet no son favorecidos. [9] La regioselectividad de cada yodolactonización se puede predecir y explicar utilizando las reglas de Baldwin.

Las yodolactonizaciones estereoselectivas se han observado en la literatura y pueden ser muy útiles para sintetizar moléculas grandes como las antes mencionadas vernopelina y vernomenina porque la lactona se puede formar manteniendo otros estereocentros. El cierre del anillo puede incluso ser impulsado por estereocentros adyacentes al enlace múltiple carbono-carbono, como se muestra a continuación. [7]
Incluso en sistemas sin estereocentros existentes, Bartlett y sus compañeros descubrieron que se podía lograr la estereoselectividad. Pudieron sintetizar las lactonas de cinco miembros cis y trans ajustando las condiciones de reacción, como la temperatura y el tiempo de reacción. El producto trans se formó en condiciones termodinámicas (por ejemplo, un tiempo de reacción largo) mientras que el producto cis se formó en condiciones cinéticas (por ejemplo, un tiempo de reacción relativamente más corto). [10]
La yodolactonización se ha utilizado en la síntesis de muchos productos biológicamente importantes, como los inhibidores del crecimiento tumoral vernolepina y vernomenina, el inhibidor de la lipasa pancreática vibralactona y las prostaglandinas, un lípido que se encuentra en animales. Todas las siguientes síntesis totales utilizan la yodolactonización como paso clave para obtener el producto deseado.
En 1977, Samuel Danishefsky y sus compañeros de trabajo pudieron sintetizar los inhibidores del crecimiento tumoral dl -vernolepina y dl -vernomenina mediante un proceso de varios pasos en el que se empleó una lactonización. [2] Esta síntesis demuestra el uso de yodolactonización para formar preferentemente un anillo de cinco miembros sobre un anillo de cuatro o seis miembros, como se esperaba de las reglas de Baldwin.
En 2006, Zhou y sus compañeros sintetizaron otro producto natural, la vibralactona, en el que el paso clave fue la formación de una lactona. [3] La estereoselectividad de la yodolactonización establece una configuración estereoquímica crítica para el compuesto objetivo.
En 1969, Corey y colaboradores sintetizaron la prostaglandina E 2 utilizando un intermediario yodolactona. [4] Nuevamente, la estereoselectividad de la yodolactonización juega un papel integral en la formación del producto.