

El canal de calcio tipo L (también conocido como canal de dihidropiridina o canal DHP ) es parte de la familia de canales de calcio dependientes de voltaje activados por alto voltaje . [2] "L" significa larga duración y se refiere a la duración de la activación. Este canal tiene cuatro isoformas: Cav1.1 , Cav1.2 , Cav1.3 y Cav1.4 .
Los canales de calcio tipo L son responsables del acoplamiento excitación- contracción del músculo cardíaco liso y esquelético y de la secreción de aldosterona en las células endocrinas de la corteza suprarrenal . [1] También se encuentran en las neuronas y, con la ayuda de los canales de calcio tipo L en las células endocrinas, regulan las neurohormonas y los neurotransmisores . También se ha visto que desempeñan un papel en la expresión génica, la estabilidad del ARNm , la supervivencia neuronal, la lesión axonal inducida por isquemia, la eficacia sináptica y tanto en la activación como en la desactivación de otros canales iónicos. [3]
En los miocitos cardíacos, el canal de calcio tipo L pasa corriente de Ca 2+ hacia adentro (I CaL ) y desencadena la liberación de calcio desde el retículo sarcoplásmico activando el receptor 2 de rianodina (RyR2) (liberación de calcio inducida por calcio). [4] La fosforilación de estos canales aumenta su permeabilidad al calcio y aumenta la contractilidad de sus respectivos miocitos cardíacos.
Los bloqueadores de los canales de calcio tipo L se utilizan como antiarrítmicos cardíacos o antihipertensivos , dependiendo de si los fármacos tienen mayor afinidad por el corazón (las fenilalquilaminas , como el verapamilo ), o por los vasos sanguíneos (las dihidropiridinas , como la nifedipina ). [5]
En el músculo esquelético hay una concentración muy alta de canales de calcio tipo L, situados en los túbulos T. La despolarización muscular produce grandes corrientes de activación, pero un flujo de calcio anormalmente bajo, lo que ahora se explica por la muy lenta activación de las corrientes iónicas. Por esta razón, poco o nada de Ca 2+ pasa a través de la membrana del túbulo T durante un único potencial de acción.
En 1953, Paul Fatt y Bernard Katz descubrieron canales de calcio dependientes de voltaje en el músculo de los crustáceos. Los canales exhibieron diferentes voltajes de activación y propiedades conductoras de calcio y, por lo tanto, se separaron en canales de activación de alto voltaje (HVA) y canales de activación de bajo voltaje (LVA). Después de más experimentación, se descubrió que los canales HVA estaban bloqueados por derivados de 1,4-dihidropiridina (DHP). [6] Utilizando DHP, se descubrió que los canales HVA eran específicos de ciertos tejidos y reaccionaban de manera diferente, lo que llevó a una mayor categorización de los canales HVA en tipo L, tipo P y tipo N. [3] Los canales de calcio tipo L fueron secuenciados con péptidos y se descubrió que había 4 tipos de canales de calcio tipo L: α 1 S (músculo esquelético), α 1 C (cardíaco), α 1 D (que se encuentra en el cerebro). ), y α 1 F (que se encuentra en la retina). [6] En 2000, después de que se realizaron más investigaciones sobre las subunidades α 1 en los canales de calcio dependientes de voltaje, se utilizó una nueva nomenclatura que llamó canales de calcio tipo L CaV1 y sus subunidades se denominaron CaV1.1 , Cav1.2 , CaV1. 3 y CaV1.4 . [3] La investigación sobre las subunidades CaV1 continúa revelando más sobre su estructura, función y aplicaciones farmacéuticas. [7]
Los canales de calcio tipo L contienen cinco subunidades diferentes, las subunidades α1 (170–240 kDa), α2 (150 kDa), δ (17-25 kDa), β (50-78 kDa) y γ (32 kDa). [8] Las subunidades α2, δ y β están unidas de forma no covalente a la subunidad α1 y modulan el tráfico iónico y las propiedades biofísicas de la subunidad α1. Las subunidades α2 y δ se encuentran en el espacio extracelular mientras que las subunidades β y γ se encuentran en el espacio citosólico. [8]
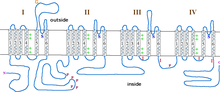
La subunidad α1 es un heterotetrámero que tiene cuatro regiones transmembrana , conocidas como Dominios I-IV, que cruzan el plasma seis veces como hélices α , denominándose S0-S6 (S0 y S1 juntos cruzan la membrana una vez). [3] La subunidad α1 en su conjunto contiene el dominio de detección de voltaje, el poro de conducción y el aparato de compuerta. [9] Como la mayoría de los canales iónicos dependientes de voltaje , la subunidad α está compuesta por 4 subunidades. Cada subunidad está formada por 6 dominios transmembrana de hélice alfa que cruzan la membrana (numerados S1-S6). Las subunidades S1-S4 forman el sensor de voltaje, mientras que las subunidades S5-S6 forman el filtro de selectividad. [10] Para detectar el voltaje de la célula, las hélices S1-S3 contienen muchos aminoácidos cargados negativamente, mientras que las hélices S4 contienen principalmente aminoácidos cargados positivamente con un bucle P que conecta las hélices S4 a S5. Después de los dominios S1-6, hay seis dominios C que constan de dos motivos de mano EF (C1-2 y C3-4) y un dominio Pre-IQ (C5) y un dominio IQ (C6). También hay dos motivos de manos EF en el extremo N. Tanto el extremo N como el C están en el espacio citosólico y el extremo C es mucho más largo que el extremo N. [11]
Se sabe que la subunidad β tiene cuatro isoformas (β1-β4) para regular las funciones del canal y está conectada a α1 a través del conector α1 I y II en el citosol en el bolsillo de unión de β α1 (ABP). [7] [12] Cada isoforma contiene un dominio de homología src 3 (SH3) y un dominio similar a guanilato-quinasa (GK) que están separados por un dominio HOOK y tres regiones no estructuradas. [12]
Las subunidades α2 y δ están conectadas entre sí mediante enlaces disulfuro (a veces conocidas como subunidad α2δ) e interactúan con α1. [7] tienen cuatro isoformas conocidas llamadas α2δ-1 a α2δ-2 y contienen un dominio von Willebrand A (VWA) y un dominio Cache . La región α2 está en el espacio extracelular mientras que la región δ está en la membrana celular y se ha visto que está anclada con un anclaje de glicosilfosfatidilinositol (GPI). [12]
La subunidad γ tiene ocho isoformas (γ1-γ8) y está conectada a la subunidad α1 y solo se ha encontrado en células musculares en los canales CaV1.1 y CaV1.2. [12] No se sabe mucho sobre la subunidad γ, pero se ha relacionado con interacciones en fuerzas hidrofóbicas. [3]
La apertura del poro en los canales de calcio tipo L tiene lugar en la subunidad α1. Cuando la membrana se despolariza, la hélice S4 se mueve a través de los conectores S4 y S5 hasta los extremos citoplasmáticos de las hélices S5 y S6. Esto abre la puerta de activación que está formada por el lado interno de las hélices S6 en la subunidad α1. [11]
La forma más predominante de autoinhibición de los canales de calcio tipo L es con el complejo Ca 2+ /Cam. [11] A medida que el poro se abre y provoca una entrada de calcio, el calcio se une a la calmodulina y luego interactúa con el bucle que conecta los motivos de la mano EF adyacentes y provoca un cambio conformacional en el motivo de la mano EF para que interactúe con el poro para causar una rápida inhibición en el canal. [6] Todavía se debate dónde y cómo interactúan el poro y la mano EF. Las bolsas hidrofóbicas en el complejo Ca 2+ /Cam también se unirán a tres secciones del dominio IQ conocidas como "anclas aromáticas". [11] El complejo Ca 2+ /Cam tiene una alta afinidad hacia los canales de calcio tipo L, lo que le permite bloquearse incluso cuando hay bajas cantidades de calcio presentes en la célula. El poro finalmente se cierra a medida que la célula se repolariza y provoca un cambio conformacional en el canal para ponerlo en la conformación cerrada.
Una de las características más reconocidas del canal de calcio tipo L es su sensibilidad única a las 1,4-dihidropiridinas (DHP) . [3] A diferencia de otros canales de calcio dependientes de voltaje, los canales de calcio tipo L son resistentes a los fármacos inhibidores ⍵-CT X (GVIA) y ⍵-AG A (IVA). [3]
Una forma de modulación bien observada se debe al empalme alternativo . Una forma común de modulación a partir de empalme alternativo es el modulador C-terminal (CTM). Tiene una hélice α cargada positivamente en el terminal C llamada DCRD y una hélice cargada negativamente justo después del motivo IQ (sitio de interacción CaM) llamada PCRD. Las dos hélices pueden formar una estructura que se une competitivamente con CaM para reducir la probabilidad de estado abierto y disminuir la inhibición dependiente de calcio (CDI). [7]
También se observa un empalme alternativo en las subunidades β para crear diferentes isoformas y dar a los canales diferentes propiedades debido a la palmitoilación [6] y la edición de ARN . [7] Otras formas de modulación en la subunidad β incluyen el aumento o disminución de la expresión de la subunidad. Esto se debe al hecho de que las subunidades β aumentan la probabilidad de apertura del canal, la actividad en la membrana plasmática y antagonizan la ubiquitinación del canal. [6]
Los canales de calcio tipo L también están modulados por receptores acoplados a proteína G y el sistema nervioso adrenérgico . [6] La proteína quinasa A (PKA) activada por una cascada de receptores acoplados a proteína G puede fosforilar los canales de calcio de tipo L, después de que los canales formen un complejo de señalización con las proteínas de anclaje de la quinasa A (AKAP) , para aumentar la corriente de calcio a través del canal. , aumentando la probabilidad de estado abierto y un período de recuperación acelerado. La fosfolipasa C activada (PLC) de los receptores acoplados a la proteína G puede descomponer los polifosfoinosítidos para disminuir la corriente de calcio del canal en un 20% -30%. [7]
Se ha observado que el sistema nervioso adrenérgico modula los canales de calcio tipo L escindiendo el fragmento C-terminal cuando se estimula el receptor β-adrenérgico para aumentar la activación de los canales. [6]
Este artículo incorpora texto de la Biblioteca Nacional de Medicina de Estados Unidos , que se encuentra en el dominio público .