Maltasa
En los seres humanos se encuentra presente en el intestino delgado y juega un papel fundamental en la digestión.
La digestión del almidón requiere seis enzimas intestinales, de las cuales dos son α-amilasas.
Las cuatro restantes se han identificado como maltasas, exoglucosidasas unidas a la superficie luminal de los enterocitos.
Trabaja junto con la maltasa-glucoamilasa para degradar polisacáridos grandes, concretamente se encarga en catalizar la hidrólisis de los enlaces α(1→6) que puedan haber.
[4] La maltasa o α-glucosidasa pertenece al familia GH13 de enzimas intestinales que actúan sobre sustratos con enlaces alfa-glicosídicos.
A esta se le añaden carbohidratos ricos en manosa por glicosilación cotraduccional en aquellos dominios de la membrana en los que precipita Ca2+.
[9] El gen que codifica la maltasa se sitúa en el cromosoma 7 del cariotipo y es la siguiente secuencia de aminoácidos:
Dos genes principales de α-glucosidasa (maltasa), sacarasa-isomaltasa (SI) y maltasa-glucoamilasa (MGAM), respectivamente, se expresan en el intestino delgado.
La maltasa centra su actividad en escindir el enlace α-(1→4) entre las dos unidades de glucosa que conforman la maltosa.
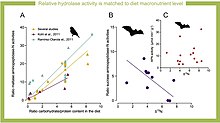
Se ha demostrado que en roedores un cambio de dieta a una más alta en carbohidratos provoca un aumento del control transcripcional del SI intestinal y el MGAM en un periodo de seis a doce horas.
La familia Desmodontinae parece ser el único vertebrado que no muestra actividad intestinal de maltasa.
[17] Para la década del 1960, los avances en bioquímica habilitaron a Dahlqvist y Semenza para fraccionar y caracterizar 2 estructuras peptídicas principales en las que encontraban intrínsecas 4 enzimas responsables de la actividad de la maltasa.
La enzima maltasa juega un rol crucial en la fermentación, proceso mediante el cual la levadura consume los azúcares que se encuentran presentes en la masa y que proceden de la degradación del almidón de la harina: glucosa, sacarosa, fructosa y maltosa.
Por ello, la compañía Brist-Brocades desarrolló un método para solucionar el problema del empleo tardío de la maltosa.
[20] El primer paso para la producción de la cerveza es el malteado, donde los almidones se transforman en maltosa y dextrinas.
La maltosa, se trata de un azúcar utilizable para la fermentación alcohólica, y las dextrinas están relacionadas con el sabor.
En 1932, el patólogo holandés Johannes Cassinus Pompe realizó una autopsia a una niña de 7 meses que había muerto sin causa conocida.
Más tarde descubrió que la causa de la aglutinación del glucógeno era la deficiencia de la enzima α-glucosidasa ácida o maltasa ácida cuya función es hidrolizar el glucógeno produciendo glucosa dentro del lisosoma celular.
La deficiencia de la maltasa es una anomalía que está determinada genéticamente y causadas por mutaciones en el gen GAA.
Se ha demostrado que proporciones reducidas del gen AMY1A en el cerebro aumentan el riesgo de padecer Alzheimer.
La enzima alfa-amilasa 1 se encuentra principalmente en la saliva, donde descompone los polisacáridos de los alimentos, como el almidón.
Además, esta enzima se encuentra en otros órganos, como los pulmones, el corazón, los ovarios o el intestino, y ha sido recientemente descubierto en el hipocampo.