Fase (materia)
El término fase se usa a veces como un sinónimo para estado de la materia, pero puede haber varias fases inmiscibles del mismo estado de la materia.
Sin embargo, los usos del estado de la materia y del diagrama de fase no son proporcionales a la definición formal dada anteriormente y el significado que se pretende debe determinarse en parte a partir del contexto en el que se usa el término.
Mesofases útiles entre sólido y líquido forman otros estados de la materia.
A 100 °C y la presión atmosférica, el equilibrio no se alcanza hasta que el aire es 100% agua.
El término fase se utiliza principalmente para distinguir dos o más zonas de composición y propiedades homogéneas.
Esto se debe a que en termodinámica suelen interesar hechos relacionados con el intercambio de energía o materia.
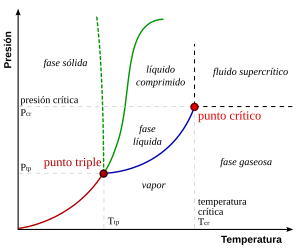
En este sistema simple, las fases posibles solo dependen de la presión y la temperatura.
A temperaturas y presiones alejadas de las marcas, solo habrá una fase en equilibrio.
A medida que la temperatura y la presión se acercan al punto crítico, las propiedades del líquido y el gas se vuelven progresivamente más similares.
Por encima del punto crítico, ya no hay fases separadas de líquido y gas: solo hay una fase de fluido genérico que se conoce como fluido supercrítico.
En el agua, el punto crítico ocurre a alrededor de 647 K (374 °C o 705 °F) y 22.064 MPa.
Para la mayoría de las sustancias, la pendiente es positiva, como lo ejemplifica la línea verde oscuro.
Aunque esta región puede ser muy delgada, puede tener efectos significativos y fácilmente observables, como hacer que un líquido exhiba tensión superficial.
Un mismo material puede tener varios estados sólidos distintos capaces de formar fases separadas.
Por ejemplo, el diamante, el grafito y los fullerenos son diferentes alótropos del carbono.
[nota 3] Si bien las fases de la materia se definen tradicionalmente para los sistemas en equilibrio térmico, el trabajo en sistemas cuánticos localizados en muchos cuerpos (MBL, en inglés many-body localized systems) ha proporcionado un marco para definir las fases fuera del equilibrio.