Complejo (química)
[2] El término también es utilizado para referirse a una enorme cantidad de estructuras inestables o metaestables que participan como intermediarias en diferentes reacciones; por lo cual es preferible utilizar siempre que se pueda un término más explicativo para referirse a estos compuestos.
Estos electrones no compartidos pueden ser inyectados en los orbitales vacíos del grupo central para formar enlaces coordinados.
Esto puede conducir a la idea de que los iones metálicos con carga positiva (cationes) deberían ser muy abundantes en la naturaleza.
Sin embargo los cationes metálicos rara vez se encuentran en estado libre en la naturaleza, esto es así porque al perder uno o más electrones su radio disminuye y su carga eléctrica aumenta.
Hasta mediados del siglo XIX los químicos no comenzaron a interesarse por la verdadera naturaleza de su constitución y por su relación con otros compuestos más sencillos.
A decir verdad, este era un nombre acertado para la época, pues era difícil encontrarles una estructura valedera que pudiera explicar todas sus propiedades.
Proust en 1799, la cual establece que: «un compuesto determinado siempre estará constituido por las mismas proporciones de sus elementos constituyentes».
Berzelius introdujo el concepto de isomería, el cual complementa la definición anterior pero introduce una pregunta clave: ¿cómo se unen entre sí los átomos?
El estado de oxidación 3+ del cobalto está compensado, como se ve claramente en todos los casos, por 3 iones cloruro.
En el primer ejemplo todos los cloruros son iónicos y no forman parte del catión complejo [Co(NH3)6]3+; el número de coordinación 6 está satisfecho por 6 grupos NH3.
Sin embargo este enfoque no permite explicar cómo se forman los complejos con grupos centrales neutros o con carga negativa.
Esto por lo general provoca un aumento en la solubilidad del ion, o, mejor expresado, una disminución de su tendencia a precipitar.
Entre este tipo de compuestos encontramos por ejemplo a los aniones fosfato (PO3−4), carbonato (CO2−3), oxalato (-OOC-COO-), etilendiamina (NH2-CH2-CH2-NH2) y bipiridina.
Grupos centrales grandes y ligandos pequeños permiten números de coordinación elevados, por ejemplo el [Mo(CN)8]4-.
Es en estos puntos donde es posible que se produzca el solapamiento entre los orbitales de los ligandos y el grupo central.
Las repulsiones ligando-ligando tienden a dirigir esta organización hacia determinadas geometrías regulares que minimizan las interferencias.
se puede ver como dos tetraedros unidos por la base y está muy próxima en energía a su isocoordinada.
La geometría molecular prismática trigonal es la siguiente en estabilidad para un número de coordinación seis, suele ser de menor estabilidad porque implica que los ligandos de los vértices del prisma queden enfrentados unos a otros, esta interferencia se minimiza en la disposición octaédrica (que en cierta forma podría ser considerada un antiprisma trigonal, donde se ha girado la cara superior para que los vértices no queden enfrentados).
Por lo general esta estructura se presenta por una estabilización debida a algún otro factor no exclusivamente geométrico, por ejemplo por distorsión forzada de orbitales.
La geometría molecular antiprismática cuadrada es la configuración de menor energía entre las tres posibles configuraciones para un número de coordinación ocho, se puede pensar como un cubo en el que se ha girado la cara superior para que los vértices no queden enfrentados.
La Prismática trigonal triapicada es la geometría más regular y estable que existe para un número de coordinación nueve.
Por el contrario, la gran mayoría de las estructuras descriptas corresponden a tetraedros truncados, cubooctaedros o cubos tetraapicados.
El estereoisomerismo puede ser clasificado en: La isomería geométrica ocurre en complejos octaédricos y cuadrados planos (no así en los tetraédricos).
De manera similar se utiliza el símbolo Δ (delta) como prefijo para describir la hélice con giro hacia la derecha.
Los orbitales enlazantes son aquellos en los que los electrones tienden a pasar la mayor parte del tiempo formando una zona con alta densidad de carga entre los núcleos atómicos, esta zona provoca interacciones atractivas núcleo-electrones-núcleo que mantienen unidos a los átomos entre sí.
(Como ejemplo, según esta teoría un complejo con un átomo central del bloque d, y cinco ligandos del bloque p, posee 29 orbitales moleculares, y eso considerando ligandos monoatómicos), por lo que muchas veces resulta más sencillo utilizar la TEV.
Una sustancia posee color cuando absorbe determinadas longitudes de onda electromagnéticas comprendidas dentro del rango visible.
Si no hay electrones desapareados, el compuesto será diamagnético y se verá ligeramente repelido por los campos magnéticos.
Como al estar desapareados, la energía del sistema es menor, si el desdoblamiento energético es pequeño, es más favorable la situación en la cual los electrones están desapareados, ocupando los orbitales d superiores e inferiores (configuración de alto espín) , mientras que si el desdoblamiento es grande, los electrones estarán apareados en los niveles d inferiores (configuración de bajo espín).
En el primer caso, el complejo es fuertemente paramagnético, mientras que en el segundo solo lo es débilmente (5 e- desapareados frente a 1).
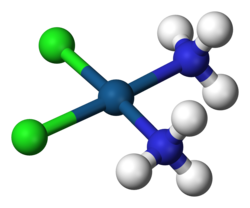
2 (NH
3 )
2
Un complejo formado por un átomo de platino coordinado con dos cloruros (en verde) y dos grupos amino . Este complejo basado en el platino reacciona in vivo, uniéndose al ADN celular y causando apoptosis , por lo que se utiliza como agente quimioterápico en el tratamiento de muchos tipos de cáncer.












