Las sustancias poliméricas extracelulares ( EPS ) son polímeros naturales de alto peso molecular secretados por microorganismos a su entorno. [1] Los EPS establecen la integridad funcional y estructural de las biopelículas y se consideran el componente fundamental que determina las propiedades fisicoquímicas de una biopelícula. [2] El EPS en la matriz de biopelículas proporciona apoyo compositivo y protección a las comunidades microbianas de los entornos hostiles. [3] Los componentes de los EPS pueden ser de diferentes clases de polisacáridos, lípidos, ácidos nucleicos, proteínas, lipopolisacáridos y minerales. Esta fórmula química es (C 135 H 217 N 15 Na 2 O 74 P 10 ).
Los EPS están compuestos mayoritariamente por polisacáridos (exopolisacáridos) y proteínas , pero incluyen otras macromoléculas como ADN , lípidos y sustancias húmicas . Los EPS son el material de construcción de los asentamientos bacterianos y permanecen adheridos a la superficie exterior de la célula o se secretan en su medio de crecimiento . Estos compuestos son importantes en la formación de biopelículas y en la unión de las células a las superficies. Los EPS constituyen entre el 50% y el 90% de la materia orgánica total de una biopelícula . [2] [4] [5]
Los exopolisacáridos (también a veces abreviados EPS ; en adelante, azúcares de EPS ) son las partes a base de azúcar de los EPS. Los microorganismos sintetizan un amplio espectro de polisacáridos multifuncionales, incluidos polisacáridos intracelulares , polisacáridos estructurales y polisacáridos o exopolisacáridos extracelulares . Los exopolisacáridos generalmente consisten en monosacáridos y algunos sustituyentes que no son carbohidratos (como acetato , piruvato , succinato y fosfato ). Debido a la amplia diversidad de composiciones, los exopolisacáridos han encontrado diversas aplicaciones en diversas industrias alimentarias y farmacéuticas. Muchos azúcares EPS microbianos proporcionan propiedades que son casi idénticas a las de las gomas que se utilizan actualmente. Con enfoques innovadores, se están realizando esfuerzos para reemplazar las gomas de plantas y algas utilizadas tradicionalmente por sus contrapartes microbianas. Además, se han logrado avances considerables en el descubrimiento y desarrollo de nuevos azúcares EPS microbianos que poseen nuevas aplicaciones industriales. [6] Se informó que el levan producido por Pantoea agglomerans ZMR7 disminuye la viabilidad de las células de rabdomiosarcoma (RD) y de cáncer de mama (MDA) en comparación con las células cancerosas no tratadas . Además, tiene alta actividad antiparasitaria frente al promastigote de Leishmania tropica . [7] En las décadas de 1960 y 1970, se investigó la presencia de exopolisacáridos en la matriz de las placas asociadas con la caries dental. [8] En el campo de la paleomicrobiología, las biopelículas dentales y sus componentes EPS proporcionan a los científicos información sobre la composición de biomoléculas microbianas y del huésped antiguas, así como sobre la dieta del huésped. [9]
Los minerales, resultado de procesos de biomineralización regulados por el medio ambiente o por bacterias, también son componentes esenciales del EPS. Proporcionan integridad estructural a la matriz de la biopelícula y actúan como un andamio para proteger las células bacterianas de las fuerzas de corte y los químicos antimicrobianos. [10] Se descubrió que los minerales del EPS contribuyen a la morfogénesis de las bacterias y a la integridad estructural de la matriz. Por ejemplo, en las biopelículas de Bacillus subtilis , Mycobacterium smegmatis y Pseudomonas aeruginosa , la calcita ( CaCO 3 ) contribuye a la integridad de la matriz. Los minerales también se asocian con condiciones médicas. En las biopelículas de Proteus mirabilis , Proteus vulgaris y Providencia rettgeri , los minerales calcio y magnesio provocan incrustaciones en el catéter. [11]

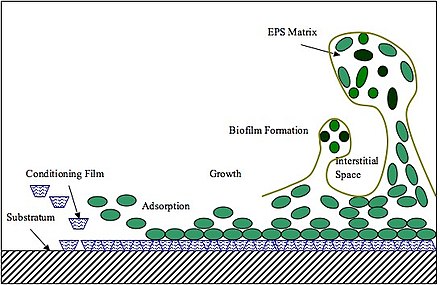
El primer paso en la formación de biopelículas es la adhesión. La adhesión bacteriana inicial a las superficies implica interacciones entre adhesina y receptor. Ciertos polisacáridos, lípidos y proteínas de la matriz funcionan como agentes adhesivos. El EPS también promueve la cohesión célula-célula (incluido el reconocimiento entre especies) para facilitar la agregación microbiana y la formación de biopelículas. [12] En general, la matriz basada en EPS media el ensamblaje de biopelículas de la siguiente manera. Primero, la formación de EPS tiene lugar en el sitio de adhesión, se producirá en superficies bacterianas o se secretará en la superficie de unión y formará una matriz polimérica inicial que promoverá la colonización microbiana y la agrupación celular. A continuación, la producción continua de EPS expande aún más la matriz en 3 dimensiones mientras forma un núcleo de células bacterianas. El núcleo bacteriano proporciona un marco de soporte y facilita el desarrollo de grupos 3D y la agregación de microcolonias. [13] Los estudios sobre P. aeruginosa , B. subtilis , V. cholerae y S. mutans sugirieron que la transición del agrupamiento celular inicial a la microcolonia parece conservarse entre diferentes organismos modelo formadores de biopelículas. [13] Como ejemplo, S. mutans produce exoenzimas, llamadas glucosiltransferasas (Gtfs), que sintetizan glucanos in situ utilizando azúcares de la dieta del huésped como sustratos. Los Gtfs incluso se unen a las bacterias que no los sintetizan y, por lo tanto, facilitan la coadhesión entre especies y entre reinos. [14]
Posteriormente, a medida que se establece la biopelícula, el EPS proporciona estabilidad física y resistencia a la eliminación mecánica, a los antimicrobianos y a la inmunidad del huésped. Los exopolisacáridos y el ADN ambiental (eDNA) contribuyen a la viscoelasticidad de las biopelículas maduras, por lo que el desprendimiento de la biopelícula del sustrato será un desafío incluso bajo tensión de corte de fluido sostenida o alta presión mecánica. [15] Además de la resistencia mecánica, el EPS también promueve la protección contra los antimicrobianos y una mayor tolerancia a los medicamentos. [16] Los antimicrobianos no pueden difundirse a través de la barrera del EPS, lo que limita el acceso de los medicamentos a las capas más profundas de la biopelícula. [17] Además, los agentes cargados positivamente se unirán a los EPS cargados negativamente, contribuyendo a la tolerancia antimicrobiana de las biopelículas y permitiendo la inactivación o degradación de los antimicrobianos por las enzimas presentes en la matriz de la biopelícula. El EPS también funciona como reservorio local de nutrientes de diversas biomoléculas, como los polisacáridos fermentables. [18] Un estudio sobre V. cholerae en 2017 sugirió que debido a las diferencias de presión osmótica en las biopelículas de V. cholerae , las colonias microbianas se hinchan físicamente, maximizando así su contacto con las superficies nutritivas y, por lo tanto, la absorción de nutrientes. [19]
El EPS se encuentra en la matriz de otras biopelículas microbianas, como las biopelículas de microalgas . La formación de biopelículas y la estructura de los EPS comparten muchas similitudes con las bacterianas. La formación de biopelículas comienza con la absorción reversible de células flotantes en la superficie. Seguida de la producción de EPS, la adsorción se volverá irreversible. El EPS colonizará las células de la superficie mediante enlaces de hidrógeno. La replicación de los primeros colonizadores se verá facilitada por la presencia de moléculas orgánicas en la matriz que proporcionarán nutrientes a las células de las algas. A medida que los colonizadores se reproducen, la biopelícula crece y se convierte en una estructura tridimensional. [20] Las biopelículas de microalgas consisten en un 90% de EPS y un 10% de células de algas. El EPS de algas tiene componentes similares al bacteriano; está formado por proteínas, fosfolípidos, polisacáridos, ácidos nucleicos, sustancias húmicas, ácidos urónicos y algunos grupos funcionales, como los grupos fosfórico, carboxílico, hidroxilo y amino. Las células de algas consumen EPS como fuente de energía y carbono. [21] Además, el EPS las protege de la deshidratación y refuerza la adhesión de las células a la superficie. En las biopelículas de algas, el EPS tiene dos subcategorías; El EPS soluble (sEPS) y el EPS ligado (bEPS), el primero distribuido en el medio y el segundo adherido a las células de las algas. [22] Los EPS acotados se pueden subdividir en EPS estrechamente acotados (TB-EPS) y EPS poco acotados (LB-EPS). Varios factores contribuyen a la composición del EPS, incluidas las especies, el tipo de sustrato, la disponibilidad de nutrientes, la temperatura, el pH y la intensidad de la luz. [23]
Los exopolisacáridos capsulares pueden proteger a las bacterias patógenas contra la desecación y la depredación y contribuir a su patogenicidad . [24] Las bacterias sésiles fijadas y agregadas en biopelículas son menos vulnerables en comparación con las bacterias planctónicas a la deriva , ya que la matriz de EPS puede actuar como una barrera protectora contra la difusión. [25] Las características físicas y químicas de las células bacterianas pueden verse afectadas por la composición del EPS, lo que influye en factores como el reconocimiento, la agregación y la adhesión celular en sus entornos naturales. [25] Además, la capa de EPS actúa como una trampa de nutrientes, facilitando el crecimiento bacteriano . [25] Los exopolisacáridos de algunas cepas de bacterias del ácido láctico , por ejemplo, Lactococcus lactis subsp. cremoris , aportan una textura gelatinosa a los productos lácteos fermentados (p. ej., Viili ), y estos polisacáridos también son digeribles. [26] [27] Un ejemplo del uso industrial de exopolisacáridos es la aplicación de dextrano en panettone y otros panes en la industria de la panadería. [28]
Además de las contribuciones negativas del EPS en las biopelículas, el EPS también puede contribuir a algunas funciones beneficiosas. Por ejemplo, B. subtilis ha ganado interés por sus propiedades probióticas debido a su biopelícula que le permite mantener eficazmente un microambiente favorable en el tracto gastrointestinal. Para sobrevivir al paso por el tracto gastrointestinal superior, B. subtilis produce una matriz extracelular que la protege de ambientes estresantes como el ambiente altamente ácido del estómago. [29] En B. subtilis , se ha demostrado que el componente proteico de la matriz, TasA, y el exopolisacárido son esenciales para la colonización efectiva de las raíces de las plantas en Arabidopsis y plantas de tomate. [16] También se sugirió que TasA desempeña un papel importante en la mediación de la agregación entre especies con estreptococos. [30]
Los exopolisacáridos pueden facilitar la unión de bacterias fijadoras de nitrógeno a las raíces de las plantas y a las partículas del suelo, lo que media una relación simbiótica . [24] Esto es importante para la colonización de las raíces y la rizosfera , que es un componente clave de las redes alimentarias del suelo y del ciclo de nutrientes en los ecosistemas . También permite una invasión e infección exitosa de la planta huésped . [24] Las sustancias poliméricas extracelulares bacterianas pueden ayudar en la biorremediación de metales pesados, ya que tienen la capacidad de adsorber cationes metálicos, entre otras sustancias disueltas . [31] Esto puede ser útil en el tratamiento de sistemas de aguas residuales , ya que las biopelículas pueden unirse y eliminar metales como cobre , plomo , níquel y cadmio . [31] La afinidad de unión y la especificidad del metal de los EPS varía, dependiendo de la composición del polímero, así como de factores como la concentración y el pH . [31] En un contexto geomicrobiológico , se ha observado que los EPS afectan la precipitación de minerales, particularmente carbonatos . [32] El EPS también puede unirse y atrapar partículas en suspensiones de biopelículas, lo que puede restringir la dispersión y el ciclo de elementos. [32] El EPS puede aumentar la estabilidad del sedimento , ya que influye en la cohesión , la permeabilidad y la erosión del sedimento. [32] Existe evidencia de que la capacidad de adhesión y unión de metales del EPS afecta las tasas de lixiviación de minerales en contextos tanto ambientales como industriales. [32] Estas interacciones entre el EPS y el entorno abiótico permiten que el EPS tenga un gran impacto en el ciclo biogeoquímico . Se han estudiado ampliamente las interacciones depredador-presa entre biopelículas y bacterívoros , como el nematodo Caenorhabditis elegans que habita en el suelo. Mediante la producción de una matriz pegajosa y la formación de agregados, las biopelículas de Yersinia pestis pueden impedir la alimentación obstruyendo la boca de C. elegans . [33]Además, las biopelículas de Pseudomonas aeruginosa pueden impedir la motilidad deslizante de C. elegans , denominada " fenotipo de atolladero ", lo que resulta en el atrapamiento de C. elegans dentro de las biopelículas e impide la exploración de nematodos para alimentarse de biopelículas susceptibles. [34] Esto redujo significativamente la capacidad del depredador para alimentarse y reproducirse, promoviendo así la supervivencia de las biopelículas.
Debido a la creciente necesidad de encontrar una alternativa más eficiente y respetuosa con el medio ambiente a los métodos convencionales de eliminación de residuos, las industrias están prestando más atención a la función de las bacterias y sus azúcares EPS en la biorremediación . [35]
Los investigadores descubrieron que la adición de azúcares EPS de cianobacterias a las aguas residuales elimina metales pesados como el cobre , el cadmio y el plomo . [35] Los azúcares EPS por sí solos pueden interactuar físicamente con estos metales pesados y absorberlos mediante biosorción . [35] La eficiencia de la eliminación se puede optimizar tratando los azúcares de EPS con diferentes ácidos o bases antes de agregarlos a las aguas residuales. [35] Algunos suelos contaminados contienen altos niveles de hidrocarburos aromáticos policíclicos (HAP); EPS de la bacteria Zoogloea sp . y el hongo Aspergillus niger , son eficaces para eliminar estos compuestos tóxicos. [36] Los EPS contienen enzimas como la oxidorreductasa y la hidrolasa , que son capaces de degradar los HAP. [36] La cantidad de degradación de los HAP depende de la concentración de EPS añadidos al suelo. Este método demuestra ser de bajo costo y altamente eficiente. [36]
En los últimos años, se ha descubierto que los azúcares EPS de bacterias marinas aceleran la limpieza de derrames de petróleo. [37] Durante el derrame de petróleo de Deepwater Horizon en 2010, estas bacterias productoras de EPS pudieron crecer y multiplicarse rápidamente. [37] Más tarde se descubrió que sus azúcares EPS disolvieron el petróleo y formaron agregados de petróleo en la superficie del océano, lo que aceleró el proceso de limpieza. [37] Estos agregados de petróleo también proporcionaron una valiosa fuente de nutrientes para otras comunidades microbianas marinas. Esto permitió a los científicos modificar y optimizar el uso de azúcares EPS para limpiar derrames de petróleo . [37]
La aplicación de nanopartículas (NP) es una de las técnicas novedosas y prometedoras para atacar biopelículas debido a su alta relación superficie-volumen, su capacidad para penetrar hasta las capas más profundas de las biopelículas y su capacidad de liberar agentes antimicrobianos de forma controlada. . El estudio de las interacciones NP-EPS podría proporcionar una comprensión más profunda sobre cómo desarrollar nanopartículas más efectivas. [3] Se han desarrollado nanoportadores de "liberación inteligente" que pueden penetrar biopelículas y ser activados por microambientes patógenos para administrar fármacos o compuestos multifuncionales, como nanopartículas catalíticas a aptámeros, dendrímeros y péptidos bioactivos) para alterar el EPS y la viabilidad o metabólica. actividad de las bacterias incrustadas. Algunos factores que alterarían el potencial de las NP para transportar agentes antimicrobianos a la biopelícula incluyen las interacciones fisicoquímicas de las NP con los componentes del EPS, las características de los espacios de agua (poros) dentro de la matriz de EPS y la viscosidad de la matriz de EPS. [38] El tamaño y las propiedades de la superficie (carga y grupos funcionales) de las NP son los principales determinantes de la penetración y la interacción con las EPS. [3] Otra posible estrategia antibiofilm es la terapia con fagos. Se sugirió que los bacteriófagos, virus que invaden células hospedadoras bacterianas específicas, eran agentes eficaces para penetrar las biopelículas. [11] Para alcanzar la máxima eficacia para erradicar las biopelículas, las estrategias terapéuticas deben apuntar tanto a los componentes de la matriz de la biopelícula como a los microorganismos incrustados para atacar el complejo microambiente de la biopelícula. [11]