El síndrome de Guillain-Barré ( SGB ) es una debilidad muscular de aparición rápida causada por el daño del sistema inmunológico al sistema nervioso periférico . [3] Por lo general, ambos lados del cuerpo están afectados, y los síntomas iniciales son cambios en la sensibilidad o dolor, a menudo en la espalda, junto con debilidad muscular, que comienza en los pies y las manos, y a menudo se extiende a los brazos y la parte superior del cuerpo. [3] Los síntomas pueden desarrollarse en cuestión de horas o semanas. [3] Durante la fase aguda, el trastorno puede poner en peligro la vida, y aproximadamente el 15 % de las personas desarrollan debilidad de los músculos respiratorios que requieren ventilación mecánica . [1] Algunos se ven afectados por cambios en la función del sistema nervioso autónomo , que pueden provocar anomalías peligrosas en la frecuencia cardíaca y la presión arterial . [3]
Aunque se desconoce la causa, el mecanismo subyacente implica un trastorno autoinmunitario en el que el sistema inmunitario del cuerpo ataca por error a los nervios periféricos y daña su aislamiento de mielina . [3] A veces, esta disfunción inmunitaria se desencadena por una infección o, con menor frecuencia, por una cirugía y por la vacunación . [1] [3] El diagnóstico generalmente se basa en los signos y síntomas a través de la exclusión de causas alternativas y se apoya en pruebas como estudios de conducción nerviosa y examen del líquido cefalorraquídeo . [3] Hay una serie de subtipos basados en las áreas de debilidad, los resultados de los estudios de conducción nerviosa y la presencia de ciertos anticuerpos . [5] Se clasifica como una polineuropatía aguda . [1]
En aquellos con debilidad severa, el tratamiento rápido con inmunoglobulinas intravenosas o plasmaféresis , junto con cuidados de apoyo, conducirá a una buena recuperación en la mayoría de los casos. [3] La recuperación puede llevar semanas o años, y aproximadamente un tercio presenta alguna debilidad permanente. [3] A nivel mundial, la muerte ocurre en aproximadamente el 7,5% de los afectados. [1] El síndrome de Guillain-Barré es poco común, con 1 o 2 casos por cada 100.000 personas cada año. [3] [4]
El síndrome debe su nombre a los neurólogos franceses Georges Guillain y Jean Alexandre Barré , quienes, junto con el médico francés André Strohl , describieron la enfermedad en 1916. [6] [7]
Los primeros síntomas del síndrome de Guillain-Barré son entumecimiento, hormigueo y dolor, solos o en combinación. A esto le sigue una debilidad en las piernas y los brazos que afecta a ambos lados por igual y empeora con el tiempo. [8] [9] La debilidad puede tardar medio día o más de dos semanas en alcanzar la gravedad máxima, y luego se vuelve constante. [9] En una de cada cinco personas, la debilidad continúa progresando durante cuatro semanas. [5] Los músculos del cuello también pueden verse afectados, y aproximadamente la mitad experimenta afectación de los nervios craneales que irrigan la cabeza y la cara; esto puede provocar debilidad de los músculos de la cara , dificultades para tragar y, a veces, debilidad de los músculos oculares . [5] En el 8%, la debilidad afecta solo a las piernas (paraplejía o paraparesia). [5] La afectación de los músculos que controlan la vejiga y el ano es poco común. [9] En total, aproximadamente un tercio de las personas con síndrome de Guillain-Barré siguen siendo capaces de caminar. [5] Una vez que la debilidad ha dejado de progresar, persiste en un nivel estable ("fase de meseta") antes de que se produzca una mejoría. La fase de meseta puede durar entre dos días y seis meses, pero la duración más común es una semana. [5] Los síntomas relacionados con el dolor afectan a más de la mitad e incluyen dolor de espalda , hormigueo doloroso, dolor muscular y dolor en la cabeza y el cuello relacionado con la irritación del revestimiento del cerebro. [5]
Muchas personas con síndrome de Guillain-Barré han experimentado signos y síntomas de una infección en las 3 a 6 semanas anteriores a la aparición de los síntomas neurológicos. Estos pueden consistir en una infección de las vías respiratorias superiores (rinitis, dolor de garganta) o diarrea . [9]

En los niños, especialmente en los menores de seis años, el diagnóstico puede ser difícil y la afección suele confundirse inicialmente (a veces hasta por dos semanas) con otras causas de dolores y dificultad para caminar, como infecciones virales [5] o problemas en los huesos y las articulaciones. [10]
En el examen neurológico , los rasgos característicos son la fuerza reducida de los músculos y los reflejos tendinosos reducidos o ausentes ( hipo o arreflexia , respectivamente). Sin embargo, una pequeña proporción tiene reflejos normales en las extremidades afectadas antes de desarrollar arreflexia, y algunos pueden tener reflejos exagerados. [5] En la variante Miller Fisher del síndrome de Guillain-Barré (ver más abajo), se puede encontrar una tríada de debilidad de los músculos oculares, anomalías en la coordinación , así como reflejos ausentes. [9] El nivel de conciencia normalmente no se ve afectado en el síndrome de Guillain-Barré, pero el subtipo de encefalitis del tronco encefálico de Bickerstaff puede presentar somnolencia, sueño o coma. [6] [11]
Una cuarta parte de todas las personas con síndrome de Guillain-Barré desarrollan debilidad de los músculos respiratorios que conduce a insuficiencia respiratoria , la incapacidad de respirar adecuadamente para mantener niveles saludables de oxígeno y/o dióxido de carbono en la sangre. [5] [9] [12] Este escenario potencialmente mortal se complica por otros problemas médicos como neumonía , infecciones graves , coágulos de sangre en los pulmones y sangrado en el tracto digestivo en el 60% de los que requieren ventilación artificial. [9]
El sistema nervioso autónomo o involuntario , que está involucrado en el control de funciones corporales como la frecuencia cardíaca y la presión arterial , se ve afectado en dos tercios de las personas con síndrome de Guillain-Barré, pero el impacto es variable. [5] El veinte por ciento puede experimentar fluctuaciones graves de la presión arterial e irregularidades en el ritmo cardíaco , a veces hasta el punto de que el latido cardíaco se detiene y requiere tratamiento basado en marcapasos . [9] Otros problemas asociados son anomalías en la transpiración y cambios en la reactividad de las pupilas . [6] La afectación del sistema nervioso autónomo puede afectar incluso a quienes no tienen debilidad muscular grave. [6]
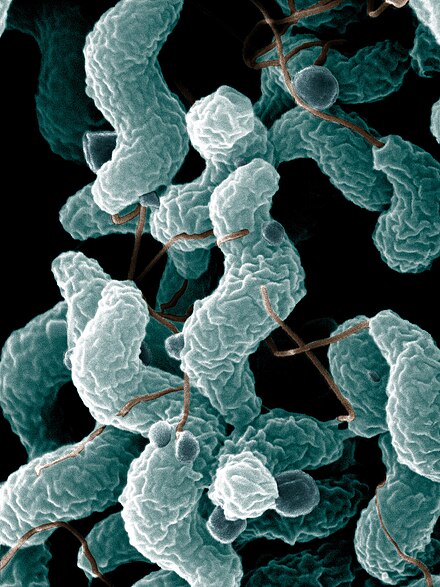
Dos tercios de las personas con síndrome de Guillain-Barré han sufrido una infección antes de la aparición de la enfermedad. Lo más común es que se trate de episodios de gastroenteritis o de una infección de las vías respiratorias . En muchos casos, se puede confirmar la naturaleza exacta de la infección. [5] Aproximadamente el 30% de los casos son provocados por la bacteria Campylobacter jejuni , que causa diarrea. Otro 10% son atribuibles al citomegalovirus (CMV, HHV-5). A pesar de ello, sólo muy pocas personas con infecciones por Campylobacter o CMV desarrollan el síndrome de Guillain-Barré (0,25-0,65 por 1000 y 0,6-2,2 por 1000 episodios, respectivamente). [9] La cepa de Campylobacter implicada puede determinar el riesgo de SGB; las diferentes formas de la bacteria tienen diferentes lipopolisacáridos en su superficie, y algunas pueden inducir la enfermedad (véase más adelante) mientras que otras no. [5]
Los vínculos entre otras infecciones y el SGB son menos seguros. Otros dos virus del herpes ( el virus de Epstein-Barr /HHV-4 y el virus de la varicela-zóster /HHV-3) y la bacteria Mycoplasma pneumoniae se han asociado con el SGB. [9] Se sabe que el SGB se presenta después de la gripe, y se ha demostrado que la vacunación contra la gripe está asociada con un riesgo reducido. [13] Las infecciones tropicales por flavivirus, el dengue y el virus del Zika, también se han asociado con episodios de SGB. [14] [15] Se ha descubierto que la infección previa por el virus de la hepatitis E es más común en personas con SGB. [5] [7]
Tras la vacunación contra la gripe que siguió al brote de gripe porcina de 1976 (H1N1 A/NJ/76) se produjo un aumento de la incidencia del síndrome de Guillain-Barré; 8,8 casos por millón (0,0088 por 1000) de los receptores lo desarrollaron como complicación. [16] Se produjeron casos de SGB en 362 pacientes durante las 6 semanas posteriores a la vacunación contra la gripe de 45 millones de personas, un aumento de 8,8 veces por encima de las tasas normales. [17] El SGB inducido por la vacunación contra la gripe porcina de 1976 fue un caso atípico; se han observado pequeños aumentos de la incidencia en campañas de vacunación posteriores, pero no en la misma medida. [16] La vacuna antigripal pandémica de 2009 contra el virus de la gripe porcina pandémica H1N1/PDM09 no provocó un aumento significativo de los casos. De hecho, "los estudios encontraron un pequeño aumento de aproximadamente 1 caso por millón de vacunas por encima de la tasa de referencia, que es similar a la observada después de la administración de vacunas contra la gripe estacional en los últimos años". [9] La infección natural por influenza es un factor de riesgo más fuerte para el desarrollo del síndrome de Guillain-Barré que la vacunación contra la influenza, y la vacunación redujo el riesgo de síndrome de Guillain-Barré en general al disminuir el riesgo de contraer influenza. [18]
En los Estados Unidos, el síndrome de Guillain-Barré después de la vacunación contra la influenza estacional figura en la tabla de lesiones por vacunas del gobierno federal . [19] El 24 de marzo de 2021, después de revisar varios estudios de observación posteriores a la comercialización, donde se observó un mayor riesgo de síndrome de Guillain-Barré después de 42 días de la vacunación con la vacuna contra el herpes zóster Shingrix, la FDA exigió cambios en la etiqueta de seguridad del fabricante GlaxoSmithKline para incluir advertencias sobre el riesgo de síndrome de Guillain-Barré. [20]
Se ha informado de que el SGB está asociado con la COVID-19 y puede ser una posible complicación neurológica de la enfermedad. [21] [22] [23] [24] Se ha informado de que el SGB es un efecto secundario muy raro de las vacunas Janssen y Oxford-AstraZeneca contra la COVID-19 [25] y la Agencia Europea de Medicamentos emitió una advertencia a los pacientes y a los proveedores de atención médica. [26] Originalmente se informó que la incidencia del SGB después de la vacunación con la vacuna Oxford-AstraZeneca era menor que la incidencia del SGB después de una infección por COVID-19. [27] Sin embargo, estudios más recientes no encontraron un vínculo mensurable entre la infección por COVID-19 y el SGB, mientras que las correlaciones con una primera dosis de las vacunas AstraZeneca o Janssen seguían siendo positivas. [28]
Se ha informado que la COVID-19 causa neuropatía periférica y, más recientemente, cierta evidencia de agravamiento de trastornos autoinmunes, incluido el síndrome de Guillain-Barré. [29]
La zimelidina , un antidepresivo, tenía un perfil de seguridad muy favorable, pero como resultado de informes de casos raros de síndrome de Guillain-Barré, se retiró del mercado. [30] [31] [32]

La disfunción nerviosa en el síndrome de Guillain-Barré es causada por un ataque inmunológico a las células nerviosas del sistema nervioso periférico y sus estructuras de soporte. Las células nerviosas tienen su cuerpo (el soma) en la médula espinal y una proyección larga (el axón ) que lleva impulsos nerviosos eléctricos a la unión neuromuscular , donde el impulso se transfiere al músculo. Los axones están envueltos en una vaina de células de Schwann que contienen mielina . Entre las células de Schwann hay espacios ( nódulos de Ranvier ) donde el axón está expuesto. [9] Los diferentes tipos de síndrome de Guillain-Barré presentan diferentes tipos de ataques inmunológicos. La variante desmielinizante (AIDP, ver más abajo) presenta daño a la vaina de mielina por glóbulos blancos ( linfocitos T y macrófagos ); este proceso está precedido por la activación de un grupo de proteínas sanguíneas conocidas como complemento . Por el contrario, la variante axonal está mediada por anticuerpos IgG y complemento contra la membrana celular que cubre el axón sin participación directa de los linfocitos. [9]
Se han descrito varios anticuerpos dirigidos a las células nerviosas en el síndrome de Guillain-Barré. En el subtipo axonal, se ha demostrado que estos anticuerpos se unen a los gangliósidos , un grupo de sustancias que se encuentran en los nervios periféricos. Un gangliósido es una molécula que consiste en ceramida unida a un pequeño grupo de azúcares de tipo hexosa y que contiene varios números de grupos de ácido N -acetilneuramínico . Los cuatro gangliósidos clave contra los que se han descrito anticuerpos son GM1 , GD1a, GT1a y GQ1b, y los diferentes anticuerpos antigangliósidos se asocian con características particulares; por ejemplo, los anticuerpos GQ1b se han relacionado con la variante de Miller Fisher del SGB y formas relacionadas, incluida la encefalitis de Bickerstaff. [9] La producción de estos anticuerpos después de una infección probablemente sea el resultado del mimetismo molecular , donde el sistema inmunológico reacciona a sustancias microbianas, pero los anticuerpos resultantes también reaccionan con sustancias que se producen de forma natural en el cuerpo. [9] [33] Después de una infección por Campylobacter , el cuerpo produce anticuerpos de la clase IgA ; Sólo una pequeña proporción de personas también produce anticuerpos IgG contra sustancias de la pared celular de sustancias bacterianas (por ejemplo, lipooligosacáridos) que reaccionan de forma cruzada con los gangliósidos de las células nerviosas humanas. Actualmente no se sabe cómo este proceso escapa a la tolerancia central a los gangliósidos, cuyo objetivo es suprimir la producción de anticuerpos contra las propias sustancias del cuerpo. [34] No todos los anticuerpos antigangliósidos causan enfermedades, y recientemente se ha sugerido que algunos anticuerpos se unen a más de un tipo de epítopo simultáneamente (unión heterodímera) y que esto determina la respuesta. Además, el desarrollo de anticuerpos patógenos puede depender de la presencia de otras cepas de bacterias en el intestino. [34]
Se ha sugerido que una técnica de inyección deficiente también puede causar una lesión directa a los nervios axilares adyacentes al sitio de la inyección en el músculo deltoides, lo que puede provocar neuropatía periférica. La consiguiente transfección y traducción de la vacuna en los nervios puede estimular una respuesta inmunitaria contra las células nerviosas, lo que puede causar un daño nervioso autoinmune, lo que conduce a afecciones como el síndrome de Guillain-Barré. [35]
El diagnóstico del síndrome de Guillain-Barré depende de hallazgos como el rápido desarrollo de parálisis muscular, ausencia de reflejos, ausencia de fiebre y ausencia de una causa probable. El análisis del líquido cefalorraquídeo (a través de una punción espinal lumbar ) y los estudios de conducción nerviosa son investigaciones de apoyo que se realizan comúnmente en el diagnóstico del SGB. [5] [7] [9] A menudo se realizan pruebas de anticuerpos antigangliósidos, pero su contribución al diagnóstico suele ser limitada. [5] Los análisis de sangre generalmente se realizan para excluir la posibilidad de otra causa de debilidad, como un nivel bajo de potasio en la sangre . [9] A menudo se encuentra un nivel anormalmente bajo de sodio en la sangre en el síndrome de Guillain-Barré. Esto se ha atribuido a la secreción inadecuada de hormona antidiurética , lo que lleva a una retención relativa de agua. [36]
En muchos casos, se realiza una resonancia magnética de la médula espinal para distinguir entre el síndrome de Guillain-Barré y otras afecciones que causan debilidad en las extremidades, como la compresión de la médula espinal . [5] [9] Si una resonancia magnética muestra un realce de las raíces nerviosas , esto puede ser indicativo de SGB. [5] En los niños, esta característica está presente en el 95 % de las exploraciones, pero no es específica del síndrome de Guillain-Barré, por lo que también se necesita otra confirmación. [10]
El líquido cefalorraquídeo envuelve el cerebro y la columna vertebral, y la punción lumbar o punción raquídea es la extracción de una pequeña cantidad de líquido mediante una aguja insertada entre las vértebras lumbares . Los hallazgos característicos en el síndrome de Guillain-Barré son un nivel elevado de proteínas, generalmente mayor de 0,55 g/L, y menos de 10 glóbulos blancos por milímetro cúbico de líquido ("disociación albuminocitológica"). [37] Este patrón distingue al síndrome de Guillain-Barré de otras afecciones (como el linfoma y la poliomielitis ) en las que tanto el recuento de proteínas como el de células están elevados . Se encuentran niveles elevados de proteínas en el LCR en aproximadamente el 50% de los pacientes en los primeros 3 días después del inicio de la debilidad, que aumenta al 80% después de la primera semana. [5]
No se recomienda repetir la punción lumbar durante el curso de la enfermedad, ya que los niveles de proteínas pueden aumentar después de administrar el tratamiento. [5]
La evaluación directa de la conducción nerviosa de los impulsos eléctricos permite excluir otras causas de debilidad muscular aguda, así como distinguir los diferentes tipos de síndrome de Guillain-Barré. Se pueden realizar electromiografías con aguja (EMG) y estudios de conducción nerviosa. En las primeras dos semanas, estas investigaciones pueden no mostrar ninguna anomalía. [5] [38] No se requieren estudios neurofisiológicos para el diagnóstico. [9]
Existen criterios formales para cada uno de los principales subtipos del síndrome de Guillain-Barré (AIDP y AMAN/AMSAN, ver más abajo), pero estos pueden clasificar erróneamente algunos casos (particularmente cuando hay una falla reversible de la conducción) y por lo tanto se han propuesto cambios a estos criterios. [39] A veces, las pruebas repetidas pueden ser útiles. [39]
Se reconocen varios subtipos del síndrome de Guillain-Barré. [5] [39] A pesar de esto, muchas personas presentan síntomas superpuestos que pueden dificultar la clasificación en casos individuales. [6] [40] Todos los tipos tienen formas parciales. Por ejemplo, algunas personas experimentan solo problemas aislados de coordinación o movimiento ocular; se cree que estos son un subtipo del síndrome de Miller Fisher y tienen patrones de anticuerpos antigangliósidos similares. [11] [40]
Otras entidades diagnósticas se incluyen a menudo en el espectro del síndrome de Guillain-Barré. La encefalitis del tronco encefálico de Bickerstaff (EBB), por ejemplo, forma parte del grupo de afecciones que ahora se consideran formas del síndrome de Miller Fisher (síndrome de anticuerpos anti-GQ1b), [11] así como una afección relacionada denominada "hipersomnolencia atáxica aguda" [42] en la que hay problemas de coordinación y somnolencia pero no se puede detectar debilidad muscular. [40] La EBB se caracteriza por la aparición rápida de oftalmoplejía, ataxia y alteración de la conciencia, y puede estar asociada con la ausencia o disminución de los reflejos tendinosos y también con el signo de Babinski . [40] El curso de la enfermedad suele ser monofásico, pero se han descrito episodios recurrentes. Se han descrito anomalías en la resonancia magnética en el tronco encefálico en el 11 %. [11]
Si la pérdida sensorial aguda aislada puede considerarse una forma de síndrome de Guillain-Barré es un tema de debate; se trata de una ocurrencia rara en comparación con el síndrome de Guillain-Barré, con debilidad muscular pero sin síntomas sensoriales. [38]
La plasmaféresis y las inmunoglobulinas intravenosas (IVIG) son los dos principales tratamientos de inmunoterapia para el síndrome de Guillain-Barré. La plasmaféresis intenta reducir el ataque del cuerpo al sistema nervioso filtrando los anticuerpos del torrente sanguíneo. [43] De manera similar, la administración de IVIG neutraliza los anticuerpos dañinos y la inflamación. Estos dos tratamientos son igualmente efectivos, pero una combinación de los dos no es significativamente mejor que cualquiera de ellos por separado. [44] La plasmaféresis acelera la recuperación cuando se usa dentro de las cuatro semanas posteriores al inicio de los síntomas. [45] La IVIG funciona tan bien como la plasmaféresis cuando se inicia dentro de las dos semanas posteriores al inicio de los síntomas y tiene menos complicaciones. [45] La IVIG generalmente se usa primero debido a su facilidad de administración y seguridad; los riesgos incluyen causar ocasionalmente inflamación del hígado o, en casos raros, insuficiencia renal. [46] No se ha demostrado que los glucocorticoides por sí solos sean efectivos para acelerar la recuperación y podrían retrasarla. [47]
La insuficiencia respiratoria puede requerir intubación de la tráquea y soporte respiratorio mediante ventilación mecánica , generalmente en una unidad de cuidados intensivos . La necesidad de soporte ventilatorio se puede anticipar mediante la medición de dos pruebas de respiración basadas en la espirometría : la capacidad vital forzada (FVC) y la fuerza inspiratoria negativa (NIF). Una FVC de menos de 15 mL por kilogramo de peso corporal o una NIF de menos de 60 cmH 2 O se consideran marcadores de insuficiencia respiratoria grave. [48]
Si bien el dolor es común en personas con síndrome de Guillain-Barré, los estudios que comparan diferentes tipos de analgésicos son insuficientes para hacer una recomendación sobre cuál se debe utilizar. [49]
Después de la fase aguda, alrededor del 40% de las personas requieren rehabilitación intensiva con la ayuda de un equipo multidisciplinario para centrarse en mejorar las actividades de la vida diaria (AVD). [50] Los estudios sobre el tema han sido limitados, pero es probable que la rehabilitación intensiva mejore los síntomas a largo plazo. [51] Los equipos pueden incluir fisioterapeutas , terapeutas ocupacionales , patólogos del lenguaje del habla, trabajadores sociales, psicólogos , otros profesionales de la salud afines y enfermeras . El equipo suele trabajar bajo la supervisión de un neurólogo o médico de rehabilitación que dirige los objetivos del tratamiento. [50]
Las intervenciones de fisioterapia incluyen entrenamiento de fuerza, resistencia y marcha con aumentos graduales de la movilidad, mantenimiento de la postura y la alineación, así como la función articular. La terapia ocupacional tiene como objetivo mejorar la función diaria con las tareas domésticas y comunitarias, así como la conducción y el trabajo. Se pueden proporcionar modificaciones en el hogar, ayudas para la marcha, ortesis y férulas. [50] Puede ser necesaria la participación de un logopeda en aquellos con problemas de habla y deglución, así como para apoyar la comunicación en aquellos que requieren apoyo respiratorio continuo (a menudo a través de una traqueotomía ). El equipo y los dietistas pueden proporcionar apoyo nutricional . Los psicólogos pueden proporcionar asesoramiento y apoyo. También pueden requerirse intervenciones psicológicas para la ansiedad, el miedo y la depresión. [50]
Hay disponible apoyo, información, asesoramiento y orientación especializados de la comunidad de forma continua a través de una variedad de organizaciones benéficas , organizaciones no gubernamentales (ONG) y grupos de asesoramiento de pacientes de todo el mundo. En el Reino Unido, esto lo proporciona GAIN (Guillain–Barré and Associated Inflammatory Neuropathies), [52] en los EE. UU. lo proporciona GBS/CIDP Foundation International, [53] y en la Unión Europea, una variedad de organizaciones bajo el paraguas de EPODIN (European Patient Organization for Disimmune & Inflammatory Neuropathies). [54]
El síndrome de Guillain-Barré puede ser mortal como resultado de muchas complicaciones: infecciones graves, coágulos sanguíneos y paro cardíaco probablemente debido a neuropatía autonómica. A pesar de una atención óptima, esto ocurre en aproximadamente el 5% de los casos. [9]
Existe una variación en la tasa y el grado de recuperación. [9] El pronóstico del síndrome de Guillain-Barré está determinado principalmente por la edad (los mayores de 40 años pueden tener un pronóstico peor) y por la gravedad de los síntomas después de dos semanas. Además, aquellos que experimentaron diarrea antes del inicio de la enfermedad tienen un peor pronóstico. [12] En el estudio de conducción nerviosa, la presencia de bloqueo de la conducción predice un peor pronóstico a los 6 meses. [12] En aquellos que han recibido inmunoglobulinas intravenosas, un aumento menor de IgG en la sangre dos semanas después de la administración se asocia con peores resultados de movilidad a los seis meses que aquellos cuyo nivel de IgG aumentó sustancialmente. [12] Si la enfermedad continúa progresando más allá de las cuatro semanas, o hay múltiples fluctuaciones en la gravedad (más de dos en ocho semanas), el diagnóstico puede ser polineuropatía desmielinizante inflamatoria crónica , que se trata de manera diferente. [5]
En estudios de investigación, el resultado de un episodio del síndrome de Guillain-Barré se registra en una escala de 0 a 6, donde 0 denota completamente saludable; 1 síntomas muy leves pero capaz de correr; 2 capaz de caminar pero no de correr; 3 requiere un bastón u otro apoyo; 4 confinado a cama o silla; 5 requiere asistencia respiratoria a largo plazo; 6 muerte. [55]
La calidad de vida relacionada con la salud (CVRS) después de un ataque de síndrome de Guillain-Barré puede verse afectada significativamente. Alrededor de una quinta parte de los pacientes no pueden caminar sin ayuda después de seis meses, y muchos experimentan dolor crónico , fatiga y dificultad para trabajar, estudiar, realizar pasatiempos y realizar actividades sociales. [56] La CVRS mejora significativamente en el primer año. [56]
En los países occidentales, se ha estimado que el número de nuevos episodios por año oscila entre 0,89 y 1,89 casos por cada 100.000 personas. Los niños y los adultos jóvenes tienen menos probabilidades de verse afectados que los ancianos: el riesgo relativo aumenta un 20% por cada década de vida. [4] Los hombres tienen más probabilidades de desarrollar el síndrome de Guillain-Barré que las mujeres; el riesgo relativo para los hombres es de 1,78 en comparación con las mujeres. [4] [9]
La distribución de los subtipos varía entre países. En Europa y Estados Unidos, entre el 60 y el 80 % de las personas con síndrome de Guillain-Barré tienen el subtipo desmielinizante (AIDP), y el AMAN afecta solo a un pequeño número (6-7 %). En Asia y América Central y del Sur, esa proporción es significativamente mayor (30-65 %). Esto puede estar relacionado con la exposición a diferentes tipos de infecciones, pero también con las características genéticas de esa población. [5] Se cree que la variante Miller-Fisher es más común en el sudeste asiático. [9] [11]

Jean-Baptiste Octave Landry describió por primera vez el trastorno en 1859. [58] En 1916, Georges Guillain , Jean Alexandre Barré y André Strohl diagnosticaron la enfermedad a dos soldados y describieron la anomalía diagnóstica clave (disociación albuminocitológica) consistente en una mayor concentración de proteínas en el líquido cefalorraquídeo pero un recuento celular normal. [6] [7] [59]
C. Miller Fisher describió la variante que lleva su nombre en 1956. [11] [60] El neurólogo británico Edwin Bickerstaff describió el tipo de encefalitis en 1951 e hizo contribuciones adicionales con otro artículo en 1957. [11] [61] [62] Guillain había informado sobre algunas de estas características antes de su descripción completa en 1938. [11] Desde entonces se han descrito otros subtipos, como la forma que presenta ataxia pura y el tipo que causa debilidad faríngeo-cervical-braquial. [11] El subtipo axonal se describió por primera vez en 1986. [63]
Los criterios de diagnóstico se desarrollaron a finales de los años 1970, tras la serie de casos asociados a la vacunación contra la gripe porcina . Se perfeccionaron en 1990. [5] [64] La definición de caso fue revisada por la Brighton Collaboration para la seguridad de las vacunas en 2009, [65] pero está destinada principalmente a la investigación. [5] El recambio plasmático se utilizó por primera vez en 1978, y su beneficio se confirmó en estudios más amplios en 1985. [66] Las inmunoglobulinas intravenosas se introdujeron en 1988, y los estudios a principios de los años 1990 demostraron que no eran menos eficaces que el recambio plasmático. [66]
La comprensión del mecanismo de la enfermedad del síndrome de Guillain-Barré ha evolucionado en los últimos años. [38] El desarrollo de nuevos tratamientos ha sido limitado desde que se introdujo la inmunoterapia en los años 1980 y 1990. [38] [66] La investigación actual tiene como objetivo demostrar si algunas personas que han recibido IgIV podrían beneficiarse de un segundo ciclo si los niveles de anticuerpos medidos en sangre después del tratamiento han mostrado solo un pequeño aumento. [12] [66] Los estudios de los fármacos inmunosupresores micofenolato de mofetilo , factor neurotrófico derivado del cerebro e interferón beta (IFN-β) no han demostrado beneficios que respalden su uso generalizado. [66]
A menudo se utiliza un modelo animal (neuritis autoinmune experimental en ratas) para los estudios, y algunos agentes han demostrado ser prometedores: acetato de glatiramer , quinupramina , fasudil (un inhibidor de la enzima Rho-quinasa ), [38] y el fármaco cardíaco flecainida . [66] Un anticuerpo dirigido contra el anticuerpo antigangliósido anti-GD3 ha demostrado ser beneficioso en la investigación de laboratorio. [38] Dado el papel del sistema del complemento en el SGB, se ha sugerido que los inhibidores del complemento (como el fármaco eculizumab ) pueden ser eficaces. [66]
En los animales se denomina polirradiculoneuritis aguda o "parálisis del perro de caza", y puede aparecer en el perro de caza entre 7 y 10 días después de la transmisión de los mapaches . Si el perro de caza no ha estado cerca de mapaches, la enfermedad se denomina polirradiculoneuritis idiopática aguda. [67] [68]