Un marcapasos cardíaco artificial , comúnmente llamado simplemente marcapasos , es un dispositivo médico implantado que genera pulsos eléctricos que se envían mediante electrodos a una o más de las cámaras del corazón . Cada pulso hace que la(s) cámara(s) objetivo se contraigan y bombeen sangre, [3] regulando así la función del sistema de conducción eléctrica del corazón .
El objetivo principal de un marcapasos es mantener una frecuencia cardíaca constante, ya sea porque el marcapasos cardíaco natural del corazón proporciona un latido cardíaco inadecuado o irregular, o porque hay un bloqueo en el sistema de conducción eléctrica del corazón. Los marcapasos modernos son programables externamente y permiten al cardiólogo seleccionar los modos de estimulación óptimos para cada paciente. La mayoría de los marcapasos son a demanda, en los que la estimulación del corazón se basa en la demanda dinámica del sistema circulatorio . Otros envían una frecuencia fija de impulsos. [4]
Un tipo específico de marcapasos, llamado desfibrilador cardioversor implantable , combina las funciones de marcapasos y desfibrilador en un único dispositivo implantable . [5] Otros, llamados marcapasos biventriculares , tienen múltiples electrodos que estimulan diferentes posiciones dentro de los ventrículos (las cámaras inferiores del corazón) para mejorar su sincronización. [6]


La estimulación percusiva, también conocida como estimulación mecánica transtorácica, consiste en golpear con el puño cerrado, generalmente en el borde inferior izquierdo del esternón sobre el ventrículo derecho en la vena cava , desde una distancia de 20 a 30 cm para inducir un latido ventricular (el British Journal of Anaesthesia sugiere que esto debe hacerse para elevar la presión ventricular a 10-15 mmHg para inducir la actividad eléctrica). Este es un procedimiento antiguo que se utilizaba únicamente como un medio para salvar vidas hasta que se le colocase un marcapasos eléctrico al paciente. [7]
La estimulación transcutánea (TCP), también llamada estimulación externa, se recomienda para la estabilización inicial de bradicardias hemodinámicamente significativas de todo tipo. El procedimiento se realiza colocando dos electrodos de estimulación en el tórax del paciente, ya sea en posición anterior/lateral o anterior/posterior. El reanimador selecciona la frecuencia de estimulación y aumenta gradualmente la corriente de estimulación (medida en mA) hasta que se logra la captura eléctrica (caracterizada por un complejo QRS ancho con una onda T alta y ancha en el ECG ), con un pulso correspondiente. El artefacto de estimulación en el ECG y las contracciones musculares graves pueden dificultar esta determinación. No se debe confiar en la estimulación externa durante un período prolongado de tiempo. Es un procedimiento de emergencia que actúa como un puente hasta que se pueda aplicar la estimulación transvenosa u otras terapias. [8]

La estimulación epicárdica temporal se utiliza durante la cirugía a corazón abierto si el procedimiento quirúrgico crea un bloqueo auriculoventricular. Los electrodos se colocan en contacto con la pared externa del ventrículo (epicardio) para mantener un gasto cardíaco satisfactorio hasta que se inserte un electrodo transvenoso temporal. [9]
La estimulación transvenosa, cuando se utiliza como estimulación temporal, es una alternativa a la estimulación transcutánea. Se coloca un cable de marcapasos en una vena, en condiciones estériles, y luego se pasa a la aurícula derecha o al ventrículo derecho. Luego, el cable de estimulación se conecta a un marcapasos externo fuera del cuerpo. La estimulación transvenosa se utiliza a menudo como un puente a la colocación de un marcapasos permanente. Se puede mantener en su lugar hasta que se implante un marcapasos permanente o hasta que ya no sea necesario un marcapasos y luego se lo retire.

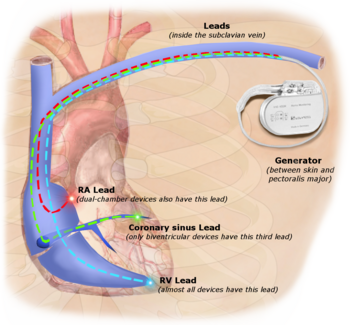
La estimulación permanente con un marcapasos implantable implica la colocación transvenosa de uno o más electrodos de estimulación dentro de una o más cámaras del corazón, mientras que el marcapasos se implanta debajo de la piel, por debajo de la clavícula. El procedimiento se realiza mediante una incisión en una vena adecuada en la que se inserta el cable del electrodo y se pasa a lo largo de la vena, a través de la válvula del corazón, hasta que se coloca en la cámara. El procedimiento se facilita mediante fluoroscopia , que permite al médico ver el paso del cable del electrodo. Una vez que se confirma que el electrodo está alojado satisfactoriamente, el extremo opuesto del cable del electrodo se conecta al generador del marcapasos.
Existen tres tipos básicos de marcapasos permanentes, clasificados según el número de cámaras involucradas y su mecanismo básico de funcionamiento: [10]
El generador de marcapasos es un dispositivo herméticamente sellado que contiene una fuente de energía, generalmente una batería de litio , un amplificador de detección que procesa la manifestación eléctrica de los latidos cardíacos naturales detectados por los electrodos cardíacos, la lógica de la computadora para el marcapasos y el circuito de salida que envía el impulso de estimulación a los electrodos.
Lo más común es que el generador se coloque debajo de la grasa subcutánea de la pared torácica, por encima de los músculos y los huesos del tórax. Sin embargo, la ubicación puede variar según el caso.
La carcasa exterior de los marcapasos está diseñada de tal manera que rara vez será rechazada por el sistema inmunológico del cuerpo . Generalmente está hecha de titanio , que es inerte en el cuerpo.
Los marcapasos sin cables son dispositivos tan pequeños como una cápsula y lo suficientemente pequeños como para permitir que el generador se coloque dentro del corazón, evitando así la necesidad de cables de estimulación. [11] Como los cables de los marcapasos pueden fallar con el tiempo, un sistema de estimulación que evite estos componentes ofrece ventajas teóricas. Los marcapasos sin cables se pueden implantar en el corazón utilizando un catéter dirigible que se introduce en la vena femoral a través de una incisión en la ingle. [11]

.jpg/440px-Boston_Scientific_Altrua_50_Dual-chamber_cardiac_pacemaker_29.01.21_JM_(2).jpg)
Los marcapasos modernos suelen tener múltiples funciones. La forma más básica controla el ritmo eléctrico nativo del corazón. Cuando el cable o "cable" del marcapasos no detecta actividad eléctrica cardíaca en la cámara (aurícula o ventrículo) en un período de tiempo normal de latido a latido (normalmente un segundo), estimulará la aurícula o el ventrículo con un pulso corto de bajo voltaje. Si detecta actividad eléctrica, suspenderá la estimulación. Esta actividad de detección y estimulación continúa latido a latido y se denomina "estimulación a demanda". En el caso de un dispositivo bicameral, cuando las cámaras superiores tienen una activación espontánea o estimulada, el dispositivo inicia una cuenta regresiva para garantizar que en un intervalo aceptable (y programable) se active el ventrículo; de lo contrario, se enviará nuevamente un impulso.
Las formas más complejas incluyen la capacidad de detectar y/o estimular las cámaras auriculares y ventriculares.
A partir de esto, el modo básico de estimulación ventricular "a demanda" es VVI o con ajuste automático de frecuencia para el ejercicio VVIR; este modo es adecuado cuando no se requiere sincronización con el latido auricular, como en la fibrilación auricular. El modo de estimulación auricular equivalente es AAI o AAIR, que es el modo de elección cuando la conducción auriculoventricular está intacta pero el nódulo sinoauricular del marcapasos natural no es confiable: enfermedad del nódulo sinusal (SND) o síndrome del seno enfermo . Cuando el problema es un bloqueo auriculoventricular (AVB), se requiere que el marcapasos detecte (detecte) el latido auricular y después de un retraso normal (0,1 a 0,2 segundos) active un latido ventricular, a menos que ya haya sucedido; este es el modo VDD y se puede lograr con un solo cable de estimulación con electrodos en la aurícula derecha (para detectar) y el ventrículo derecho (para detectar y estimular). Estos modos AAIR y VDD son inusuales en los EE. UU., pero se usan ampliamente en América Latina y Europa. [13] [14] El modo DDDR es el más utilizado ya que cubre todas las opciones, aunque los marcapasos requieren cables auriculares y ventriculares separados y son más complejos, por lo que requieren una programación cuidadosa de sus funciones para obtener resultados óptimos.
Los marcapasos automáticos están diseñados para ser reemplazados por la frecuencia cardíaca natural en cualquier momento en que vuelva a un ritmo sinusal normal no patológico y pueden reiniciarse influyendo en la actividad eléctrica del corazón cuando el evento patológico vuelva a ocurrir. [15] Un " marcapasos a demanda ventricular " produce una punta vertical estrecha en el ECG , justo antes de un QRS ancho . La punta de un " marcapasos a demanda auricular " aparece justo antes de la onda P. [16]
De manera similar, un marcapasos activado se activa inmediatamente después de que se inicia una actividad eléctrica en el tejido cardíaco. Un "marcapasos activado ventricular" produce el impulso justo después de que se crea un pulso en el tejido ventricular y aparece como un pico simultáneo con el complejo QRS. Un "marcapasos activado auricular" es el modo en el que se produce un impulso inmediatamente después de un evento eléctrico en la aurícula. Aparece como una descarga después de la onda p pero antes del complejo QRS, que generalmente está ensanchado. [17]

La terapia de resincronización cardíaca (TRC) se utiliza para personas con insuficiencia cardíaca en las que los ventrículos izquierdo y derecho no se contraen simultáneamente ( disincronía ventricular ), lo que ocurre en aproximadamente el 25-50% de los pacientes con insuficiencia cardíaca. Para lograr la TRC, se utiliza un marcapasos biventricular (BVP), que puede estimular tanto las paredes septales como las laterales del ventrículo izquierdo . Al estimular ambos lados del ventrículo izquierdo, el marcapasos puede resincronizar las contracciones ventriculares.
Los dispositivos de TRC tienen al menos dos cables, uno que pasa a través de la vena cava y la aurícula derecha hacia el ventrículo derecho para estimular el tabique , y otro que pasa a través de la vena cava y la aurícula derecha y se inserta a través del seno coronario para estimular la pared epicárdica del ventrículo izquierdo. A menudo, para pacientes en ritmo sinusal normal, también hay un cable en la aurícula derecha para facilitar la sincronía con la contracción auricular. De este modo, la sincronización entre las contracciones auricular y ventricular, así como entre las paredes septal y lateral del ventrículo izquierdo se puede ajustar para lograr una función cardíaca óptima.
Se ha demostrado que los dispositivos de TRC reducen la mortalidad y mejoran la calidad de vida en pacientes con síntomas de insuficiencia cardíaca, una fracción de eyección del VI menor o igual al 35% y una duración del complejo QRS en el ECG de 120 ms o más. [18] [19]
La estimulación biventricular sola se denomina TRC-P (por estimulación). Para pacientes seleccionados con riesgo de arritmias, la TRC se puede combinar con un desfibrilador automático implantable (DAI): estos dispositivos, conocidos como TRC-D (por desfibrilación), también brindan protección eficaz contra arritmias potencialmente mortales. [20]
La colocación convencional de los cables ventriculares en la punta o el ápex del ventrículo derecho o alrededor de ellos , o la estimulación apical del ventrículo derecho, puede tener efectos negativos en la función cardíaca. Se ha asociado con un mayor riesgo de fibrilación auricular , insuficiencia cardíaca , debilitamiento del músculo cardíaco y una esperanza de vida potencialmente más corta. La estimulación del haz de His (HBP) conduce a una activación ventricular más natural o perfectamente natural y ha generado un fuerte interés clínico y de investigación. Al estimular la red de fibras de His-Purkinje directamente con un cable especial y una técnica de colocación, la HBP provoca una activación ventricular sincronizada y, por lo tanto, más efectiva y evita la enfermedad del músculo cardíaco a largo plazo. En algunos casos, la HBP también puede corregir los patrones de bloqueo de rama del haz de His . [21] [22]

Un gran avance en la función del marcapasos ha sido intentar imitar a la naturaleza utilizando varias entradas para producir un marcapasos que responda a la frecuencia utilizando parámetros como el intervalo QT , pO 2 – pCO 2 ( niveles de oxígeno disuelto o dióxido de carbono ) en el sistema arterial-venoso, actividad física determinada por un acelerómetro , temperatura corporal , niveles de ATP , adrenalina , etc. En lugar de producir una frecuencia cardíaca estática predeterminada o un control intermitente, un marcapasos de este tipo, un "marcapasos dinámico", podría compensar tanto la carga respiratoria real como la carga respiratoria potencialmente anticipada. El primer marcapasos dinámico fue inventado por Anthony Rickards del National Heart Hospital , Londres, Reino Unido, en 1982. [23]
La tecnología de marcapasos dinámicos también podría aplicarse a futuros corazones artificiales . Los avances en la soldadura de tejidos transicionales respaldarían este y otros esfuerzos de reemplazo de órganos, articulaciones y tejidos artificiales. Las células madre pueden ser de interés en la soldadura de tejidos transicionales. [ cita requerida ]
Se han realizado muchos avances para mejorar el control del marcapasos una vez implantado. Muchos de ellos han sido posibles gracias a la transición a los marcapasos controlados por microprocesador . Los marcapasos que controlan no sólo los ventrículos sino también las aurículas se han vuelto comunes. Los marcapasos que controlan tanto las aurículas como los ventrículos se denominan marcapasos bicamerales. Aunque estos modelos bicamerales suelen ser más caros, programar las contracciones de las aurículas para que precedan a las de los ventrículos mejora la eficiencia de bombeo del corazón y puede ser útil en la insuficiencia cardíaca congestiva.
La estimulación sensible a la frecuencia permite que el dispositivo detecte la actividad física del paciente y responda adecuadamente aumentando o disminuyendo la frecuencia de estimulación base a través de algoritmos de respuesta a la frecuencia.
Los ensayos DAVID [24] han demostrado que la estimulación innecesaria del ventrículo derecho puede exacerbar la insuficiencia cardíaca y aumentar la incidencia de fibrilación auricular. Los dispositivos bicamerales más nuevos pueden mantener la cantidad de estimulación del ventrículo derecho al mínimo y, de este modo, evitar el empeoramiento de la enfermedad cardíaca.
Un marcapasos puede implantarse mientras una persona está despierta usando anestesia local para adormecer la piel con o sin sedación , o dormida usando una anestesia general . [25] Generalmente se administra un antibiótico para reducir el riesgo de infección. [25] Los marcapasos generalmente se implantan en la parte delantera del pecho en la región del hombro izquierdo o derecho. La piel se prepara recortando o afeitando el pelo sobre el sitio del implante antes de limpiar la piel con un desinfectante como la clorhexidina . Se hace una incisión debajo de la clavícula y se crea un espacio o bolsillo debajo de la piel para albergar el generador del marcapasos. Este bolsillo generalmente se crea justo encima del músculo pectoral mayor (prepectoral), pero en algunos casos el dispositivo puede insertarse debajo del músculo (submuscular). [26] El cable o los cables se introducen en el corazón a través de una vena grande guiada por imágenes de rayos X ( fluoroscopia ). Las puntas de los cables pueden colocarse dentro del ventrículo derecho , la aurícula derecha o el seno coronario, según el tipo de marcapasos necesario. [25] La cirugía suele completarse en un plazo de 30 a 90 minutos. Después de la implantación, la herida quirúrgica debe mantenerse limpia y seca hasta que haya cicatrizado. Algunos movimientos del hombro en las semanas posteriores a la inserción conllevan el riesgo de que se desprendan los cables del marcapasos. [25]
Las baterías de un generador de marcapasos suelen durar entre 5 y 10 años. Cuando las baterías se acercan al final de su vida útil, se reemplaza el generador mediante un procedimiento que suele ser más sencillo que un implante nuevo. El reemplazo implica realizar una incisión para retirar el dispositivo existente, desconectar los cables del dispositivo antiguo y volver a conectarlos a un nuevo generador, volver a insertar el nuevo dispositivo y cerrar la piel. [25]

Una vez implantado el marcapasos, se lo revisa periódicamente para garantizar que el dispositivo esté operativo y funcione adecuadamente; el dispositivo puede revisarse con la frecuencia que se considere necesaria. Las revisiones de rutina del marcapasos generalmente se realizan en el consultorio cada seis meses, aunque varían según el estado del paciente/dispositivo y la disponibilidad de monitoreo remoto. Los modelos de marcapasos más nuevos también pueden interrogarse de forma remota, y el paciente transmite los datos de su marcapasos mediante un transmisor en el hogar conectado a una red de telefonía celular.
Durante el seguimiento en el consultorio, las pruebas de diagnóstico pueden incluir:
El estilo de vida del paciente no suele modificarse en gran medida tras la inserción de un marcapasos. Hay algunas actividades que no son recomendables, como los deportes de contacto y la exposición del marcapasos a campos magnéticos intensos.
El paciente con marcapasos puede notar que es necesario modificar algunos tipos de acciones cotidianas. Por ejemplo, el arnés de hombro del cinturón de seguridad de un vehículo puede resultar incómodo si cae sobre el lugar de inserción del marcapasos. Las mujeres no podrán usar sujetadores durante un tiempo después de la operación y, más adelante, es posible que tengan que usar sujetadores con tirantes anchos.
Para algunos deportes y actividades físicas, se puede usar una protección especial para marcapasos para evitar posibles lesiones o daños en los cables del marcapasos.
Los marcapasos pueden verse afectados por campos magnéticos o electromagnéticos y radiación ionizante y acústica . Sin embargo, un estudio de 2013 encontró que "El riesgo general de eventos adversos clínicamente significativos relacionados con EMI (interferencia electromagnética) en receptores de CIED (dispositivos electrónicos implantables cardiovasculares) es muy bajo. Por lo tanto, no se necesitan precauciones especiales cuando se utilizan electrodomésticos. Las fuentes ambientales e industriales de EMI son relativamente seguras cuando el tiempo de exposición es limitado y la distancia de los CIED se maximiza. El riesgo de eventos inducidos por EMI es más alto dentro del entorno hospitalario". [27] El estudio enumera y tabula muchas fuentes de interferencia y muchos efectos potenciales diferentes: daño a los circuitos, estimulación asincrónica, etc. Algunas fuentes de peligro en dispositivos más antiguos se han eliminado en los más nuevos.
Se deben evitar las actividades que impliquen campos magnéticos fuertes . Esto incluye actividades como la soldadura por arco con ciertos tipos de equipos [28] y el mantenimiento de equipos pesados que puedan generar campos magnéticos fuertes. Algunos procedimientos médicos, en particular la resonancia magnética (RM), implican campos magnéticos muy fuertes u otras condiciones que pueden dañar los marcapasos.
Sin embargo, muchos marcapasos modernos están especificados para ser compatibles con RM o RMN , y su uso durante la RMN está sujeto a ciertas condiciones. [29] El primero en ser especificado de esta manera fue el Medtronic Revo MRI SureScan, aprobado por la FDA de EE. UU. en febrero de 2011, [30] que fue el primero en ser especificado como compatible con RM. [31] [32] Existen varias condiciones para el uso de marcapasos compatibles con RM, incluidas ciertas calificaciones de los pacientes y configuraciones de escaneo. Un dispositivo compatible con RMN debe tener configuraciones de RMN habilitadas antes de un escaneo y deshabilitadas después. [33]
A partir de 2014, [actualizar]los cinco fabricantes de dispositivos de estimulación cardíaca más utilizados (que cubren más del 99 % del mercado estadounidense) fabricaron marcapasos condicionales para RM aprobados por la FDA. [34] El uso de RM puede descartarse si el paciente tiene un marcapasos más antiguo, no condicional para RM, o si tiene cables de estimulación antiguos dentro del corazón, que ya no están conectados a un marcapasos.
Un estudio realizado en Estados Unidos en 2008 descubrió [35] que el campo magnético creado por algunos auriculares utilizados con reproductores de música portátiles o teléfonos móviles puede causar interferencias si se colocan muy cerca de algunos marcapasos.
Además, según la Asociación Estadounidense del Corazón , algunos dispositivos domésticos tienen el potencial de inhibir ocasionalmente un solo latido. Los teléfonos celulares no parecen dañar los generadores de pulso ni afectar el funcionamiento del marcapasos. [36] Se recomienda que los objetos que contengan imanes o que generen un campo magnético significativo no se encuentren cerca de un marcapasos. Las cocinas de inducción, en particular, pueden representar un riesgo. [37]
Antes de cualquier procedimiento médico, el paciente debe informar a todo el personal médico que tiene un marcapasos. El hecho de tener un marcapasos no implica que el paciente deba recibir antibióticos antes de cualquier procedimiento, como un trabajo dental. [38]
Un panel de la Heart Rhythm Society , una organización estadounidense especializada con sede en Washington, DC, consideró que era legal y ético respetar las solicitudes de los pacientes, o de aquellos con autoridad legal para tomar decisiones por los pacientes, para desactivar los dispositivos cardíacos implantados. Los abogados dicen que la situación legal es similar a la de retirar una sonda de alimentación, aunque hasta 2010 [actualizar]no había ningún precedente legal relacionado con los marcapasos en los Estados Unidos. En muchas jurisdicciones (incluidos los EE. UU.) se considera que un paciente tiene derecho a rechazar o interrumpir el tratamiento, incluido un marcapasos que lo mantiene con vida. Los médicos tienen derecho a negarse a apagarlo, pero el panel de la HRS les recomienda que deben derivar al paciente a un médico que lo haga. [39] [40] Algunos pacientes consideran que las condiciones desesperanzadoras y debilitantes, como los accidentes cerebrovasculares graves o la demencia en etapa avanzada, pueden causar tanto sufrimiento que preferirían no prolongar sus vidas con medidas de apoyo. [41]
Se han planteado preocupaciones sobre la seguridad y la privacidad en relación con los marcapasos que permiten la comunicación inalámbrica. Terceros no autorizados pueden leer los registros de pacientes contenidos en el marcapasos o reprogramar los dispositivos, como ha demostrado un equipo de investigadores. [42] La demostración funcionó a corta distancia; no intentaron desarrollar una antena de largo alcance. El exploit de prueba de concepto ayuda a demostrar la necesidad de mejores medidas de seguridad y alerta al paciente en implantes médicos accesibles de forma remota. [42] En respuesta a esta amenaza, los investigadores de la Universidad de Purdue y la Universidad de Princeton han desarrollado un prototipo de dispositivo cortafuegos, llamado MedMon, que está diseñado para proteger a los dispositivos médicos inalámbricos, como marcapasos y bombas de insulina, de los atacantes. [43]
Las complicaciones de la cirugía para implantar un marcapasos son poco frecuentes (cada una de ellas afecta aproximadamente al 1-3 %), pero pueden incluir: infección en el lugar donde se implanta el marcapasos o en el torrente sanguíneo; reacción alérgica al tinte o la anestesia utilizada durante el procedimiento; hinchazón, hematomas o sangrado en el sitio del generador o alrededor del corazón, especialmente si el paciente está tomando anticoagulantes , es anciano, de complexión delgada o si usa esteroides de forma crónica . [45]
Una posible complicación de los marcapasos artificiales bicamerales es la «taquicardia mediada por marcapasos» (TMP), una forma de taquicardia reentrante. En la TMP, el marcapasos artificial forma la rama anterógrada (de aurícula a ventrículo) del circuito y el nódulo auriculoventricular (AV) forma la rama retrógrada (de ventrículo a aurícula) del circuito. [46] El tratamiento de la TMP normalmente implica la reprogramación del marcapasos. [46]
Otra posible complicación es la "taquicardia rastreada por marcapasos", en la que una taquicardia supraventricular, como una fibrilación auricular o un aleteo auricular, es rastreada por el marcapasos y produce latidos desde un cable ventricular. [47] Esto se está volviendo extremadamente raro ya que los dispositivos más nuevos a menudo están programados para reconocer taquicardias supraventriculares y cambiar a modos sin seguimiento. [48]
Es importante considerar los electrodos como un posible nido de eventos tromboembólicos . Los electrodos son cables de pequeño diámetro que van desde el marcapasos hasta el sitio de implantación en el músculo cardíaco y generalmente se colocan por vía intravenosa a través de la vena subclavia para acceder a la aurícula derecha. La colocación de un objeto extraño dentro del sistema venoso de esa manera puede interrumpir el flujo sanguíneo y permitir la formación de trombos. Por lo tanto, es posible que los pacientes con marcapasos deban recibir terapia anticoagulante para evitar una posible trombosis o émbolo potencialmente mortal. [49] [50]
Estos cables también pueden dañar las valvas de la válvula tricúspide , ya sea durante su colocación o por el desgaste con el tiempo. Esto puede provocar insuficiencia tricúspide e insuficiencia cardíaca derecha , que puede requerir el reemplazo de la válvula tricúspide . [51]
En ocasiones será necesario retirar los cables. La razón más común para la extracción de cables es la infección; sin embargo, con el tiempo, los cables pueden degradarse debido a una serie de razones, como la flexión del cable. [52] Los cambios en la programación del marcapasos pueden superar la degradación del cable hasta cierto punto. Sin embargo, un paciente que haya tenido varios reemplazos de marcapasos en una década o dos en los que se reutilizaron los cables puede requerir una cirugía de reemplazo de cables.
El reemplazo de los cables se puede realizar de dos maneras: insertando un nuevo conjunto de cables sin quitar los cables actuales (no se recomienda ya que esto genera una obstrucción adicional al flujo sanguíneo y al funcionamiento de la válvula cardíaca) o retirando los cables actuales y luego insertando los de reemplazo. La técnica de extracción de los cables variará según la estimación del cirujano de la probabilidad de que una simple tracción sea suficiente para procedimientos más complejos. Normalmente, los cables se pueden desconectar del marcapasos fácilmente, por lo que el reemplazo del dispositivo generalmente implica una cirugía simple para acceder al dispositivo y reemplazarlo simplemente desenganchando los cables del dispositivo a reemplazar y conectando los cables al nuevo dispositivo. Las posibles complicaciones, como la perforación de la pared cardíaca, surgen de la extracción de los cables del cuerpo del paciente.
El extremo libre de un cable de marcapasos se implanta en el músculo cardíaco con un tornillo en miniatura o se ancla con pequeños ganchos de plástico llamados púas. Cuanto más tiempo hayan estado implantados los cables (a partir de un año o dos), más probable es que tengan conexiones adicionales al cuerpo del paciente en varios lugares de la vía desde el dispositivo hasta el músculo cardíaco, ya que el cuerpo tiende a incorporar dispositivos extraños en el tejido. En algunos casos, en el caso de un cable que ha estado insertado durante un corto período de tiempo, la extracción puede implicar una simple tracción para sacarlo del cuerpo. En otros casos, la extracción se realiza normalmente con un láser o un dispositivo de corte que se enrosca como una cánula con un borde cortante sobre el cable y se mueve a lo largo del cable para eliminar cualquier conexión orgánica con pequeños láseres de corte o un dispositivo similar. [53] [54]
En la literatura se ha descrito la mala posición del cable del marcapasos en diversas localizaciones. El tratamiento varía según la ubicación del cable del marcapasos y los síntomas. [55]
Otra posible complicación llamada síndrome de Twiddler ocurre cuando un paciente manipula el marcapasos y hace que los cables se retiren de su ubicación prevista, provocando una posible estimulación de otros nervios.
La expectativa de vida general con marcapasos es excelente y depende principalmente de las enfermedades subyacentes, la presencia de fibrilación auricular, la edad y el sexo en el momento de la primera implantación. [56]
A veces se implantan dispositivos parecidos a marcapasos, llamados desfibriladores automáticos implantables (DAI). Estos dispositivos se utilizan a menudo en el tratamiento de pacientes con riesgo de muerte súbita cardíaca. Un desfibrilador automático implantable tiene la capacidad de tratar muchos tipos de alteraciones del ritmo cardíaco mediante estimulación, cardioversión o desfibrilación . Algunos dispositivos de desfibrilador automático implantable pueden distinguir entre fibrilación ventricular y taquicardia ventricular (TV), y pueden intentar estimular el corazón más rápido que su frecuencia intrínseca en el caso de TV, para tratar de romper la taquicardia antes de que progrese a fibrilación ventricular. Esto se conoce como estimulación rápida , estimulación con sobremarcha o estimulación antitaquicardia (ATP). La ATP solo es eficaz si el ritmo subyacente es una taquicardia ventricular, y nunca es eficaz si el ritmo es una fibrilación ventricular.

En 1889, John Alexander MacWilliam informó en el British Medical Journal (BMJ) sobre sus experimentos en los que la aplicación de un impulso eléctrico al corazón humano en asistolia causó una contracción ventricular y que un ritmo cardíaco de 60-70 latidos por minuto podía ser evocado por impulsos aplicados con espaciamientos iguales a 60-70/minuto. [58]
En 1926, Mark C. Lidwill , del Royal Prince Alfred Hospital de Sydney, con el apoyo del físico Edgar H. Booth de la Universidad de Sydney , ideó un aparato portátil que "se enchufaba a un punto de luz" y en el que "un polo se aplicaba a una almohadilla cutánea empapada en una solución salina fuerte", mientras que el otro polo "consistía en una aguja aislada excepto en su punta, y se sumergía en la cámara cardíaca apropiada". "La frecuencia del marcapasos variaba de aproximadamente 80 a 120 pulsos por minuto, y del mismo modo el voltaje variaba de 1,5 a 120 voltios". [59] En 1928, el aparato se utilizó para reanimar a un bebé nacido muerto en el Crown Street Women's Hospital de Sydney, cuyo corazón seguía "latiendo por sí solo", "al final de 10 minutos" de estimulación. [60] [61]
En 1932, el fisiólogo estadounidense Albert Hyman , con la ayuda de su hermano, describió un instrumento electromecánico de su propia creación, accionado por un motor accionado manualmente con un resorte. El propio Hyman se refirió a su invento como un "marcapasos artificial", término que sigue utilizándose hasta el día de hoy. [62] [63]
Una aparente pausa en la publicación de las investigaciones realizadas entre principios de los años 1930 y la Segunda Guerra Mundial puede atribuirse a la percepción pública de que se interfería con la naturaleza al "revivir a los muertos". [64] Por ejemplo, "Hyman no publicó datos sobre el uso de su marcapasos en humanos debido a la publicidad adversa, tanto entre sus colegas médicos como debido a los artículos de los periódicos de la época. Es posible que Lidwell fuera consciente de esto y no prosiguiera con sus experimentos en humanos". [61]
En 1950, el ingeniero eléctrico canadiense John Hopps diseñó y construyó el primer marcapasos externo basándose en las observaciones de los cirujanos cardiotorácicos Wilfred Gordon Bigelow y John Callaghan en el Hospital General de Toronto . [65] El dispositivo se probó por primera vez en un perro en el Instituto Banting de la Universidad de Toronto . [66] Un dispositivo externo sustancial que utiliza tecnología de tubo de vacío para proporcionar estimulación transcutánea , era algo rudimentario y doloroso para el paciente en su uso y, al estar alimentado por un enchufe de pared de CA, conllevaba un riesgo potencial de electrocución del paciente e inducción de fibrilación ventricular . [67]
Varios innovadores, entre ellos Paul Zoll , fabricaron a partir de 1952 dispositivos de estimulación transcutánea más pequeños, pero aún voluminosos, utilizando una gran batería recargable como fuente de energía. [68]
En 1957, William L. Weirich publicó los resultados de una investigación realizada en la Universidad de Minnesota . Estos estudios demostraron la restauración de la frecuencia cardíaca, el gasto cardíaco y las presiones aórticas medias en sujetos animales con bloqueo cardíaco completo mediante el uso de un electrodo miocárdico . [69]
En 1958, el médico colombiano Alberto Vejarano Laverde y el ingeniero eléctrico colombiano Jorge Reynolds Pombo construyeron un marcapasos externo, similar a los de Hopps y Zoll, que pesaba 45 kg y funcionaba con una batería de plomo-ácido de 12 voltios de automóvil , pero conectada a electrodos adheridos al corazón. Este aparato se utilizó con éxito para sostener a un sacerdote de 70 años, Gerardo Florez. [70]
El desarrollo del transistor de silicio y su primera disponibilidad comercial en 1956 fue el acontecimiento fundamental que condujo al rápido desarrollo del marcapasos cardíaco práctico. [71]
En 1958, el ingeniero Earl Bakken de Minneapolis, Minnesota, fabricó el primer marcapasos externo portátil para un paciente de C. Walton Lillehei . Este marcapasos transistorizado, alojado en una pequeña caja de plástico, tenía controles que permitían ajustar la frecuencia cardíaca y el voltaje de salida y estaba conectado a cables de electrodos que pasaban a través de la piel del paciente para terminar en electrodos adheridos a la superficie del miocardio del corazón.
En el Reino Unido, en los años 60, el Sr. Abrams, del Hospital Queen Elizabeth, encargó a Lucas Engineering, de Birmingham, que produjera un prototipo de un producto electromecánico que fuera reemplazado por un transistor. El equipo estaba dirigido por Roger Nolan, ingeniero del Centro de Investigación del Grupo Lucas. Nolan diseñó y creó el primer marcapasos con oscilador de bloqueo y alimentado por transistores. Este marcapasos se llevaba en un cinturón y funcionaba con una batería sellada recargable, lo que permitía a los usuarios llevar una vida más normal.
Una de las primeras pacientes que recibió este marcapasos Lucas fue una mujer de unos 30 años. La operación fue realizada en 1964 por el cirujano cardíaco sudafricano Alf Gunning, [72] [73] alumno de Christiaan Barnard . Esta operación pionera se llevó a cabo bajo la dirección del consultor cardíaco Peter Sleight en el Radcliffe Infirmary de Oxford y su equipo de investigación cardíaca en el St George's Hospital de Londres. [74] [75]
El primer implante clínico en un ser humano de un marcapasos totalmente implantable se realizó el 8 de octubre de 1958, [76] en el Instituto Karolinska en Solna, Suecia , utilizando un marcapasos diseñado por el inventor Rune Elmqvist y el cirujano Åke Senning (en colaboración con Elema-Schönander AB, posteriormente Siemens-Elema AB), conectado a electrodos adheridos al miocardio del corazón mediante toracotomía . El dispositivo falló después de tres horas. Luego se implantó un segundo dispositivo que duró dos días. El primer paciente con marcapasos implantable del mundo, Arne Larsson , recibió 26 marcapasos diferentes durante su vida. Murió en 2001, a la edad de 86 años, sobreviviendo al inventor y al cirujano. [77]
En 1959, Seymour Furman y John Schwedel demostraron por primera vez la estimulación transvenosa temporal, mediante la cual el electrodo del catéter se insertaba a través de la vena basílica del paciente . [78]
En febrero de 1960, una versión mejorada del diseño sueco de Elmqvist fue implantada por los doctores Orestes Fiandra y Roberto Rubio en el Hospital Casmu 1 de Montevideo , Uruguay. Este marcapasos, el primero implantado en América, duró hasta que el paciente murió por otras dolencias, nueve meses después. Los primeros dispositivos de diseño sueco utilizaban baterías recargadas por una bobina de inducción desde el exterior.
Los marcapasos implantables construidos por el ingeniero Wilson Greatbatch comenzaron a utilizarse en humanos a partir de abril de 1960, tras extensas pruebas con animales . La innovación de Greatbatch se diferenciaba de los dispositivos suecos anteriores en que utilizaba células primarias (una batería de mercurio ) como fuente de energía. El primer paciente vivió otros 18 meses.
El primer uso de la estimulación transvenosa junto con un marcapasos implantado fue realizado por Parsonnet en los Estados Unidos, [79] [80] [81] Lagergren en Suecia [82] [83] y Jean-Jacques Welti en Francia [84] en 1962-63. El procedimiento transvenoso, o pervenoso, implicaba la incisión de una vena en la que se insertaba el electrodo del catéter bajo guía fluoroscópica , hasta que se alojaba dentro de las trabéculas del ventrículo derecho. Este se convirtió en el método de elección a mediados de la década de 1960.
El cirujano cardiotorácico Leon Abrams y el ingeniero médico Ray Lightwood desarrollaron e implantaron el primer marcapasos cardíaco de frecuencia variable controlado por el paciente en 1960 en la Universidad de Birmingham . El primer implante se realizó en marzo de 1960, y dos implantes más al mes siguiente. Estos tres pacientes se recuperaron bien y recuperaron una alta calidad de vida. En 1966, 56 pacientes se habían sometido a la implantación y uno de ellos sobrevivió más de 5 años .+1 ⁄ 2 años. [85] [86]

Todos los dispositivos implantables anteriores adolecían de la falta de fiabilidad y la corta vida útil de la tecnología de celdas primarias disponible, principalmente la batería de mercurio . A finales de la década de 1960, varias empresas, incluida ARCO en los EE. UU., desarrollaron marcapasos alimentados con isótopos , pero este desarrollo fue superado por el desarrollo en 1971 de la celda de yoduro de litio por Wilson Greatbatch . [88] Las celdas de yoduro de litio o de ánodo de litio se convirtieron en el estándar para los diseños de marcapasos.
Otro impedimento para la fiabilidad de los primeros dispositivos era la difusión del vapor de agua de los fluidos corporales a través de la encapsulación de resina epoxi , lo que afectaba a los circuitos electrónicos. Este fenómeno se superó encerrando el generador del marcapasos en una caja metálica herméticamente sellada, inicialmente por Telectronics de Australia en 1969, seguida por Cardiac Pacemakers, Inc. de St. Paul, Minnesota en 1972. Esta tecnología, que utiliza titanio como metal de encapsulación, se convirtió en el estándar a mediados de la década de 1970.
El 9 de julio de 1974, Manuel A. Villafaña y Anthony Adducci , fundadores de Cardiac Pacemakers, Inc. ( Guidant ), fabricaron el primer marcapasos del mundo con un ánodo de litio y una batería de estado sólido con electrolito de yoduro de litio. Las células de yoduro de litio o ánodo de litio aumentaron la vida útil de los marcapasos de un año a once años, y se han convertido en el estándar para los diseños de marcapasos. Comenzaron a diseñar y probar su marcapasos cardíaco implantable alimentado por una nueva batería de litio de mayor duración en 1971. El primer paciente en recibir un marcapasos CPI salió de la cirugía en junio de 1973. [87] [89]
A Liza Morton le implantaron un marcapasos cuando tenía 11 días en 1978, en el hospital Yorkhill de Glasgow, Escocia. En ese momento era la bebé más pequeña [90] [91]
En 2013, varias empresas anunciaron dispositivos que podrían insertarse a través de un catéter en la pierna en lugar de una cirugía invasiva. Los dispositivos tienen aproximadamente el tamaño y la forma de una píldora, mucho más pequeños que el tamaño de un marcapasos tradicional. Una vez implantados, las puntas del dispositivo entran en contacto con el músculo y estabilizan los latidos del corazón. El desarrollo de este tipo de dispositivo continuaba. [92] En noviembre de 2014, Bill Pike de Fairbanks, Alaska , recibió un marcapasos Medtronic Micra en el Providence St Vincent Hospital en Portland, Oregon . D. Randolph Jones fue el médico de EP. También en 2014, St. Jude Medical Inc. anunció las primeras inscripciones en el Estudio de observación de marcapasos sin cables de la compañía que evalúa la tecnología de marcapasos sin cables Nanostim. El marcapasos Nanostim recibió la marca CE europea en 2013. Los ensayos de implantes posteriores a la aprobación se llevaron a cabo en Europa. [93] El estudio europeo se detuvo después de los informes de seis perforaciones que llevaron a la muerte de dos pacientes. Después de las investigaciones, St Jude Medical reinició el estudio. [94] En los Estados Unidos, esta terapia no había sido aprobada por la FDA hasta 2014. [actualizar][ 95] Si bien el St Jude Nanostim y el Medtronic Micra son marcapasos de una sola cámara, se anticipó que la estimulación bicameral sin cables para pacientes con bloqueo auriculoventricular sería posible con un mayor desarrollo. [96]
Cada año, en todo el mundo, en un procedimiento simple para evitar explosiones, miles de marcapasos son retirados de los cuerpos para ser incinerados. Los marcapasos con una vida útil de batería restante significativa son dispositivos que potencialmente salvan vidas para las personas en países de ingresos bajos y medios (LMIC). [97] El Instituto de Medicina , una organización no gubernamental estadounidense , ha informado que el acceso inadecuado a tecnologías cardiovasculares avanzadas es un contribuyente importante a la morbilidad y mortalidad por enfermedades cardiovasculares en los LMIC. Desde la década de 1970, múltiples estudios en todo el mundo han informado sobre la seguridad y eficacia de la reutilización de marcapasos. A partir de 2016 [actualizar], no se habían desarrollado estándares ampliamente aceptables para la reutilización segura de marcapasos y DCI, y seguían existiendo barreras legales y regulatorias para la adopción generalizada de la reutilización de dispositivos médicos. [98]
Fabricantes actuales y anteriores de marcapasos implantables
{{cite web}}: CS1 maint: URL no apta ( enlace )