Los respiraderos hidrotermales son fisuras en el fondo marino desde donde se descarga agua calentada geotermalmente . Se encuentran comúnmente cerca de lugares volcánicamente activos, áreas donde las placas tectónicas se están separando en las dorsales oceánicas , cuencas oceánicas y puntos calientes . [1] La dispersión de fluidos hidrotermales en todo el océano global en sitios de ventilación activa crea columnas hidrotermales. Los depósitos hidrotermales son rocas y depósitos de minerales formados por la acción de los respiraderos hidrotermales.
Los respiraderos hidrotermales existen porque la Tierra es geológicamente activa y tiene grandes cantidades de agua en su superficie y dentro de su corteza. Bajo el mar, pueden formar características llamadas fumaderos negros o fumaderos blancos, que entregan una amplia gama de elementos a los océanos del mundo, contribuyendo así a la biogeoquímica marina global . En relación con la mayoría de las profundidades marinas, las áreas alrededor de los respiraderos hidrotermales son biológicamente más productivas, y a menudo albergan comunidades complejas alimentadas por los químicos disueltos en los fluidos de los respiraderos. Las bacterias quimiosintéticas y las arqueas que se encuentran alrededor de los respiraderos hidrotermales forman la base de la cadena alimentaria , sustentando diversos organismos, incluidos gusanos tubícolas gigantes , almejas, lapas y camarones. Se cree que existen respiraderos hidrotermales activos en la luna Europa de Júpiter y en la luna Encélado de Saturno , [2] [3] y se especula que alguna vez existieron respiraderos hidrotermales antiguos en Marte . [1] [4]
Se ha planteado la hipótesis de que las fuentes hidrotermales fueron un factor importante para el inicio de la abiogénesis y la supervivencia de la vida primitiva . Se ha demostrado que las condiciones de estas fuentes favorecen la síntesis de moléculas importantes para la vida. Algunas pruebas sugieren que ciertas fuentes, como las fuentes hidrotermales alcalinas o las que contienen CO2 supercrítico , son más propicias para la formación de estas moléculas orgánicas . Sin embargo, el origen de la vida es un tema ampliamente debatido y existen muchos puntos de vista contradictorios.
Los respiraderos hidrotermales en las profundidades oceánicas suelen formarse a lo largo de las dorsales oceánicas , como la dorsal del Pacífico oriental y la dorsal mesoatlántica . Se trata de lugares en los que dos placas tectónicas divergen y se forma nueva corteza. [5]
El agua que sale de los respiraderos hidrotermales del fondo marino consiste principalmente en agua de mar extraída hacia el sistema hidrotermal cerca del edificio volcánico a través de fallas y sedimentos porosos o estratos volcánicos, más algo de agua magmática liberada por el magma ascendente . [1] En los sistemas hidrotermales terrestres [ aclaración necesaria ] , la mayoría del agua que circula dentro de los sistemas de fumarolas y géiseres es agua meteórica más agua subterránea que se ha filtrado hacia el sistema termal desde la superficie, pero también contiene comúnmente alguna porción de agua metamórfica , agua magmática y salmuera sedimentaria formativa que es liberada por el magma. La proporción de cada uno varía de un lugar a otro. [ cita requerida ]
En contraste con la temperatura ambiente del agua de aproximadamente 2 °C (36 °F) a estas profundidades, el agua emerge de estos respiraderos a temperaturas que van desde 60 °C (140 °F) [6] hasta 464 °C (867 °F). [7] [8] Debido a la alta presión hidrostática a estas profundidades, el agua puede existir en su forma líquida o como un fluido supercrítico a tales temperaturas. [5] El punto crítico del agua (pura) es 375 °C (707 °F) a una presión de 218 atmósferas .
Sin embargo, la introducción de salinidad en el fluido eleva el punto crítico a temperaturas y presiones más altas. El punto crítico del agua de mar (3,2 % en peso de NaCl) es de 407 °C (765 °F) y 298,5 bares, [9] correspondiente a una profundidad de ~2960 m (9710 pies) por debajo del nivel del mar. En consecuencia, si un fluido hidrotermal con una salinidad de 3,2 % en peso de NaCl se ventila por encima de 407 °C (765 °F) y 298,5 bares, es supercrítico. Además, se ha demostrado que la salinidad de los fluidos de ventilación varía ampliamente debido a la separación de fases en la corteza. [10] El punto crítico para fluidos de menor salinidad se encuentra en condiciones de temperatura y presión más bajas que las del agua de mar, pero más altas que las del agua pura. Por ejemplo, un fluido de ventilación con un 2,24 % en peso de NaCl se ventila por encima de 407 °C (765 °F) y 298,5 bares, es supercrítico. La salinidad del NaCl al 100 % alcanza su punto crítico a 400 °C (752 °F) y 280,5 bares. Por lo tanto, el agua que emerge de las partes más calientes de algunas fuentes hidrotermales puede ser un fluido supercrítico , que posee propiedades físicas entre las de un gas y las de un líquido . [7] [8]
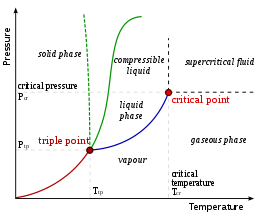
Se encuentran ejemplos de ventilación supercrítica en varios sitios. Sister Peak (campo hidrotermal Comfortless Cove, 4°48′S 12°22′O / 4.800, -12.367 , profundidad 2996 m o 9829 pies) ventila fluidos de tipo vapor separados en fases de baja salinidad . No se encontró que la ventilación sostenida fuera supercrítica, pero una breve inyección de 464 °C (867 °F) estuvo muy por encima de las condiciones supercríticas. Se encontró que un sitio cercano, Turtle Pits, ventilaba fluido de baja salinidad a 407 °C (765 °F), que está por encima del punto crítico del fluido a esa salinidad. Un sitio de ventilación en la fosa de las Caimán llamado Beebe , que es el sitio hidrotermal más profundo conocido del mundo a ~5000 m (16 000 pies) por debajo del nivel del mar, ha mostrado ventilación supercrítica sostenida a 401 °C (754 °F) y 2,3 % en peso de NaCl. [11]
Aunque se han observado condiciones supercríticas en varios sitios, aún no se sabe qué importancia, si la hay, tiene la ventilación supercrítica en términos de circulación hidrotermal, formación de depósitos minerales, flujos geoquímicos o actividad biológica. [ cita requerida ]
Las etapas iniciales de la formación de una chimenea de ventilación comienzan con la deposición del mineral anhidrita . Luego, los sulfuros de cobre , hierro y zinc se precipitan en los huecos de la chimenea, lo que la hace menos porosa con el transcurso del tiempo. Se han registrado crecimientos de ventilación del orden de 30 cm (1 pie) por día. [12] Una exploración de abril de 2007 de las chimeneas de aguas profundas frente a la costa de Fiji descubrió que esas chimeneas eran una fuente importante de hierro disuelto (véase ciclo del hierro ). [13]

Algunas chimeneas hidrotermales forman estructuras de forma aproximadamente cilíndrica. Estas se forman a partir de minerales que se disuelven en el fluido de la chimenea. Cuando el agua sobrecalentada entra en contacto con el agua del mar casi congelada, los minerales se precipitan y forman partículas que aumentan la altura de las chimeneas. Algunas de estas chimeneas pueden alcanzar alturas de 60 m (200 pies). [14] Un ejemplo de una chimenea tan imponente fue "Godzilla", una estructura en el fondo marino profundo del Océano Pacífico cerca de Oregón que se elevó hasta 40 m (130 pies) antes de derrumbarse en 1996. [15]

Una fumarola negra o ventilación de aguas profundas es un tipo de ventilación hidrotermal que se encuentra en el lecho marino , típicamente en la zona batial (con mayor frecuencia en profundidades de 2500 a 3000 m (8200 a 9800 pies)), pero también en profundidades menores, así como más profundamente en la zona abisal . [1] Aparecen como estructuras negras, similares a chimeneas, que emiten una nube de material negro. Las fumadoras negras generalmente emiten partículas con altos niveles de minerales que contienen azufre, o sulfuros. Las fumadoras negras se forman en campos de cientos de metros de ancho cuando el agua sobrecalentada de debajo de la corteza terrestre atraviesa el fondo del océano (el agua puede alcanzar temperaturas superiores a 400 °C (752 °F)). [1] Esta agua es rica en minerales disueltos de la corteza, más notablemente sulfuros . Cuando entra en contacto con el agua fría del océano, muchos minerales precipitan, formando una estructura negra similar a una chimenea alrededor de cada ventilación. Los sulfuros metálicos depositados pueden convertirse con el tiempo en enormes depósitos de minerales de sulfuro . Algunas fumarolas negras de la parte de las Azores de la dorsal mesoatlántica son extremadamente ricas en contenido metálico , como Rainbow , con concentraciones de hierro de 24.000 μM . [16]
Las fumatas negras fueron descubiertas por primera vez en 1979 en la dorsal del Pacífico oriental por científicos del Instituto Scripps de Oceanografía durante el Proyecto RISE . [17] Se observaron utilizando el vehículo de inmersión profunda ALVIN del Instituto Oceanográfico Woods Hole . Ahora, se sabe que existen fumatas negras en los océanos Atlántico y Pacífico , a una profundidad media de 2.100 m (6.900 pies). Las fumatas negras más septentrionales son un grupo de cinco llamado Castillo de Loki , [18] descubierto en 2008 por científicos de la Universidad de Bergen a 73°N , en la dorsal mesoatlántica entre Groenlandia y Noruega . Estas fumatas negras son de interés ya que se encuentran en una zona más estable de la corteza terrestre, donde las fuerzas tectónicas son menores y, en consecuencia, los campos de respiraderos hidrotermales son menos comunes. [19] Las fumarolas negras más profundas conocidas del mundo se encuentran en la fosa de las Caimán , a 5.000 m (3,1 millas) por debajo de la superficie del océano. [20]

Los respiraderos de las fumarolas blancas emiten minerales de tonos más claros, como los que contienen bario , calcio y silicio . Estos respiraderos también tienden a tener columnas de menor temperatura, probablemente porque generalmente están alejados de su fuente de calor. [1]
Las fumarolas blancas y negras pueden coexistir en el mismo campo hidrotermal, pero generalmente representan respiraderos proximales (cercanos) y distales (distantes) a la zona de flujo ascendente principal, respectivamente. Sin embargo, las fumarolas blancas corresponden principalmente a etapas de decadencia de tales campos hidrotermales, a medida que las fuentes de calor magmático se vuelven progresivamente más distantes de la fuente (debido a la cristalización del magma) y los fluidos hidrotermales pasan a estar dominados por agua de mar en lugar de agua magmática. Los fluidos mineralizantes de este tipo de respiradero son ricos en calcio y forman depósitos predominantemente ricos en sulfatos (es decir, barita y anhidrita ) y carbonatos . [1]

Las columnas hidrotermales son entidades fluidas que se manifiestan donde los fluidos hidrotermales son expulsados a la columna de agua suprayacente en sitios de ventilación hidrotermal activa. [21] Como los fluidos hidrotermales generalmente albergan propiedades físicas (por ejemplo, temperatura , densidad ) y químicas (por ejemplo, pH , Eh , iones principales) distintas del agua de mar , las columnas hidrotermales incorporan gradientes físicos y químicos que promueven varios tipos de reacciones químicas, incluidas reacciones de oxidación-reducción y reacciones de precipitación . [21] Debido a estas reacciones, las columnas hidrotermales son entidades dinámicas cuyas propiedades físicas y químicas evolucionan tanto en el espacio como en el tiempo dentro del océano.
Los fluidos de los respiraderos hidrotermales albergan temperaturas (~40 a >400 °C) muy superiores a las del agua de mar del fondo del océano (~4 °C), lo que significa que el fluido hidrotermal es menos denso que el agua de mar circundante y se elevará a través de la columna de agua debido a la flotabilidad , formando una columna hidrotermal; por lo tanto, la fase durante la cual las columnas hidrotermales se elevan a través de la columna de agua se conoce como la fase de "columna flotante". [21] Durante esta fase, las fuerzas de corte entre la columna hidrotermal y el agua de mar circundante generan un flujo turbulento que facilita la mezcla entre los dos tipos de fluidos, lo que diluye progresivamente la columna hidrotermal con agua de mar. [21] Finalmente, los efectos acoplados de la dilución y el ascenso hacia agua de mar suprayacente progresivamente más cálida (menos densa) harán que la columna hidrotermal se vuelva neutralmente flotante a cierta altura sobre el fondo marino; por lo tanto, esta etapa de la evolución de la columna hidrotermal se conoce como la fase de "columna no flotante". [21] Una vez que la columna alcanza una flotabilidad neutra, ya no puede seguir ascendiendo a través de la columna de agua y, en cambio, comienza a extenderse lateralmente por todo el océano, potencialmente a lo largo de varios miles de kilómetros. [22]
Las reacciones químicas ocurren simultáneamente con la evolución física de las columnas hidrotermales. Si bien el agua de mar es un fluido relativamente oxidante, los fluidos de los respiraderos hidrotermales son típicamente de naturaleza reductora. [21] En consecuencia, los productos químicos reducidos como el gas hidrógeno , el sulfuro de hidrógeno , el metano , Fe 2+ y Mn 2+ que son comunes en muchos fluidos de los respiraderos reaccionarán al mezclarse con agua de mar. En fluidos con altas concentraciones de H 2 S, los iones metálicos disueltos como Fe 2+ y Mn 2+ precipitan fácilmente como minerales de sulfuro metálico de color oscuro (ver "fumadores negros"). [21] Además, Fe 2+ y Mn 2+ arrastrados dentro de la columna hidrotermal eventualmente se oxidarán para formar minerales insolubles de Fe y Mn (oxi)hidróxido . [23] Por esta razón, se ha propuesto que el "campo cercano" hidrotermal se refiera a la región de la columna hidrotermal que experimenta una oxidación activa de metales, mientras que el término "campo lejano" se refiere a la región de la columna dentro de la cual se ha producido una oxidación completa de los metales. [22]
Varios trazadores químicos encontrados en columnas hidrotermales se utilizan para localizar respiraderos hidrotermales en aguas profundas durante cruceros de descubrimiento. Los trazadores útiles de la actividad hidrotermal deben ser químicamente no reactivos para que los cambios en la concentración del trazador posteriores al respiradero se deban únicamente a la dilución. [21] El gas noble helio cumple con este criterio y es un trazador particularmente útil de la actividad hidrotermal. Esto se debe a que el respiradero hidrotermal libera concentraciones elevadas de helio-3 en relación con el agua de mar, un isótopo He raro, de origen natural y derivado exclusivamente del interior de la Tierra. [21] Por lo tanto, la dispersión de 3 He en los océanos a través de columnas hidrotermales crea composiciones isotópicas He anómalas en el agua de mar que indican respiradero hidrotermal. Otro gas noble que puede servir como trazador de la actividad hidrotermal es el radón . Como todos los isótopos naturales de Rn son radiactivos, las concentraciones de Rn en el agua de mar también pueden proporcionar información sobre las edades de las columnas hidrotermales cuando se combinan con los datos de isótopos He. [21] El isótopo radón-222 se utiliza para este propósito ya que el 222 Rn tiene la vida media más larga de todos los isótopos de radón que se encuentran en la naturaleza, de aproximadamente 3,82 días. [24] Los gases disueltos, como H 2 , H 2 S y CH 4 , y los metales, como Fe y Mn, presentes en altas concentraciones en los fluidos de los respiraderos hidrotermales en relación con el agua de mar, también pueden ser diagnósticos de columnas hidrotermales y, por lo tanto, de ventilación activa; sin embargo, estos componentes son reactivos y, por lo tanto, son menos adecuados como trazadores de la actividad hidrotermal. [21]
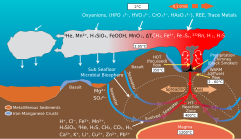
Las columnas hidrotermales representan un mecanismo importante a través del cual los sistemas hidrotermales influyen en la biogeoquímica marina . Los respiraderos hidrotermales emiten una amplia variedad de metales traza al océano, incluidos Fe , Mn , Cr , Cu , Zn , Co , Ni , Mo , Cd , V y W , [25] muchos de los cuales tienen funciones biológicas. [26] Numerosos procesos físicos y químicos controlan el destino de estos metales una vez que son expulsados a la columna de agua. Según la teoría termodinámica , Fe2 + y Mn2 + deberían oxidarse en el agua de mar para formar precipitados de (oxi)hidróxido metálico insoluble; sin embargo, la complejación con compuestos orgánicos y la formación de coloides y nanopartículas pueden mantener estos elementos sensibles a la oxidación-reducción suspendidos en solución lejos del sitio del respiradero. [21] [23]
El Fe y el Mn a menudo tienen las concentraciones más altas entre los metales en los fluidos de los respiraderos hidrotermales ácidos, [25] y ambos tienen importancia biológica, particularmente el Fe, que a menudo es un nutriente limitante en los entornos marinos. [26] Por lo tanto, el transporte de campo lejano de Fe y Mn a través de la complexación orgánica puede constituir un mecanismo importante del ciclo de los metales oceánicos. [22] Además, los respiraderos hidrotermales entregan concentraciones significativas de otros metales traza biológicamente importantes al océano, como el Mo, que puede haber sido importante en la evolución química temprana de los océanos de la Tierra y en el origen de la vida (ver "teoría del origen hidrotermal de la vida"). [25] [27] Sin embargo, los precipitados de Fe y Mn también pueden influir en la biogeoquímica del océano al eliminar metales traza de la columna de agua. Las superficies cargadas de los minerales de (oxi)hidróxido de hierro adsorben eficazmente elementos como el fósforo , el vanadio , el arsénico y los metales de tierras raras del agua de mar; Por lo tanto, aunque las columnas hidrotermales pueden representar una fuente neta de metales como Fe y Mn para los océanos, también pueden absorber otros metales y nutrientes no metalíferos como P del agua de mar, lo que representa un sumidero neto de estos elementos. [23]
Tradicionalmente, se ha considerado que la vida está impulsada por la energía del sol, pero los organismos de las profundidades marinas no tienen acceso a la luz solar, por lo que las comunidades biológicas alrededor de los respiraderos hidrotermales deben depender de los nutrientes que se encuentran en los depósitos químicos polvorientos y los fluidos hidrotermales en los que viven. Anteriormente, los oceanógrafos bentónicos asumían que los organismos de los respiraderos dependían de la nieve marina , como lo hacen los organismos de las profundidades marinas. Esto los dejaría dependientes de la vida vegetal y, por lo tanto, del sol. Algunos organismos de los respiraderos hidrotermales consumen esta "lluvia", pero con un sistema así, las formas de vida serían escasas. Sin embargo, en comparación con el fondo marino circundante, las zonas de respiraderos hidrotermales tienen una densidad de organismos entre 10.000 y 100.000 veces mayor. Estos organismos incluyen cangrejos yeti , que tienen brazos largos y peludos que extienden sobre el respiradero para recolectar alimento. [ cita requerida ]
Los respiraderos hidrotermales se reconocen como un tipo de ecosistemas basados en quimiosíntesis (CBE) donde la productividad primaria es impulsada por compuestos químicos como fuentes de energía en lugar de luz ( quimioautotrofia ). [28] Las comunidades de respiraderos hidrotermales pueden sustentar cantidades tan grandes de vida porque los organismos de los respiraderos dependen de bacterias quimiosintéticas para alimentarse. El agua del respiradero hidrotermal es rica en minerales disueltos y sustenta una gran población de bacterias quimioautotróficas. Estas bacterias utilizan compuestos de azufre, particularmente sulfuro de hidrógeno , una sustancia química altamente tóxica para la mayoría de los organismos conocidos, para producir material orgánico a través del proceso de quimiosíntesis .
El impacto de los respiraderos en el entorno vital va más allá de los organismos que viven a su alrededor, ya que actúan como una fuente importante de hierro en los océanos, proporcionando hierro al fitoplancton. [29]

El ecosistema así formado depende de la existencia continua del campo de respiraderos hidrotermales como fuente primaria de energía, lo que difiere de la mayor parte de la vida superficial de la Tierra, que se basa en la energía solar . Sin embargo, aunque a menudo se dice que estas comunidades existen independientemente del sol, algunos de los organismos en realidad dependen del oxígeno producido por organismos fotosintéticos, mientras que otros son anaeróbicos .

Las bacterias quimiosintéticas crecen formando una gruesa capa que atrae a otros organismos, como anfípodos y copépodos , que se alimentan directamente de ellas. Los organismos más grandes, como caracoles, camarones, cangrejos, gusanos tubícolas , peces (especialmente anguilas , anguilas degolladas , Ophidiiformes y Symphurus thermophilus ) y pulpos (en particular Vulcanoctopus hydrothermalis ), forman una cadena alimentaria de relaciones depredador-presa por encima de los consumidores primarios. Las principales familias de organismos que se encuentran alrededor de los respiraderos del fondo marino son anélidos , pogonóforos , gasterópodos y crustáceos, y los grandes bivalvos , gusanos vestimentíferos y camarones "sin ojos" constituyen la mayor parte de los organismos no microbianos. [ cita requerida ]
.jpg/440px-Expl1534_(9734552643).jpg)
Los gusanos tubícolas siboglínidos , que pueden crecer hasta más de 2 m (6,6 pies) de altura en las especies más grandes, a menudo forman una parte importante de la comunidad alrededor de un respiradero hidrotermal. No tienen boca ni tracto digestivo y, como los gusanos parásitos, absorben los nutrientes producidos por las bacterias en sus tejidos. Se encuentran alrededor de 285 mil millones de bacterias por onza de tejido de gusano tubícola. Los gusanos tubícolas tienen penachos rojos que contienen hemoglobina . La hemoglobina se combina con sulfuro de hidrógeno y lo transfiere a las bacterias que viven dentro del gusano. A cambio, las bacterias nutren al gusano con compuestos de carbono. Dos de las especies que habitan en un respiradero hidrotermal son Tevnia jerichonana y Riftia pachyptila . Una comunidad descubierta, llamada " Eel City ", consiste predominantemente en la anguila Dysommina rugosa . Aunque las anguilas no son poco comunes, los invertebrados generalmente dominan los respiraderos hidrotermales. Eel City está ubicada cerca del cono volcánico de Nafanua , Samoa Americana . [30]
En 1993, ya se sabía que más de 100 especies de gasterópodos se encontraban en fuentes hidrotermales. [31] Se han descubierto más de 300 especies nuevas en fuentes hidrotermales, [32] muchas de ellas "especies hermanas" de otras que se encuentran en áreas de fuentes hidrotermales geográficamente separadas. Se ha propuesto que antes de que la placa norteamericana pasara por encima de la dorsal mesooceánica , había una única región de fuentes biogeográficas en el Pacífico oriental. [33] La posterior barrera para viajar inició la divergencia evolutiva de especies en diferentes lugares. Los ejemplos de evolución convergente observados entre fuentes hidrotermales distintas se consideran un importante apoyo a la teoría de la selección natural y de la evolución en su conjunto.

Aunque la vida es muy escasa a estas profundidades, las fumarolas negras son el centro de ecosistemas enteros . La luz solar es inexistente, por lo que muchos organismos, como las arqueas y los extremófilos , convierten el calor, el metano y los compuestos de azufre proporcionados por las fumarolas negras en energía a través de un proceso llamado quimiosíntesis . Las formas de vida más complejas, como las almejas y los gusanos tubícolas , se alimentan de estos organismos. Los organismos en la base de la cadena alimentaria también depositan minerales en la base de la fumarola negra, completando así el ciclo de vida .
Se ha descubierto una especie de bacteria fototrófica que vive cerca de una fumarola negra frente a la costa de México, a una profundidad de 2500 m (8200 pies). La luz del sol no penetra tan lejos en las aguas. En cambio, la bacteria, parte de la familia Chlorobiaceae , utiliza el débil resplandor de la fumarola negra para realizar la fotosíntesis . Este es el primer organismo descubierto en la naturaleza que utiliza exclusivamente una luz distinta a la luz solar para la fotosíntesis. [34]
En las cercanías de las fumarolas negras se descubren constantemente nuevas e inusuales especies. El gusano de Pompeya Alvinella pompejana , que es capaz de soportar temperaturas de hasta 80 °C (176 °F), fue descubierto en la década de 1980, y un gasterópodo de patas escamosas Chrysomallon squamiferum en 2001 durante una expedición al campo de respiraderos hidrotermales de Kairei en el océano Índico . Este último utiliza sulfuros de hierro ( pirita y greigita) para la estructura de sus escleritas dérmicas (partes del cuerpo endurecidas), en lugar de carbonato de calcio . Se cree que la presión extrema de 2.500 m de agua (aproximadamente 25 megapascales o 250 atmósferas ) desempeña un papel en la estabilización del sulfuro de hierro para fines biológicos. Esta armadura probablemente sirve como defensa contra la rádula venenosa (dientes) de los caracoles depredadores en esa comunidad.
En marzo de 2017, los investigadores informaron sobre la evidencia de posiblemente las formas de vida más antiguas de la Tierra . Se descubrieron microorganismos fosilizados putativos en precipitados de respiraderos hidrotermales en el Cinturón Nuvvuagittuq de Quebec, Canadá , que pueden haber vivido hace 4.280 millones de años , poco después de que se formaran los océanos hace 4.400 millones de años , y poco después de la formación de la Tierra hace 4.540 millones de años. [35] [36] [37]



Los ecosistemas de los respiraderos hidrotermales tienen una enorme biomasa y productividad, pero esto se basa en las relaciones simbióticas que se han desarrollado en los respiraderos. Los ecosistemas de respiraderos hidrotermales de aguas profundas se diferencian de sus contrapartes hidrotermales terrestres y de aguas poco profundas debido a la simbiosis que ocurre entre los hospedadores macroinvertebrados y los simbiontes microbianos quimioautotróficos en los primeros. [38] Dado que la luz solar no llega a los respiraderos hidrotermales de aguas profundas, los organismos en los respiraderos hidrotermales de aguas profundas no pueden obtener energía del sol para realizar la fotosíntesis. En cambio, la vida microbiana que se encuentra en los respiraderos hidrotermales es quimiosintética; fijan el carbono utilizando energía de sustancias químicas como el sulfuro, en lugar de la energía luminosa del sol. En otras palabras, el simbionte convierte moléculas inorgánicas (H 2 S, CO 2 , O) en moléculas orgánicas que el hospedador luego utiliza como nutrición. Sin embargo, el sulfuro es una sustancia extremadamente tóxica para la mayoría de la vida en la Tierra. Por esta razón, los científicos se quedaron atónitos cuando descubrieron por primera vez respiraderos hidrotermales repletos de vida en 1977. Lo que descubrieron fue la simbiosis omnipresente de quimioautótrofos que viven en las branquias de los animales de los respiraderos ( endosimbiosis ); la razón por la que la vida multicelular es capaz de sobrevivir a la toxicidad de los sistemas de ventilación. Por lo tanto, los científicos ahora están estudiando cómo los simbiontes microbianos ayudan en la desintoxicación de sulfuro (permitiendo así que el huésped sobreviva a las condiciones que de otro modo serían tóxicas). El trabajo sobre la función del microbioma muestra que los microbiomas asociados al huésped también son importantes en el desarrollo del huésped, la nutrición, la defensa contra los depredadores y la desintoxicación. A cambio, el huésped proporciona al simbionte los químicos necesarios para la quimiosíntesis, como el carbono, el sulfuro y el oxígeno. [ cita requerida ]
En las primeras etapas del estudio de la vida en los respiraderos hidrotermales, existían diferentes teorías sobre los mecanismos por los cuales los organismos multicelulares podían adquirir nutrientes de estos ambientes y cómo podían sobrevivir en condiciones tan extremas. En 1977, se planteó la hipótesis de que las bacterias quimioautotróficas de los respiraderos hidrotermales podrían ser responsables de contribuir a la dieta de los bivalvos que se alimentan por suspensión. [39]
Finalmente, en 1981, se entendió que la adquisición de nutrición por parte de los gusanos tubícolas gigantes se producía como resultado de endosimbiontes bacterianos quimioautotróficos. [40] [41] [42] A medida que los científicos continuaban estudiando la vida en los respiraderos hidrotermales, se comprendió que las relaciones simbióticas entre los quimioautotróficos y las especies de invertebrados de la macrofauna eran omnipresentes. Por ejemplo, en 1983, se confirmó que el tejido de las branquias de las almejas contenía endosimbiontes bacterianos; [43] en 1984, se descubrió también que los mejillones batimodiólidos de los respiraderos y las almejas vesicomídas portaban endosimbiontes. [44] [45]
Sin embargo, los mecanismos por los cuales los organismos adquieren sus simbiontes difieren, al igual que las relaciones metabólicas. Por ejemplo, los gusanos tubícolas no tienen boca ni intestino, pero sí tienen un "trofosoma", que es donde se ocupan de la nutrición y donde se encuentran sus endosimbiontes. También tienen una columna roja brillante, que utilizan para absorber compuestos como O, H 2 S y CO 2 , que alimentan a los endosimbiontes en su trofosoma. Sorprendentemente, la hemoglobina de los gusanos tubícolas (que por cierto es la razón del color rojo brillante de la columna) es capaz de transportar oxígeno sin interferencia o inhibición del sulfuro, a pesar del hecho de que el oxígeno y el sulfuro suelen ser muy reactivos. En 2005, se descubrió que esto es posible debido a los iones de zinc que se unen al sulfuro de hidrógeno en la hemoglobina de los gusanos tubícolas, evitando así que el sulfuro reaccione con el oxígeno. También reduce la exposición del tejido de los gusanos tubícolas al sulfuro y proporciona a las bacterias el sulfuro para realizar la quimioautotrofia. [46] También se ha descubierto que los gusanos tubícolas pueden metabolizar el CO2 de dos maneras diferentes y pueden alternar entre las dos según sea necesario a medida que cambian las condiciones ambientales. [47]
En 1988, una investigación confirmó la presencia de bacterias tiotróficas (oxidantes de sulfuro) en Alviniconcha hessleri , un gran molusco de respiradero. [48] Para evitar la toxicidad del sulfuro, los mejillones primero lo convierten en tiosulfato antes de transferirlo a los simbiontes. [49] En el caso de organismos móviles como el camarón alvinocárido, deben rastrear ambientes óxicos (ricos en oxígeno) / anóxicos (pobres en oxígeno) a medida que fluctúan en el medio ambiente. [ cita requerida ]
Los organismos que viven en los límites de los campos de ventilación hidrotermal, como las vieiras pectínidas, también tienen endosimbiontes en sus branquias y, como resultado, su densidad bacteriana es baja en relación con los organismos que viven más cerca de la ventilación. Sin embargo, la dependencia de la vieira del endosimbionte microbiano para obtener su nutrición también es menor. [ cita requerida ]
Además, no todos los animales hospedadores tienen endosimbiontes; algunos tienen episimbiontes, es decir, simbiontes que viven sobre el animal en lugar de dentro de él. En el pasado, se pensaba que los camarones que se encuentran en los respiraderos de la cordillera mesoatlántica eran una excepción a la necesidad de simbiosis para la supervivencia de los macroinvertebrados en los respiraderos. Eso cambió en 1988, cuando se descubrió que eran portadores de episimbiontes. [50] Desde entonces, se ha descubierto que otros organismos de los respiraderos también son portadores de episimbiontes, [51] como Lepetodrilis fucensis. [52]
Además, mientras que algunos simbiontes reducen los compuestos de azufre, otros son conocidos como " metanótrofos " y reducen los compuestos de carbono, en concreto el metano. Los mejillones batmodiólidos son un ejemplo de un huésped que contiene endosimbiontes metanotróficos; sin embargo, estos últimos se encuentran principalmente en filtraciones frías en lugar de en fuentes hidrotermales. [ cita requerida ]
Si bien la quimiosíntesis que se produce en las profundidades oceánicas permite a los organismos vivir sin luz solar en el sentido inmediato, técnicamente siguen dependiendo del sol para sobrevivir, ya que el oxígeno del océano es un subproducto de la fotosíntesis. Sin embargo, si el sol desapareciera repentinamente y la fotosíntesis dejara de producirse en nuestro planeta, la vida en las fuentes hidrotermales de las profundidades oceánicas podría continuar durante milenios (hasta que se agotara el oxígeno). [ cita requerida ]
La dinámica química y térmica de los respiraderos hidrotermales hace que estos entornos sean termodinámicamente muy adecuados para que se produzcan procesos de evolución química. Por lo tanto, el flujo de energía térmica es un agente permanente y se plantea la hipótesis de que ha contribuido a la evolución del planeta, incluida la química prebiótica. [1]
Günter Wächtershäuser propuso la teoría del mundo de hierro y azufre y sugirió que la vida podría haberse originado en fuentes hidrotermales. Wächtershäuser propuso que una forma temprana de metabolismo precedió a la genética. Por metabolismo se refería a un ciclo de reacciones químicas que liberan energía en una forma que puede ser aprovechada por otros procesos. [53]
Se ha propuesto que la síntesis de aminoácidos podría haber ocurrido en las profundidades de la corteza terrestre y que estos aminoácidos fueron posteriormente disparados junto con los fluidos hidrotermales a aguas más frías, donde las temperaturas más bajas y la presencia de minerales arcillosos habrían fomentado la formación de péptidos y protocélulas . [54] Esta es una hipótesis atractiva debido a la abundancia de CH 4 ( metano ) y NH 3 ( amoníaco ) presente en las regiones de los respiraderos hidrotermales, una condición que no fue proporcionada por la atmósfera primitiva de la Tierra. Una limitación importante de esta hipótesis es la falta de estabilidad de las moléculas orgánicas a altas temperaturas, pero algunos han sugerido que la vida se habría originado fuera de las zonas de temperatura más alta. [55] Hay numerosas especies de extremófilos y otros organismos que viven actualmente inmediatamente alrededor de los respiraderos de aguas profundas, lo que sugiere que este es de hecho un escenario posible. [ cita requerida ]
La investigación experimental y el modelado por computadora indican que las superficies de las partículas minerales dentro de los respiraderos hidrotermales tienen propiedades catalíticas similares a las enzimas y son capaces de crear moléculas orgánicas simples, como metanol (CH 3 OH) y ácido fórmico (HCO 2 H), a partir del CO 2 disuelto en el agua. [56] [57] [58] Además, el descubrimiento de CO 2 supercrítico en algunos sitios se ha utilizado para apoyar aún más la teoría del origen hidrotermal de la vida, dado que puede aumentar las tasas de reacción orgánica. Su alto poder de solvatación y tasa de difusión le permiten promover la síntesis de aminoácidos y ácido fórmico , así como la síntesis de otros compuestos orgánicos, polímeros y los cuatro aminoácidos: alanina, arginina, ácido aspártico y glicina. Los experimentos in situ han revelado la convergencia de alto contenido de N 2 y CO 2 supercrítico en algunos sitios, así como evidencia de material orgánico complejo (aminoácidos) dentro de burbujas de CO 2 supercrítico . [59] [60] [61] Los defensores de esta teoría sobre el origen de la vida también proponen la presencia de CO2 supercrítico como una solución a la “paradoja del agua” que impregna las teorías sobre el origen de la vida en entornos acuáticos. Esta paradoja abarca el hecho de que el agua es necesaria para la vida y, en abundancia, hidrolizará las moléculas orgánicas y evitará las reacciones de síntesis por deshidratación necesarias para la evolución química y biológica. [62] El CO2 supercrítico , al ser hidrófobo, actúa como un disolvente que facilita un entorno propicio para la síntesis por deshidratación. Por lo tanto, se ha planteado la hipótesis de que la presencia de CO2 supercrítico en los respiraderos hidrotermales del Hádico jugó un papel importante en el origen de la vida. [60]
Hay algunas evidencias que vinculan el origen de la vida con los respiraderos hidrotermales alcalinos en particular. Las condiciones de pH de estos respiraderos pueden haberlos hecho más adecuados para la vida emergente. [63] [64] Una teoría actual es que los gradientes de protones naturales en estos respiraderos de aguas profundas complementaron la falta de membranas de bicapa de fosfolípidos y bombas de protones en los organismos primitivos, lo que permitió que se formaran gradientes de iones a pesar de la falta de maquinaria celular y componentes presentes en las células modernas. [65] Hay cierto debate en torno a este tema. [66] [67] Se ha argumentado que es realmente improbable que los gradientes de pH naturales de estos respiraderos desempeñen un papel en el origen de la vida. El contraargumento se basa, entre otros puntos, en lo que el autor describe como la improbabilidad de la formación de maquinaria que produzca energía a partir de los gradientes de pH encontrados en los respiraderos hidrotermales sin/antes de la existencia de información genética. [67] Este contrapunto ha sido respondido por Nick Lane , uno de los investigadores en cuyo trabajo se centra. Sostiene que el contrapunto malinterpreta en gran medida tanto su trabajo como el de otros. [66]
Otra razón por la que la visión de los respiraderos hidrotermales de aguas profundas como un entorno ideal para el origen de la vida sigue siendo controvertida es la ausencia de ciclos húmedos-secos y la exposición a la luz ultravioleta, que promueven la formación de vesículas membranosas y la síntesis de muchas biomoléculas. [68] [69] [70] Las concentraciones iónicas de los respiraderos hidrotermales difieren del fluido intracelular en la mayoría de los seres vivos. En cambio, se ha sugerido que los entornos terrestres de agua dulce tienen más probabilidades de ser un entorno ideal para la formación de células tempranas. [71] [72] Mientras tanto, los defensores de la hipótesis de los respiraderos hidrotermales de aguas profundas sugieren que la termoforesis en cavidades minerales es un compartimento alternativo para la polimerización de biopolímeros. [73] [74]
Se desconoce cómo la termoforesis dentro de las cavidades minerales podría promover la codificación y el metabolismo. Nick Lane sugiere que la polimerización de nucleótidos en altas concentraciones de nucleótidos dentro de protocélulas autorreplicantes, donde "la aglomeración molecular y la fosforilación en tales protocélulas confinadas y de alta energía podrían promover potencialmente la polimerización de nucleótidos para formar ARN". [75] El fosfato de acetilo podría posiblemente promover la polimerización en superficies minerales o en baja actividad de agua. [76] Una simulación computacional muestra que la concentración de nucleótidos de la catálisis de nucleótidos de "la vía de la moneda de energía se ve favorecida, ya que la energía es limitante; favorecer esta vía alimenta hacia adelante una mayor síntesis de nucleótidos". La catálisis rápida de nucleótidos de la fijación de CO2 reduce la concentración de nucleótidos a medida que el crecimiento y la división de las protocélulas son rápidos, lo que luego conduce a la reducción a la mitad de la concentración de nucleótidos, la catálisis débil de nucleótidos de la fijación de CO2 promueve poco el crecimiento y la división de las protocélulas. [77]
En bioquímica, las reacciones con CO2 y H2 producen precursores de biomoléculas que también se producen a partir de la vía del acetil-CoA y el ciclo de Krebs , lo que respaldaría un origen de vida en respiraderos alcalinos de aguas profundas. El fosfato de acetilo producido a partir de las reacciones es capaz de fosforilar ADP a ATP, [78] con una síntesis máxima que ocurre en alta actividad de agua y bajas concentraciones de iones, el océano Hádico probablemente tenía concentraciones más bajas de iones que los océanos modernos. Las concentraciones de Mg2 + y Ca2 + en sistemas hidrotermales alcalinos son más bajas que en el océano. [79] La alta concentración de potasio dentro de la mayoría de las formas de vida podría explicarse fácilmente por el hecho de que las protocélulas podrían haber desarrollado antiportadores de sodio-hidrógeno para bombear Na + ya que las membranas lipídicas prebióticas son menos permeables al Na + que al H + . [80] Si las células se originaron en estos entornos, habrían sido autótrofas con una vía de Wood-Ljungdahl y un ciclo de Krebs inverso incompleto. [81] El modelado matemático de la síntesis orgánica de ácidos carboxílicos a lípidos, nucleótidos, aminoácidos y azúcares, y las reacciones de polimerización son favorables en los respiraderos hidrotermales alcalinos. [82]
Al comienzo de su artículo de 1992 The Deep Hot Biosphere , Thomas Gold se refirió a los respiraderos oceánicos en apoyo de su teoría de que los niveles inferiores de la Tierra son ricos en material biológico vivo que encuentra su camino hacia la superficie. [83] Amplió aún más sus ideas en el libro The Deep Hot Biosphere . [84]
Un artículo sobre la producción de hidrocarburos abiogénicos en la edición de febrero de 2008 de la revista Science utilizó datos de experimentos en el campo hidrotermal de Ciudad Perdida para informar cómo la síntesis abiótica de hidrocarburos de baja masa molecular a partir del dióxido de carbono derivado del manto puede ocurrir en presencia de rocas ultramáficas, agua y cantidades moderadas de calor. [85]
En 1949, un estudio de aguas profundas informó de la presencia de salmueras anormalmente calientes en la parte central del mar Rojo . Trabajos posteriores en la década de 1960 confirmaron la presencia de salmueras salinas calientes, a 60 °C (140 °F), y lodos metalíferos asociados. Las soluciones calientes emanaban de una grieta activa en el subsuelo marino . El carácter altamente salino de las aguas no era hospitalario para los organismos vivos. [86] Las salmueras y los lodos asociados se están investigando actualmente como fuente de metales preciosos y básicos explotables.


En junio de 1976, los científicos de la Institución Scripps de Oceanografía obtuvieron la primera evidencia de respiraderos hidrotermales submarinos a lo largo de la falla de las Galápagos, un espolón de la dorsal del Pacífico Oriental , en la expedición Pleiades II , utilizando el sistema de imágenes del fondo marino Deep-Tow. [87] En 1977, los primeros artículos científicos sobre respiraderos hidrotermales fueron publicados [88] por científicos de la Institución Scripps de Oceanografía ; el científico investigador Peter Lonsdale publicó fotografías tomadas con cámaras remolcadas en profundidad, [89] y la estudiante de doctorado Kathleen Crane publicó mapas y datos de anomalías de temperatura. [90] Se desplegaron transpondedores en el sitio, que fue apodado "Clam-bake", para permitir que una expedición regresara al año siguiente para realizar observaciones directas con el DSV Alvin .
Los ecosistemas quimiosintéticos que rodean los respiraderos hidrotermales submarinos de la falla de las Galápagos se observaron directamente por primera vez en 1977, cuando un grupo de geólogos marinos financiados por la National Science Foundation regresó a los sitios de Clambake. El investigador principal del estudio sumergible fue Jack Corliss de la Universidad Estatal de Oregón . Corliss y Tjeerd van Andel de la Universidad de Stanford observaron y tomaron muestras de los respiraderos y su ecosistema el 17 de febrero de 1977, mientras buceaban en el DSV Alvin , un sumergible de investigación operado por la Institución Oceanográfica Woods Hole (WHOI). [91] Otros científicos en el crucero de investigación incluyeron a Richard (Dick) Von Herzen y Robert Ballard de WHOI, Jack Dymond y Louis Gordon de la Universidad Estatal de Oregón, John Edmond y Tanya Atwater del Instituto Tecnológico de Massachusetts , Dave Williams del Servicio Geológico de Estados Unidos y Kathleen Crane de la Institución Scripps de Oceanografía . [91] [92] Este equipo publicó sus observaciones de los respiraderos, los organismos y la composición de los fluidos de los respiraderos en la revista Science. [93] En 1979, un equipo de biólogos dirigido por J. Frederick Grassle, en ese momento en el WHOI , regresó al mismo lugar para investigar las comunidades biológicas descubiertas dos años antes.
Los respiraderos hidrotermales de alta temperatura, los "fumadores negros", fueron descubiertos en la primavera de 1979 por un equipo de la Institución Scripps de Oceanografía utilizando el sumergible Alvin . La expedición RISE exploró la dorsal del Pacífico oriental a 21° N con el objetivo de probar el mapeo geofísico del fondo marino con el Alvin y encontrar otro campo hidrotermal más allá de los respiraderos de la falla de las Galápagos. La expedición fue dirigida por Fred Spiess y Ken Macdonald e incluyó participantes de los EE. UU., México y Francia. [17] La región de buceo fue seleccionada en función del descubrimiento de montículos de minerales de sulfuro en el fondo marino por la expedición francesa CYAMEX en 1978. [94] Antes de las operaciones de buceo, el miembro de la expedición Robert Ballard localizó anomalías de temperatura del agua cerca del fondo utilizando un paquete de instrumentos remolcado profundamente. La primera inmersión se dirigió a una de esas anomalías. El domingo de Pascua, 15 de abril de 1979, durante una inmersión del Alvin a 2.600 metros, Roger Larson y Bruce Luyendyk encontraron un campo de respiraderos hidrotermales con una comunidad biológica similar a los respiraderos de las Galápagos. En una inmersión posterior el 21 de abril, William Normark y Thierry Juteau descubrieron los respiraderos de alta temperatura que emiten chorros de partículas minerales negras desde las chimeneas; las fumarolas negras. [95] Después de esto, Macdonald y Jim Aiken colocaron una sonda de temperatura en el Alvin para medir la temperatura del agua en los respiraderos de las fumarolas negras. Esto observó las temperaturas más altas registradas hasta entonces en los respiraderos hidrotermales de aguas profundas (380 ± 30 °C). [96] El análisis del material de las fumarolas negras y las chimeneas que las alimentaban reveló que los precipitados de sulfuro de hierro son los minerales comunes en el "humo" y las paredes de las chimeneas. [97]

En 2005, Neptune Resources NL, una empresa de exploración minera, solicitó y obtuvo 35.000 km2 de derechos de exploración sobre el Arco Kermadec en la Zona Económica Exclusiva de Nueva Zelanda para explorar depósitos masivos de sulfuro en el fondo marino , una nueva fuente potencial de sulfuros de plomo , zinc y cobre formados a partir de campos de respiraderos hidrotermales modernos. El descubrimiento de un respiradero en el Océano Pacífico frente a la costa de Costa Rica , llamado campo de respiraderos hidrotermales Medusa (en honor a la Medusa con cabello de serpiente de la mitología griega ), fue anunciado en abril de 2007. [98] El campo hidrotermal Ashadze (13°N en la dorsal mesoatlántica, elevación -4200 m) fue el campo hidrotermal de alta temperatura más profundo conocido hasta 2010, cuando un penacho hidrotermal que emanaba del sitio Beebe [99] ( 18°33′N 81°43′O / 18.550, -81.717 , elevación -5000 m) fue detectado por un grupo de científicos del Laboratorio de Propulsión a Chorro de la NASA y la Institución Oceanográfica Woods Hole . Este sitio está ubicado en la Elevación Media de las Islas Caimán, de 110 km de longitud y de expansión ultralenta, dentro de la Fosa de las Islas Caimán . [100] A principios de 2013, se descubrieron los respiraderos hidrotermales más profundos conocidos en el mar Caribe, a una profundidad de casi 5000 metros (16 000 pies). [101]
Los oceanógrafos están estudiando los volcanes y los respiraderos hidrotermales de la dorsal oceánica de Juan de Fuca , donde las placas tectónicas se están alejando unas de otras. [102]
Actualmente se están explorando respiraderos hidrotermales y otras manifestaciones geotérmicas en la Bahía de Concepción, Baja California Sur, México. [103]
Los respiraderos hidrotermales se distribuyen a lo largo de los límites de las placas de la Tierra, aunque también pueden encontrarse en lugares intraplaca, como volcanes calientes. En 2009, se conocían aproximadamente 500 campos de respiraderos hidrotermales submarinos activos, de los cuales aproximadamente la mitad se observaban visualmente en el fondo marino y la otra mitad se sospechaba que se originaban en indicadores de columnas de agua y/o depósitos en el fondo marino. [104]
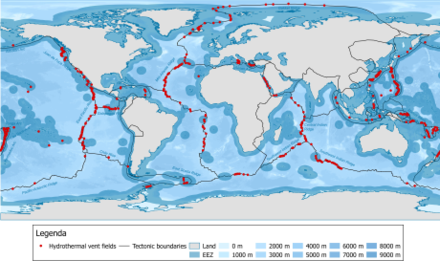
Rogers et al. (2012) [105] reconocieron al menos 11 provincias biogeográficas de sistemas de ventilación hidrotermal:

Los respiraderos hidrotermales, en algunos casos, han dado lugar a la formación de recursos minerales explotables a través de la deposición de depósitos masivos de sulfuro en el fondo marino . El yacimiento de Mount Isa , ubicado en Queensland , Australia , es un excelente ejemplo. [106] Muchos respiraderos hidrotermales son ricos en cobalto , oro , cobre y tierras raras esenciales para los componentes electrónicos. [107] Se considera que los respiraderos hidrotermales en el fondo marino del Arcaico han formado formaciones de hierro bandeado de tipo Algoma , que han sido una fuente de mineral de hierro . [108]
Recientemente, las empresas de exploración minera, impulsadas por la elevada actividad de precios en el sector de los metales básicos durante mediados de la década de 2000, han centrado su atención en la extracción de recursos minerales de los yacimientos hidrotermales del fondo marino. En teoría, es posible lograr reducciones significativas de costos. [109]
En países como Japón , donde los recursos minerales se derivan principalmente de importaciones internacionales, [110] existe un impulso particular para la extracción de recursos minerales del fondo marino. [111] La primera minería "a gran escala" del mundo de depósitos minerales de respiraderos hidrotermales fue realizada por Japan Oil, Gas and Metals National Corporation (JOGMEC) en agosto-septiembre de 2017. JOGMEC llevó a cabo esta operación utilizando el buque de investigación Hakurei . Esta minería se llevó a cabo en el campo de ventilación "Izena hole/cauldron" dentro de la cuenca de arco posterior hidrotermalmente activa conocida como Okinawa Trough , que contiene 15 campos de ventilación confirmados según la base de datos de respiraderos InterRidge.
Dos empresas están actualmente en las últimas etapas de la extracción de sulfuros masivos del fondo marino (SMS). Nautilus Minerals está en las etapas avanzadas de la extracción de su depósito Solwarra, en el archipiélago de Bismarck , y Neptune Minerals está en una etapa más temprana con su depósito Rumble II West, ubicado en el Arco Kermadec , cerca de las Islas Kermadec . Ambas empresas están proponiendo utilizar tecnología existente modificada. Nautilus Minerals, en asociación con Placer Dome (ahora parte de Barrick Gold ), logró en 2006 devolver más de 10 toneladas métricas de SMS extraído a la superficie utilizando cortadores de tambor modificados montados en un ROV, una primicia mundial. [112] Neptune Minerals en 2007 logró recuperar muestras de sedimentos de SMS utilizando una bomba de succión de la industria petrolera modificada montada en un ROV, también una primicia mundial. [113]
La posible explotación minera del fondo marino tiene impactos ambientales, incluyendo columnas de polvo provenientes de maquinaria minera que afectan a organismos que se alimentan por filtración, [107] colapso o reapertura de respiraderos, liberación de clatrato de metano o incluso deslizamientos de tierra sub-oceánicos. [114]

También existen posibles efectos ambientales de las herramientas necesarias para la minería de estos ecosistemas de ventilación hidrotermal, incluida la contaminación acústica y la luz antropogénica. La minería del sistema de ventilación hidrotermal requeriría el uso de herramientas mineras sumergidas en el fondo marino, incluidos vehículos submarinos operados a distancia (ROV), así como buques de apoyo de superficie en la superficie del océano. [115] Inevitablemente, a través del funcionamiento de estas máquinas, se creará algún nivel de ruido, lo que presenta un problema para los organismos de ventilación hidrotermal porque, como están hasta 12.000 pies por debajo de la superficie del océano, experimentan muy poco sonido. [115] Como resultado de esto, estos organismos han evolucionado para tener órganos auditivos altamente sensibles, por lo que si hay un aumento repentino del ruido, como el creado por la maquinaria minera, existe el potencial de dañar estos órganos auditivos y dañar a los organismos de ventilación. [115] También es importante considerar que muchos estudios han podido demostrar que un gran porcentaje de los organismos bentónicos se comunican utilizando sonidos de frecuencia muy baja; Por lo tanto, el aumento de los niveles de ruido ambiental en el fondo marino podría potencialmente enmascarar la comunicación entre los organismos y alterar los patrones de comportamiento. [115] De manera similar a cómo las herramientas de minería SMS en aguas profundas crean contaminación acústica, también crean fuentes de luz antropogénicas en el fondo marino (de las herramientas de minería) y la superficie del océano (de los buques de apoyo de superficie). Los organismos en estos sistemas de ventilación hidrotermal están en la zona afótica del océano y se han adaptado a condiciones de luz muy bajas. Los estudios sobre camarones de aguas profundas han demostrado el potencial de las luces de inundación utilizadas en el fondo marino para estudiar los sistemas de ventilación para causar daño permanente a la retina, [115] lo que justifica una mayor investigación sobre el riesgo potencial para otros organismos de ventilación. Además del riesgo presentado para los organismos de aguas profundas, los buques de apoyo de superficie utilizan iluminación antropogénica nocturna . [115] La investigación ha demostrado que este tipo de iluminación en la superficie del océano puede desorientar a las aves marinas y causar lluvia radiactiva, donde vuelan hacia la luz antropogénica y se agotan o chocan con objetos artificiales, lo que resulta en lesiones o muerte. [115] Al evaluar los efectos ambientales de la minería de fuentes hidrotermales se tienen en cuenta tanto los organismos acuáticos como los terrestres.
Hay tres procesos de desechos mineros, conocidos como liberación de sedimentos por vertido lateral, proceso de deshidratación y desplazamiento o perturbación de sedimentos, que se esperarían con los procesos de minería en aguas profundas y podrían dar como resultado la acumulación de una columna o nube de sedimentos, lo que puede tener implicaciones ambientales sustanciales. La liberación de sedimentos por vertido lateral es un proceso que ocurriría en el fondo marino e implicaría el movimiento de material en el fondo marino por parte de los ROV sumergidos y, muy probablemente, contribuiría a la formación de columnas de sedimentos en el fondo marino. [115] La idea de la liberación por vertido lateral es que los ROV descartarían material económicamente invaluable al costado del sitio de minería antes de transportar el material de sulfuro al buque de apoyo en la superficie. El objetivo de este proceso es reducir la cantidad de material que se transfiere a la superficie y minimizar el material en tierra. [115] El proceso de deshidratación es un proceso de desechos mineros que, muy probablemente, contribuiría a la formación de columnas de sedimentos desde la superficie. El método de eliminación de desechos mineros libera agua del barco que puede haberse obtenido durante la extracción y el transporte del material desde el fondo marino hasta la superficie. La tercera contribución a la formación de la nube o penacho de sedimentos sería la perturbación y liberación de sedimentos. Esta contribución de desechos mineros está asociada principalmente a la actividad minera en el fondo marino asociada al movimiento de los ROV y la perturbación destructiva del fondo marino como parte del proceso minero en sí. [115]
Las dos principales preocupaciones ambientales como resultado de estos procesos de extracción de desechos que contribuyen a la formación de la columna de sedimentos serían la liberación de metales pesados y mayores cantidades de sedimentos liberados. La liberación de metales pesados está asociada principalmente con el proceso de deshidratación que tendría lugar a bordo del barco en la superficie del agua. [115] El principal problema asociado con la deshidratación es que no es solo la liberación de agua de mar que vuelve a ingresar a la columna de agua. Los metales pesados, como el cobre y el cobalto, que se obtendrían del material extraído en el fondo marino también se mezclan con el agua que se libera en la columna de agua. La primera preocupación ambiental asociada con la liberación de metales pesados es que tiene el potencial de cambiar la química del océano dentro de esa área localizada de la columna de agua. La segunda preocupación sería que algunos de los metales pesados que podrían liberarse pueden tener cierto nivel de toxicidad no solo para los organismos que habitan esa área, sino también para los organismos que pasan por el área del sitio minero. [115] Las preocupaciones en torno al aumento de la liberación de sedimentos están relacionadas principalmente con los otros dos procesos de desechos mineros, el sedimento vertido lateralmente y la alteración del sedimento del fondo marino. La principal preocupación ambiental sería la asfixia de los organismos que se encuentran debajo como resultado de la redistribución de grandes cantidades de sedimentos a otras áreas del fondo marino, lo que podría amenazar potencialmente a la población de organismos que habitan el área. La redistribución de grandes cantidades de sedimentos también puede afectar los procesos de alimentación e intercambio de gases entre organismos, lo que representa una grave amenaza para la población. Finalmente, estos procesos también pueden aumentar la tasa de sedimentación en el fondo marino, lo que da como resultado un mínimo previsto de 500 m por cada 1–10 km. [115]
Actualmente, ambas empresas mencionadas están realizando una gran cantidad de trabajo para garantizar que se comprendan bien los posibles impactos ambientales de la minería del fondo marino y se implementen medidas de control antes de que comience la explotación. [116] Sin embargo, este proceso se ha visto obstaculizado posiblemente por la distribución desproporcionada del esfuerzo de investigación entre los ecosistemas de ventilación; los ecosistemas de ventilación hidrotermal mejor estudiados y comprendidos no son representativos de aquellos que son objeto de minería. [117]
En el pasado se han hecho intentos de explotar minerales del fondo marino. En los años 1960 y 1970 hubo mucha actividad (y gasto) en la recuperación de nódulos de manganeso de las llanuras abisales , con distintos grados de éxito. Sin embargo, esto demuestra que la recuperación de minerales del fondo marino es posible y ha sido posible durante algún tiempo. La extracción de nódulos de manganeso sirvió como tapadera para el elaborado intento en 1974 por parte de la CIA de sacar a la superficie el submarino soviético hundido K-129 utilizando el Glomar Explorer , un barco construido específicamente para la tarea por Howard Hughes . [118] La operación se conoció como Proyecto Azorian , y la tapadera de la extracción de nódulos de manganeso del fondo marino puede haber servido como impulso para impulsar a otras empresas a hacer el intento.
La conservación de los respiraderos hidrotermales ha sido objeto de un debate a veces acalorado en la comunidad oceanográfica durante los últimos 20 años. [119] Se ha señalado que puede ser que quienes causan el mayor daño a estos hábitats relativamente raros sean los científicos. [120] [121] Ha habido intentos de forjar acuerdos sobre el comportamiento de los científicos que investigan los sitios de los respiraderos, pero, aunque existe un código de práctica acordado, no hay un acuerdo internacional formal y jurídicamente vinculante. [122]
La conservación de los ecosistemas de ventilación hidrotermal después del hecho de la minería de un sistema activo dependería de la recolonización de bacterias quimiosintéticas y, por lo tanto, de la continuación del fluido de ventilación hidrotermal, ya que es la principal fuente de energía hidrotermal . [115] Es muy difícil hacerse una idea de los efectos de la minería en el fluido de ventilación hidrotermal porque no se han realizado estudios a gran escala. [115] Sin embargo, se han realizado estudios sobre la recolonización de estos ecosistemas de ventilación después de la destrucción volcánica. [123] A partir de estos, podemos desarrollar una idea de los efectos potenciales de la destrucción minera , y hemos aprendido que las bacterias tardaron entre 3 y 5 años en recolonizar el área, y alrededor de 10 años en regresar la megafauna. [123] También se encontró que hubo un cambio en la composición de especies en el ecosistema en comparación con antes de la destrucción, y la presencia de especies inmigrantes. [115] Aunque se necesita más investigación sobre los efectos de la minería sostenida de SMS del fondo marino en la recolonización de especies.
Los métodos comunes para averiguar las edades de los respiraderos hidrotermales son fechar los minerales de sulfuro (por ejemplo, pirita ) y sulfato (por ejemplo, barita ). [124] [125] [126] [127] [128] Los métodos de datación comunes incluyen la datación radiométrica [124] [125] y la datación por resonancia de espín electrónico . [126] [127] [128] Los diferentes métodos de datación tienen sus propias limitaciones, suposiciones y desafíos. Los desafíos generales incluyen la alta pureza de los minerales extraídos necesarios para la datación, el rango de edad de cada método de datación, el calentamiento por encima de las temperaturas de cierre que borra las edades de los minerales más antiguos y los múltiples episodios de formación de minerales que dan como resultado una mezcla de edades. En entornos con múltiples fases de formación de minerales , generalmente, la datación por resonancia de espín electrónico proporciona la edad promedio del mineral a granel, mientras que las fechas radiométricas están sesgadas hacia las edades de las fases más jóvenes debido a la desintegración de los núcleos parentales . Esto explica por qué diferentes métodos pueden dar diferentes edades a la misma muestra y por qué la misma chimenea hidrotermal puede tener muestras con diferentes edades. [127] [128] [129]
{{cite web}}: CS1 maint: unfit URL (link){{cite web}}: Missing or empty |url= (help){{cite book}}: |journal=ignorado ( ayuda ){{cite journal}}: CS1 maint: numeric names: authors list (link)