El virus respiratorio sincitial ( VSR ), [a] también llamado virus respiratorio sincitial humano ( VSRh ) y ortopneumovirus humano , es un virus contagioso que causa infecciones del tracto respiratorio . Es un virus ARN monocatenario de polaridad negativa . [2] Su nombre se deriva de las células grandes conocidas como sincitios que se forman cuando las células infectadas se fusionan. [2] [3]
El VSR es una causa común de hospitalización por problemas respiratorios en los bebés y la reinfección sigue siendo común en etapas posteriores de la vida, aunque a menudo con menor gravedad. Es un patógeno notable en todos los grupos de edad. Las tasas de infección suelen ser más altas durante los meses fríos de invierno, causando bronquiolitis en los bebés, resfriados comunes en los adultos y enfermedades respiratorias más graves, como neumonía , en los ancianos y los inmunodeprimidos . [4]
El VRS puede causar brotes tanto en la comunidad como en el ámbito hospitalario. Tras la infección inicial a través de los ojos o la nariz, el virus infecta las células epiteliales de las vías respiratorias superiores e inferiores, lo que provoca inflamación, daño celular y obstrucción de las vías respiratorias. [2] Hay una variedad de métodos disponibles para la detección y el diagnóstico del VRS, entre ellos , pruebas de antígenos , pruebas moleculares y cultivos virales . [3]
Además de la vacunación, las medidas de prevención incluyen el lavado de manos y evitar el contacto cercano con personas infectadas. [5] La detección del VRS en aerosoles respiratorios, [6] junto con la producción de aerosoles finos y ultrafinos durante la respiración normal, el habla, [7] y la tos, [8] y el consenso científico emergente en torno a la transmisión de todas las infecciones respiratorias, [9] también pueden requerir precauciones aéreas para una protección confiable. En mayo de 2023, la Administración de Alimentos y Medicamentos de los EE. UU. (FDA) aprobó las primeras vacunas contra el VRS , Arexvy (desarrollada por GSK plc ) y Abrysvo ( Pfizer ). [10] [11] El uso profiláctico de palivizumab o nirsevimab (ambos son tratamientos con anticuerpos monoclonales ) puede prevenir la infección por VRS en bebés de alto riesgo. [5] [12]
El tratamiento de la enfermedad grave es principalmente de apoyo, incluyendo oxigenoterapia y soporte respiratorio más avanzado con presión positiva continua en las vías respiratorias (CPAP) u oxígeno nasal de alto flujo , según sea necesario. En casos de insuficiencia respiratoria grave , puede ser necesaria la intubación y la ventilación mecánica . La ribavirina es un medicamento antiviral autorizado para el tratamiento del VSR en niños. [13] La infección por VSR no suele ser grave, pero puede ser una causa importante de morbilidad y mortalidad en lactantes y adultos, en particular los ancianos y aquellos con enfermedades cardíacas o pulmonares subyacentes.
El virus respiratorio sincitial (VRS) se descubrió en 1956 cuando los investigadores aislaron un virus de una población de chimpancés con enfermedades respiratorias. Llamaron al virus agente de la coriza del chimpancé (CCA). [14] En 1957, Robert M. Chanock identificó este mismo virus en niños con enfermedades respiratorias. [15] Los estudios de anticuerpos humanos en bebés y niños revelaron que la infección era común en las primeras etapas de la vida. [16] Más tarde, el virus pasó a llamarse ortopneumovirus humano o virus respiratorio sincitial humano (hRSV). [17] [18]
Varios otros neumovirus muestran una gran similitud con el hRSV. El virus respiratorio sincitial bovino ( bRSV ) comparte aproximadamente el 80% de su genoma con el hRSV. También comparte la predilección del hRSV por los animales jóvenes, causando una enfermedad más grave en los terneros de menos de seis meses de edad. Debido a que los terneros infectados con bRSV tienen síntomas casi idénticos a los niños infectados con hRSV, han demostrado ser un modelo animal importante en la investigación del RSV. [19]
La infección por VRS puede presentarse con una amplia variedad de signos y síntomas que van desde infecciones leves del tracto respiratorio superior (ITRS) hasta infecciones graves y potencialmente mortales del tracto respiratorio inferior (ITRI) que requieren hospitalización y ventilación mecánica . [19] Si bien el VRS puede causar infecciones del tracto respiratorio en personas de todas las edades y se encuentra entre las infecciones infantiles comunes, su presentación a menudo varía entre los grupos de edad y el estado inmunológico. [4] La reinfección es común a lo largo de la vida, pero los bebés y los ancianos siguen corriendo el riesgo de contraer una infección sintomática. [19]
Casi todos los niños en los Estados Unidos experimentan al menos una infección por VSR antes de los dos años de edad. [20] Las infecciones por VSR en la infancia son bastante autolimitadas con signos y síntomas típicos del tracto respiratorio superior, como congestión nasal, secreción nasal , tos y fiebre baja. [4] [20] La inflamación de la mucosa nasal ( rinitis ) y la garganta ( faringitis ), así como el enrojecimiento de los ojos ( infección conjuntival ), pueden verse en el examen. [3] Aproximadamente el 15-50% de los niños desarrollarán infecciones más graves de las vías respiratorias inferiores, como bronquiolitis, neumonía viral o crup . [19] [21] Los bebés tienen el mayor riesgo de progresión de la enfermedad. [3]
La bronquiolitis es una infección común del tracto respiratorio inferior caracterizada por la inflamación y obstrucción de las vías respiratorias pequeñas en los pulmones. [22] Si bien varios virus pueden causar bronquiolitis, el VSR es responsable de aproximadamente el 70% de los casos. [4] Por lo general, se presenta con 2 a 4 días de secreción nasal y congestión seguida de empeoramiento de la tos, respiración ruidosa, taquipnea (respiración rápida) y sibilancias . [20] A medida que los bebés trabajan más para respirar, también pueden mostrar signos de dificultad respiratoria , como retracciones subcostales (cuando el vientre tira debajo de la caja torácica), retracciones intercostales (cuando los músculos entre las costillas tiran hacia adentro), gruñidos y aleteo nasal. [19] Si el niño no ha podido alimentarse adecuadamente, también pueden estar presentes signos de deshidratación . [20] Puede haber fiebre, pero la fiebre alta es poco común. [19] A menudo se pueden escuchar crepitaciones y sibilancias durante la auscultación , y los niveles de saturación de oxígeno pueden estar disminuidos. [22]
En los lactantes muy pequeños, menores de seis semanas de edad, y en particular en los prematuros, los signos de infección pueden ser menos específicos. Pueden tener una afectación respiratoria mínima. En cambio, pueden presentar una disminución de la actividad, irritabilidad, mala alimentación o dificultad para respirar. Esto también puede ir acompañado de episodios de apnea o breves pausas en la respiración. [4] [23]
La reinfección por VRS sigue siendo común durante toda la vida. La reinfección en la edad adulta a menudo produce solo síntomas leves a moderados indistinguibles de un resfriado común o una infección sinusal . [4] La infección también puede ser asintomática . Si está presente, los síntomas generalmente se limitan al tracto respiratorio superior: secreción nasal, dolor de garganta, fiebre y malestar . En la gran mayoría de los casos, la congestión nasal precede al desarrollo de la tos. [3] A diferencia de otras infecciones de las vías respiratorias superiores, el VRS también es más probable que cause sibilancias de nueva aparición en adultos. [3] Alrededor del 25% de los adultos infectados progresarán a una infección significativa del tracto respiratorio inferior, como bronquitis o traqueobronquitis . [19]
Si bien el VSR rara vez causa una enfermedad grave en adultos sanos, puede causar morbilidad y mortalidad en los ancianos y en aquellos con compromiso inmunológico subyacente o enfermedad cardiopulmonar. Los adultos mayores tienen una presentación similar a la de los adultos más jóvenes, pero tienden a tener una mayor gravedad de los síntomas con un mayor riesgo de compromiso de las vías respiratorias inferiores. En particular, los ancianos tienen más probabilidades de sufrir neumonía , dificultad respiratoria y muerte. [3]
Tanto en adultos como en niños, las personas inmunodeprimidas tienen un mayor riesgo de infección grave por VRS. Las personas infectadas en este grupo tienen más probabilidades de progresar de la afectación del tracto respiratorio superior a la inferior y tener una eliminación viral prolongada . [24] La gravedad de los síntomas parece estar estrechamente relacionada con el grado de supresión inmunitaria. Aquellos que se han sometido a un trasplante de células madre hematopoyéticas (TCMH), quimioterapia intensiva y trasplante de pulmón son particularmente susceptibles. [3] [25] Los pacientes con trasplante de médula ósea parecen tener el mayor riesgo, especialmente antes del injerto de médula. En este grupo, la infección por VRS conlleva un riesgo de casi el 80% tanto de neumonía como de muerte. [3] [26]
El virus sincitial respiratorio (VSR) afecta a muchas poblaciones de manera diferente. La población con mayor riesgo de complicaciones por VSR son los adultos mayores y aquellos con afecciones médicas subyacentes o individuos inmunodeprimidos. [27] Entre 60.000 y 160.000 adultos mayores en los Estados Unidos son hospitalizados anualmente con VSR. Entre 6.000 y 10.000 de los adultos mayores mueren por infección por VSR cada año. [28] Además, el VSR puede "... conducir al empeoramiento de afecciones graves como asma , enfermedad pulmonar obstructiva crónica (EPOC), una enfermedad crónica de los pulmones que dificulta la respiración, e incluso insuficiencia cardíaca congestiva, cuando el corazón no puede bombear suficiente sangre y oxígeno a través del cuerpo". [28] La atención médica oportuna y adecuada es importante para los adultos mayores, ya que esperar o recibir un diagnóstico erróneo puede estar asociado con un mayor riesgo de complicaciones. A partir de agosto de 2023, los adultos de 60 años o más califican para la vacunación contra el VSR en Canadá y los Estados Unidos. [28]
Los factores de riesgo para el desarrollo de una infección grave del tracto respiratorio inferior por VSR varían según la población.
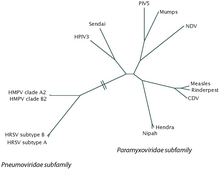
El VRS es un virus de ARN monocatenario de sentido negativo . [2] El nombre científico de esta especie viral es ortopneumovirus humano . Este es sinónimo de virus respiratorio sincitial humano (hRSV), que a menudo se abrevia simplemente como VRS. [34] Pertenece al género Orthopneumovirus , familia Pneumoviridae , orden Mononegavirales . [2] Su nombre proviene del hecho de que las proteínas F en la superficie del virus hacen que las membranas celulares vecinas se fusionen, creando grandes sincitios multinucleados . [3]
El VSR se divide en dos subtipos antigénicos, A y B, según la reactividad de las proteínas de superficie F y G a los anticuerpos monoclonales. [2] [3] Los subtipos tienden a circular simultáneamente en epidemias locales, aunque el subtipo A tiende a ser más frecuente. [26] En general, se cree que el subtipo A del VSR (VASR) es más virulento que el subtipo B del VSR (VBSR), con cargas virales más altas y un tiempo de transmisión más rápido. [2] [3] Hasta la fecha, se han identificado 16 clados del VASR y 22 del VBSR. [2] Entre el VASR, predominan los clados GA1, GA2, GA5 y GA7; el GA7 se encuentra solo en los Estados Unidos. [2] Entre el VBSR, el clado BA predomina en todo el mundo. [2]

El VSR tiene un genoma de ARN monocatenario de sentido negativo . [2] El genoma es lineal y tiene una longitud de aproximadamente 15 000 nucleótidos . [3] Tiene 10 genes que codifican 11 proteínas. [2] [4] El orden de los genes es NS1-NS2-NPM-SH-GF-M2-L, y los genes NS1 y NS2 actúan como genes promotores no estructurales. [35]

_EM_PHIL_2175_lores.jpg/440px-Respiratory_Syncytial_Virus_(RSV)_EM_PHIL_2175_lores.jpg)
El VSR es un virus con envoltura de tamaño mediano (~150 nm ) . Si bien muchas partículas son esféricas, también se han identificado especies filamentosas. [2] [3] El genoma se encuentra dentro de una nucleocápside helicoidal y está rodeado por una proteína matriz y una envoltura que contiene glucoproteínas virales. [36] Hay 11 proteínas, que se describen con más detalle en la siguiente tabla.
_(52456711008).jpg/440px-Human_Respiratory_Syncytial_Virus_(RSV)_(52456711008).jpg)
_(52501736052).jpg/440px-Human_Respiratory_Syncytial_Virus_(RSV)_(52501736052).jpg)
La proteína de superficie G (glicoproteína) es la principal responsable de la unión viral a las células huésped. [37] Esta proteína es muy variable entre cepas. [26] La proteína G existe tanto en forma unida a la membrana como secretada. [3] [37] La forma que se encuentra en la membrana es responsable de la unión mediante la unión a los glicosaminoglicanos (GAG), como el heparán sulfato , en la superficie de las células huésped. [2] [4] [3] La forma secretada actúa como un señuelo, interactuando con las células presentadoras de antígenos para inhibir la neutralización mediada por anticuerpos . [3] [37] La proteína G también contiene un motivo similar a la fractalquina CX3C que se une al receptor de quimiocina CX3C 1 ( CX3CR1 ) en la superficie de las células huésped bronquiales ciliadas. [2] [4] Esta unión puede alterar la quimiotaxis celular y reducir la migración de células inmunes a los pulmones de individuos infectados. [37] La proteína G también altera la respuesta inmune del huésped al inhibir la señalización de varios receptores tipo Toll , incluido TLR4 . [4] [37]
La proteína de superficie F (proteína de fusión) es responsable de la fusión de las membranas virales y de la célula huésped, así como de la formación de sincitios entre partículas virales. [37] Su secuencia está altamente conservada entre cepas. [26] Si bien la unión viral parece involucrar tanto a las proteínas F como a las G, la fusión de F ocurre independientemente de G. [37] La proteína F existe en múltiples formas conformacionales. [2] [4] En el estado de prefusión (PreF), la proteína existe en una forma trimérica y contiene el sitio antigénico principal Ø. [2] Ø sirve como un objetivo primario de anticuerpos neutralizantes en el cuerpo. [4] Después de unirse a su objetivo en la superficie de la célula huésped (su ligando exacto sigue sin estar claro), PreF sufre un cambio conformacional durante el cual se pierde Ø. [2] [4] Este cambio permite que la proteína se inserte en la membrana de la célula huésped y conduce a la fusión de las membranas viral y de la célula huésped. [2] Un cambio conformacional final da como resultado una forma más estable y alargada de la proteína (posfusión, PostF). [4] A diferencia de la proteína G del VRS, la proteína F del VRS también se une al receptor tipo Toll 4 (TLR4) y lo activa, iniciando la respuesta inmune innata y la transducción de señales. [2] [37]

Tras la fusión de las membranas virales y de la célula huésped, la nucleocápside viral (que contiene el genoma viral) y la polimerasa viral asociada se introducen en el citoplasma de la célula huésped . Tanto la transcripción como la traducción se producen dentro del citoplasma. La ARN polimerasa dependiente de ARN transcribe el genoma en 10 segmentos de ARN mensajero ( ARNm ) que se traduce en proteínas estructurales por la maquinaria de la célula huésped. Durante la replicación del genoma viral de sentido negativo , la ARN polimerasa dependiente de ARN sintetiza un complemento de sentido positivo llamado el antígeno. Esta cadena complementaria se utiliza como plantilla para construir el ARN genómico de sentido negativo, que se empaqueta en nucleocápsides y se transporta a la membrana plasmática para el ensamblaje y la gemación de partículas. [36]
El VSR es altamente contagioso y puede causar brotes tanto en la comunidad como en el hospital. [3] Por cada persona infectada con VSR, se estima que un promedio de 5 a 25 personas no infectadas se infectarán. [38] El VSR puede propagarse cuando una persona infectada tose o estornuda, liberando gotitas contaminadas en el aire. La transmisión generalmente ocurre cuando estas gotitas entran en contacto con los ojos, la nariz o la boca de otra persona. [39] Al igual que con todos los patógenos respiratorios que alguna vez se presumía que se transmitían a través de gotitas respiratorias, es muy probable que se transmita por los aerosoles generados durante la respiración rutinaria, el habla e incluso el canto. [9] El VSR también puede vivir hasta 25 minutos en la piel contaminada (es decir, las manos) y varias horas en otras superficies como encimeras y pomos de puertas. [3] [38] Tiene un período de incubación de 2 a 8 días. [3] Una vez infectadas, las personas suelen ser contagiosas durante 3 a 8 días. Sin embargo, en los bebés y en las personas con sistemas inmunitarios debilitados, el virus puede seguir propagándose hasta cuatro semanas (incluso después de que ya no presenten síntomas). [39]
_infection_x400.jpg/440px-Respiratory_syncytial_virus_(RSV)_infection_x400.jpg)
Después de la transmisión a través de la nariz o los ojos, el VRS infecta las células epiteliales columnares ciliadas de las vías respiratorias superiores e inferiores. [3] El VRS continúa replicándose dentro de estas células bronquiales durante unos 8 días. [2] Después de los primeros días, las células infectadas por el VRS se volverán más redondeadas y finalmente se desprenderán en los bronquiolos más pequeños de las vías respiratorias inferiores. [2] También se cree que este mecanismo de desprendimiento es responsable de la propagación del virus del tracto respiratorio superior al inferior. [2] La infección causa inflamación generalizada dentro de los pulmones, incluida la migración e infiltración de células inflamatorias (como monocitos y células T), necrosis de la pared celular epitelial, edema y aumento de la producción de moco. [3] La inflamación y el daño celular tienden a ser irregulares en lugar de difusos. [3] Juntos, las células epiteliales desprendidas, los tapones mucosos y las células inmunes acumuladas causan obstrucción de las vías respiratorias inferiores. [2] [3]
Después de la recuperación de las “enfermedades respiratorias asociadas con la infección por VRS, el virus interfiere con el establecimiento de la memoria inmunológica, lo que conduce a reinfecciones recurrentes”. [40] Se estima que “el 36% de los individuos” pueden volver a infectarse con VRS “al menos una vez, durante la temporada de invierno”. [40] Reinfecciones como estas pueden ser el resultado de “un encuentro inicial con el VRS” que “no logra iniciar respuestas inmunes humorales y celulares adecuadas para generar linfocitos de memoria protectores”. [40]
La reinfección por VRS puede ocurrir a lo largo de la vida. Como resultado, puede causar "epidemias de invierno o principios de primavera en regiones templadas, pero la sincronización de la actividad del VRS puede variar ampliamente" según la región en la que viva una persona. [40] Por lo general, "a menos que estén inmunodeprimidos", los adultos tienen síntomas leves cuando se vuelven a infectar. [41] Los síntomas leves tienden a restringir las vías respiratorias superiores. Sin embargo, las personas más jóvenes son extremadamente vulnerables a desarrollar "síntomas graves", que generalmente afectan las vías respiratorias inferiores. [41] Dado que los bebés tienen vías respiratorias más pequeñas que los niños, "pueden estar obstruidas por inflamación, edema y moco". [41] Esto puede contribuir al desarrollo de una "enfermedad más grave del tracto respiratorio inferior". [41] Como se mencionó, la reinfección por VRS es frecuente entre todas las edades y el tipo de respuesta del huésped a la reinfección puede determinar "qué niños desarrollarán sibilancias persistentes y posiblemente asma". [41] Es posible que la edad en la que se contrae la infección por VRS sea un factor vital para "determinar el fenotipo de la respuesta de las vías respiratorias a la infección posterior por VRS". [41]
Las variaciones genéticas en los epítopos virales y las regiones adyacentes afectan el plegamiento de proteínas, las modificaciones postranscripcionales y el procesamiento antigénico, lo que influye en la inmunidad de las células B y T durante las infecciones virales. [42] Esta alteración en la conformación puede conducir a la evasión inmunológica, lo que puede afectar la gravedad de la enfermedad, los brotes y las reinfecciones. En particular, la variabilidad observada en el gen G, seguido de los genes SH y F, sugiere una correlación entre las diferencias estructurales en las proteínas y su inmunogenicidad. [42] Específicamente, la curvatura irregular y la baja energía de enlace de la proteína G la hacen propensa a cambios conformacionales, lo que afecta su inmunogenicidad y potencialmente modula la respuesta inmunológica. [42]
Los diferentes genotipos del VRS presentan variaciones en la conformación estructural de proteínas clave como G, SH y F, lo que afecta las respuestas inmunitarias. La aparición de nuevos genotipos como ON1 y BA9 se asocia con diferencias estructurales distintivas, en particular en la proteína G, que puede contribuir a la evasión inmunitaria. La evidencia sugiere que la glicoproteína G del VRS desempeña un papel crucial en la modulación inmunitaria durante la infección, afectando la expresión de citocinas y la respuesta antiviral. [42] Además, la presión de selección positiva impulsa el predominio de ciertos genotipos sobre otros, posiblemente impulsado por mutaciones dentro de regiones específicas del gen G. [ cita requerida ]
La proteína F es un objetivo importante para los anticuerpos neutralizantes, pero su variabilidad permite la evasión viral de la neutralización, lo que afecta la eficacia de anticuerpos como Palivizumab. [42] Se observan reacciones cruzadas entre los subtipos y genotipos del VRS, pero las respuestas inmunitarias son específicas del subtipo o genotipo, lo que indica el impacto de las mutaciones genéticas, particularmente en la proteína G, en la evasión inmunitaria. Además, las diferencias en la expresión de citocinas y las respuestas de las células inmunitarias resaltan la complejidad de las interacciones inmunitarias durante la infección por VRS. Las variaciones genómicas del VRS, particularmente en proteínas como G y F, influyen en las respuestas inmunitarias y contribuyen a la evasión inmunitaria. Este arsenal inmunomodulador multifacético probablemente contribuye a la capacidad del VRS de causar síntomas respiratorios leves en la mayoría de los casos, pero plantea una amenaza grave para las poblaciones vulnerables, como los bebés y los ancianos, y puede provocar una enfermedad pulmonar potencialmente mortal caracterizada por una desregulación inmunitaria. El VRS ha desarrollado numerosas estrategias para evadir la respuesta antiviral del huésped, y más de la mitad de sus proteínas ejercen efectos inmunomoduladores.
Existen diversas pruebas de laboratorio disponibles para el diagnóstico de la infección por VRS. Si bien la Academia Estadounidense de Pediatría (AAP) no recomienda de manera rutinaria el uso de pruebas de laboratorio para diagnosticar la bronquiolitis por VRS (para la cual el tratamiento es en gran medida de apoyo), [5] la confirmación de la infección por VRS puede estar justificada en grupos de alto riesgo si el resultado orientará las decisiones clínicas. Las técnicas de identificación comunes incluyen pruebas de antígenos, pruebas moleculares y cultivo viral. [3]
La prueba de antígenos implica la detección de fragmentos de antígenos del VRS (o partes de estructuras virales moleculares), generalmente a partir de un hisopo o aspirado nasofaríngeo . Esto se puede lograr ya sea observando antígenos marcados con fluorescencia bajo un microscopio (ensayo de fluorescencia directa o DFA) o utilizando una prueba de detección rápida de antígenos (RADT) disponible comercialmente. [3] En general, la prueba de antígenos es altamente sensible en niños pequeños (80-90%) pero sustancialmente menos confiable en niños mayores y adultos, que tienen una menor eliminación viral. [3] Las pruebas de antígenos también están sujetas a tasas más altas de falsos positivos fuera de la temporada alta del VRS, como en los meses de verano. En estos escenarios, el uso de un cultivo viral o una prueba de amplificación de ácidos nucleicos (NAAT) puede ayudar a un diagnóstico preciso del VRS. [ cita requerida ]
Los ensayos moleculares, como las pruebas de amplificación de ácidos nucleicos (NAAT), permiten la detección sensible de cantidades muy pequeñas de virus en hisopos y aspirados nasofaríngeos. Los ensayos NAAT, como la reacción en cadena de la polimerasa (PCR), detectan material genético específico del virus, en lugar de antígenos virales. Tienen una sensibilidad y especificidad cercanas al 100%. [43] Sin embargo, tienden a ser más costosos y requieren equipos más complejos que otros métodos de prueba, lo que los hace menos prácticos en áreas con recursos limitados. Las pruebas moleculares para el VRS no se recomiendan de manera rutinaria para todas las personas con síntomas respiratorios. Sin embargo, pueden recomendarse para aquellos con alto riesgo de complicaciones por el VRS, como bebés, adultos mayores y personas con afecciones médicas crónicas. [ cita médica requerida ] La RT-PCR tiene una sensibilidad del 90-95% y una especificidad del 98-99%, mientras que la LAMP tiene una sensibilidad del 95-100% y una especificidad del 99-100%. [ cita requerida ]
En el cultivo viral tradicional , se introduce una muestra del virus en diferentes líneas celulares y se permite que se replique para poder estudiarlo. Los beneficios de esta técnica incluyen la capacidad de realizar caracterización genética, tipificación de cepas y pruebas de susceptibilidad antiviral. Sin embargo, está limitada por su prolongado tiempo de respuesta de 3 a 7 días, lo que la hace menos común en la atención al paciente y más común en entornos de investigación. [3]
La serología (la medición de anticuerpos específicos del virus en el suero ) no se utiliza con frecuencia en el diagnóstico del VRS. El tiempo que requiere el cuerpo para generar una respuesta serológica significativa (y demostrar un aumento significativo de los anticuerpos que se pueden detectar en el suero) no suele ser útil para orientar la atención del paciente. [2] Hasta el 30% de los pacientes con infección documentada por VRS tendrán resultados serológicos negativos. [43] Por ello, este método se reserva generalmente para estudios de investigación y vigilancia. [2]
Los hallazgos de las radiografías de tórax en niños con bronquiolitis por VRS son generalmente inespecíficos e incluyen marcas perihiliares , hiperinsuflación irregular y atelectasia . [20] Sin embargo, la Academia Estadounidense de Pediatría (AAP) no recomienda la realización de imágenes de rutina para niños con presunta bronquiolitis por VRS porque no cambia los resultados clínicos y se asocia con un mayor uso de antibióticos. [20] [5] A veces se considera la realización de una radiografía de tórax cuando el diagnóstico de bronquiolitis no está claro o cuando hay un empeoramiento inesperado. [5] En adultos con infección por VRS, las radiografías de tórax a menudo son normales o muestran cambios inespecíficos compatibles con neumonía viral, como infiltrados bilaterales irregulares. [44]
El diagnóstico diferencial para las personas que presentan signos y síntomas de infección de las vías respiratorias superiores e inferiores incluye otras infecciones virales (como rinovirus , metapneumovirus e influenza) y neumonía bacteriana primaria. En los niños, generalmente se consideran los cuerpos extraños inhalados y las afecciones congénitas como la fibrosis quística o el asma. [3]
La principal medida de prevención es evitar el contacto cercano con personas infectadas. [5] Las precauciones contra la transmisión aérea, como respiradores , ventilación y filtros HEPA / MERV alto , probablemente protejan contra los aerosoles cargados de VSR. [9]
Existe interés y se están realizando investigaciones para descubrir una vacuna contra el VRS, dada la carga de morbilidad del virus y la falta de terapias específicas para la enfermedad. [45] El desarrollo de la vacuna se ha enfrentado a obstáculos que han bloqueado su progreso. Entre ellos se encuentran factores específicos de los bebés, como el sistema inmunológico inmaduro del niño y la presencia de anticuerpos maternos , que dificultan la inmunización infantil . [3]
La infección por VRS está muy extendida en la primera infancia y contribuye de forma significativa a la carga mundial de enfermedad. No se entiende del todo la asociación entre infecciones graves en la infancia y problemas respiratorios posteriores, en particular el vínculo sugerido entre bronquiolitis, sibilancias infantiles recurrentes y asma infantil. A diferencia de otros patógenos respiratorios prevenibles mediante vacunas, el VRS ha demostrado ser un desafío para el desarrollo de vacunas. Los esfuerzos en curso se centran en la creación de vacunas que confieran protección duradera, y se esperan con impaciencia los ensayos de campo. En la actualidad, la atención de apoyo es el pilar para el tratamiento de la enfermedad por VRS, ya que se esperan vacunas y medicamentos antivirales eficaces. La introducción de antivirales y vacunas, junto con técnicas de diagnóstico avanzadas, promete reducir el impacto mundial del VRS en los próximos años. Estas intervenciones pueden alterar la dinámica de la infección y debilitar el control del VRS en las comunidades de todo el mundo. [3]
Las vacunas potenciales que se están investigando se dividen en cinco grandes categorías: vacunas vivas atenuadas , vacunas de subunidades proteicas , vacunas basadas en vectores , vacunas de subunidades de partículas virales y vacunas de ARN mensajero . Cada una de ellas se dirige a diferentes respuestas inmunitarias y, por lo tanto, puede ser más adecuada para prevenir enfermedades en diferentes grupos de riesgo. Las vacunas vivas atenuadas han demostrado cierto éxito en bebés que no han estado expuestos al VRS. Se espera que otras vacunas candidatas se dirijan a poblaciones vulnerables a lo largo de la vida, incluidas las mujeres embarazadas y los ancianos. [46] [3]
Los principales desarrolladores farmacéuticos, GSK y Pfizer, obtuvieron la aprobación de la Administración de Alimentos y Medicamentos (FDA) para vacunas contra el VRS dirigidas a adultos de 60 años o más. Arexvy de GSK cuenta con una eficacia del 94% contra el VRS grave y del 83% contra el sintomático en este grupo de edad, mientras que Abrysvo de Pfizer tiene una eficacia del 86% contra los síntomas graves y del 67% contra la enfermedad sintomática en adultos de 60 años o más. [49]
Para abordar el aspecto más desafiante, la necesidad de una vacuna para recién nacidos, los investigadores emplearon un enfoque de administración durante el embarazo para proteger a los bebés durante los primeros seis meses, un período crítico para la susceptibilidad al VRS. [49] El comité asesor de la FDA respaldó la vacuna contra el VRS de Pfizer, reconociendo su efectividad del 82% contra el VRS grave en recién nacidos hasta los tres meses y una eficacia del 69% hasta los seis meses. Si bien el comité votó unánimemente a favor de la eficacia, por 10 a 4 a favor de la seguridad, con preocupaciones sobre una tasa de nacimientos prematuros ligeramente más alta en el grupo vacunado. GSK detuvo su propio ensayo debido a una probabilidad un 38% mayor de nacimientos prematuros en el grupo de la vacuna. [49]
En mayo de 2023, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) aprobó las primeras vacunas contra el VRS , Arexvy (desarrollada por GSK plc ) y Abrysvo ( Pfizer ). [10] [11] Mresvia es una vacuna de ARNm que fue aprobada para uso médico en los Estados Unidos en mayo de 2024. [50] [51] [52]
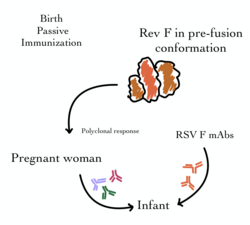
Históricamente, se utilizaba inmunoglobulina intravenosa específica contra el VRS (IVIG) para proporcionar inmunidad pasiva y prevenir la infección por VRS y la hospitalización en los lactantes de mayor riesgo. Esto implicaba la administración mensual de anticuerpos neutralizantes del VRS (o inmunoglobulinas) de donantes humanos que se recuperaban de la enfermedad. Si bien esta transferencia de anticuerpos era razonablemente eficaz para proporcionar inmunización a corto plazo a los lactantes en riesgo, estaba limitada tanto por su administración intravenosa como por su costo. [53]
Desde entonces, la inmunoglobulina intravenosa contra el VSR ha sido sustituida por un anticuerpo monoclonal (MAb) que se puede administrar mediante inyección muscular . Palivizumab (Synagis) es un anticuerpo monoclonal dirigido contra la proteína de fusión de superficie (F) del virus VSR. Se autorizó en 1998 y es eficaz para proporcionar profilaxis temporal contra los VSR A y B. Se administra mediante inyecciones mensuales, que se inician justo antes de la temporada de VSR y suelen continuar durante cinco meses. Se ha demostrado que el palivizumab reduce tanto las tasas de hospitalización como la mortalidad por todas las causas en ciertos grupos de niños de alto riesgo (como los que padecen enfermedad pulmonar crónica, cardiopatía congénita y los nacidos prematuramente). [38] [54] Sin embargo, su coste limita su uso en muchas partes del mundo. Desde entonces se han desarrollado derivados más potentes de este anticuerpo (incluido el motavizumab ), pero se asociaron a efectos adversos considerables. [55]
La Academia Estadounidense de Pediatría (AAP 2014) recomienda la profilaxis del VSR con palivizumab durante la temporada de VSR para: [5]
Según las pautas de la AAP, la profilaxis con palivizumab también puede considerarse en bebés con: [5]
El nirsevimab (Beyfortus) es otro anticuerpo monoclonal antiviral que ha sido aprobado para la prevención de la enfermedad del tracto respiratorio inferior causada por el virus sincitial respiratorio en recién nacidos y lactantes durante su primera temporada de infección por el virus sincitial respiratorio. [56] El nirsevimab requiere solo una dosis que dura toda la temporada de infección por el virus sincitial respiratorio, a diferencia del palivizumab, que debe inyectarse aproximadamente una vez al mes hasta cuatro veces para mantener su eficacia. [12] El nirsevimab fue aprobado para uso médico en la Unión Europea [57] [58] y el Reino Unido [59] en noviembre de 2022, y en Canadá en abril de 2023. [12]
El tratamiento de la infección por VRS se centra principalmente en medidas de apoyo, que pueden incluir la monitorización de la respiración del paciente o el uso de succión para eliminar las secreciones de las vías respiratorias superiores. También se puede administrar oxígeno suplementario a través de una cánula nasal o una mascarilla facial para mejorar el flujo de aire. En casos graves de insuficiencia respiratoria, puede ser necesaria la intubación y la ventilación mecánica para ayudar a la respiración. Si hay signos de deshidratación, también se pueden administrar líquidos por vía oral o intravenosa. [53]
Se han investigado otros tratamientos de apoyo en los bebés hospitalizados con bronquiolitis por VRS, entre ellos:
Los broncodilatadores , medicamentos que se usan comúnmente para tratar el asma, a veces se usan para tratar las sibilancias asociadas con la infección por VRS. Estos medicamentos (como el albuterol o el salbutamol ) son beta-agonistas que relajan los músculos de las vías respiratorias para permitir un mejor flujo de aire. Sin embargo, no se ha demostrado que los broncodilatadores mejoren la gravedad clínica de la infección o la tasa de hospitalización entre las personas con infección por VRS. Dado su beneficio limitado, además de su perfil de eventos adversos , no se recomiendan de manera rutinaria para su uso en la bronquiolitis por VRS. [53] [67]
La terapia con antibióticos no es adecuada para el tratamiento de la bronquiolitis o la neumonía viral relacionadas con el VRS. [69] Los antibióticos se dirigen a los patógenos bacterianos , no a los patógenos virales como el VRS. Sin embargo, se puede considerar el uso de antibióticos si hay evidencia clara de que se ha desarrollado una infección bacteriana secundaria. También pueden desarrollarse infecciones de oído en un pequeño número de bebés con bronquiolitis por VRS, en cuyo caso a veces se pueden utilizar antibióticos orales. [53]
Además de las vacunas, AstraZeneca y Sanofi introdujeron el nirsevimab , un anticuerpo monoclonal profiláctico con una eficacia del 75% contra los casos de VRS en bebés menores de un año. Europa aprobó el nirsevimab en noviembre de 2022 y la FDA hizo lo propio en julio de 2023. El clerrovimab de Merck, un anticuerpo monoclonal similar, se encuentra en ensayos de fase avanzada. [49]
En todo el mundo, el VSR es la principal causa de bronquiolitis y neumonía en lactantes y niños menores de 5 años. El riesgo de infección grave es mayor durante los primeros 6 meses de vida. De las personas infectadas con VSR, entre el 2 y el 3 % desarrollarán bronquiolitis , lo que requerirá hospitalización. [70] Cada año, aproximadamente 30 millones de enfermedades respiratorias agudas y más de 60 000 muertes infantiles son causadas por el VSR en todo el mundo. Se estima que el 87 % de los lactantes habrán experimentado una infección por VSR a la edad de 18 meses, y casi todos los niños habrán sido infectados a los 3 años. En los Estados Unidos, el VSR es responsable de hasta el 20 % de las hospitalizaciones por infección respiratoria aguda en niños menores de 5 años. Sin embargo, la gran mayoría de las muertes relacionadas con el VSR ocurren en países de bajos ingresos que carecen de acceso a cuidados básicos de apoyo. [3]
El uso profiláctico de palivizumab o nirsevimab (ambos son tratamientos con anticuerpos monoclonales ) puede prevenir la infección por VRS en lactantes de alto riesgo. Existe la inmunización pasiva para prevenir la infección por VRS y la hospitalización en los lactantes de mayor riesgo.
Un artículo de JAMA Open de 2024 sugirió que un aumento en las muertes infantiles súbitas e inesperadas (SUID, por sus siglas en inglés) puede estar relacionado con un aumento inusual del VSR en 2021. [71] Los investigadores analizaron más de 14 000 casos de SUID utilizando registros de los CDC y descubrieron que la tasa por cada 100 000 nacidos vivos aumentó un 10 % entre 2019 y 2021. [72] El estudio reveló que el riesgo de SUID fue más alto de junio a diciembre de 2021, coincidiendo con un aumento fuera de temporada en las hospitalizaciones por VSR después de que el virus se desviara de su patrón invernal típico en 2020. [73]
Es poco frecuente que los adultos jóvenes sanos desarrollen una enfermedad grave que requiera hospitalización a causa del VRS. Sin embargo, ahora se reconoce como una causa importante de morbilidad y mortalidad en ciertas poblaciones adultas, incluidos los ancianos y aquellos con enfermedades cardíacas o pulmonares subyacentes. Se estima que su impacto clínico entre los adultos mayores es similar al de la gripe . [26] Cada año, aproximadamente el 5-10% de los residentes de hogares de ancianos sufrirán una infección por VRS, con tasas significativas de neumonía y muerte. El VRS también es responsable del 2-5% de las neumonías adquiridas en la comunidad en adultos . [26]
Tanto en adultos como en niños, la inmunosupresión aumenta la susceptibilidad a la infección por VRS. Los niños que viven con VIH tienen más probabilidades de desarrollar una enfermedad aguda y tienen 3,5 veces más probabilidades de requerir hospitalización que los niños sin VIH. [3] Los pacientes con trasplante de médula ósea antes del injerto de médula ósea tienen un riesgo particularmente alto, ya que el VRS representa casi la mitad de las infecciones virales en esta población. Este grupo también ha demostrado tasas de mortalidad de hasta el 80% entre aquellos con neumonía por VRS. [26] Si bien la infección puede ocurrir dentro de la comunidad, se cree que la infección adquirida en el hospital representa el 30-50% de los casos entre las personas inmunodeprimidas. [26]
La estacionalidad del VRS varía en todo el mundo. En climas templados , las tasas de infección tienden a ser más altas durante los meses fríos de invierno. Esto a menudo se atribuye al aumento del hacinamiento en interiores y al aumento de la estabilidad viral en las temperaturas más bajas. Sin embargo, en climas tropicales y árticos, la variación anual está menos definida y parece ser más frecuente durante la temporada de lluvias. [2] [3] Las epidemias anuales generalmente son causadas por la presencia de varias cepas virales diferentes. Los virus de los subtipos A y B a menudo circulan simultáneamente dentro de una región geográfica específica, aunque los virus del grupo A son más frecuentes. [26]
Un estudio investigó las respuestas de las células T específicas del VRS en "55 bebés hospitalizados por bronquiolitis por VRS y descubrió que estas respuestas eran similares durante la enfermedad aguda y la recuperación, y no aumentaban después de infecciones posteriores por VRS. [41] Esto sugiere que las respuestas de las células T específicas del VRS pueden no prevenir la reinfección y podrían no expandirse de manera efectiva en el cuerpo después de la reinfección. Sin embargo, es posible que estas células puedan estar ubicadas en áreas específicas de los pulmones y responder con más fuerza a la infección secundaria, como se vio en estudios con animales. Por ejemplo, un estudio con ratones mostró que la "extensión de la respuesta inflamatoria del BALF a la reinfección en la edad adulta está determinada por la edad en la primera infección". [41] El estudio también descubrió que los patrones difieren en que "la infección neonatal prepara al huésped para desarrollar una respuesta sesgada hacia Th2". [41] Los mecanismos exactos detrás de este fenómeno siguen sin estar claros. Una posibilidad es que la falta de producción de IFN-γ en los recién nacidos durante su primer encuentro con el VRS, posiblemente debido a un sistema inmunológico inmaduro, permita la La aparición de una respuesta sesgada hacia Th2 que persiste y puede volver a desencadenarse durante infecciones posteriores por VRS. [41] Sin embargo, es improbable que las variaciones únicamente en los niveles de IFN-γ expliquen esta ventana de susceptibilidad. La IL-13 parece desempeñar un papel importante como regulador en este proceso. La IL-13 es una proteína ubicada en el pulmón. Es un "mediador del asma alérgico" y se encarga de "regular la inflamación eosinofílica, la secreción de moco y la hiperreactividad de las vías respiratorias". [74]
Las infecciones por SARS-CoV-2 , el virus responsable de la COVID-19 , pueden provocar un mayor riesgo de infección por VRS. [75] En noviembre de 2022, la tasa de hospitalización por VRS en recién nacidos fue siete veces mayor que en 2018. [ cita requerida ] Esto, combinado con el aumento de la circulación de la gripe, provocó que el estado estadounidense de Oregón declarara el estado de emergencia. [ cita requerida ] La Asociación de Hospitales Infantiles y la Academia Estadounidense de Pediatría pidieron al presidente estadounidense Joe Biden que declarara el estado de emergencia. [76]
Los hallazgos de un estudio transversal de 2024 de 6248 adultos hospitalizados con infección por VRS sugieren que los eventos cardíacos agudos son comunes entre los adultos mayores hospitalizados con infección por VRS y están asociados con resultados clínicos graves. Casi una cuarta parte de las personas hospitalizadas mayores de 50 años con VRS experimentaron un evento cardíaco agudo (con mayor frecuencia insuficiencia cardíaca aguda), incluido 1 de cada 12 adultos (8,5 %) sin enfermedad cardiovascular subyacente documentada. Los pacientes que tuvieron eventos cardíacos agudos tuvieron casi el doble de riesgo de un resultado grave que los pacientes que no los tuvieron. [77] [78]
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace )