La púrpura de Henoch-Schönlein ( PHS ), también conocida como vasculitis por IgA , es una enfermedad de la piel , las mucosas y, en ocasiones, otros órganos que afecta con mayor frecuencia a los niños . En la piel, la enfermedad causa púrpura palpable (pequeñas zonas elevadas de sangrado debajo de la piel), a menudo con dolor en las articulaciones y dolor abdominal . En caso de afectación renal , puede haber una pérdida de pequeñas cantidades de sangre y proteínas en la orina ( hematuria y proteinuria ), pero esto suele pasar desapercibido; en una pequeña proporción de casos, la afectación renal progresa a una enfermedad renal crónica . La PHS suele estar precedida por una infección , como una infección de garganta .
La HSP es una vasculitis sistémica ( inflamación de los vasos sanguíneos ) y se caracteriza por el depósito de complejos inmunes que contienen el anticuerpo inmunoglobulina A (IgA); la causa exacta de este fenómeno es desconocida. En los niños, por lo general se resuelve en varias semanas y no requiere tratamiento aparte del control de los síntomas, pero puede recaer en un tercio de los casos y causar daño renal irreversible en aproximadamente uno de cada cien casos. En los adultos, el pronóstico es diferente al de los niños. La duración media de las lesiones cutáneas es de 27,9 meses. [3] Para muchos, tiende a ser recurrente-remitente durante un largo período de tiempo, en lugar de autolimitarse y tiende a haber más complicaciones. [4]


La púrpura , la artritis y el dolor abdominal se conocen como la "tríada clásica" de la púrpura de Henoch-Schönlein. [5] La púrpura se presenta en todos los casos, los dolores articulares y la artritis en el 80%, y el dolor abdominal en el 62%. Algunos incluyen la hemorragia gastrointestinal como cuarto criterio; esto ocurre en el 33% de los casos, a veces, pero no necesariamente siempre, debido a la invaginación intestinal . [6] La púrpura suele aparecer en las piernas y las nalgas, pero también puede verse en los brazos, la cara y el tronco. El dolor abdominal es de carácter cólico y puede ir acompañado de náuseas, vómitos, estreñimiento o diarrea. Puede haber sangre o moco en las heces. [7] Las articulaciones afectadas tienden a ser los tobillos , las rodillas y los codos , pero es posible la artritis en las manos y los pies; la artritis no es erosiva y, por tanto, no causa deformidad permanente. [5] El cuarenta por ciento tiene evidencia de compromiso renal , principalmente en forma de hematuria (sangre en la orina), pero sólo una cuarta parte tendrá ésta en cantidades suficientes para ser notoria sin pruebas de laboratorio. [6] Pueden ocurrir problemas en otros órganos, como el sistema nervioso central (cerebro y médula espinal) y los pulmones , pero es mucho menos común que en la piel, el intestino y los riñones. [8]
Del 40% de los pacientes que desarrollan afectación renal, casi todos tienen evidencia (visible o en el análisis de orina ) de sangre en la orina. Más de la mitad también tienen proteinuria (proteína en la orina), que en una octava parte es lo suficientemente grave como para causar síndrome nefrótico (hinchazón generalizada debido al bajo contenido de proteínas en la sangre). Si bien las anomalías en el análisis de orina pueden continuar durante mucho tiempo, solo el 1% de todos los pacientes con HSP desarrollan enfermedad renal crónica . [8] Puede producirse hipertensión (presión arterial alta). La pérdida de proteínas y la presión arterial alta, así como las características de la biopsia del riñón si se realiza, pueden predecir la progresión a una enfermedad renal avanzada. Los adultos tienen más probabilidades que los niños de desarrollar enfermedad renal avanzada. [8] [9]
La púrpura de Henoch-Schönlein es una vasculitis de vasos pequeños en la que se depositan complejos de inmunoglobulina A (IgA) y componente 3 del complemento (C3) en arteriolas, capilares y vénulas (por lo tanto, es una reacción de hipersensibilidad de tipo III). La activación de la vía alternativa del complemento da como resultado la deposición de agregados de IgA o complejos de IgA en órganos diana (con deposición de C3). [10] Esto conduce a la producción de mediadores inflamatorios, incluidas prostaglandinas vasculares como la prostaciclina, que pueden desempeñar un papel clave en el desarrollo de IgAV y sus manifestaciones clínicas específicas de órganos. [11] Al igual que con la nefropatía por IgA , los niveles séricos de IgA son altos en la HSP y hay hallazgos idénticos en la biopsia renal; sin embargo, la nefropatía por IgA tiene predilección por los adultos jóvenes, mientras que la HSP es más predominante entre los niños. Además, la nefropatía por IgA generalmente afecta solo a los riñones, mientras que la HSP es una enfermedad sistémica. La HSP afecta la piel y los tejidos conectivos, el escroto, las articulaciones, el tracto gastrointestinal y los riñones. [12] La base genética sigue sin estar clara, excepto por la participación de la región del antígeno leucocitario humano del genoma. [13] Se plantea la hipótesis de que involucra autoinmunidad desencadenada por infecciones. Las cepas de Streptococcus y el virus de la parainfluenza son los patógenos asociados más comúnmente, y en los niños el parvovirus humano B19 es un desencadenante viral frecuente [14]

El diagnóstico se basa en la combinación de los síntomas, ya que muy pocas enfermedades provocan los mismos síntomas juntos. Los análisis de sangre pueden mostrar niveles elevados de creatinina y urea (en caso de afectación renal), niveles elevados de IgA (en aproximadamente el 50 % [12] ) y resultados elevados de proteína C reactiva (PCR) o velocidad de sedimentación globular (VSG); ninguno de ellos es específico de la púrpura de Henoch-Schönlein. El recuento de plaquetas puede estar elevado, lo que la distingue de enfermedades en las que la causa de la púrpura es un recuento bajo de plaquetas, como la púrpura trombocitopénica idiopática y la púrpura trombocitopénica trombótica [5] .
Si hay dudas sobre la causa de las lesiones cutáneas, se puede realizar una biopsia de la piel para distinguir la púrpura de otras enfermedades que la causan, como la vasculitis por crioglobulinemia ; en la microscopía, las apariencias son de una vasculitis por hipersensibilidad , y la inmunofluorescencia demuestra IgA y C3 (una proteína del sistema del complemento ) en la pared de los vasos sanguíneos. [5] Sin embargo, los niveles generales del complemento sérico son normales.
En base a los síntomas, es posible distinguir la HSP de la vasculitis por hipersensibilidad (HV). En una serie que comparaba 85 pacientes con HSP y 93 con HV, se encontraron cinco síntomas indicativos de HSP: púrpura palpable, angina abdominal , hemorragia del tracto digestivo (no debida a invaginación intestinal), hematuria y edad menor de 20 años. La presencia de tres o más de estos indicadores tiene una sensibilidad del 87% para predecir la HSP. [15]
La biopsia del riñón puede realizarse tanto para establecer el diagnóstico como para evaluar la gravedad de una enfermedad renal ya sospechada. Los principales hallazgos en la biopsia renal son el aumento de células y depósitos de Ig en el mesangio (parte del glomérulo , donde se filtra la sangre), glóbulos blancos y el desarrollo de semilunas . Los cambios son indistinguibles de los observados en la nefropatía por IgA . [12]
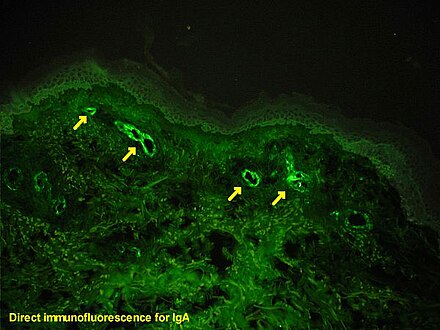
La HSP puede desarrollarse después de infecciones por estreptococos ( β-hemolíticos, grupo A de Lancefield ), hepatitis B , virus del herpes simple , parvovirus B19 , virus Coxsackie , adenovirus , Helicobacter pylori , [8] sarampión , paperas , rubéola , Mycoplasma y muchos otros. [12] Los medicamentos vinculados con la HSP, generalmente como una reacción idiosincrásica, incluyen los antibióticos vancomicina y cefuroxima , los inhibidores de la ECA enalapril y captopril , el agente antiinflamatorio diclofenaco , así como la ranitidina y la estreptoquinasa . Se ha informado que varias enfermedades están asociadas con la HSP, a menudo sin un vínculo causal. Solo en aproximadamente el 35% de los casos se puede rastrear la HSP hasta alguna de estas causas. [12]
La causa exacta de la HSP es desconocida, pero la mayoría de sus características se deben a la deposición de anticuerpos anormales en la pared de los vasos sanguíneos, lo que conduce a vasculitis . Estos anticuerpos son de la subclase IgA 1 en polímeros ; no se sabe con certeza si la causa principal es la sobreproducción (en el tracto digestivo o la médula ósea ) o la disminución de la eliminación de IgA anormal de la circulación. [12] Se sospecha que las anomalías en la molécula de IgA 1 pueden proporcionar una explicación de su comportamiento anormal tanto en la HSP como en la afección relacionada, la nefropatía por IgA . Una de las características de la IgA 1 (y la IgD ) es la presencia de una "región bisagra" de 18 aminoácidos de longitud entre las regiones de fijación del complemento 1 y 2. De los aminoácidos, la mitad es prolina , mientras que los otros son principalmente serina y treonina . La mayoría de las serinas y las treoninas tienen cadenas de azúcar elaboradas, conectadas a través de átomos de oxígeno ( O-glicosilación ). Se cree que este proceso estabiliza la molécula de IgA y la hace menos propensa a la proteólisis . El primer azúcar es siempre la N-acetilgalactosamina (GalNAc), seguida de otras galactosas y el ácido siálico . En la HSP y la IgAN, estas cadenas de azúcar parecen ser deficientes. Se desconoce la razón exacta de estas anomalías. [8] [12]
Existen múltiples estándares para definir la púrpura de Henoch-Schönlein, incluida la clasificación del Colegio Americano de Reumatología (ACR) de 1990 [16] [17] y la Conferencia de Consenso de Chapel Hill (CHCC) de 1994. [18] Algunos han informado que los criterios del ACR son más sensibles que los del CHCC. [19]
Clasificaciones más recientes, la Liga Europea Contra el Reumatismo (EULAR) de 2006 y la Sociedad de Reumatología Pediátrica (PReS), incluyen la púrpura palpable como criterio obligatorio, junto con al menos uno de los siguientes hallazgos: dolor abdominal difuso, depósito predominante de IgA (confirmado en biopsia de piel), artritis aguda en cualquier articulación y compromiso renal (evidenciado por la presencia de sangre y/o proteínas en la orina). [20]
La púrpura de Henoch-Schönlein puede presentarse con una manifestación atípica, que puede confundirse con urticaria papular , lupus eritematoso sistémico , meningococemia , dermatitis herpetiforme y edema hemorrágico agudo de la infancia . [21]
A partir de 2017, la forma óptima de tratar la púrpura de Henoch-Schönlein sigue siendo controvertida. [22] Es posible que se necesiten analgésicos para los dolores abdominales y articulares. El cuidado de la herida está justificado si se producen muerte de la piel y ulceraciones. [22] No se sabe con certeza si la PSH necesita tratamiento más allá de controlar los síntomas. La mayoría de las personas no reciben terapia debido a la alta tasa de recuperación espontánea. Los expertos no están de acuerdo sobre si se deben usar corticosteroides de manera rutinaria como tratamiento para la PSH. [22] Sin embargo, si se administran al principio del episodio de la enfermedad, la duración de los síntomas puede acortarse y el dolor abdominal puede mejorar significativamente. [22] Además, se puede reducir la probabilidad de problemas renales graves. [23] Una revisión sistemática no encontró ninguna evidencia de que el tratamiento con esteroides ( prednisona ) sea eficaz para disminuir la probabilidad de desarrollar enfermedad renal a largo plazo. [24]
La evidencia de un empeoramiento del daño renal normalmente motivaría una biopsia renal. El tratamiento puede estar indicado en función del aspecto de la muestra de biopsia; se pueden utilizar diversos tratamientos, que van desde esteroides por vía oral hasta una combinación de metilprednisolona intravenosa (esteroide), ciclofosfamida y dipiridamol seguido de prednisona. Otros regímenes incluyen esteroides/ azatioprina y esteroides/ciclofosfamida (con o sin heparina y warfarina ). Ocasionalmente se utiliza inmunoglobulina intravenosa (IVIG). [12]
No hay evidencia sólida de que el tratamiento con agentes antiplaquetarios en niños con HSP prevenga la enfermedad renal persistente. [25] [ necesita actualización ] Tampoco hay evidencia de que el tratamiento con ciclofosfamida en niños o adultos prevenga la enfermedad renal grave. [25] El tratamiento con heparina no está justificado. [25]
El pronóstico general es bueno en la mayoría de los pacientes; un estudio muestra que la recuperación ocurre en el 94% y el 89% de los niños y adultos, respectivamente (algunos de los cuales necesitaron tratamiento). [26] En los niños menores de diez años, la afección recurre en aproximadamente un tercio de todos los casos, generalmente dentro de los cuatro meses posteriores al ataque inicial. [6] La recurrencia es más común en niños mayores y adultos. [8]
En los adultos, la afectación renal progresa a enfermedad renal terminal (ERT) con más frecuencia que en los niños. En una serie de 37 pacientes del Reino Unido, 10 (27%) desarrollaron enfermedad renal avanzada. La proteinuria, la hipertensión en la presentación y las características patológicas (cambios en semilunas, fibrosis intersticial y atrofia tubular) predijeron la progresión. [9] Alrededor del 20% de los niños que presentan características nefróticas o nefríticas experimentan deterioro renal permanente y prolongado. [27]
Los hallazgos en la biopsia renal se correlacionan con la gravedad de los síntomas: aquellos con hematuria asintomática pueden tener solo proliferación mesangial focal, mientras que aquellos con proteinuria pueden tener una marcada proliferación celular o incluso la formación de semilunas. El número de glomérulos en semilunas es un factor pronóstico importante para determinar si el paciente desarrollará enfermedad renal crónica. [8]
En la enfermedad renal crónica terminal, algunos pacientes necesitan hemodiálisis o terapia de reemplazo renal equivalente. Si se encuentra un trasplante de riñón para un paciente en terapia de reemplazo renal, la enfermedad reaparecerá en el injerto (riñón trasplantado) en aproximadamente el 35 % de los casos y, en el 11 %, el injerto fallará por completo (lo que requerirá la reanudación de la terapia de reemplazo renal y un trasplante adicional). [12]
La HSP se presenta con mayor frecuencia en niños que en adultos [26] y suele aparecer después de una infección de las vías respiratorias superiores . La mitad de los pacientes afectados tienen menos de seis años y el 90 % menos de diez. Se presenta aproximadamente con el doble de frecuencia en niños que en niñas [8] . La incidencia de HSP en niños es de aproximadamente 20 por cada 100 000 niños por año, lo que la convierte en la vasculitis más común en niños [28] .
Los casos de HSP pueden ocurrir en cualquier momento durante el año, pero algunos estudios han encontrado que ocurren menos casos durante los meses de verano. [29]

La enfermedad recibe su nombre de Eduard Heinrich Henoch (1820-1910), un pediatra alemán (sobrino de Moritz Heinrich Romberg, el pionero de la neurología que publicó su libro de texto clásico entre 1840 y 1846 y el primero en describir el signo de Romberg) y su maestro Johann Lukas Schönlein (1793-1864). Johann Schönlein describió la afección como una entidad en 1837; Eduard Heinrich Henoch en 1868 informó del primer caso de un paciente con cólico, diarrea sanguinolenta, articulaciones dolorosas y sarpullido. [30] El médico inglés William Heberden (1710-1801) y el dermatólogo Robert Willan (1757-1812) ya habían descrito la enfermedad en 1802 y 1808, respectivamente, pero el nombre de enfermedad de Heberden-Willan ha caído en desuso. [31] Además, Willan fue el primero en describir una erupción exantemática de la infancia conocida como eritema infeccioso en 1799 [32] . En 1920, Eduard Glanzmann (1887-1959), un pediatra suizo conocido por sus contribuciones en los campos de las enfermedades infecciosas, la terapia con vitaminas y, sobre todo, el campo de la hematología, reconoció el papel de la alergia en la patogénesis de la púrpura de Henoch-Schönlein, de ahí la comprensión del componente alérgico en la PSH. [33] William Osler también es el primero en reconocer el mecanismo alérgico subyacente de la PSH. [34] En 2012, la Conferencia de Consenso Internacional de Chapel Hill sobre Nomenclatura de Vasculitis cambió el nombre a vasculitis por IgA por PSH. Antes de esto, la enfermedad se conocía más a menudo como púrpura de Henoch-Schönlein en lugar de al revés. [35]