La enfermedad de Wilson (también llamada degeneración hepatolenticular ) es un trastorno genético que se caracteriza por la acumulación excesiva de cobre en el cuerpo. Los síntomas suelen estar relacionados con el cerebro y el hígado . Los síntomas relacionados con el hígado incluyen vómitos , debilidad, acumulación de líquido en el abdomen , hinchazón de las piernas , piel amarillenta y picazón . Los síntomas relacionados con el cerebro incluyen temblores , rigidez muscular, dificultad para hablar, cambios de personalidad, ansiedad y psicosis . [1]
La enfermedad de Wilson es causada por una mutación en el gen de la proteína de la enfermedad de Wilson ( ATP7B ) . Esta proteína transporta el exceso de cobre a la bilis , donde se excreta en los productos de desecho. La enfermedad es autosómica recesiva ; para que las personas se vean afectadas, deben heredar una copia mutada del gen de ambos padres. El diagnóstico puede ser difícil y, a menudo, implica una combinación de análisis de sangre, análisis de orina y una biopsia de hígado . Se pueden utilizar pruebas genéticas para evaluar a los miembros de la familia de los afectados. [1]
La enfermedad de Wilson se trata generalmente con cambios en la dieta y medicación. Los cambios en la dieta implican llevar una dieta baja en cobre y no utilizar utensilios de cocina de cobre. Los medicamentos utilizados incluyen agentes quelantes , como trientina y D -penicilamina , y suplementos de zinc . Las complicaciones de la enfermedad de Wilson pueden incluir insuficiencia hepática y problemas renales . Un trasplante de hígado puede ser útil para aquellas personas para quienes otros tratamientos no son eficaces o si se produce insuficiencia hepática. [1]
La enfermedad de Wilson se presenta en aproximadamente una de cada 30.000 personas. [1] Los síntomas suelen comenzar entre los 5 y los 35 años. [1] Fue descrita por primera vez en 1854 por el patólogo alemán Friedrich Theodor von Frerichs y lleva el nombre del neurólogo británico Samuel Wilson . [4]
Los principales sitios de acumulación de cobre son el hígado y el cerebro . En consecuencia, la enfermedad hepática y los síntomas neuropsiquiátricos son las principales características que conducen al diagnóstico. [5] Las personas con problemas hepáticos tienden a buscar atención médica antes (generalmente cuando son niños o adolescentes) que aquellas con síntomas neurológicos y psiquiátricos, que tienden a tener entre 20 y 30 años o más. Algunos son identificados solo porque a sus familiares se les ha diagnosticado la enfermedad de Wilson; muchos de ellos, cuando se les realizan pruebas, resultan haber estado experimentando síntomas de la afección pero no han recibido un diagnóstico. [6]
La enfermedad hepática puede presentarse como cansancio , ictericia , aumento de la tendencia al sangrado o confusión (debido a encefalopatía hepática ) e hipertensión portal . [7] Esta última, una afección en la que la presión en la vena porta aumenta notablemente, conduce a varices esofágicas (venas distendidas en el esófago que pueden sangrar de manera potencialmente mortal), así como agrandamiento del bazo ( esplenomegalia ) y acumulación de líquido en la cavidad abdominal ( ascitis ). En el examen, se pueden observar signos de enfermedad hepática crónica, como angiomas aracniformes (pequeños vasos sanguíneos distendidos, generalmente en el tórax). La hepatitis activa crónica ya ha causado cirrosis del hígado en la mayoría de los pacientes cuando desarrollan los síntomas. Si bien la mayoría de las personas con cirrosis tienen un mayor riesgo de carcinoma hepatocelular (cáncer de hígado), este riesgo es relativamente bajo en la enfermedad de Wilson. [5]
Alrededor del 5% de las personas son diagnosticadas solo cuando desarrollan una insuficiencia hepática aguda fulminante , a menudo en el contexto de una anemia hemolítica (anemia debida a la destrucción de glóbulos rojos). Esto conduce a anomalías en la producción de proteínas (identificadas por una coagulación alterada ) y el metabolismo por parte del hígado. El metabolismo de las proteínas alterado conduce a la acumulación de productos de desecho, como el amoníaco , en el torrente sanguíneo. Cuando estos productos irritan el cerebro, los pacientes desarrollan encefalopatía hepática , una afección grave que causa confusión, coma, convulsiones y, finalmente, hinchazón del cerebro potencialmente mortal . [5]

Aproximadamente la mitad de las personas con enfermedad de Wilson tienen síntomas neurológicos o psiquiátricos. La mayoría presenta inicialmente un deterioro cognitivo leve y torpeza, así como cambios en el comportamiento. Luego suelen aparecer síntomas neurológicos específicos, a menudo en forma de parkinsonismo (rigidez en rueda dentada, bradicinesia o movimientos lentos y falta de equilibrio son las características parkinsonianas más comunes [8] ) con o sin un temblor típico de manos , expresiones faciales enmascaradas, dificultad para hablar, ataxia (falta de coordinación) o distonía (movimientos repetitivos y de torsión de una parte del cuerpo). Las convulsiones y la migraña parecen ser más comunes en la enfermedad de Wilson. [5] Un temblor característico descrito como "temblor de aleteo" se encuentra en muchas personas con Wilson; este está ausente en reposo pero puede ser provocado por la abducción de los brazos y la flexión de los codos hacia la línea media. [9]
La cognición también puede verse afectada en la enfermedad de Wilson, en dos categorías no mutuamente excluyentes: trastorno del lóbulo frontal (puede presentarse como impulsividad , deterioro del juicio, promiscuidad , apatía y disfunción ejecutiva con mala planificación y toma de decisiones) y demencia subcortical (puede presentarse como pensamiento lento, pérdida de memoria y disfunción ejecutiva , sin signos de afasia , apraxia o agnosia ). Se cree que estas afectaciones cognitivas están relacionadas y estrechamente vinculadas a las manifestaciones psiquiátricas de la enfermedad. [8]
Los problemas psiquiátricos debidos a la enfermedad de Wilson pueden incluir cambios de conducta, depresión , trastornos de ansiedad y psicosis . [5] Los síntomas psiquiátricos se observan comúnmente junto con síntomas neurológicos y rara vez se manifiestan por sí solos. Estos síntomas a menudo están mal definidos y, a veces, pueden atribuirse a otras causas. Debido a esto, el diagnóstico de la enfermedad de Wilson rara vez se realiza cuando solo están presentes los síntomas psiquiátricos. [8]
Se han relacionado las siguientes afecciones médicas con la acumulación de cobre en la enfermedad de Wilson:

El gen de la enfermedad de Wilson ( ATP7B ) se encuentra en el cromosoma 13 (13q14.3) y se expresa principalmente en el hígado, el riñón y la placenta . El gen codifica una ATPasa de tipo P (enzima de transporte de cationes) que transporta cobre a la bilis y lo incorpora a la ceruloplasmina . [5] La mayoría de las personas que padecen la enfermedad de Wilson (el 60 %) son homocigotas para las mutaciones de ATP7B (dos copias anormales) y el 30 % de ellas tienen solo una copia anormal. En aproximadamente el 10 % de los casos, las personas con la enfermedad de Wilson no tienen mutaciones detectables. [6]
Aunque se han descrito 300 posibles mutaciones de ATP7B , una cantidad muy pequeña de ellas causa la mayoría de los casos de enfermedad de Wilson; la mutación que tendrá un individuo tiende a ser específica de la población a la que pertenece. Por ejemplo, en las poblaciones occidentales, la mutación H1069Q (reemplazo de una histidina por una glutamina en la posición 1069 en la proteína) está presente en el 37%–63% de los casos, mientras que en China esta mutación es muy poco común; R778L ( arginina a leucina en 778) se encuentra allí con más frecuencia. Se sabe relativamente poco sobre el impacto relativo de las diversas mutaciones, aunque la mutación H1069Q parece predecir un inicio más tardío y predominantemente problemas neurológicos, según algunos estudios. [5] [15] Un recurso completo anotado clínicamente, WilsonGen, proporciona una clasificación clínica para las variantes según las recientes pautas de ACMG y AMP. [16]
Una variación normal en el gen PRNP puede modificar el curso de la enfermedad al retrasar la edad de aparición y afectar el tipo de síntomas que se desarrollan. Este gen produce la proteína priónica , que está activa en el cerebro y otros tejidos y también parece estar involucrada en el transporte de cobre. [17] Inicialmente se sospechó que el gen ApoE tenía un papel , pero no se pudo confirmar. [15]
La enfermedad se hereda con un patrón autosómico recesivo. Para heredarla, ambos padres de un individuo deben ser portadores de un gen afectado. La mayoría de las personas con enfermedad de Wilson no tienen antecedentes familiares de la enfermedad. [15] Las personas con un solo gen anormal se denominan portadores (heterocigotos) y pueden tener anomalías leves, pero médicamente insignificantes, del metabolismo del cobre. [14]
Existen varias enfermedades hereditarias que causan una sobrecarga de cobre en el hígado; la enfermedad de Wilson es la más común de ellas. Todas pueden causar cirrosis a una edad temprana. Las otras enfermedades por sobrecarga de cobre son la cirrosis infantil india (ICC), la cirrosis infantil tirolesa endémica y la toxicosis idiopática por cobre. Estas tres, a diferencia de la enfermedad de Wilson, no están relacionadas con mutaciones de ATP7B ; por ejemplo, la ICC se ha relacionado con mutaciones en los genes KRT8 y KRT18 . [15]

El cuerpo necesita cobre para una serie de funciones , predominantemente como cofactor de una serie de enzimas como la ceruloplasmina, la citocromo c oxidasa , la dopamina β-hidroxilasa , la superóxido dismutasa y la tirosinasa . [15]
El cobre entra al cuerpo a través del tracto digestivo . Una proteína transportadora en las células del intestino delgado , el transportador de membrana de cobre 1 (Ctr1; SLC31A1), lleva cobre dentro de las células, donde una parte se une a la metalotioneína y parte es transportada por ATOX1 a un orgánulo conocido como la red trans-Golgi . Aquí, en respuesta al aumento de las concentraciones de cobre, una enzima llamada ATP7A (proteína de Menkes) libera cobre en la vena porta hacia el hígado. Las células hepáticas también transportan la proteína CMT1, y la metalotioneína y ATOX1 se unen a ella dentro de la célula, pero aquí, ATP7B une el cobre a la ceruloplasmina y lo libera en el torrente sanguíneo, además de eliminar el exceso de cobre secretándolo en la bilis. Ambas funciones de ATP7B están alteradas en la enfermedad de Wilson. El cobre se acumula en el tejido hepático; La ceruloplasmina todavía se secreta, pero en una forma que carece de cobre (denominada apoceruloplasmina) y se degrada rápidamente en el torrente sanguíneo. [15]
Cuando la cantidad de cobre en el hígado supera a las proteínas que normalmente lo unen, causa daño oxidativo al hígado a través de un proceso conocido como química de Fenton ; este daño eventualmente conduce a hepatitis activa crónica , fibrosis (deposición de tejido conectivo) y cirrosis . El hígado también libera cobre en el torrente sanguíneo que no está unido a la ceruloplasmina. Este cobre libre se precipita en todo el cuerpo, pero particularmente en los riñones, los ojos y el cerebro. En el cerebro, la mayor parte del cobre se deposita en los ganglios basales , particularmente en el putamen y el globo pálido (juntos llamados núcleo lenticular ); estas áreas normalmente participan en la coordinación del movimiento y juegan un papel significativo en los procesos neurocognitivos como el procesamiento de estímulos y la regulación del estado de ánimo. El daño a estas áreas, nuevamente por la química de Fenton, produce los síntomas neuropsiquiátricos observados en la enfermedad de Wilson. [15]
No está claro por qué la enfermedad de Wilson causa hemólisis, pero varias líneas de evidencia sugieren que un alto nivel de cobre libre (no unido a ceruloplasmina) puede estar afectando directamente la oxidación de la hemoglobina , o inhibiendo las enzimas que suministran energía en los glóbulos rojos , o causando daño directo a las membranas celulares . [18]
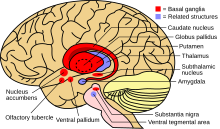
La enfermedad de Wilson puede sospecharse sobre la base de cualquiera de los síntomas mencionados anteriormente, o cuando se ha descubierto que un pariente cercano padece la enfermedad de Wilson. La mayoría de los pacientes presentan pruebas de función hepática ligeramente anormales, como niveles elevados de aspartato transaminasa , alanina transaminasa y bilirrubina . Si el daño hepático es significativo, la albúmina puede disminuir debido a una incapacidad de las células hepáticas dañadas para producir esta proteína; asimismo, el tiempo de protrombina (una prueba de coagulación ) puede prolongarse ya que el hígado es incapaz de producir proteínas conocidas como factores de coagulación. [5] Los niveles de fosfatasa alcalina son relativamente bajos en aquellos con insuficiencia hepática aguda relacionada con Wilson. [19] Si se observan síntomas neurológicos, generalmente se realiza una resonancia magnética del cerebro; esto muestra hiperintensidades en la parte del cerebro llamada ganglios basales en el entorno T2 . [14] La resonancia magnética también puede mostrar el patrón característico de "cara del panda gigante" . [20]
No se conoce ninguna prueba totalmente fiable para la enfermedad de Wilson, pero los niveles de ceruloplasmina y cobre en la sangre, así como la cantidad de cobre excretado en la orina durante un período de 24 horas, se utilizan en conjunto para formar una impresión de la cantidad de cobre en el cuerpo. La prueba más precisa es una biopsia de hígado . [5]

Los niveles de ceruloplasmina son anormalmente bajos (<0,2 g/L) en el 80-95% de los casos. [5] Sin embargo, puede estar presente en niveles normales en personas con inflamación en curso , ya que es una proteína de fase aguda . También se encuentran niveles bajos de ceruloplasmina en la enfermedad de Menkes y la aceruloplasminemia , que están relacionadas con la enfermedad de Wilson, pero son mucho más raras. [5] [14] La combinación de síntomas neurológicos, signos oculares y un nivel bajo de ceruloplasmina se considera suficiente para el diagnóstico de la enfermedad de Wilson. Sin embargo, en muchos casos, se necesitan más pruebas. [14]
El cobre sérico es bajo, lo que puede parecer paradójico dado que la enfermedad de Wilson es una enfermedad de exceso de cobre. Sin embargo, el 95% del cobre plasmático es transportado por la ceruloplasmina, que a menudo es baja en la enfermedad de Wilson. El cobre en orina está elevado en la enfermedad de Wilson y se recoge durante 24 horas en un frasco con un revestimiento sin cobre. Los niveles superiores a 100 μg/24 h (1,6 μmol/24 h) confirman la enfermedad de Wilson, y los niveles superiores a 40 μg/24 h (0,6 μmol/24 h) son fuertemente indicativos. [5] Los altos niveles de cobre en orina no son exclusivos de la enfermedad de Wilson; a veces se observan en la hepatitis autoinmune y en la colestasis (cualquier enfermedad que obstruya el flujo de bilis desde el hígado hasta el intestino delgado). [14]
En los niños, se puede utilizar la siguiente prueba de penicilamina : se administra una dosis oral de 500 mg de penicilamina y se recoge toda la orina durante 24 horas. Si la orina de todo el día contiene más de 1600 μg (25 μmol) de cobre, es un indicador fiable de la enfermedad de Wilson. Esta prueba no ha sido validada en adultos. [14]
Se examinan los ojos del paciente utilizando una lámpara de hendidura para buscar anillos de Kayser-Fleischer , que están fuertemente asociados con la enfermedad de Wilson y son causados por la deposición de cobre en la córnea interna en la membrana de Descemet . [10]
Una vez que otras investigaciones han indicado la enfermedad de Wilson, la prueba ideal es la extracción de una pequeña cantidad de tejido hepático mediante una biopsia hepática. Esto se evalúa microscópicamente para determinar el grado de esteatosis y cirrosis, y se utilizan la histoquímica y la cuantificación de cobre para medir la gravedad de la acumulación de cobre. Un nivel de 250 μg de cobre por gramo de tejido hepático seco confirma la enfermedad de Wilson. Ocasionalmente, se encuentran niveles más bajos de cobre; en ese caso, la combinación de los hallazgos de la biopsia con todas las demás pruebas aún podría conducir a un diagnóstico formal de Wilson. [5]
En las primeras etapas de la enfermedad, la biopsia muestra típicamente esteatosis (depósito de material graso), aumento de glucógeno en el núcleo y áreas de necrosis (muerte celular). En la enfermedad más avanzada, los cambios observados son bastante similares a los que se observan en la hepatitis autoinmune, como la infiltración de células inflamatorias , necrosis fragmentada y fibrosis (tejido cicatricial). En la enfermedad avanzada, finalmente, la cirrosis es el hallazgo principal. En la insuficiencia hepática aguda, se observa degeneración de las células hepáticas y colapso de la arquitectura del tejido hepático, típicamente sobre un fondo de cambios cirróticos. Los métodos histoquímicos para detectar el cobre son inconsistentes y poco confiables, y tomados por sí solos se consideran insuficientes para establecer un diagnóstico. [14]
Se puede realizar un análisis de las mutaciones del gen ATP7B , así como de otros genes relacionados con la acumulación de cobre en el hígado. Una vez que se confirma una mutación, se puede realizar un examen de detección de la enfermedad a los miembros de la familia como parte del asesoramiento familiar en genética clínica . [5] Es importante seguir las distribuciones regionales de los genes asociados con la enfermedad de Wilson, ya que esto puede ayudar a los médicos a diseñar estrategias de detección adecuadas. Dado que las mutaciones del gen ATP7B varían entre poblaciones, la investigación y las pruebas genéticas realizadas en países como los EE. UU. o el Reino Unido pueden plantear problemas, ya que tienden a tener poblaciones más mixtas. [21]
En general, se recomienda una dieta baja en alimentos que contengan cobre. Los alimentos con alto contenido de cobre que se deben evitar en la enfermedad de Wilson incluyen hongos , nueces , chocolate , frutos secos , hígado, semillas de sésamo, aceite de sésamo y mariscos . [5]
Existen tratamientos médicos para la enfermedad de Wilson. Algunos aumentan la eliminación de cobre del cuerpo, mientras que otros impiden la absorción de cobre de la dieta.
Generalmente, la penicilamina es el primer tratamiento utilizado. Esta se une al cobre (por quelación ) y conduce a la excreción de cobre en la orina. Por lo tanto, se puede realizar un seguimiento de la cantidad de cobre en la orina para garantizar que se tome una dosis suficientemente alta. La penicilamina no está exenta de problemas; alrededor del 20% experimenta un efecto secundario o una complicación del tratamiento con penicilamina, como lupus inducido por fármacos (que causa dolores articulares y sarpullido) o miastenia (una afección nerviosa que provoca debilidad muscular). En aquellos que presentaron síntomas neurológicos, casi la mitad experimenta un empeoramiento paradójico de sus síntomas. Si bien este fenómeno se observa en otros tratamientos para la enfermedad de Wilson, generalmente se toma como una indicación para suspender la penicilamina y comenzar un tratamiento de segunda línea. [5] [14] Aquellos intolerantes a la penicilamina pueden comenzar con clorhidrato de trientina , que también tiene propiedades quelantes. Algunos recomiendan la trientina como tratamiento de primera línea, pero la experiencia con la penicilamina es más extensa. [14] Otro agente con actividad conocida en la enfermedad de Wilson, que está siendo investigado clínicamente por Wilson Therapeutics , es el tetratiomolibdato . Se considera experimental, [14] aunque algunos estudios han demostrado un efecto beneficioso. [5]
Una vez que todos los resultados hayan vuelto a la normalidad, se puede utilizar zinc (generalmente en forma de una receta de acetato de zinc llamada Galzin) en lugar de quelantes para mantener estables los niveles de cobre en el cuerpo. El zinc estimula la metalotioneína , una proteína en las células intestinales que se une al cobre y evita su absorción y transporte al hígado. La terapia con zinc se continúa a menos que los síntomas reaparezcan o si aumenta la excreción urinaria de cobre. [14]
En casos excepcionales en los que ninguno de los tratamientos orales es eficaz, especialmente en enfermedades neurológicas graves, a veces es necesario administrar dimercaprol (antilewisita británico). Este tratamiento se inyecta por vía intramuscular (en un músculo) cada pocas semanas y tiene efectos secundarios desagradables, como dolor. [22]
Las personas asintomáticas (por ejemplo, las diagnosticadas mediante un examen familiar o solo como resultado de resultados anormales de las pruebas) generalmente reciben tratamiento, ya que la acumulación de cobre puede causar daños a largo plazo en el futuro. No está claro si es mejor tratar a estas personas con penicilamina o acetato de zinc. [14]
La fisioterapia y la terapia ocupacional son beneficiosas para los pacientes con la forma neurológica de la enfermedad. El tratamiento con quelantes de cobre puede tardar hasta seis meses en empezar a surtir efecto, y estas terapias pueden ayudar a hacer frente a la ataxia , la distonía y los temblores, así como a prevenir el desarrollo de contracturas que pueden resultar de la distonía. [23]
El trasplante de hígado es una cura eficaz para la enfermedad de Wilson, pero se utiliza sólo en situaciones particulares debido a los riesgos y complicaciones asociados con el procedimiento. Se utiliza principalmente en personas con insuficiencia hepática fulminante que no responden al tratamiento médico o en aquellas con enfermedad hepática crónica avanzada. El trasplante de hígado se evita en enfermedades neuropsiquiátricas graves, en las que no se ha demostrado su beneficio. [5] [14]
Si no se trata, la enfermedad de Wilson tiende a empeorar progresivamente y, finalmente, es mortal. Entre las complicaciones graves se encuentran la cirrosis hepática, la insuficiencia renal aguda y la psicosis. Puede producirse cáncer de hígado y colangiocarcinoma , pero con una incidencia menor que otras enfermedades hepáticas crónicas, y el riesgo se reduce en gran medida con el tratamiento. [13] Con una detección y un tratamiento tempranos, la mayoría de los afectados pueden llevar una vida relativamente normal y tener una esperanza de vida cercana a la de la población general. [13] El daño hepático y neurológico que se produce antes del tratamiento puede mejorar, pero a menudo es permanente. [24] La fertilidad suele ser normal y las complicaciones del embarazo no aumentan en las personas con enfermedad de Wilson que reciben tratamiento. [13]
La enfermedad lleva el nombre del médico británico Samuel Alexander Kinnier Wilson (1878-1937), un neurólogo que describió la afección, incluidos los cambios patológicos en el cerebro y el hígado, en 1912. [25] El trabajo de Wilson había sido precedido y se basó en informes del neurólogo alemán Karl Westphal (en 1883), quien la denominó "pseudoesclerosis"; por el neurólogo británico William Gowers (en 1888); [26] por el neuropatólogo finlandés Ernst Alexander Homén (en 1889-1892), quien señaló la naturaleza hereditaria de la enfermedad; [27] y por Adolph Strümpell (en 1898), quien señaló la cirrosis hepática. [26] El neuropatólogo John Nathaniel Cumings estableció el vínculo con la acumulación de cobre tanto en el hígado como en el cerebro en 1948. [28] La aparición de hemólisis se observó en 1967. [29]
En 1951, Cumings (en Inglaterra), y el neurólogo neozelandés Derek Denny-Brown (trabajando en los Estados Unidos), informaron simultáneamente el primer tratamiento efectivo, utilizando el quelante de metales británico anti-Lewisite . [30] [31] Este tratamiento tenía que ser inyectado, pero fue una de las primeras terapias disponibles en el campo de la neurología, un campo que clásicamente era capaz de observar y diagnosticar, pero tenía pocos tratamientos que ofrecer. [26] [32] El primer agente quelante oral efectivo en la enfermedad de Wilson, la penicilamina , fue descubierto en 1956 por el neurólogo británico John Walshe. [33] En 1982, Walshe también introdujo la trientina, [34] y fue el primero en desarrollar tetra-tiomolibdato para uso clínico. [35] La terapia con acetato de zinc apareció inicialmente en los Países Bajos, donde los médicos Schouwink y Hoogenraad la utilizaron en 1961 y en la década de 1970, respectivamente, y fue desarrollada posteriormente por Brewer y sus colegas de la Universidad de Michigan . [22] [36]
La base genética de la enfermedad de Wilson y su vínculo con las mutaciones de ATP7B fueron dilucidadas por varios grupos de investigación en los años 1980 y 1990. [37] [38]
La acumulación hereditaria de cobre se ha descrito en los Bedlington Terriers , [39] donde generalmente solo afecta al hígado. En los Bedlington Terriers se debe a mutaciones en el gen COMMD1 (o MURR1 ). [40] El descubrimiento de estas mutaciones en los perros llevó a los investigadores a examinar los genes humanos correspondientes, pero las mutaciones de COMMD1 no pudieron detectarse en humanos con estados de acumulación de cobre no wilsonianos (como la cirrosis infantil india ). [41]