La cresta neural es una estructura similar a una cresta que se forma transitoriamente entre el ectodermo epidérmico y la placa neural durante el desarrollo de los vertebrados . Las células de la cresta neural se originan a partir de esta estructura a través de la transición epitelial-mesenquimal y, a su vez, dan lugar a un linaje celular diverso, que incluye melanocitos , cartílago y hueso craneofacial , músculo liso , dentina , neuronas periféricas y entéricas , médula suprarrenal y glía . [1] [2]
Después de la gastrulación , la cresta neural se especifica en el borde de la placa neural y el ectodermo no neural . Durante la neurulación , los bordes de la placa neural, también conocidos como pliegues neurales , convergen en la línea media dorsal para formar el tubo neural . [3] Posteriormente, las células de la cresta neural de la placa del techo del tubo neural experimentan una transición epitelial a mesenquimal , deslaminándose del neuroepitelio y migrando a través de la periferia donde se diferencian en diversos tipos de células. [1] La aparición de la cresta neural fue importante en la evolución de los vertebrados porque muchos de sus derivados estructurales son características definitorias del clado de los vertebrados . [4]
Detrás del desarrollo de la cresta neural hay una red reguladora de genes , descrita como un conjunto de señales que interactúan, factores de transcripción y genes efectores posteriores , que confieren características celulares como multipotencia y capacidades migratorias. [5] Comprender los mecanismos moleculares de la formación de la cresta neural es importante para nuestro conocimiento de las enfermedades humanas debido a sus contribuciones a múltiples linajes celulares . Las anomalías en el desarrollo de la cresta neural causan neurocristopatías , que incluyen afecciones como la displasia frontonasal , el síndrome de Waardenburg-Shah y el síndrome de DiGeorge . [1]
Definir los mecanismos del desarrollo de la cresta neural puede revelar conocimientos clave sobre la evolución de los vertebrados y las neurocristopatías .
La cresta neural fue descrita por primera vez en el embrión de pollo por Wilhelm His Sr. en 1868 como "el cordón intermedio" (Zwischenstrang) debido a su origen entre la placa neural y el ectodermo no neural. [1] Denominó al tejido "cresta ganglionar", ya que su destino final era cada lado lateral del tubo neural, donde se diferenciaba en ganglios espinales. [6] Durante la primera mitad del siglo XX, la mayoría de las investigaciones sobre la cresta neural se realizaron utilizando embriones de anfibios, lo que fue revisado por Hörstadius (1950) en una conocida monografía. [7]
Las técnicas de marcaje celular han hecho avanzar la investigación sobre la cresta neural porque han permitido visualizar la migración del tejido a lo largo de los embriones en desarrollo. En la década de 1960, Weston y Chibon utilizaron el marcaje radioisotópico del núcleo con timidina tritiada en embriones de pollo y anfibios respectivamente. Sin embargo, este método presenta inconvenientes en cuanto a estabilidad, ya que cada vez que la célula marcada se divide, la señal se diluye. También se han desarrollado técnicas modernas de marcaje celular, como el dextrano lisinado con rodamina y el colorante vital diI, para marcar transitoriamente los linajes de la cresta neural. [6]
El sistema de marcado de polluelos de codorniz, ideado por Nicole Le Douarin en 1969, fue otra técnica instrumental utilizada para rastrear células de la cresta neural. [8] [9] Las quimeras , generadas a través del trasplante, permitieron a los investigadores distinguir las células de la cresta neural de una especie del tejido circundante de otra especie. Con esta técnica, generaciones de científicos pudieron marcar y estudiar de manera confiable la ontogenia de las células de la cresta neural.
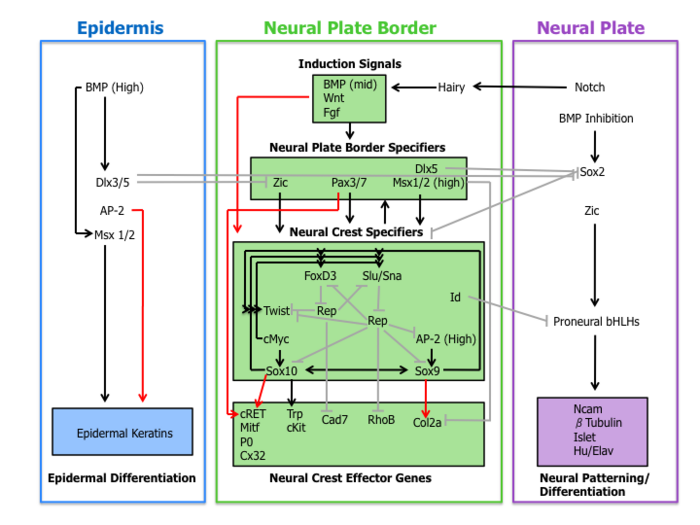
En el establecimiento de las características migratorias y multipotentes de las células de la cresta neural interviene una cascada molecular de acontecimientos. Esta red reguladora de genes puede subdividirse en las cuatro subredes que se describen a continuación.
En primer lugar, las moléculas de señalización extracelular, secretadas desde la epidermis adyacente y el mesodermo subyacente, como Wnt , BMP y Fgf, separan el ectodermo no neuronal (epidermis) de la placa neuronal durante la inducción neuronal . [1] [4]
Se ha demostrado la señalización de Wnt en la inducción de la cresta neural en varias especies mediante experimentos de ganancia y pérdida de función. En coherencia con esta observación, la región promotora de slug (un gen específico de la cresta neural) contiene un sitio de unión para factores de transcripción involucrados en la activación de genes diana dependientes de Wnt, lo que sugiere un papel directo de la señalización de Wnt en la especificación de la cresta neural. [10]
El papel actual de BMP en la formación de la cresta neural está asociado con la inducción de la placa neural. Los antagonistas de BMP que se difunden desde el ectodermo generan un gradiente de actividad de BMP. De esta manera, el linaje de la cresta neural se forma a partir de niveles intermedios de señalización de BMP necesarios para el desarrollo de la placa neural (BMP bajo) y la epidermis (BMP alto). [1]
Se ha sugerido que el Fgf del mesodermo paraxial es una fuente de señal inductiva de la cresta neural. Los investigadores han demostrado que la expresión del receptor Fgf dominante negativo en explantos de ectodermo bloquea la inducción de la cresta neural cuando se recombina con el mesodermo paraxial. [11] La comprensión del papel de las vías BMP, Wnt y Fgf en la expresión de especificadores de la cresta neural sigue siendo incompleta.
Los eventos de señalización que establecen el borde de la placa neural conducen a la expresión de un conjunto de factores de transcripción delineados aquí como especificadores del borde de la placa neural. Estas moléculas incluyen factores Zic, Pax3/7, Dlx5, Msx1/2 que pueden mediar la influencia de Wnts, BMP y Fgfs. Estos genes se expresan ampliamente en la región del borde de la placa neural y preceden a la expresión de marcadores genuinos de la cresta neural. [4]
La evidencia experimental coloca a estos factores de transcripción en una posición anterior a los especificadores de la cresta neural. Por ejemplo, en Xenopus, Msx1 es necesario y suficiente para la expresión de Slug, Snail y FoxD3. [12] Además, Pax3 es esencial para la expresión de FoxD3 en embriones de ratón. [13]
Tras la expresión de los especificadores del borde de la placa neural se encuentra una colección de genes que incluyen Slug/Snail, FoxD3, Sox10, Sox9, AP-2 y c-Myc. Este conjunto de genes, designados aquí como especificadores de la cresta neural, se activan en las células de la cresta neural emergentes. Al menos en Xenopus, cada especificador de la cresta neural es necesario y/o suficiente para la expresión de todos los demás especificadores, lo que demuestra la existencia de una amplia regulación cruzada. [4] Además, este organismo modelo fue fundamental para la elucidación del papel de la vía de señalización Hedgehog en la especificación de la cresta neural, donde el factor de transcripción Gli2 desempeña un papel clave. [14]
Fuera de la red estrechamente regulada de especificadores de la cresta neural hay otros dos factores de transcripción Twist e Id. Twist, un factor de transcripción bHLH , es necesario para la diferenciación del mesénquima de las estructuras del arco faríngeo . [15] Id es un objetivo directo de c-Myc y se sabe que es importante para el mantenimiento de las células madre de la cresta neural. [16]
Por último, los especificadores de la cresta neural activan la expresión de genes efectores, que confieren ciertas propiedades como la migración y la multipotencia. Dos efectores de la cresta neural, las GTPasas Rho y las cadherinas , funcionan en la delaminación regulando la morfología celular y las propiedades adhesivas. Sox9 y Sox10 regulan la diferenciación de la cresta neural activando muchos efectores específicos del tipo celular, entre ellos Mitf, P0, Cx32, Trp y cKit. [4]

La migración de las células de la cresta neural implica una cascada de eventos altamente coordinada que comienza con el cierre del tubo neural dorsal .
Después de la fusión de los pliegues neurales para crear el tubo neural , las células ubicadas originalmente en el borde de la placa neural se convierten en células de la cresta neural . [17] Para que comience la migración, las células de la cresta neural deben sufrir un proceso llamado delaminación que implica una transición epitelial-mesenquimal (EMT) total o parcial. [18] La delaminación se define como la separación del tejido en diferentes poblaciones, en este caso las células de la cresta neural se separan del tejido circundante. [19] Por el contrario, la EMT es una serie de eventos que coordinan un cambio de un fenotipo epitelial a mesenquimal . [18] Por ejemplo, la delaminación en embriones de pollo es desencadenada por una cascada BMP / Wnt que induce la expresión de factores de transcripción promotores de EMT como SNAI2 y FOXD3 . [19] Aunque todas las células de la cresta neural experimentan EMT, el momento de la delaminación ocurre en diferentes etapas en diferentes organismos: en los embriones de Xenopus laevis hay una delaminación masiva que ocurre cuando la placa neural no está completamente fusionada, mientras que la delaminación en el embrión de pollo ocurre durante la fusión del pliegue neural . [19]
Antes de la delaminación, las presuntas células de la cresta neural se anclan inicialmente a las células vecinas mediante proteínas de unión estrecha como la ocludina y moléculas de adhesión celular como NCAM y N - cadherina . [20] Las BMP expresadas dorsalmente inician la delaminación al inducir la expresión de los factores de transcripción de la proteína de dedo de zinc snail , slug y twist . [17] Estos factores desempeñan un papel directo en la inducción de la transición epitelial-mesenquimal al reducir la expresión de ocludina y N-cadherina , además de promover la modificación de NCAM con residuos de ácido polisiálico para disminuir la adhesividad. [17] [21] Las células de la cresta neural también comienzan a expresar proteasas capaces de degradar cadherinas como ADAM10 [22] y secretar metaloproteinasas de matriz (MMP) que degradan la lámina basal suprayacente del tubo neural para permitir que las células de la cresta neural escapen. [20] Además, las células de la cresta neural comienzan a expresar integrinas que se asocian con proteínas de la matriz extracelular , incluido el colágeno , la fibronectina y la laminina , durante la migración. [23] Una vez que la lámina basal se vuelve permeable, las células de la cresta neural pueden comenzar a migrar por todo el embrión.
.jpg/440px-Migration_of_Neural_Crest_Cells_(v2).jpg)
La migración de las células de la cresta neural ocurre en una dirección rostral a caudal sin la necesidad de un andamiaje neuronal como a lo largo de una célula glial radial . Por esta razón, el proceso de migración de las células de la cresta neural se denomina "migración libre". En lugar de un andamiaje en células progenitoras , la migración de la cresta neural es el resultado de la guía repulsiva a través de la señalización EphB / EphrinB y semaforina / neuropilina , interacciones con la matriz extracelular e inhibición de contacto entre sí. [17] Mientras que las proteínas Ephrin y Eph tienen la capacidad de experimentar señalización bidireccional, la repulsión de las células de la cresta neural emplea predominantemente señalización hacia adelante para iniciar una respuesta dentro de la célula de la cresta neural portadora del receptor . [23] Las células de la cresta neural en crecimiento expresan EphB, una tirosina quinasa del receptor , que se une al ligando transmembrana EphrinB expresado en la mitad caudal de cada somita . Cuando estos dos dominios interactúan, se produce la fosforilación de la tirosina del receptor, la activación de las rhoGTPasas y, finalmente, reordenamientos del citoesqueleto dentro de las células de la cresta, lo que las induce a repelerse. Este fenómeno permite que las células de la cresta neural se dispersen a través de la porción rostral de cada somita. [17]
La señalización repulsiva semaforina-neuropilina funciona sinérgicamente con la señalización EphB para guiar a las células de la cresta neural por la mitad rostral de los somitas en ratones. En embriones de pollo, la semaforina actúa en la región cefálica para guiar a las células de la cresta neural a través de los arcos faríngeos . Además de la señalización repulsiva repulsiva, las células de la cresta neural expresan integrinas β1 y α4 que permiten la unión y la interacción guiada con colágeno , laminina y fibronectina de la matriz extracelular a medida que viajan. Además, las células de la cresta tienen inhibición de contacto intrínseca entre sí mientras invaden libremente tejidos de diferente origen, como el mesodermo . [17] Las células de la cresta neural que migran a través de la mitad rostral de los somitas se diferencian en neuronas sensoriales y simpáticas del sistema nervioso periférico . La otra ruta principal que toman las células de la cresta neural es dorsolateralmente entre la epidermis y el dermamiotomo . Las células que migran a través de esta ruta se diferencian en células pigmentarias de la dermis . La posterior diferenciación y especificación de las células de la cresta neural en su tipo celular final está sesgada por su sujeción espaciotemporal a señales morfogénicas como BMP, Wnt, FGF, Hox y Notch . [20]
Las neurocristopatías son resultado de la especificación, migración, diferenciación o muerte anormal de las células de la cresta neural a lo largo del desarrollo embrionario. [24] [25] Este grupo de enfermedades comprende un amplio espectro de malformaciones congénitas que afectan a muchos recién nacidos. Además, surgen debido a defectos genéticos que afectan la formación de la cresta neural y por la acción de teratógenos [26]
El síndrome de Waardenburg es una neurocristopatía que resulta de una migración defectuosa de las células de la cresta neural. Las principales características de la afección incluyen piebaldismo y sordera congénita . En el caso del piebaldismo, las áreas de piel incoloras son causadas por una ausencia total de melanocitos productores de pigmento derivados de la cresta neural . [27] Hay cuatro tipos diferentes de síndrome de Waardenburg, cada uno con características genéticas y fisiológicas distintas. Los tipos I y II se distinguen en función de si los miembros de la familia del individuo afectado tienen o no distopia canthorum . [28] El tipo III da lugar a anomalías de las extremidades superiores. Por último, el tipo IV también se conoce como síndrome de Waardenburg-Shah, y los individuos afectados muestran tanto el síndrome de Waardenburg como la enfermedad de Hirschsprung . [29] Los tipos I y III se heredan de forma autosómica dominante , [27] mientras que II y IV exhiben un patrón de herencia autosómico recesivo . En general, el síndrome de Waardenburg es poco frecuente, con una incidencia de aproximadamente 2/100.000 personas en los Estados Unidos. Afecta por igual a todas las razas y sexos . [27] Actualmente no existe cura ni tratamiento para el síndrome de Waardenburg.
También implicada en defectos relacionados con el desarrollo y migración de células de la cresta neural está la enfermedad de Hirschsprung , caracterizada por una falta de inervación en regiones del intestino . Esta falta de inervación puede conducir a otras anomalías fisiológicas como un colon agrandado ( megacolon ), obstrucción de los intestinos o incluso un crecimiento lento. En un desarrollo saludable, las células de la cresta neural migran al intestino y forman los ganglios entéricos . Los genes que juegan un papel en la migración saludable de estas células de la cresta neural al intestino incluyen RET , GDNF , GFRα , EDN3 y EDNRB . RET , una tirosina quinasa receptora (RTK), forma un complejo con GDNF y GFRα . EDN3 y EDNRB están implicados en la misma red de señalización. Cuando esta señalización se interrumpe en ratones, se produce aganglionosis o la falta de estos ganglios entéricos. [30]
El trastorno del espectro alcohólico fetal es una de las causas más comunes de defectos del desarrollo . [31] Dependiendo del grado de exposición y la gravedad de las anomalías resultantes, los pacientes son diagnosticados dentro de un continuo de trastornos ampliamente etiquetados como trastorno del espectro alcohólico fetal]] (FASD). El FASD grave puede perjudicar la migración de la cresta neural , como lo evidencian las anomalías craneofaciales características que incluyen fisuras palpebrales cortas , un labio superior alargado y un filtrum alisado . Sin embargo, debido a la naturaleza promiscua de la unión del etanol , los mecanismos por los cuales surgen estas anomalías aún no están claros. Los explantos de cultivos celulares de células de la cresta neural, así como los embriones de pez cebra en desarrollo in vivo expuestos al etanol muestran una disminución en el número de células migratorias y una disminución de las distancias recorridas por las células migratorias de la cresta neural. Los mecanismos detrás de estos cambios no se comprenden bien, pero la evidencia sugiere que el PAE puede aumentar la apoptosis debido al aumento de los niveles de calcio citosólico causados por la liberación de calcio mediada por IP3 de los depósitos intracelulares . También se ha propuesto que la disminución de la viabilidad de las células de la cresta neural expuestas al etanol se debe a un mayor estrés oxidativo . A pesar de estos y otros avances, aún queda mucho por descubrir sobre cómo afecta el etanol al desarrollo de la cresta neural. Por ejemplo, parece que el etanol afecta de manera diferencial a ciertas células de la cresta neural en comparación con otras; es decir, mientras que las anomalías craneofaciales son comunes en la EAP, las células pigmentarias derivadas de la cresta neural parecen verse mínimamente afectadas. [32]
El síndrome de DiGeorge se asocia con deleciones o translocaciones de un pequeño segmento en el cromosoma humano 22. Esta deleción puede alterar la migración o el desarrollo de las células de la cresta neural rostral . Algunos defectos observados están relacionados con el sistema de la bolsa faríngea , que recibe la contribución de las células de la cresta migratoria rostral. Los síntomas del síndrome de DiGeorge incluyen defectos cardíacos congénitos , defectos faciales y algunas discapacidades neurológicas y de aprendizaje . También se ha informado que los pacientes con deleciones 22q11 tienen una mayor incidencia de esquizofrenia y trastorno bipolar . [33]
El síndrome de Treacher Collins (SCT) es el resultado de un desarrollo deficiente del primer y segundo arcos faríngeos durante la etapa embrionaria temprana, lo que finalmente conduce a anomalías en la parte media e inferior de la cara. El SCT es causado por una mutación sin sentido del gen TCOF1 , que hace que las células de la cresta neural sufran apoptosis durante la embriogénesis . Aunque las mutaciones del gen TCOF1 se encuentran entre las mejor caracterizadas en cuanto a su papel en el SCT, las mutaciones en los genes POLR1C y POLR1D también se han relacionado con la patogénesis del SCT. [34]
Las células de la cresta neural que se originan en diferentes posiciones a lo largo del eje anteroposterior se desarrollan en diversos tejidos. Estas regiones de la cresta neural se pueden dividir en cuatro dominios funcionales principales, que incluyen la cresta neural craneal, la cresta neural del tronco, la cresta neural vagal y sacra y la cresta neural cardíaca.
La cresta neural craneal migra dorsolateralmente para formar el mesénquima craneofacial que se diferencia en varios ganglios craneales y cartílagos y huesos craneofaciales. [21] Estas células ingresan a las bolsas y arcos faríngeos donde contribuyen al timo , los huesos del oído medio y la mandíbula y los odontoblastos de los primordios dentarios. [35]
La cresta neural del tronco da lugar a dos poblaciones de células. [36] Un grupo de células destinadas a convertirse en melanocitos migra dorsolateralmente hacia el ectodermo en dirección a la línea media ventral. Un segundo grupo de células migra ventrolateralmente a través de la porción anterior de cada esclerotomo . Las células que permanecen en el esclerotomo forman los ganglios de la raíz dorsal , mientras que las que continúan más ventralmente forman los ganglios simpáticos, la médula suprarrenal y los nervios que rodean la aorta. [35]
Las células de la cresta neural vagal y sacra se desarrollan en los ganglios del sistema nervioso entérico y los ganglios parasimpáticos. [35]
La cresta neural cardíaca se desarrolla en melanocitos, cartílago, tejido conectivo y neuronas de algunos arcos faríngeos. Además, este dominio da origen a regiones del corazón como el tejido musculoconectivo de las grandes arterias y parte del tabique , que divide la circulación pulmonar de la aorta. [35] Las válvulas semilunares del corazón están asociadas a células de la cresta neural según una nueva investigación. [37]
Varias estructuras que distinguen a los vertebrados de otros cordados se forman a partir de los derivados de las células de la cresta neural. En su teoría de la "nueva cabeza", Gans y Northcut sostienen que la presencia de la cresta neural fue la base de las características específicas de los vertebrados, como los ganglios sensoriales y el esqueleto craneal. Además, la aparición de estas características fue fundamental en la evolución de los vertebrados porque permitió un estilo de vida depredador. [38] [39]
Sin embargo, considerar la cresta neural como una innovación de los vertebrados no significa que surgiera de novo . En cambio, las nuevas estructuras a menudo surgen a través de la modificación de los programas reguladores del desarrollo existentes. Por ejemplo, los programas reguladores pueden cambiarse mediante la cooptación de nuevos reguladores aguas arriba o mediante el empleo de nuevos objetivos genéticos aguas abajo, colocando así las redes existentes en un contexto novedoso. [40] [41] Esta idea está respaldada por datos de hibridación in situ que muestran la conservación de los especificadores del borde de la placa neural en protocordados , lo que sugiere que parte de la red precursora de la cresta neural estaba presente en un ancestro común de los cordados. [5] En algunos cordados no vertebrados, como los tunicados, se ha identificado un linaje de células (melanocitos) que son similares a las células de la cresta neural en vertebrados. Esto implica que existía una cresta neural rudimentaria en un ancestro común de vertebrados y tunicados. [42]
Ectomesénquima (también conocido como mesectodermo ): [43] odontoblastos , papilas dentales , el condrocráneo (cápsula nasal, cartílago de Meckel , huesecillos esclerales, cuadrado, articular, hioides y columela), cartílago traqueal y laríngeo , el dermatocráneo (huesos membranosos), aletas dorsales y el plastrón de tortuga (vertebrados inferiores), pericitos y músculo liso de las arterias y venas branquiales, tendones de los músculos oculares y masticatorios, tejido conectivo de las glándulas de la cabeza y el cuello (hipófisis, salival, lagrimal, timo, tiroides), dermis y tejido adiposo de la calota, cuello ventral y cara.
Células endocrinas : células cromafines de la médula suprarrenal, células glómicas tipo I/II.
Sistema nervioso periférico : neuronas sensoriales y glía de los ganglios de la raíz dorsal , ganglios cefálicos (VII y en parte, V, IX y X), células de Rohon-Beard , algunas células de Merkel en el bigote, [44] [45] células gliales satélite de todos los ganglios autónomos y sensoriales, células de Schwann de todos los nervios periféricos.
Células entéricas : células enterocromafines . [46]
Melanocitos , células musculares del iris y células pigmentarias , e incluso asociadas a algunos tumores (como el tumor neuroectodérmico melanótico de la infancia ).