El lémur ratón gris ( Microcebus murinus ), lémur ratón gris o lémur ratón menor es un lémur pequeño , un tipo de primate estrepsirrino , que se encuentra únicamente en la isla de Madagascar . Con un peso de 58 a 67 gramos (2,0 a 2,4 oz), es el más grande de los lémures ratón ( género Microcebus ), grupo que incluye a los primates más pequeños del mundo. La especie recibe su nombre por su tamaño y coloración parecidos a los de un ratón y se la conoce localmente (en malgache ) como tsidy , koitsiky , titilivaha , pondiky y vakiandry . El lémur ratón gris y todos los demás lémures ratón se consideran especies crípticas , ya que son casi indistinguibles entre sí por su apariencia. Por esta razón, el lémur ratón gris fue considerado la única especie de lémur ratón durante décadas hasta que estudios más recientes comenzaron a distinguir entre las especies.
Como todos los lémures ratón, esta especie es nocturna y arbórea . Es muy activo y, aunque busca alimento solo, grupos de machos y hembras forman grupos para dormir y comparten agujeros en los árboles durante el día. Exhibe una forma de letargo llamada letargo durante los meses fríos y secos del invierno y, en algunos casos, sufre letargo estacional (o hibernación ), lo cual es inusual en los primates. El lémur ratón gris se puede encontrar en varios tipos de bosques en todo el oeste y sur de Madagascar. Su dieta se compone principalmente de frutas, insectos, flores y néctar. En la naturaleza, sus depredadores naturales incluyen búhos, serpientes y depredadores mamíferos endémicos. La presión de depredación es mayor en esta especie que en cualquier otra especie de primates: uno de cada cuatro individuos es capturado por un depredador cada año. Esto se ve contrarrestado por su alta tasa de reproducción. La reproducción es estacional y se utilizan vocalizaciones distintas para evitar la hibridación con especies que se superponen en su área de distribución. La gestación dura aproximadamente 60 días y normalmente nacen dos crías. Las crías suelen ser independientes en dos meses y pueden reproducirse al cabo de un año. El lémur ratón gris tiene una vida reproductiva de cinco años, aunque se ha informado que los individuos cautivos viven hasta 15 años.
Aunque está amenazado por la deforestación , la degradación del hábitat y la captura de animales vivos para el comercio de mascotas , se le considera uno de los pequeños mamíferos nativos más abundantes de Madagascar. Puede tolerar una escasez moderada de alimentos experimentando un letargo diario para conservar energía, pero una escasez prolongada de alimentos debido al cambio climático puede representar un riesgo significativo para la especie.
El lémur ratón gris o menor recibe su nombre por su pelaje gris pardusco y su tamaño y apariencia parecidos a los de un ratón. El nombre del género, Microcebus , deriva de las palabras griegas mikros , que significa "pequeño", y kebos , que significa "mono". La versión latina de kebos , cebus , es un sufijo común utilizado para los nombres de primates, a pesar de que el lémur ratón gris es un lémur y no un mono . El nombre de la especie , murinus , significa "parecido a un ratón" y deriva de la palabra latina mus , o "ratón", y del sufijo latino -inus , que significa "parecido". [5]
El lémur es conocido localmente por varios nombres en malgache, según la región. Alrededor de Tôlanaro (Fort Dauphin), se le llama pondiky [punˈdikʲ] . En el extremo norte de su área de distribución, se le conoce como tsidy [ˈtʃidʲ] . Alrededor de Morondava , se le conoce como koitsiky [kuiˈtʃikʲ] , titilivaha [ti̥tiliˈva] y vakiandry [vakiˈaɳɖʐʲ] . [6] [7] En muchos casos, estos nombres malgaches también se utilizan para otras especies de lémures ratón visualmente indistinguibles que viven dentro de su área de distribución. [8]
Como su nombre lo indica, el lémur ratón gris es un lémur, un tipo de primate, y pertenece al suborden Strepsirrhini y al infraorden Lemuriformes. [3] Dentro de los Lemuriformes, pertenece a la familia Cheirogaleidae , que contiene los lémures ratón, los lémures enanos , los lémures ratón gigantes , los lémures marcados con un tenedor y el lémur enano de orejas peludas . El género Microcebus de lémures ratón incluye a los primates más pequeños del mundo. [3] [6] [9] [10] Los análisis filogenéticos de secuencias de ADN del bucle D de varias especies de lémures sugieren que el lémur ratón gris puede estar más estrechamente relacionado con el lémur ratón gris rojizo ( M. griseorufus ). [11]
En 1777, el ilustrador inglés John Frederick Miller incluyó una placa coloreada a mano del lémur ratón gris en su Icones animalium et plantarum y acuñó el nombre binomial Lemur murinus . [12] La especie fue trasladada al género Microcebus por el naturalista francés Étienne Geoffroy Saint-Hilaire en 1834. [13] M. murinus siguió siendo la única especie de su género, así como el nombre utilizado para todos los lémures ratón de Madagascar. entre la primera revisión taxonómica importante en 1931 y un extenso estudio de campo realizado en 1972. El estudio de campo distinguió al lémur ratón marrón , M. rufus —entonces considerado una subespecie— como una especie simpátrica distinta en la parte sureste de la isla. [14] Tras esta revisión, se pensó que el lémur ratón gris representaba a todos los lémures ratón que vivían en las partes más secas del norte, oeste y sur, mientras que el lémur ratón marrón representaba a los lémures ratón de la selva oriental. Más recientemente, la comprensión científica de la distribución y diversidad de los lémures ratón se ha vuelto mucho más compleja. [9] Estudios de campo adicionales, pruebas genéticas y revisiones taxonómicas resultantes a lo largo de las décadas de 1990 y 2000 identificaron numerosas especies nuevas de lémures ratón, lo que demuestra que el género incluye al menos 17 especies crípticas . [15] [16] [17] [18]
El lémur ratón gris comparte muchos rasgos con otros lémures ratón, incluido un pelaje suave, una cola larga, extremidades traseras largas, una raya dorsal en la espalda (no siempre distinta), un hocico corto, un cráneo redondeado, ojos prominentes, [10] y Orejas grandes, membranosas y protuberantes. [6] [7] [9] Tiene ojos grandes y un tapetum lucidum para mejorar su visión nocturna. [9] El pelaje dorsal es de color gris pardusco con varios tonos rojizos, los flancos son de gris claro a beige y el pelaje ventral tiene discretas manchas de color beige opaco o beige blanquecino a lo largo de partes del vientre. En la cara redondeada, hay una mancha blanca pálida encima de la nariz y entre los ojos; algunos individuos tienen marcas orbitales oscuras. Las partes peludas de las manos y los pies son de color blanquecino. [6]
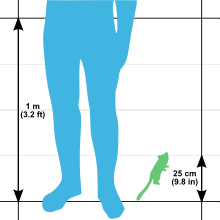
El lémur ratón gris es uno de los primates más pequeños del mundo, pero también es el lémur ratón más grande. [9] Su longitud total es de 25 a 28 cm (9,8 a 11,0 pulgadas), con una longitud cabeza-cuerpo de 12 a 14 cm (4,7 a 5,5 pulgadas) y una longitud de cola de 13 a 14,5 cm (5,1 a 5,7 pulgadas) . [6] El peso promedio para esta especie es de 60 g (2,1 oz), [9] con rangos de 58 y 67 g (2,0 y 2,4 oz) [6] y 40 y 70 g (1,4 y 2,5 oz) [9] informó. Es más pequeño que el mono más pequeño del mundo, el tití pigmeo , que pesa entre 85 y 140 g (3,0 y 4,9 oz). [10] El peso varía según la estación, y ambos sexos acumulan reservas de grasa, hasta el 35% de su peso corporal, en la cola y las patas traseras antes de la estación seca y los períodos de inactividad. [9] La cola del lémur ratón gris puede multiplicar por cuatro su volumen durante la estación húmeda cuando almacena grasa. Incluso en cautiverio, cuando las limitaciones ambientales no son un problema, los lémures ratón han mostrado una preferencia dietética estacional con una mayor ingesta de proteínas durante la que sería su temporada más activa. [19]
Los investigadores han identificado diferencias en la morfología de los dientes del primer y segundo molar entre el lémur ratón gris y el lémur ratón gris rojizo. En el lémur ratón de color gris rojizo, el primer molar inferior (m1) es cuadrado y tanto el primer como el segundo molar superior (M1 y M2) tienen ligeras hendiduras alrededor de la mitad del margen posterior. El lémur ratón gris tiene un m1 más alargado y carece de la sangría antes mencionada en M1 y M2. [20] En términos de su dentición general , el lémur ratón gris comparte la misma fórmula dental que todos los demás miembros de su familia, Cheirogaleidae:2.1.3.32.1.3.3 × 2 = 36 [21]
Esta especie tiene 66 cromosomas , [22] muy parecido al cariotipo de los lémures enanos (género Cheirogaleus ). A excepción del cromosoma X , todos los cromosomas son acrocéntricos (con el brazo corto ausente o prácticamente ausente). [23] El tamaño de su genoma es de 3,12 picogramos (pg). [22]
Como todos los demás miembros de la familia Cheirogaleidae , el lémur ratón gris es nocturno y arbóreo . Habita en bosque seco tropical de tierras bajas, matorral espinoso subárido, bosque de galería , bosque espinoso , bosque litoral oriental , bosques secos caducifolios , bosque semihúmedo caducifolio, bosque húmedo de tierras bajas , bosque de transición y bosques secundarios o bosques degradados (incluidas las plantaciones), todos hasta 800 m (2600 pies) sobre el nivel del mar. [6] [7] [9] La especie es más común en bosques secundarios que en bosques primarios, particularmente en hábitats de arbustos y matorrales, donde ocupa un nicho de "ramas finas" , restringiendo el rango vertical a ramas finas, soportes terminales finos, lianas y follaje denso. [7] [9] [24] Estos lémures generalmente se ven en ramas de menos de 5 cm (2,0 pulgadas) de diámetro. [24] El lémur ratón gris tiende a preferir los niveles más bajos del bosque y el sotobosque , donde las ramas y la vegetación son densas. [9]
En el bosque secundario, generalmente se observa desde el nivel del suelo hasta 10 m (33 pies) sobre el suelo, pero de 15 a 30 m (50 a 100 pies) en el dosel del bosque primario . [7] [24] Los estudios han encontrado que la especie puede pasar hasta el 40% de su tiempo por debajo de 3 m (10 pies), y el 70% de su tiempo en este nivel durante el final de la estación seca, cuando la planta la comida es limitada y los insectos constituyen un porcentaje mayor de la dieta. [24] La especie es más numerosa en el bosque espinoso, como la Reserva Especial Andohahela , que en el bosque de galería, prefiriendo el bosque litoral más seco, mientras que el lémur ratón marrón prefiere el bosque lluvioso del interior. [7]
Los límites de la distribución no se conocen bien. Se cree que se extiende desde el río Onilahy o el lago Tsimanampetsotsa en el sur hasta el Parque Nacional Ankarafantsika en el norte. [6] [9] También existe una población aislada y desarticulada en la parte sureste de la isla, cerca de Tôlanaro y el Parque Nacional Andohahela, hasta la Zona de Conservación de Mandena . [6] [9] Los individuos tienden a ocupar pequeños territorios de 1 a 2 ha (2,5 a 4,9 acres). [9] El lémur ratón gris también simpatría con el lémur ratón gris rojizo, el lémur ratón marrón dorado , el lémur ratón de Madame Berthe y varios otros lémures queirogaleidos . [6] En el Parque Nacional Ankarafantsika , donde coexiste con el lémur ratón marrón dorado, la densidad de población relativa del lémur ratón gris fue mayor en altitudes más altas y en hábitats más secos, mientras que el lémur ratón marrón dorado prefería lo contrario. [25] Otro estudio analizó la coexistencia del lémur ratón gris y el lémur ratón de Madame Berthe y encontró grupos pequeños y exclusivos de cada especie y un alto grado de superposición de nichos de alimentación . [26]
El lémur ratón gris puede alcanzar altas densidades de población de hasta varios cientos de individuos por kilómetro cuadrado [7] [9] (hasta 167 individuos/km 2 en el Parque Nacional Ankarafantsika y 712 individuos/km 2 en el Parque Nacional Kirindy Mitea ). [1] Esta abundancia no es uniforme y tiende a concentrarse en "núcleos de población", [9] lo que sugiere que es difícil estimar con precisión las densidades de población cuando se extrapola desde un área pequeña (a partir de varios estudios) a un área grande. La dificultad para encontrar individuos durante algunas épocas del año, particularmente durante los períodos secos, puede complicar aún más el problema de estimar las densidades de población. [7]
Los lémures ratón son omnívoros y prefieren frutas e insectos en la mayor parte de su dieta. El lémur ratón gris puede incluso bajar al suelo para atrapar insectos presa, [7] aunque rápidamente regresa a la cubierta protectora del sotobosque para consumir sus capturas. [24] El néctar también forma parte de la dieta del lémur ratón gris, lo que lo convierte en un polinizador potencial para especies de plantas locales. [9] Se conoce un solo caso de un macho canibalizando a una hembra adulta. [27]
Los depredadores más importantes del lémur ratón gris son el búho de Madagascar y la lechuza común . [6] [24] Los estudios realizados en la Reserva Beza Mahafaly y el Parque Nacional Kirindy Mitea indican una tasa de depredación de alrededor del 25% (porcentaje de población capturada por depredadores por año), la más alta conocida para cualquier especie de primate. Sin embargo, dado el alto potencial reproductivo de la especie, la depredación no parece tener un efecto drástico en sus poblaciones. [24] Otras aves rapaces , como el azor de Henst y otros búhos, también se alimentan de esta especie. También se sabe que las serpientes , como Ithycyphus miniatus (una serpiente colúbrida nativa ) y la boa arbórea de Madagascar , así como los depredadores mamíferos, como la mangosta de cola anillada , la mangosta de rayas estrechas , la fosa y los perros domésticos , se alimentan de la gris. lémur ratón. [9] [24] Los depredadores mamíferos a menudo descubren agujeros en los árboles que sirven como nidos y agrandan la abertura para poder atrapar y comerse al ocupante. Esto ejerce una fuerte presión selectiva sobre la elección del diámetro y la profundidad de la abertura del agujero del nido. [24]
Debido a su naturaleza no gregaria, el lémur ratón gris, al igual que otros lémures nocturnos, se defiende principalmente de los depredadores mediante estrategias de evitación, [24] aunque en esta especie se ha observado defensa grupal mediante el uso de llamadas de alarma y acoso de depredadores . [28] Los estudios que involucran la colocación de olores fecales de depredadores y no depredadores en poblaciones cautivas han demostrado una predisposición genética para el reconocimiento de los depredadores mediante la detección de metabolitos de la digestión de la carne. Se demostró que los lémures ratón evitaban los lugares donde normalmente recibían recompensas, además de exhibir una mayor actividad y comportamiento antidepredador, cuando el olor de las heces de los depredadores estaba presente en esa vecindad, pero no cuando el olor fecal de los no depredadores malgaches estaba presente. presente. [29]
Durante el día, cuando son más vulnerables, los individuos se refugian dentro de los agujeros de los árboles, a veces formando nidos. Pueden usar de tres a nueve hoyos de árboles diferentes dentro de su área de distribución, pero los individuos pueden usar un hoyo en particular durante hasta cinco días consecutivos. [6] [9] Los lémures ratón tienden a preferir los huecos de los árboles, pero también suelen hacer construcciones esféricas con hojas. Los nidos generalmente se encuentran en agujeros de árboles con un diámetro mínimo de 5 cm (2,0 pulgadas), con una mediana de 13 cm (5,1 pulgadas), lo que sugiere que este rango de diámetro de los agujeros de los árboles puede ser crucial para mantener un hábitat saludable. [7] El lémur ratón gris también pasa la mayor parte de su tiempo en una densa vegetación, lo que limita su visibilidad y accesibilidad a los depredadores. Además, tiene una alta tasa de reproducción para contrarrestar las pérdidas por depredación. [24]
El lémur ratón gris es nocturno y duerme durante el día en agujeros de árboles revestidos con hojarasca o en nidos esféricos especialmente construidos con hojas muertas, musgo y ramitas. [9] Por lo general, busca alimento solo durante la noche, pero puede dormir en grupos durante el día, cuya composición depende del género y la estación. [7] Los huecos de los árboles se pueden compartir con hasta otros 15 individuos, [9] aunque los machos tienden a dormir solos mientras que las hembras tienden a compartir nidos. [6]

Todos los lémures ratón son muy activos durante la noche, [10] a menudo correteando como ratones y saltando más de 3 m (9,8 pies), [24] utilizando la cola como órgano de equilibrio. [10] Cuando se mueven entre las ramas terminales de arbustos y árboles, se agarran usando los cuatro pies y se mueven con cuatro patas. [10] [24] Cuando están en el suelo, ya sea para atrapar insectos o cruzar áreas abiertas cortas, los lémures ratón saltan como una rana. [10] Cuando caza, se sabe que el lémur ratón gris captura invertebrados y pequeños vertebrados con agarres rápidos con las manos. [19]
En la estación seca, el lémur ratón gris se enfrenta al desafío de explotar eficientemente los recursos alimentarios escasamente distribuidos. Los resultados de un estudio reciente sobre esto mostraron que el lémur ratón gris no se mueve al azar, sino que utiliza señales espaciales para encontrar recursos alimenticios en ausencia de señales sensoriales, y que parecen reutilizar rutas comunes y altamente eficientes con respecto a los viajes. distancia. Se cree que, en lugar de utilizar una red basada en rutas, el lémur ratón gris tiene algún sentido de representación mental de su entorno espacial, que utiliza para encontrar y explotar recursos alimentarios. [30]
El comportamiento de búsqueda de alimento suele ser lento y la altura y la dirección cambian continuamente. La depredación de insectos ocurre principalmente en el suelo. [7] Antes de descender, las orejas se mueven alternativamente para ayudar a identificar la ubicación precisa de su presa. Los insectos son capturados durante una carrera rápida a través de la hojarasca y son transportados por la boca hacia la relativa seguridad de las ramas. [24] Los estudios con lémures ratón grises cautivos han demostrado que la visión se utiliza principalmente para la detección de presas, aunque los otros sentidos ciertamente desempeñan un papel en la búsqueda de alimento. [31]
El lémur ratón gris es omnívoro y se alimenta principalmente de frutas e invertebrados . [7] [24] Las poblaciones locales parecen especializarse en frutas disponibles localmente. Tanto en Marosalaza como en Mandena, los escarabajos son la principal presa de insectos, aunque también se comen polillas, mantis religiosas , chinches fulgoridas , grillos, cucarachas y arañas. Menos de la mitad de su dieta se compone de insectos y las frutas constituyen una fracción ligeramente mayor. [24] Este lémur también consume flores, gomas y néctar de árboles Euphorbia y Terminalia , hojas ( Uapaca sp.), exudados ( secreciones de larvas de homópteros ) y pequeños vertebrados como ranas arbóreas , geckos y camaleones . [6] [7] [9] Su dieta es variada estacionalmente y de contenido diverso, lo que le otorga un nicho de alimentación muy amplio en comparación con otras especies como el lémur ratón de Madame Berthe. Por lo tanto, se ve más afectado por la disponibilidad de alimentos que por la división de nichos donde se produce la simpatía. [32]
Como ocurre con todos los miembros del género lémur ratón, se sabe que el lémur ratón gris entra en breves estados de letargo diario, especialmente durante el frío y seco invierno del hemisferio sur . [8] [14] [33] Este rasgo raro en primates, [34] junto con la facilidad de observar la especie dentro de su amplia distribución geográfica [6] y su buena representación en cautiverio, [35] lo convierte en un tema popular para La investigación como organismo modelo .

El lémur ratón gris es único entre los lémures ratón estudiados hasta ahora porque es la única especie que exhibe un letargo estacional prolongado, pero solo se ha observado que este comportamiento ocurre en una localidad. [33] Los patrones de actividad pueden diferir notablemente entre sexos y poblaciones. En la Estación Forestal Ampijoroa en el Parque Nacional Ankarafantsika, machos y hembras exhiben letargo diario, en lugar de estacional. [6] [14] En el bosque de Kirindy, ambos sexos comparten el mismo letargo diario, sin embargo, durante la estación seca (abril/mayo a septiembre/octubre), las hembras se vuelven completamente inactivas durante varias semanas o hasta cinco meses para conservar energía y reducir depredación. Sin embargo, los machos rara vez permanecen inactivos durante más de unos pocos días y se vuelven extremadamente activos antes de que las hembras resurjan del letargo, lo que les permite establecer jerarquías y territorios para la temporada de reproducción . [6] [9] [14] El uso de estrategias alternativas de ahorro de energía en las mismas condiciones ambientales se observó directamente en 2008, proporcionando la primera confirmación fisiológica desde el campo. [34] Este patrón de letargo estacional versus diario puede estar relacionado con la estacionalidad de la región, [24] ya que Kirindy es el único lugar al oeste de los bosques tropicales de las montañas orientales que experimenta temperaturas muy bajas por la noche durante los meses de invierno. Al entrar en un letargo prolongado, a veces denominado hibernación, se reduciría el estrés termorregulador en las hembras, [33] mientras que los machos permanecen más activos en preparación para la próxima temporada de apareamiento. [6] No se ha demostrado ninguna diferencia en la mortalidad entre las hembras en hibernación y los machos activos. [36]
Durante el letargo, la tasa metabólica del lémur ratón gris se ralentiza y su temperatura corporal desciende a la temperatura ambiente, hasta 7 °C (45 °F). Durante los meses más fríos, de mayo a agosto, la especie selecciona los huecos de los árboles más cerca del nivel del suelo, donde la temperatura ambiente permanece más estable. Esto les permite permanecer en letargo por más tiempo y conservar los recursos metabólicos. [9] Un estudio demostró que durante la temporada de reproducción, tanto los machos como las hembras reducían su gasto energético en un 20% cuando anidaban en parejas, y se lograba un beneficio energético máximo del 40% cuando tres lémures ratón anidaban juntos. Incluso durante la temporada no reproductiva, se observó una ganancia energética máxima cuando dos o más animales anidaban juntos, porque la tasa metabólica en reposo ya estaba disminuida. [37]
Si bien el lémur ratón gris se encuentra tanto en bosques caducifolios primarios como secundarios, tiene densidades de población más bajas en los bosques secundarios. Esto se debe a que las variaciones en la abundancia del lémur ratón gris están relacionadas con su capacidad de entrar en letargo durante la estación seca, especialmente en el caso de las hembras, que tienden a hibernar por más tiempo que los machos. En los bosques primarios, pueden mantener el letargo o la hibernación diarios siempre que la temperatura de su cuerpo permanezca por debajo de los 28 °C (82 °F), pero en los bosques secundarios que tienen menos árboles grandes, las temperaturas son más altas e inhiben la capacidad del lémur ratón gris para mantenerse. letargo durante períodos prolongados de tiempo. Además, el lémur ratón gris de los bosques secundarios tiende a tener una masa corporal menor que los de los bosques primarios, así como tasas de supervivencia más bajas. Es probable que esto se deba a que aquellos con menor masa corporal tienen menos probabilidades de entrar en letargo y, por lo tanto, gastan alrededor de un 40% más de energía que aquellos que mantienen el letargo. [38]
Esta capacidad inusual de un primate para exhibir latencia, además del tamaño diminuto, ha llevado a los investigadores a especular que los lémures ancestrales, y posiblemente los primates ancestrales, pueden haber compartido algunos rasgos con los lémures ratón. En consecuencia, el lémur ratón gris se ha vuelto a utilizar como organismo modelo para estudiar la evolución de lémures y primates. [33] Por ejemplo, se cree que los lémures colonizaron Madagascar haciendo rafting hasta la isla hace unos 60 millones de años, según estudios filogenéticos moleculares . [39] [40] Antes del descubrimiento de que las corrientes oceánicas eran lo contrario de lo que son hoy, favoreciendo así tal evento, [41] se pensaba que habría tardado demasiado para que cualquier animal no capaz de entrar en un estado de letargo para sobrevivir el viaje. Por lo tanto, se pensaba que los lémures ratón, como el lémur ratón gris, compartían este rasgo plesiomórfico (ancestral) con los lémures ancestrales. [33]
El lémur ratón gris se describe como solitario pero sociable , [24] busca alimento solo por la noche, pero frecuentemente duerme en grupos durante el día. [7] [9] Este patrón social varía según el género, la estación y la ubicación. Las hembras tienden a compartir nidos con otras hembras y sus crías, mientras que los machos tienden a dormir solos o en parejas fuera de la temporada de reproducción. [6] [7] [9] Los grupos de hembras que comparten un nido pueden ser relativamente estables y constan de dos a nueve individuos, aunque se puede encontrar un macho con un grupo de hembras fuera de la temporada de reproducción. [10] Durante la temporada de reproducción (de septiembre a octubre), los machos y las hembras pueden dormir en el mismo agujero del árbol. [9] [10] Los grupos de sexos mixtos pueden ser comunes en este momento, con machos solteros compartiendo sitios de anidación con tres a siete hembras o hembras solteras compartiendo sitios de anidación con uno a tres machos. [7]
Las investigaciones han demostrado que el área de distribución del lémur ratón gris suele ser pequeña, posiblemente menos de 50 m (160 pies). [7] Los machos normalmente viajan más lejos durante la noche y tienen áreas de distribución que son dos veces más grandes que las de las hembras, [6] [7] a menudo se superponen entre sí y siempre se superponen con el área de distribución de al menos una hembra. [9] [10] El área de distribución de los machos se triplica durante la temporada de reproducción. [6] [9]
Los territorios de las hembras se superponen menos que los de los machos, aunque tienden a formarse concentraciones localizadas, o "núcleos de población", en algunas áreas, donde la proporción de sexos favorece a las hembras respecto a los machos en tres o cuatro a uno en el núcleo. [7] Los estudios genéticos indican que las hembras se organizan espacialmente en grupos ("núcleos de población") de individuos relacionados, mientras que los machos tienden a emigrar de su grupo natal. [6] Las investigaciones han demostrado que las hembras de esta especie pueden mantener áreas de distribución más pequeñas y asociarse más estrechamente con otras hembras que en otras especies de lémures ratón debido a un nicho de alimentación más oportunista y, en el caso de las poblaciones de Kirindy, al uso prolongado de , letargo estacional. [42]
Las vocalizaciones y el olor son los principales modos de comunicación dentro de esta especie. Los territorios de distribución están marcados con olores en la orina y las heces . [10] Las vocalizaciones son complejas y muy agudas (que van de 10 a 36 kHz ), a veces más allá del rango del oído humano (0,02 a 20 kHz). [10] [43] Estos incluyen llamadas para buscar contacto, apareamiento, comunicación a distancia, alarma y angustia. [10]
Al igual que otros lémures ratón, el lémur ratón gris utiliza lo que se ha descrito como un silbido armónico que tiene una frecuencia más baja y una duración más corta que su pariente cercano, el lémur ratón marrón . Además, se ha descubierto que los tipos de vocalizaciones emitidas por el lémur ratón gris pueden depender del entorno. En los hábitats de bosque seco más abiertos favorecidos por el lémur ratón gris, los trinos son más comunes y efectivos ya que se transmiten más rápido y es menos probable que queden enmascarados por el viento, mientras que los chirridos son más comunes en el lémur ratón marrón, lo que favorece Hábitats cerrados de bosque lluvioso. [44]
Como ocurre con otros mamíferos sociales, las llamadas revelan el sexo y la identidad del individuo. También se han detectado dialectos entre comunidades. El trino masculino, parte de la exhibición de apareamiento del macho, se parece mucho al canto de un pájaro en términos de su secuencia ordenada de sílabas moduladas en frecuencia de banda ancha, con un tono de entre 13 y 35 kHz y una duración de 0,3 a 0,9 segundos, repitiéndose hasta 1,5 veces. por minuto. Cada localidad tiene su propio tema de trinos que es distinto de los de las comunidades vecinas, y los machos residentes producen trinos individualmente distintos dentro de ese tema. Estas llamadas no están programadas genéticamente . Durante el juego, los machos jóvenes realizan intentos tempranos de emitir un trino, que muestran un alto grado de variabilidad. Las investigaciones han demostrado que los lémures ratón machos manipulan conscientemente el dialecto para parecerse al de sus vecinos, cuando son transferidos de su casa a un nuevo vecindario. Esto puede reducir la agresión y fomentar la aceptación social de los varones emigrantes a medida que se transfieren de su grupo natal al llegar a la madurez. [43]
Como los lémures ratón son especies crípticas y, por tanto, visualmente indistinguibles, sus llamadas sociales ayudan a los individuos a seleccionar parejas de su propia especie. Este sistema diferenciado de señalización y reconocimiento ha promovido la cohesión de las especies a través del aislamiento prematura y ha ayudado a los investigadores a distinguir e identificar especies. [45]
El sistema de apareamiento se describe como multimacho y multihembra. Los machos establecen jerarquías de dominancia antes de la temporada de apareamiento; sin embargo, algunos estudios en la naturaleza no han demostrado agresión masculina ni competencia visible por las hembras receptivas. Los machos en cautiverio se vuelven muy agresivos y forman estrictas jerarquías de dominancia. Estos machos cautivos pueden mostrar los niveles plasmáticos de testosterona más altos que se encuentran en los mamíferos, e incluso el olor de un macho dominante puede reducir los niveles de testosterona e inhibir sexualmente a un macho subordinado. [24] Durante la temporada de reproducción, los testículos masculinos aumentan significativamente de tamaño, [6] facilitando la competencia de espermatozoides debido a la promiscuidad femenina . Los estudios con el lémur ratón gris han demostrado que el período de inseminación óptimo, durante el cual es más probable que un macho engendre descendencia, ocurre temprano durante la receptividad de la hembra. [46] Sólo durante la temporada de apareamiento la mortalidad de los machos supera la de las hembras. [36]
Aunque el lémur ratón gris muestra patrones de apareamiento de múltiples machos y múltiples hembras, los estudios han demostrado que las hembras exhiben selección indirecta de pareja (una forma de poliandria seleccionada). Durante el estudio, las hembras se aparearían con entre 1 y 7 machos hasta 11 veces durante su única noche de receptividad, pero evitarían o contrarrestarían a los machos que intentaran monopolizar el apareamiento. Los machos dominantes que intentan monopolizar tienden a ser individuos más grandes y pesados. Sin embargo, se ha demostrado que la selección femenina ayuda a aumentar la diversidad genética entre la descendencia. [47]
El lémur ratón gris se considera en general sexualmente monomórfico, pero se ha registrado un dimorfismo sexual que fluctúa estacionalmente en términos de masa corporal. Si bien la masa corporal de ambos sexos fluctúa a lo largo del año en función de la disponibilidad de alimentos, siendo mayor en la temporada de lluvias, los diferentes repertorios de comportamiento de los sexos conducen a patrones específicos de cada sexo en esta fluctuación. Por ejemplo, la masa corporal masculina aumenta antes de la temporada de apareamiento debido a un aumento sustancial en el volumen de los testículos que probablemente mejora el éxito de los machos en la competencia de esperma. [48] [49]
Las hembras son receptivas durante 45 a 55 días entre septiembre y octubre, y el estro dura de 1 a 5 días. [6] [9] [10] Las hembras anuncian el estro mediante llamadas distintivas de alta frecuencia y marcas de olor. [9] La gestación dura de 54 a 68 días, [10] con un promedio de 60 días, lo que generalmente da como resultado 2 o 3 crías que pesan 5 g (0,18 oz) cada una. [6] [7] [9] [10] Los bebés nacen en un nido de hojas o en un agujero de árbol en noviembre, antes del inicio de la temporada de lluvias. [9] El destete ocurre después de 25 días, [10] y las crías se dejan en el nido o se llevan en la boca de la madre y se depositan en una rama mientras ella busca alimento. [9] [24] Las crías de lémures ratón no se aferran al pelaje de la madre. La independencia se logra en 2 meses, [7] [9] mientras que la madurez sexual se alcanza entre los 10 y 29 meses en las hembras y entre los 7 y 19 meses en los machos. [7] [10] Las hembras estrechamente relacionadas permanecen vagamente asociadas después de la maduración ( filopatría femenina ), mientras que los machos se dispersan de su área natal. En la naturaleza, la vida reproductiva del lémur ratón gris no supera los 5 años, [9] aunque, según se informa, los especímenes en cautiverio han vivido hasta 15 años y 5 meses, [10] o incluso hasta 18,2 años. [50]
El lémur ratón gris utiliza la cría cooperativa como forma de seguro familiar. La hembra transfiere regularmente a sus crías a los nidos de otras hembras y, de la misma manera, prepara y cuida a otras crías además de la suya. Si bien esto puede tener un alto costo fisiológico para una hembra lactante que ya está gastando mucha energía, en general puede ser beneficioso para asegurar la supervivencia entre grupos estrechamente relacionados con alto riesgo de mortalidad. Un estudio que se llevó a cabo durante tres temporadas de reproducción mostró que las hembras estrechamente relacionadas forman grupos de reproducción principalmente cuando hay escasez de refugios adecuados; cuando hay una ventaja de un nido comunitario para la defensa, o cuando hay beneficios termorreguladores. En el caso de adopción de crías, cuando uno de los padres muere y una mujer estrechamente relacionada se hace cargo del cuidado, se cree que esto es beneficioso para los grupos con alto riesgo de mortalidad. [51]
El lémur ratón gris fue incluido en el Apéndice 1 por la Convención sobre el Comercio Internacional de Especies Amenazadas (CITES) en 1975, [52] declarándolo amenazado de extinción y prohibiendo el comercio internacional de especímenes excepto para uso no comercial, como investigación científica. . [2] La evaluación de la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (UICN) de 2008 la enumera como una especie de menor preocupación (LC) con una tendencia poblacional decreciente. [1]
Sus mayores amenazas son la pérdida de hábitat debido a la agricultura de tala y quema y el pastoreo de ganado , así como la captura de animales vivos para el comercio local de mascotas en las partes norte y sur de su área de distribución. Aunque esta especie habita en bosques secundarios, los estudios han demostrado que la disminución de la calidad del hábitat afecta negativamente a sus poblaciones, ya que menos huecos en los árboles ofrecen menos oportunidades para conservar energía, lo que aumenta el estrés y la mortalidad. [1] [6] Un estudio encontró nueve especies de parásitos en la materia fecal del lémur ratón gris que vive en bosques que sufrieron degradación y fragmentación. En pequeños fragmentos de bosque de buena calidad, así como en bosques con altos niveles de degradación, el lémur ratón gris mostró una mayor prevalencia de nematodos y protozoos parásitos que aquellos en fragmentos de bosque más grandes de buena calidad. [53] Estudios realizados a finales de los años 1960 y 1970 demostraron que la tala intensa entre 1968 y 1970 parecía dar como resultado una disminución del peso corporal, el uso de árboles más pequeños como sitios de anidación y un tamaño máximo más pequeño del grupo de anidación de hembras (hasta 7 de 15). . [7] También existe la preocupación de que, aunque el letargo diario puede ayudar a conservar energía y recursos durante una escasez moderada de alimentos, la escasez prolongada de alimentos provocada por el cambio climático podría crear demasiado estrés y afectar gravemente la capacidad de supervivencia de la especie. [54] [55]
El lémur ratón gris se considera uno de los pequeños mamíferos nativos más abundantes de Madagascar y se encuentra en siete parques nacionales, cinco reservas especiales, la Reserva Privada Berenty y otros bosques privados protegidos dentro de la Zona de Conservación de Mandena. [6]
Esta especie de lémur ratón se reproduce muy bien en cautiverio, aunque no se exhibe comúnmente en zoológicos como algunos lémures diurnos más grandes. En 1989, más de 370 individuos estaban alojados en 14 instituciones del Sistema Internacional de Información sobre Especies (ISIS) y no pertenecientes a ISIS en Estados Unidos y Europa, el 97% de los cuales nacieron en cautiverio. [7] En marzo de 2009, 167 fueron registrados en 29 instituciones del ISIS, incluido el Centro Duke Lemur . [1] [35]