
Un esteroide es un compuesto orgánico con cuatro anillos fusionados (designados A, B, C y D) dispuestos en una configuración molecular específica .
Los esteroides tienen dos funciones biológicas principales: como componentes importantes de las membranas celulares que alteran la fluidez de la membrana ; y como moléculas de señalización . Los ejemplos incluyen el colesterol lipídico , las hormonas sexuales estradiol y testosterona , [2] : 10–19 esteroides anabólicos y el corticosteroide antiinflamatorio dexametasona . [3] Cientos de esteroides se encuentran en hongos , plantas y animales . Todos los esteroides se fabrican en células a partir de los esteroles lanosterol ( opistocontes ) o cicloartenol (plantas). El lanosterol y el cicloartenol se derivan de la ciclación del triterpeno escualeno . [4]
Los esteroides llevan el nombre del colesterol esteroide [5] , que se describió por primera vez en los cálculos biliares del griego antiguo cole : " bilis " y estéreos "sólido". [6] [7] [8]
El núcleo esteroide ( estructura central ) se llama gonano (ciclopentanoperhidrofenantreno). [9] Por lo general, está compuesto por diecisiete átomos de carbono , unidos en cuatro anillos fusionados: tres anillos de ciclohexano de seis miembros (anillos A, B y C en la primera ilustración) y un anillo de ciclopentano de cinco miembros (el anillo D). Los esteroides varían según los grupos funcionales unidos a este núcleo de cuatro anillos y según el estado de oxidación de los anillos. Los esteroles son formas de esteroides con un grupo hidroxi en la posición tres y un esqueleto derivado del colestano . [1] : 1785f [10] Los esteroides también se pueden modificar de forma más radical, como mediante cambios en la estructura del anillo, por ejemplo, cortando uno de los anillos. El corte del anillo B produce secosesteroides, uno de los cuales es la vitamina D 3 .


Gonano , también conocido como esterano o ciclopentanoperhidrofenantreno, el esteroide más simple y núcleo de todos los esteroides y esteroles, [11] [12] está compuesto por diecisiete átomos de carbono en enlaces carbono-carbono formando cuatro anillos fusionados en una forma tridimensional . Los tres anillos de ciclohexano (A, B y C en la primera ilustración) forman el esqueleto de un derivado perhidro del fenantreno . El anillo D tiene una estructura de ciclopentano . Cuando los dos grupos metilo y ocho cadenas laterales de carbono (en C-17, como se muestra para el colesterol) están presentes, se dice que el esteroide tiene una estructura de colestano. Las dos formas estereoisoméricas comunes de esteroides 5α y 5β existen debido a diferencias en el lado del sistema de anillos en gran medida plano donde está unido el átomo de hidrógeno (H) en el carbono 5, lo que resulta en un cambio en la conformación del anillo A de los esteroides. La isomerización en la cadena lateral C-21 produce una serie paralela de compuestos, denominados isosteroides. [13]
Ejemplos de estructuras esteroides son:
Además de las escisiones de los anillos (escisiones), expansiones y contracciones (escisión y cierre en anillos más grandes o más pequeños), todas ellas variaciones en la estructura del enlace carbono-carbono, los esteroides también pueden variar:
Por ejemplo, los esteroles como el colesterol y el lanosterol tienen un grupo hidroxilo unido en la posición C-3, mientras que la testosterona y la progesterona tienen un carbonilo (sustituyente oxo) en C-3. Entre estos compuestos, sólo el lanosterol tiene dos grupos metilo en C-4. El colesterol, que tiene un doble enlace de C-5 a C-6, se diferencia de la testosterona y la progesterona que tienen un doble enlace de C-4 a C-5.
Casi todos los esteroides biológicamente relevantes pueden presentarse como un derivado de una estructura de hidrocarburo similar al colesterol que sirve como esqueleto . [14] [15] Estas estructuras originales tienen nombres específicos, como pregnano , androstano , etc. Los derivados llevan varios grupos funcionales llamados sufijos o prefijos después de los números respectivos, que indican su posición en el núcleo esteroide. [16] Existen nombres triviales de esteroides de origen natural ampliamente utilizados con actividad biológica significativa, como progesterona , testosterona o cortisol . Algunos de estos nombres se definen en La nomenclatura de esteroides. [17] Estos nombres triviales también se pueden usar como base para derivar nuevos nombres, sin embargo, agregando solo prefijos en lugar de sufijos, por ejemplo, el esteroide 17α-hidroxiprogesterona tiene un grupo hidroxi (-OH) en la posición 17 del núcleo del esteroide. en comparación con la progesterona.
Las letras α y β [18] denotan estereoquímica absoluta en centros quirales , una nomenclatura específica distinta de la convención R/S [19] de química orgánica para denotar la configuración absoluta de grupos funcionales, conocida como reglas de prioridad de Cahn-Ingold-Prelog . La convención R/S asigna prioridades a los sustituyentes en un centro quiral en función de su número atómico. El grupo de mayor prioridad se asigna al átomo con el número atómico más alto y el grupo de menor prioridad se asigna al átomo con el número atómico más bajo. Luego, la molécula se orienta de modo que el grupo de menor prioridad apunte en dirección opuesta al espectador, y los tres grupos restantes se organizan en orden de prioridad decreciente alrededor del centro quiral. Si esta disposición es en el sentido de las agujas del reloj, se le asigna una configuración R; si es en sentido antihorario se le asigna una configuración S. [20] Por el contrario, la nomenclatura de esteroides utiliza α y β para indicar la estereoquímica en los centros quirales. Las designaciones α y β se basan en la orientación de los sustituyentes entre sí en un sistema de anillos específico. En general, α se refiere a un sustituyente que está orientado hacia el plano del sistema de anillos, mientras que β se refiere a un sustituyente que está orientado en dirección opuesta al plano del sistema de anillos. En los esteroides extraídos desde la perspectiva estándar utilizada en este artículo, los enlaces α se representan en las figuras como cuñas discontinuas y los enlaces β como cuñas sólidas. [14]
El nombre " 11-desoxicortisol " es un ejemplo de un nombre derivado que utiliza cortisol como estructura principal sin un átomo de oxígeno (de ahí "desoxi") unido a la posición 11 (como parte de un grupo hidroxi). [14] [21] La numeración de las posiciones de los átomos de carbono en el núcleo del esteroide se establece en una plantilla que se encuentra en la Nomenclatura de esteroides [22] que se utiliza independientemente de si un átomo está presente en el esteroide en cuestión. [14]
Los carbonos insaturados (generalmente, los que forman parte de un doble enlace) en el núcleo esteroide se indican cambiando -ano por -eno. [23] Este cambio se hacía tradicionalmente en el nombre del padre, agregando un prefijo para indicar la posición, con o sin Δ (delta mayúscula griega) que designa la insaturación, por ejemplo, 4-pregneno-11β,17α-diol-3,20 -diona (también Δ 4 -pregneno-11β,17α-diol-3,20-diona) o 4-androsteno-3,11,17-triona (también Δ 4 -androsteno-3,11,17-triona). Sin embargo, la Nomenclatura de Esteroides recomienda que el localizador de un doble enlace esté siempre adyacente a la sílaba que designa la insaturación, por lo tanto, teniéndolo como sufijo en lugar de prefijo, y sin el uso del carácter Δ, es decir, pregn-4-. eno-11β,17α-diol-3,20-diona o androst-4-eno-3,11,17-triona . El doble enlace se designa por el átomo de carbono con el número más bajo, es decir, "Δ 4 -" o "4-eno" significa el doble enlace entre las posiciones 4 y 5. La saturación de los carbonos de un esteroide original se puede realizar agregando "dihidro -" prefijo, [24] es decir, una saturación de los carbonos 4 y 5 de la testosterona con dos átomos de hidrógeno es 4,5α-dihidrotestosterona o 4,5β-dihidrotestosterona. Generalmente, cuando no hay ambigüedad, se puede omitir un número de una posición de hidrógeno de un esteroide con un enlace saturado, dejando solo la posición del segundo átomo de hidrógeno, por ejemplo, 5α-dihidrotestosterona o 5β-dihidrotestosterona . Los esteroides Δ 5 son aquellos con un doble enlace entre los carbonos 5 y 6 y los esteroides Δ 4 son aquellos con un doble enlace entre los carbonos 4 y 5. [25] [23]
Las abreviaturas como " P4 " para progesterona y " A4 " para androstenediona se refieren a Δ 4 -esteroides, mientras que " P5 " para pregnenolona y " A5 " para androstenediol se refieren a Δ 5 -esteroides. [14]
El sufijo -ol denota un grupo hidroxi , mientras que el sufijo -ona denota un grupo oxo. Cuando dos o tres grupos idénticos están unidos a la estructura base en diferentes posiciones, el sufijo se indica como -diol o -triol para hidroxi y -diona o -triona para grupos oxo, respectivamente. Por ejemplo, 5α-pregnano-3α,17α-diol-20-ona tiene un átomo de hidrógeno en la posición 5α (de ahí el prefijo "5α-"), dos grupos hidroxi (-OH) en las posiciones 3α y 17α (de ahí " 3α,17α-diol" sufijo) y un grupo oxo (=O) en la posición 20 (de ahí el sufijo "20-uno"). Sin embargo, se puede encontrar un uso erróneo de sufijos, por ejemplo, "5α-pregnan-17α-diol-3,11,20-trione" [26] [ sic ], ya que tiene solo un grupo hidroxi (en 17α) en lugar de dos. , entonces el sufijo debería ser -ol, en lugar de -diol, de modo que el nombre correcto sea "5α-pregnan-17α-ol-3,11,20-trione".
De acuerdo con la regla establecida en la Nomenclatura de Esteroides, la terminal "e" en el nombre de la estructura principal debe omitirse antes de la vocal (la presencia o ausencia de un número no afecta dicha elisión). [14] [16] Esto significa, por ejemplo, que si el sufijo que se agrega inmediatamente al nombre de la estructura principal comienza con una vocal, la "e" final se elimina de ese nombre. Un ejemplo de tal eliminación es " 5α-pregnan-17α-ol-3,20-diona ", donde la última "e" de " pregnane " se elimina debido a la vocal ("o") al comienzo del sufijo - viejo. Algunos autores utilizan incorrectamente esta regla, omitiendo la terminal "e" donde debe guardarse, o viceversa. [27]
El término "11-oxigenado" se refiere a la presencia de un átomo de oxígeno como sustituyente oxo (=O) o hidroxi (-OH) en el carbono 11. "Oxigenado" se utiliza consistentemente dentro de la química de los esteroides [ 28] desde que Década de 1950. [29] Algunos estudios utilizan el término "11-oxiandrógenos" [30] [31] como abreviatura de andrógenos 11-oxigenados, para enfatizar que todos tienen un átomo de oxígeno unido al carbono en la posición 11. [32] [33] Sin embargo, en la nomenclatura química, el prefijo "oxi" está asociado a grupos funcionales éter, es decir, un compuesto con un átomo de oxígeno conectado a dos grupos alquilo o arilo (ROR), [34] por lo que, utilizar "oxi" dentro del nombre de una clase de esteroides puede ser engañosa. Se pueden encontrar ejemplos claros de "oxigenado" para referirse a una amplia clase de moléculas orgánicas que contienen una variedad de grupos funcionales que contienen oxígeno en otros dominios de la química orgánica, [35] y es apropiado utilizar esta convención. [14]
Aunque "keto" es un prefijo estándar en química orgánica, las recomendaciones de 1989 de la Comisión Conjunta sobre Nomenclatura Bioquímica desalientan la aplicación del prefijo "keto" para los nombres de esteroides y favorecen el prefijo "oxo" (p. ej., esteroides 11-oxo en lugar de 11-ceto esteroides), porque "ceto" incluye el carbono que forma parte del núcleo esteroide y el mismo átomo de carbono no debe especificarse dos veces. [36] [14]
Los esteroides se encuentran en todos los ámbitos de la vida, incluidas las bacterias , las arqueas y los eucariotas . En los eucariotas, los esteroides se encuentran en hongos, plantas y animales. [37] [38]
En los procariotas , existen vías biosintéticas para la estructura esteroide tetracíclica (por ejemplo, en mixobacterias ) [39] – donde se conjetura su origen en eucariotas [40] – y la estructura hopanoide triterpinoide pentacíclica, más común . [41]
Los esteroides fúngicos incluyen los ergosteroles , que participan en el mantenimiento de la integridad de la membrana celular fúngica. Varios fármacos antimicóticos , como la anfotericina B y los antimicóticos azólicos , utilizan esta información para matar hongos patógenos . [42] Los hongos pueden alterar su contenido de ergosterol (por ejemplo, a través de mutaciones de pérdida de función en las enzimas ERG3 o ERG6 , que inducen el agotamiento de ergosterol, o mutaciones que disminuyen el contenido de ergosterol) para desarrollar resistencia a los medicamentos que se dirigen al ergosterol. [43]
El ergosterol es análogo al colesterol que se encuentra en las membranas celulares de los animales (incluidos los humanos) o a los fitoesteroles que se encuentran en las membranas celulares de las plantas. [43] Todos los hongos contienen grandes cantidades de ergosterol, en el rango de decenas a cientos de miligramos por 100 gramos de peso seco. [43] El oxígeno es necesario para la síntesis de ergosterol en los hongos. [43]
El ergosterol es responsable del contenido de vitamina D que se encuentra en los hongos; El ergosterol se convierte químicamente en provitamina D2 mediante la exposición a la luz ultravioleta . [43] La provitamina D2 forma espontáneamente vitamina D2. [43] Sin embargo, no todos los hongos utilizan ergosterol en sus membranas celulares; por ejemplo, la especie de hongo patógeno Pneumocystis jirovecii no lo hace, lo que tiene implicaciones clínicas importantes (dado el mecanismo de acción de muchos fármacos antimicóticos). Usando el hongo Saccharomyces cerevisiae como ejemplo, otros esteroides importantes incluyen ergosta-5,7,22,24(28)-tetraen-3β-ol, zimosterol y lanosterol . S. cerevisiae utiliza 5,6-dihidroergosterol en lugar de ergosterol en su membrana celular. [43]
Los esteroides vegetales incluyen los alcaloides esteroides que se encuentran en las solanáceas [44] y Melanthiaceae (especialmente el género Veratrum ), [45] los glucósidos cardíacos , [46] los fitoesteroles y los brasinoesteroides (que incluyen varias hormonas vegetales).
Los esteroides animales incluyen compuestos de origen vertebrado e insecto , estos últimos incluyen ecdisteroides como la ecdisterona (que controlan la muda en algunas especies). Los ejemplos de vertebrados incluyen las hormonas esteroides y el colesterol; este último es un componente estructural de las membranas celulares que ayuda a determinar la fluidez de las membranas celulares y es un constituyente principal de la placa (implicado en la aterosclerosis ). Las hormonas esteroides incluyen:
Las principales clases de hormonas esteroides , con miembros destacados y ejemplos de funciones relacionadas, son: [47] [48]
Las clases adicionales de esteroides incluyen:
Además de la siguiente clase de secosteroides (esteroides de anillo abierto):
Los esteroides se pueden clasificar según su composición química. [49] Un ejemplo de cómo MeSH realiza esta clasificación está disponible en el catálogo MeSH de Wikipedia. Ejemplos de esta clasificación incluyen:


En biología, es común nombrar las clases de esteroides anteriores por el número de átomos de carbono presentes cuando se hace referencia a hormonas: esteroides C 18 para los estranos (principalmente estrógenos), esteroides C 19 para los androstanos (principalmente andrógenos) y C 21 -esteroides para las embarazadas (principalmente corticosteroides). [50] La clasificación " 17-cetoesteroide " también es importante en medicina.
El gonano (núcleo esteroide) es la molécula de hidrocarburo tetracíclico de 17 carbonos sin cadenas laterales de alquilo . [51]
Los secosteroides (del latín seco , "cortar") son una subclase de compuestos esteroides que resultan, biosintética o conceptualmente, de la escisión (escisión) de los anillos esteroides originales (generalmente uno de los cuatro). Las principales subclases de secosteroides están definidas por los átomos de carbono de los esteroides donde se ha producido esta escisión. Por ejemplo, el secoesteroide prototípico colecalciferol , la vitamina D 3 (que se muestra), pertenece a la subclase de 9,10 secosteroides y deriva de la escisión de los átomos de carbono C-9 y C-10 del anillo B del esteroide; Los 5,6-secosteroides y los 13,14-esteroides son similares. [52]
Los norsteroides ( nor- , L. norma ; "normal" en química, que indica eliminación de carbono) [53] y homoesteroides (homo-, griego homos ; "igual", que indica adición de carbono) son subclases estructurales de esteroides formados a partir de pasos biosintéticos. La primera implica reacciones enzimáticas de expansión-contracción del anillo , y la segunda se logra ( biomiméticamente ) o (más frecuentemente) mediante cierres de anillo de precursores acíclicos con más (o menos) átomos en el anillo que la estructura esteroide original. [54]
Las combinaciones de estas alteraciones de los anillos son conocidas en la naturaleza. Por ejemplo, las ovejas que pastan lirios de maíz ingieren ciclopamina (en la imagen) y veratramina , dos de una subfamilia de esteroides donde los anillos C y D se contraen y expanden respectivamente a través de una migración biosintética del átomo C-13 original. La ingestión de estos homosteroides C-nor-D produce defectos de nacimiento en los corderos: ciclopía por ciclopamina y deformidad de las patas por veratramina. [55] Otro homoesteroide C-nor-D (nakiterpiosina) es excretado por las cianobacterias esponjas de Okinawa . por ejemplo, Terpios hoshinota , que provoca la mortalidad de los corales debido a la enfermedad del coral negro. [56] Los esteroides de tipo nakiterpiosina son activos contra la vía de señalización que involucra a las proteínas smoothened y hedgehog , una vía que es hiperactiva en varios cánceres. [ cita necesaria ]
Los esteroides y sus metabolitos a menudo funcionan como moléculas de señalización (los ejemplos más notables son las hormonas esteroides), y los esteroides y los fosfolípidos son componentes de las membranas celulares . [57] Los esteroides como el colesterol disminuyen la fluidez de la membrana . [58] Al igual que los lípidos , los esteroides son reservas de energía altamente concentradas. Sin embargo, no suelen ser fuentes de energía; en los mamíferos normalmente se metabolizan y excretan.
Los esteroides desempeñan un papel fundamental en una serie de trastornos, incluidos tumores malignos como el cáncer de próstata , donde la producción de esteroides dentro y fuera del tumor promueve la agresividad de las células cancerosas. [59]
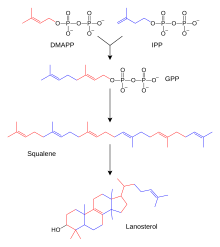
Los cientos de esteroides que se encuentran en animales, hongos y plantas están hechos de lanosterol (en animales y hongos; ver ejemplos anteriores) o cicloartenol (en otros eucariotas). Tanto el lanosterol como el cicloartenol derivan de la ciclación del triterpenoide escualeno . [4] El lanosterol y el cicloartenol a veces se denominan protoesteroles porque sirven como compuestos iniciales para todos los demás esteroides.
La biosíntesis de esteroides es una vía anabólica que produce esteroides a partir de precursores simples. En los animales se sigue una vía biosintética única (en comparación con muchos otros organismos ), lo que la convierte en un objetivo común para los antibióticos y otros fármacos antiinfecciosos. El metabolismo de los esteroides en humanos también es el objetivo de los medicamentos para reducir el colesterol, como las estatinas . En humanos y otros animales, la biosíntesis de esteroides sigue la vía del mevalonato, que utiliza acetil-CoA como componentes básicos del dimetilalil difosfato (DMAPP) y del isopentenil difosfato (IPP). [60] [ se necesita una mejor fuente ]
En pasos posteriores, DMAPP e IPP se conjugan para formar difosfato de farnesilo (FPP), que luego se conjuga entre sí para formar el escualeno triterpenoide lineal. La biosíntesis de escualeno es catalizada por la escualeno sintasa , que pertenece a la familia de las escualeno/fitoeno sintasa . La posterior epoxidación y ciclación del escualeno genera lanosterol, que es el punto de partida para modificaciones adicionales en otros esteroides (esteroidogénesis). [61] En otros eucariotas, el producto de ciclación del escualeno epoxidado (oxidoscualeno) es cicloartenol.

La vía del mevalonato (también llamada vía de la HMG-CoA reductasa) comienza con acetil-CoA y termina con dimetilalil difosfato (DMAPP) y isopentenil difosfato (IPP).
DMAPP e IPP donan unidades de isopreno , que se ensamblan y modifican para formar terpenos e isoprenoides [62] (una gran clase de lípidos, que incluyen los carotenoides y forman la clase más grande de productos naturales vegetales ). [63] Aquí, las unidades de isopreno se unen para producir escualeno y se pliegan en un conjunto de anillos para producir lanosterol . [64] El lanosterol luego se puede convertir en otros esteroides, como el colesterol y el ergosterol . [64] [65]
Dos clases de fármacos se dirigen a la vía del mevalonato : las estatinas (como la rosuvastatina ), que se utilizan para reducir los niveles elevados de colesterol , [66] y los bifosfonatos (como el zoledronato ), que se utilizan para tratar una serie de enfermedades degenerativas de los huesos. [67]

La esteroidogénesis es el proceso biológico mediante el cual los esteroides se generan a partir del colesterol y se transforman en otros esteroides. [69] Las vías de esteroidogénesis difieren entre especies. Las principales clases de hormonas esteroides, como se señaló anteriormente (con sus miembros y funciones destacados), son los progestágenos , los corticosteroides (corticoides), los andrógenos y los estrógenos . [25] [70] La esteroidogénesis humana de estas clases ocurre en varios lugares:
En plantas y bacterias, la vía sin mevalonato (vía MEP) utiliza piruvato y gliceraldehído 3-fosfato como sustratos para producir IPP y DMAPP. [62] [75]
Durante las enfermedades, se pueden utilizar vías que de otro modo no serían significativas en humanos sanos. Por ejemplo, en una forma de hiperplasia suprarrenal congénita, una deficiencia en la vía enzimática 21-hidroxilasa conduce a un exceso de 17α-hidroxiprogesterona (17-OHP); este exceso patológico de 17-OHP, a su vez, puede convertirse en dihidrotestosterona (DHT). un potente andrógeno) a través, entre otros, de la 17,20 liasa (un miembro de la familia de enzimas del citocromo P450 ), la 5α-reductasa y la 3α-hidroxiesteroide deshidrogenasa . [76]
Los esteroides son oxidados principalmente por enzimas oxidasas del citocromo P450 , como CYP3A4 . Estas reacciones introducen oxígeno en el anillo esteroide, lo que permite que otras enzimas descompongan el colesterol en ácidos biliares. [77] Estos ácidos pueden luego eliminarse mediante la secreción del hígado en la bilis . [78] La expresión del gen de la oxidasa puede ser regulada positivamente por el sensor de esteroides PXR cuando hay una alta concentración de esteroides en la sangre. [79] Las hormonas esteroides, que carecen de la cadena lateral del colesterol y los ácidos biliares, normalmente se hidroxilan en varias posiciones del anillo o se oxidan en la posición 17 , se conjugan con sulfato o ácido glucurónico y se excretan en la orina. [80]
El aislamiento de esteroides , según el contexto, es el aislamiento de materia química necesaria para la elucidación de la estructura química , la química de derivación o degradación, pruebas biológicas y otras necesidades de investigación (generalmente miligramos a gramos, pero a menudo más [81] o el aislamiento de "cantidades analíticas"). " de la sustancia de interés (donde la atención se centra en identificar y cuantificar la sustancia (por ejemplo, en tejido o fluido biológico). La cantidad aislada depende del método analítico, pero generalmente es inferior a un microgramo. [82 ] [ página necesario ]
Los métodos de aislamiento para lograr las dos escalas de producto son distintos, pero incluyen extracción , precipitación, adsorción , cromatografía y cristalización . En ambos casos, la sustancia aislada se purifica hasta alcanzar la homogeneidad química; Los métodos analíticos y de separación combinados, como LC-MS , se eligen por ser "ortogonales", logrando sus separaciones basadas en distintos modos de interacción entre la sustancia y la matriz aislante, para detectar una sola especie en la muestra pura.
La determinación de la estructura se refiere a los métodos para determinar la estructura química de un esteroide puro aislado, utilizando una variedad en evolución de métodos químicos y físicos que han incluido RMN y cristalografía de moléculas pequeñas . [2] : 10–19 Los métodos de análisis se superponen en las dos áreas anteriores, enfatizando los métodos analíticos para determinar si un esteroide está presente en una mezcla y determinar su cantidad. [82]
El catabolismo microbiano de las cadenas laterales de los fitosterol produce esteroides C-19, esteroides C-22 y 17-cetosteroides (es decir, precursores de las hormonas adrenocorticales y los anticonceptivos ). [83] [84] [85] La adición y modificación de grupos funcionales es clave a la hora de producir la amplia variedad de medicamentos disponibles dentro de esta clasificación química. Estas modificaciones se realizan utilizando técnicas convencionales de síntesis orgánica y/o biotransformación . [86] [87]
La semisíntesis de esteroides a menudo comienza a partir de precursores como el colesterol , [85] los fitoesteroles , [84] o las sapogeninas . [88] Los esfuerzos de Syntex , una empresa involucrada en el comercio de barbasco mexicano , utilizaron Dioscorea mexicana para producir la sapogenina diosgenina en los primeros días de la industria farmacéutica de esteroides sintéticos . [81]
Algunas hormonas esteroides se obtienen económicamente sólo mediante síntesis total a partir de productos petroquímicos (por ejemplo, 13- alquil esteroides). [85] Por ejemplo, el fármaco Norgestrel parte de la metoxi - 1-tetralona , un petroquímico derivado del fenol .
Se han otorgado varios premios Nobel por la investigación de esteroides, entre ellos:
Este artículo incorpora texto disponible bajo la licencia CC BY-SA 3.0.
"Je nommerai cholesterine , de χολη, bile, et στερεος, solide, la sustancia cristallisée des calculs biliares humains, ..." (nombraré colesterina – de χολη (bilis) y στερεος (sólido) – la sustancia cristalizada de los cálculos biliares humanos ... )
La base estructural del esteroide es un núcleo de esterano, un esqueleto de esterano policíclico C17 que consta de tres anillos de ciclohexano condensados en una unión no lineal o de fenantreno (A, B y C) y un anillo de ciclopentano (D).1,2
3S‐1.0.
Definición de esteroides y esteroles.
Los esteroides son compuestos que poseen el esqueleto de ciclopenta[a]fenantreno o un esqueleto derivado del mismo mediante una o más escisiones de enlaces o expansiones o contracciones de anillos.
Los grupos metilo normalmente están presentes en C-10 y C-13.
También puede estar presente una cadena lateral de alquilo en C-17.
Los esteroles son esteroides que llevan un grupo hidroxilo en C-3 y la mayor parte del esqueleto del colestano.
3S-4.
GRUPOS FUNCIONALES.
3S-4.0.
General.
Casi todos los esteroides biológicamente importantes son derivados de los hidrocarburos originales (ver Tabla 1) que llevan varios grupos funcionales.
[...] Se añaden sufijos al nombre del sistema original saturado o insaturado (ver 33-2.5), quedando elidida la e terminal de -ane, -ene, -yne, -adiene, etc. antes de una vocal (presencia o la ausencia de números no tiene ningún efecto sobre dichas elisiones).
3S‐4.9.
Nombres triviales de esteroides importantes En la Tabla 2 se dan ejemplos de nombres triviales conservados para derivados de esteroides importantes, que en su mayoría son compuestos naturales de actividad biológica significativa.
3S‐1.4.
Orientación de las fórmulas de proyección.
Cuando los anillos de un esteroide se indican como proyecciones en el plano del papel, la fórmula normalmente debe orientarse como en 2a.
Un átomo o grupo unido a un anillo representado en la orientación 2a se denomina α (alfa) si se encuentra debajo del plano del papel o β (beta) si se encuentra por encima del plano del papel.
P‐91.2.1.1 Estereodescriptores Cahn-Ingold-Prelog (CIP). Se recomiendan algunos estereodescriptores descritos en el sistema de prioridad Cahn-Ingold-Prelog (CIP), denominados 'estereodescriptores CIP', para especificar la configuración de compuestos orgánicos, como se describe y ejemplifica en este Capítulo y se aplica en los Capítulos P-1 a P-8. , y en la nomenclatura de productos naturales en el Capítulo P-10. Los siguientes estereodescriptores se utilizan como estereodescriptores preferidos (ver P‐92.1.2): (a) 'R' y 'S', para designar la configuración absoluta de los centros quirales tetracoordinados (cuadriligentes);
P‐13.8.1.1 El prefijo 'de' (no 'des'), seguido del nombre de un grupo o átomo (distinto del hidrógeno), denota la eliminación (o pérdida) de ese grupo y la adición de los átomos de hidrógeno necesarios. , es decir, intercambio de ese grupo con átomos de hidrógeno. Como excepción, "desoxi", cuando se aplica a compuestos hidroxi, denota la eliminación de un átomo de oxígeno de un grupo –OH con la reconexión del átomo de hidrógeno. "Deoxi" se utiliza ampliamente como prefijo sustractivo en la nomenclatura de carbohidratos (ver P‐102.5.3).
3S-1.1.
Numeración y letras de timbre.
Los esteroides están numerados y los anillos tienen letras como en la fórmula 1
Insaturación 3S‐2.5.
La insaturación se indica cambiando -ano a -eno, -adieno, -ino, etc., o -an- a -en-, -adien-, -yn- etc. Ejemplos: Androst-5-eno, no 5-androsteno;
5α-Colest-6-eno;
5β-colesta-7,9(11)-dieno;
5α-Colest-6-en-3β-ol.
Notas.
1) Actualmente se recomienda que el localizador de un doble enlace esté siempre adyacente a la sílaba que designa la insaturación.[...] 3) No se recomienda el uso del carácter Δ (delta mayúscula griega) para designar la insaturación en nombres individuales.
Sin embargo, se puede utilizar en términos genéricos, como 'Δ
5
-esteroides'.
P-31.2.2 Metodología general. Los prefijos 'hidro' y 'dehidro' están asociados con la hidrogenación y deshidrogenación, respectivamente, de un doble enlace; por lo tanto, se utilizan prefijos multiplicadores de valores pares, como 'di', 'tetra', etc., para indicar la saturación de los dobles enlaces, por ejemplo, 'dihidro', 'tetrahidro'; o creación de enlaces dobles (o triples), como 'didehidro', etc. En los nombres, se colocan inmediatamente delante del nombre del hidruro original y delante de cualquier prefijo no separable. Los átomos de hidrógeno indicados tienen prioridad sobre los prefijos 'hidro' para localizadores bajos. Si los átomos de hidrógeno indicados están presentes en un nombre, los prefijos "hidro" los preceden.
oxi* –O– P-15.3.1.2.1.1; P-63.2.2.1.1
El prefijo oxo- también debe usarse en relación con términos genéricos, por ejemplo, 17-oxo esteroides.
El término "17-cetoesteroides", utilizado a menudo en la literatura médica, es incorrecto porque C-17 se especifica dos veces, ya que el término ceto denota C=O.