
La muerte de las marismas es un término que se ha utilizado en los EE. UU. y el Reino Unido para describir la muerte de la esparta de las marismas , lo que provoca la consiguiente degradación del hábitat, en concreto en las zonas bajas de las marismas de las costas del Atlántico occidental. La esparta normalmente fija los sedimentos en las marismas; su pérdida provoca una disminución de la dureza del sustrato, un aumento de la erosión y el derrumbe de las orillas de los arroyos en el agua, lo que en última instancia da lugar a una disminución de la salud y la productividad de las marismas.
La mortandad puede afectar a varias especies de pastos marinos (género Spartina ), entre ellas S. alterniflora , S. densiflora y S. townsendii . Existen varias hipótesis que compiten entre sí para predecir las causas y los mecanismos de la mortandad de las marismas en todo el Atlántico occidental. Estas hipótesis ponen un énfasis diferente en los efectos de los procesos de arriba hacia abajo o de abajo hacia arriba para la mortandad de las marismas. Combinada con la mortandad regresiva de las marismas altas , la mortandad de las marismas es una amenaza grave para los servicios ecosistémicos que las marismas proporcionan a las comunidades costeras locales.
A la luz de su efecto sobre los procesos, comportamientos e interacciones ecológicas de la comunidad, las interacciones de consumo son uno de los conceptos más estudiados en ecología . Por ello, los científicos utilizan las redes alimentarias para representar todas las cadenas alimentarias y relaciones tróficas en una comunidad ecológica .

Las redes alimentarias pueden ser controladas por fuerzas de abajo hacia arriba o de arriba hacia abajo, que determinan si la estructura y la dinámica poblacional de una red alimentaria están reguladas por nutrientes (un suministro de carbono fijo ) y la producción primaria o por depredadores superiores , respectivamente.
Se pierde mucha energía de un nivel trófico al siguiente (alrededor del 90%); por lo tanto, el éxito de los niveles superiores está vinculado a los inferiores y a su suministro de recursos (Lindeman 1942). [1] Sin embargo, la abundancia y distribución de organismos en un ecosistema también se ve afectada por las densidades de consumidores, que limitan el éxito de los organismos en niveles tróficos inferiores y, por lo tanto, influyen en la abundancia de estos organismos (Hairston et al. 1960). [2]
Muchos ecologistas sostienen que el control de abajo hacia arriba y de arriba hacia abajo no juegan papeles igualmente críticos en la estructura y dinámica de las poblaciones de un ecosistema; sin embargo, los datos sugieren que tanto las fuerzas de abajo hacia arriba como las de arriba hacia abajo impactan la estructura de las redes alimentarias y la abundancia y distribución espacial y temporal de los organismos (Bertness 2007), [3] aunque no se entiende completamente en qué medida cada una juega un papel.
Históricamente, en muchos ecosistemas ha prevalecido en el pensamiento ecológico un énfasis en el control de abajo hacia arriba, a menudo con exclusión del control del consumidor (Strong 1992). [4] Muchos ecosistemas en los que el control del consumidor se ha considerado clásicamente trivial están dominados por plantas (por ejemplo, bosques, pastizales y marismas) y suelen tener un aspecto verde. Hairston y sus colegas propusieron una visión opuesta en 1960 que enfatizaba el control del consumidor. Argumentaron que el “mundo es verde” porque los niveles tróficos más altos regulan la abundancia de herbívoros (Hairston et al. 1960). [2]
Los críticos señalaron que el mundo no siempre es verde y que, cuando lo es, los herbívoros no necesariamente desempeñan un papel importante en la estructuración de las comunidades vegetales (Ehrlich y Birch, 1967). [5] Otros argumentaron que lo que es verde no siempre es comestible o de una calidad suficientemente alta como para permitir aumentos en las poblaciones de herbívoros (Dixon, 1966; Murdoch, 1966). [6] [7] El debate continúa, pero la visión dominante de los ecologistas sigue siendo que, aunque los consumidores afectan muchos aspectos de la productividad y la ecología de las plantas, el control de arriba hacia abajo no impulsa la productividad de los ecosistemas vegetales enteros.
Sin embargo, más recientemente han surgido ejemplos de un control evidente de ecosistemas enteros por parte de los consumidores en una variedad de hábitats, incluidos lagos (Carpenter et al. 1985), [8] ríos (Power 1992), [9] y hábitats marinos (Estes y Duggins 1995) [10] . Las especies de plantas fundamentales pueden ser reemplazadas por otras especies o sustratos que carecen por completo de vegetación y los insectos pueden defoliar manglares enteros (Feller 2002). [11]
Un ejemplo clásico de interacciones de arriba hacia abajo que dictan la estructura y función de una comunidad proviene del trabajo de Bob Paine en Washington, que estableció que la eliminación de la estrella de mar Pisaster desencadenó una cascada trófica en la que las poblaciones de mejillón azul ( Mytilus ) explotaron debido a la liberación de la presión de depredación (Paine 1966) [12].
Otro ejemplo influyente de control de arriba hacia abajo surgió de los experimentos de Jane Lubchenco en las costas rocosas de Nueva Inglaterra , que demostraron que el caracol herbívoro L. littorea ejerce control sobre la diversidad y sucesión de las comunidades de algas de las pozas de marea (Lubchenco y Menge 1978). [13] Una hipótesis que surgió del trabajo de Lubchenco (Little y Kitching 1996) [14] fue que la depredación del cangrejo verde ( Carcinus maenas ) influye en las comunidades de algas de las costas rocosas al regular la abundancia de L. littorea .
Los ecologistas citan estos ejemplos como evidencia de que la regulación del consumidor es más potente y predominante de lo que se reconocía anteriormente.

En las marismas, los primeros ecólogos como Eugene Odum y John Teal impulsaron el paradigma actual de abajo hacia arriba en ecología a través del trabajo en la isla Sapelo, Georgia (EE. UU.) que destacó el papel dominante de los factores físicos como la temperatura , la salinidad y los nutrientes en la regulación de la productividad primaria de las plantas y la estructura del ecosistema (Teal 1962, Odum 1971). [15] [16] Los ecólogos notaron que las plantas de las marismas no eran pastoreadas intensamente y parecían ser relativamente desagradables al paladar, y por lo tanto argumentaron que la mayoría de las plantas ingresaban a las cadenas alimentarias de las marismas como detritos (Teal 1962). [15] Un corolario de este dogma es que los consumidores juegan un papel poco importante o sutil en el control de la producción primaria de las marismas (Smalley 1960, Teal 1962). [15] [17] Este paradigma fue ampliamente aceptado durante décadas y se aplicó a otros ecosistemas como los manglares y los pastos marinos (Bertness 2007), [3] y, por lo tanto, se ha “arraigado en la comprensión conceptual de los ecosistemas costeros” (cita de Bertness y Silliman 2008; Smalley 1960, Nixon 1982). [17] [18] [19]
Sin embargo, trabajos recientes han demostrado un fuerte control de arriba hacia abajo de las comunidades de plantas en marismas por parte de una amplia variedad de consumidores, incluidos caracoles , cangrejos y gansos (Jefferies 1997, Bortolus e Iribarne 1999, Silliman y Bertness 2002, Holdredge et al. 2009). [20] [21] [22] [23] Los pastores de marismas también incluyen caballos salvajes (Furbish y Albano 1994), [24] ganado , liebres , insectos y roedores , algunos de los cuales pueden suprimir fuertemente el crecimiento de las plantas.
Se ha demostrado un fuerte control de arriba hacia abajo en los pantanos en varios sistemas de pantanos. El control del consumidor es impulsado por el cangrejo grápsido ( Chasmagnathus granulata ) en las marismas saladas de Argentina y Brasil en la costa atlántica de América del Sur (Bortolus e Iribarne 1999). [21] Otros experimentos en Argentina han contribuido al creciente cuerpo de trabajo que evidencia el control del consumidor en las marismas saladas (Alberti et al. 2007), [25] y también se ha sugerido que la herbivoría juega un papel importante en las marismas del Atlántico sudoccidental (Bortolus e Iribarne 1999, Alberti et al. 2007). [21] [25] Los consumidores no sólo son importantes a pequeña escala, como lo demuestran los experimentos con jaulas en varios lugares (Silliman y Zieman 2001, Silliman y Bertness 2002, Silliman et al. 2005), [22] [26] [27] sino que también afectan la productividad primaria en grandes áreas geográficas (Silliman y Zieman 2001). [26]
Bertness y Silliman también han sugerido que si bien las marismas pueden haber estado históricamente limitadas en nutrientes y controladas desde abajo hacia arriba, las perturbaciones humanas como la eutrofización y el agotamiento de los depredadores han cambiado estos sistemas al control de arriba hacia abajo en las últimas décadas (Bertness y Silliman 2008). [18]

Se ha propuesto que las fuerzas de arriba hacia abajo y de abajo hacia arriba son los principales impulsores de la mortandad de marismas en todo el Atlántico occidental. La importancia relativa de estos factores depende de las condiciones abióticas y bióticas de cada sistema de marismas local o regional y de su entorno.
Las actividades humanas pueden desencadenar cascadas tróficas (Jefferies 1997), [20] que ocurren cuando los depredadores que limitan la abundancia de presas y por lo tanto mejoran la supervivencia del siguiente nivel trófico inferior se agotan (Strong 1992). [4] El agotamiento de los depredadores superiores libera a sus presas del control del consumidor y conduce a disminuciones de la población del siguiente nivel trófico inferior, a menudo los productores primarios . Las cascadas tróficas ocurren a lo largo de un mínimo de tres niveles tróficos y pueden afectar la dinámica de la comunidad en una variedad de sistemas (Estes et al. 1998). [28] Las cascadas tróficas pueden inducir la muerte de marismas y transformar paisajes verdes en páramos (Estes y Duggins 1995, Silliman et al. 2005). [10] [27] Los desencadenantes primarios de las cascadas tróficas a través de la acción humana incluyen la introducción de especies invasoras , la sobreexplotación y el cambio climático (Jackson et al. 2001, Lotze et al. 2006, Gedan et al. 2009, Gedan y Bertness 2011). [29] [30]

La introducción humana de especies no nativas también puede contribuir al control de arriba hacia abajo de los sistemas pantanosos (Furbish y Albano 1994, Gough y Grace 1998). [24] [31] Los caballos salvajes introducidos en las islas barrera de Maryland, Virginia y las Carolinas han despojado por completo los ecosistemas pantanosos (Furbish y Albano 1994), [24] y la nutria roedora introducida en los pantanos de la Costa del Golfo de Luisiana puede reducir la producción primaria de plantas de los pantanos (Gough y Grace 1998). [31]
El cangrejo verde invasor, Carcinus maenas , puede desactivar el control descendente facilitando la recuperación de los ecosistemas de marismas. En marismas que han sufrido una mortandad masiva a través de la cascada trófica iniciada por la sobrepesca recreativa, los cangrejos verdes de marisma morados, Sesarma reticulatum , pueden ser expulsados por los cangrejos verdes más grandes, que se aprovechan de ellos. De esta manera, los cangrejos verdes pueden reducir indirectamente la herbivoría del cangrejo morado y promover la recuperación de la esparta. Estos resultados son alentadores porque sugieren que las especies invasoras, que clásicamente se considera que tienen impactos principalmente negativos en los ecosistemas que invaden, a veces pueden contribuir realmente a restaurar los ecosistemas degradados. [32]
La mortandad podría explicarse potencialmente por patógenos de plantas de marismas en algunas áreas: se han identificado especies de hongos en sitios de mortandad en el Reino Unido, así como en sitios de la costa atlántica y del golfo de los EE. UU. (Elmer 2013). [33] La degradación de marismas facilitada por hongos es una preocupación documentada en el Atlántico Sureste en particular. Los caracoles de marisma Littoraria irrorata hacen cortes pequeños en la hierba durante el pastoreo. Estos cortes facilitan el crecimiento de hongos y, en altas densidades de caracoles, pueden conducir a infecciones masivas , aumento del pastoreo y mortandad consecuente (Silliman y Bertness 2002, Silliman y Newell 2003, Silliman et al. 2005). [22] [27] [34]
En la costa de Nueva Inglaterra, esta evidencia es más débil. Ciertos hongos patógenos de S. alterniflora se encontraron con mayor frecuencia en sitios de mortandad. Estos patógenos tienen distintos grados de virulencia y hay cierta evidencia de asociación con especies de Fusarium y áreas de mortandad. Sin embargo, aunque la asociación sugiere un vínculo causal parcial, particularmente en plantas predispuestas al estrés, falta evidencia sólida que sugiera que dichos hongos patógenos sean una causa importante de mortandad en Nueva Inglaterra (Elmer 2013). [33]
La sobreexplotación ha provocado el colapso de varios ecosistemas marinos de aguas poco profundas en todo el mundo (Jackson et al. 2001), [29] incluidos los arrecifes de coral (Hughes et al. 2003), [35] los lechos de pastos marinos y los bosques de algas (Estes et al. 1998). [28]

Las investigaciones sobre el caracol de marisma Littoraria irrorata y sus efectos sobre la productividad de las plantas de marisma han proporcionado pruebas sólidas del control del consumidor en marismas provocado por la sobreexplotación. Este caracol es capaz de convertir hebras de espartina (Spartina alterniflora ) (>2,5 m de altura) en marismas en 8 meses, lo que es menos de una temporada de crecimiento (Silliman y Bertness 2002). [22] Como se mencionó anteriormente, los caracoles de marisma infligen cortes en las hojas de espartina cuando pastan, proporcionando sustrato y nutrientes para los hongos . En altas densidades de caracoles, la espartina puede sucumbir a infecciones por hongos y puede producirse la muerte de los pantanos (Silliman y Bertness 2002, Silliman y Newell 2003, Silliman et al. 2005). [22] [27] [34] Los depredadores naturales del caracol de pantano son los cangrejos azules ( Callinectes sapidus ) y las tortugas acuáticas ( Malaclemys terrapin ), que históricamente regulaban la abundancia de caracoles. Sin embargo, estos depredadores han sido sobreexplotados comercialmente y ahora sufren enfermedades debido al pequeño tamaño de la población, lo que libera a los caracoles de la presión del consumidor y les permite causar estragos en las poblaciones de pastos de pantanos salados (Silliman y Zieman 2001). [22] [26]

Un ejemplo clásico de una cascada trófica fue causada por la sobreexplotación de nutrias marinas en la década de 1980 (Estes y Duggins 1995). [10] Las nutrias marinas comen erizos , que a su vez pastan en macroalgas en una cadena alimentaria que, cuando se altera, puede conducir a estériles de erizos . Las nutrias marinas en Alaska fueron cazadas hasta casi la extinción por sus pieles . Donde las poblaciones de nutrias marinas han persistido, suprimen la abundancia de erizos y, por lo tanto, tienen un efecto positivo indirecto en la densidad de macroalgas. Por el contrario, en los sitios donde las nutrias marinas están ausentes, las poblaciones de erizos de mar han aumentado y han causado el desarrollo de estériles de erizos. Dondequiera que se han restablecido las nutrias marinas, las poblaciones de erizos de mar se han reducido y las densidades de algas han aumentado, devolviendo el hábitat a su estado saludable original. Este ejemplo demuestra el potencial de recuperación de todo el ecosistema con el restablecimiento de los consumidores (Estes y Duggins 1995). [10]
Otras cascadas tróficas, como las causadas por cangrejos como Chasmagnathus granulata en América del Sur, se deben al menos en parte a la sobrepesca de los depredadores superiores (Bortolus e Iribarne 1999, Alberti et al. 2007). [21] [25]

En Nueva Inglaterra, la disminución de los depredadores ha provocado una extensa mortandad de las orillas de los arroyos de las marismas. La herbivoría ya ha afectado hasta el 90% de las orillas de los arroyos en más del 70% de las marismas exteriores de Cape Cod. Ausente en 1997, la mortandad se ha extendido recientemente a la bahía de Narragansett , Rhode Island, afectando a más del 85% de las orillas de los arroyos. El cangrejo morado de los pantanos nocturno , Sesarma reticulatum , está desempeñando un papel importante en esta mortandad a través del aumento de la excavación y la herbivoría debido a la liberación de la presión de la depredación. La evidencia ha señalado al control de arriba hacia abajo causado por las perturbaciones humanas como el agente principal que impulsa la mortandad.
Altieri y sus colegas realizaron una serie de experimentos (Altieri et al. 2012) [36] diseñados para dilucidar los mecanismos que impulsan la mortandad de los pantanos de manera más específica. Los cangrejos sesarma normalmente son depredados por cangrejos azules ( Callinectes sapidus ) y peces como la lubina rayada ( Morone saxatilis ) y el tiburón liso ( Mustelus canis ). Aunque se han demostrado los efectos en cascada de la sobrepesca en varios ecosistemas (Myers y Worm 2003), la investigación sobre el agotamiento de los depredadores se ha centrado casi exclusivamente en el impacto de la sobrepesca comercial a gran escala (Worm et al. 2009). Sin embargo, Altieri y sus colegas (2012) [36] demostraron que los depredadores de sesarma fueron, y continúan siendo, sobreexplotados por los pescadores deportivos . Sus resultados muestran que la mortandad y los pantanos con vegetación diferían dramáticamente en la presión de la pesca recreativa, ya que los pescadores solo fueron observados en los sitios de mortandad.
Los pantanos con mortandad tenían la mitad de la biomasa de los depredadores de nivel superior encontrados en sitios con vegetación, mientras que la biomasa de los consumidores no cosechados no difirió entre los sitios con vegetación y los sitios con mortandad. Además, la tasa de depredación en Sesarma en sitios con vegetación fue el triple que la de los sitios con mortandad, y los cangrejos consumieron cuatro veces más pasto en los sitios con mortandad que en los sitios con vegetación. Las reconstrucciones históricas mostraron que hubo poca pérdida neta de pantanos (<5%) entre 1939 y 2005 en los sitios que actualmente tienen vegetación. En contraste, los pantanos con mortandad mostraron el inicio de la mortandad a mediados de los años 70, con una pérdida de vegetación en constante aumento hasta 2005, momento en el que se perdió >20% del área total del pantano debido a la mortandad y >80% de la zona de pastos de cuerda quedó sin vegetación. Esta divergencia entre las marismas en proceso de muerte y las marismas con vegetación coincide con un período de rápido aumento en la cantidad de muelles y amarres para embarcaciones antes de mediados de los años 70, que resultó en el establecimiento de más del 70 % de la infraestructura pesquera presente actualmente en las marismas en proceso de muerte. Estos resultados brindan evidencia de que la liberación de Sesarma debido a la presión de depredación de cangrejos y peces debido a la sobrepesca recreativa por parte de los pescadores está impulsando una cascada trófica que es responsable de la extensa muerte de marismas en todo el sur de Nueva Inglaterra (Altieri et al. 2012). [36]
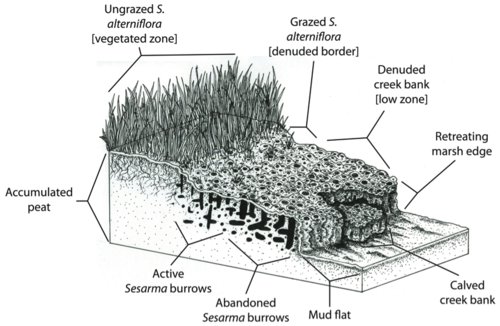
Altieri y sus colegas (2012) [36] plantearon además la hipótesis de que la sobreexplotación industrializada, histórica y a gran escala de los peces en el Atlántico noroeste (Lotze et al. 2006) [30] aumentó la vulnerabilidad de los pantanos a los efectos de la pesca recreativa localizada hasta el punto de que se produjo una mortandad a gran escala, y que las mortandades localizadas resultantes podrían fusionarse en una mortandad completa de los pantanos en toda la región si continúa la sobreexplotación de los principales consumidores (Altieri et al. 2012). [36]
Más recientemente, Bertness y sus colegas (Bertness et al. 2014b) [37] realizaron un experimento de campo excluyendo depredadores de parcelas en el borde de pastoreo del pantano. Dentro de una temporada de crecimiento, la exclusión de los principales depredadores desencadenó la mortandad al aumentar la abundancia de cangrejos Sesarma y la intensidad de la herbivoría. Para probar aún más la hipótesis de la cascada trófica, Bertness y sus colegas utilizaron la propagación de la mortandad en la bahía de Narragansett para evaluar todos los impulsores propuestos de la mortandad, incluidos: 1) la eutrofización disminuye la inversión de las plantas en la biomasa subterránea causando el colapso de las plantas, 2) las estelas de los barcos erosionan las orillas de los arroyos, 3) la contaminación o las enfermedades afectan la salud de las plantas, 4) la dureza del sustrato controla las distribuciones de cangrejos herbívoros y 5) la disfunción trófica libera a Sesarma del control de los depredadores. La disponibilidad de nitrógeno, la intensidad de las olas y el crecimiento de las plantas no explicaron ninguna variación en la mortandad. Sin embargo, la herbivoría explicó más del 70% de la variación entre sitios en la mortandad. (Bertness et al. 2014a) [38] Este trabajo destacó un ejemplo particular en el que se demostró experimentalmente que las interacciones de arriba hacia abajo son el impulsor principal del cambio del estado de la comunidad ecológica.
Una teoría de control de abajo hacia arriba se basa en la química diferencial del suelo entre las áreas con vegetación y las áreas en mortandad. Se ha propuesto que los cambios en la química del suelo asociados con la sequía están asociados con áreas de mortandad. Las sequías a menudo se asocian con un aumento de la salinidad y el estrés por acidez : los suelos se oxidan bajo la limitación de humedad del agua dulce o de las mareas , lo que conduce a un aumento de la acidez. La hipersalinidad se ha vinculado con una menor supervivencia de S. alterniflora (Brown et al. 2005). [39] Sin embargo, las plantas de marismas generalmente toleran una amplia gama de niveles de salinidad, y no se ha observado un aumento de la salinidad de manera constante en los sitios de mortandad (Alber et al. 2008). [40]
Hay incertidumbre sobre el vínculo entre las diferentes condiciones del suelo y los sitios de mortandad por varias razones. En primer lugar, las mediciones pueden no realizarse en intervalos lo suficientemente frecuentes como para capturar fluctuaciones breves en las condiciones del suelo asociadas con la mortandad. En segundo lugar, atribuir una relación causal con el cambio en las condiciones del suelo y la mortandad es potencialmente dudoso. La causalidad inversa es una posible explicación; es decir, las diferencias en la química del suelo pueden ser un resultado en lugar de un agente de la mortandad. Por ejemplo, un estudio observó niveles más altos de salinidad en áreas de mortandad en algunos meses, pero esto posiblemente se debió a una dinámica alterada de las raíces o de la evaporación debido a la mortandad (Marsh 2007).
El enriquecimiento de nutrientes es una amenaza global generalizada para los ecosistemas marinos y terrestres (Galloway et al. 2008, Verhoeven et al. 2006). [41] [42] En los ecosistemas marinos, el aumento del flujo de nitrógeno puede provocar floraciones de algas graves, condiciones anóxicas y pérdidas generalizadas de la pesca (Diaz y Rosenberg 2008). [43] En las marismas, un importante ecosistema de interfaz entre la tierra y el mar, se ha planteado la hipótesis de que la adición de nutrientes contribuye a la mortandad generalizada de arroyos (Deegan et al. 2012). [44]
Para poner a prueba esta hipótesis, Linda Deegan y sus colegas realizaron un estudio de nueve años en un lugar de Massachusetts. Los investigadores descubrieron que el enriquecimiento de nitrógeno y fósforo de los arroyos por las mareas provocó una menor inversión en raíces y rizomas que recolectan nutrientes del subsuelo, un aumento de la descomposición microbiana de la materia orgánica y, con el tiempo, el colapso de los arroyos y la pérdida de marismas (Deegan et al., 2012). [44]
Sin embargo, estudios similares en Connecticut no han podido reproducir estos hallazgos. Shimon Anisfeld y Troy Hill realizaron un experimento de fertilización de 5 años en una marisma salada en Long Island Sound y descubrieron que ni la fertilización con nitrógeno ni con fósforo condujo a una pérdida de elevación, una reducción del carbono del suelo o una disminución de la producción primaria subterránea. Sugieren que los altos niveles de nutrientes pueden alterar significativamente los procesos de la marisma y aumentar la pérdida bruta de carbono de los sedimentos, pero que otros procesos pueden compensar estos impactos. No se anticipan efectos perjudiciales netos de la carga de nutrientes en el almacenamiento de carbono o en la estabilidad de la marisma a partir de este estudio (Anisfeld y Hill 2012). [45]
Otros estudios de eutrofización realizados en la bahía de Narragansett, Rhode Island, descubrieron que la adición experimental de nitrógeno inicialmente aumenta la productividad de las plantas, pero finalmente conduce a una reducción de la biomasa de las plantas debido a la herbivoría de los insectos (Bertness et al. 2008). [46] Para complementar este experimento, los investigadores realizaron encuestas en 20 marismas para observar la interacción entre los niveles de nutrientes de las marismas y la presión de los herbívoros y descubrieron que el suministro de nitrógeno de las marismas era un buen predictor del daño de los herbívoros a las plantas. Este estudio sugiere que la eutrofización está provocando actualmente la supresión de la productividad primaria por parte de los consumidores en las marismas de Nueva Inglaterra y puede llegar a representar una amenaza para el suministro de servicios ecosistémicos de las marismas (Bertness et al. 2008). [46]
Los ecosistemas costeros sufren una variedad de impactos antropogénicos , como la eutrofización a gran escala , la alteración de la red alimentaria , los efectos del consumo descontrolado, el cambio climático , la destrucción del hábitat y las enfermedades . Rara vez estos factores actúan de manera aislada. A menudo, los investigadores encuentran interacciones aditivas o sinérgicas entre los impactos que agravan la cantidad de degradación del ecosistema . Un ejemplo de ello se encuentra en las marismas del sureste de los Estados Unidos. El agotamiento de los principales depredadores en estos sistemas ha llevado al pastoreo excesivo de caracoles en las marismas y la posterior muerte masiva (como se explicó anteriormente). Sin embargo, esta muerte masiva se ha relacionado con condiciones de sequía intensa y los aumentos resultantes en el estrés salino y ácido (Silliman et al. 2005). [27] El estrés por sequía que aumenta las salinidades del suelo y aumenta las vulnerabilidades de las hierbas al control de arriba hacia abajo puede ser un producto del cambio climático (Silliman y Bertness 2002, Silliman et al. 2005). [22] [27] Casos como estos resaltan cómo las interacciones abióticas y bióticas pueden interactuar para afectar la salud del ecosistema .
Las acciones antropogénicas también pueden causar eutrofización, o aumentar la carga de nutrientes, de los ecosistemas marinos, a través de la escorrentía en el sistema que contiene fertilizantes , aguas residuales , jabón de lavavajillas y otras sustancias ricas en nitrógeno y fósforo. La eutrofización es omnipresente en los ecosistemas marinos costeros (Lotze et al. 2006) [30] y puede iniciar indirectamente cascadas tróficas y aumentar el control de los consumidores sobre las plantas. Por ejemplo, la herbivoría de insectos en pantanos se ha correlacionado positivamente con la disponibilidad de nutrientes en marismas saladas del Atlántico (Bertness et al. 2008). [46] En la bahía de Narragansett, la herbivoría de insectos suprime la producción primaria de marismas saladas perturbadas por humanos en casi un 40%. Las adiciones de nitrógeno a través de la actividad humana pueden aumentar la herbivoría de insectos tanto que la producción primaria se suprime en casi un 60%, mientras que los pantanos sin desarrollo humano de la costa permanecen únicamente bajo control de abajo hacia arriba (Bertness et al. 2008). [46] El aumento del suministro de nutrientes también puede provocar una herbivoría descontrolada en otros sistemas (Gough y Grace 1998, Silliman y Zieman 2001). [26] [31]
Por ejemplo, la eutrofización inicia un control de arriba hacia abajo a través del impacto de los gansos nivales en las marismas árticas de la bahía de Hudson (Jefferies 1997). [20] En la década de 1980, los gansos nivales que originalmente migraban anualmente a la bahía de Hudson habían pasado de alimentarse en humedales templados a alimentarse en campos agrícolas altamente fertilizados . En un período de 30 años, la población de gansos se disparó. Desde entonces, los gansos nivales han destruido por completo cientos de miles de acres del humedal de la bahía de Hudson. Los gansos arrancaron las raíces de las plantas de los pantanos, la evaporación aumentó, lo que llevó a un aumento posterior de la salinidad y, sin plantas que oxigenaran el suelo, el sustrato se volvió anóxico. Este entorno indeseable para las plantas de los pantanos no permite el reclutamiento sexual en el área. Los gansos nivales han desnudado el pantano hasta que la recolonización por corredores clonales pueda restaurar la vegetación del pantano, lo que podría llevar años. Debido al uso de fertilizantes artificiales en los campos agrícolas de la zona templada, se inició una cascada trófica (Jefferies 1997). [20]
Uno de los principales objetivos de la ecología durante el próximo siglo será comprender cómo responderán los ecosistemas a los impactos humanos actuales y futuros y las interacciones aditivas o sinérgicas entre ellos.

Los servicios ecosistémicos son los beneficios que los humanos obtienen de los sistemas ecológicos. Hoy en día, uno de los argumentos para proteger las marismas es aumentar la calidad y cantidad de estos servicios. Las marismas secuestran nitrógeno, filtrando el agua de escorrentía y reduciendo la entrada de nitrógeno a los estuarios (Valiela y Cole 2002). [47] Las marismas también proporcionan un hábitat de refugio esencial para peces jóvenes y crustáceos , abasteciendo las pesquerías costeras (Boesch y Turner 1984) [48] que representan el 90% de la captura mundial de peces (PNUMA 2006). [49] Las marismas también secuestran carbono , que será un servicio ecosistémico importante a medida que se intensifique el cambio climático (Chmura et al. 2003). [50] Podría decirse que el servicio ecosistémico más importante que proporcionan las marismas es actuar como barreras marinas naturales porque las hierbas unen los suelos, previenen la erosión de la costa , atenúan las olas y reducen las inundaciones costeras (Costanza et al. 2008). [51]
Sin embargo, la capacidad natural de las marismas para amortiguar la erosión y las inundaciones puede verse reducida por la muerte de las orillas de los arroyos. Dado que Spartina alterniflora es responsable de la fijación de sedimentos y la deposición de turba (Redfield 1965), [52] la muerte de la grama puede comprometer la capacidad de las marismas para seguir el ritmo del aumento del nivel del mar . Además, la concentración de madrigueras de Sesarma en la turba de las marismas de Nueva Inglaterra puede desencadenar directamente la erosión y el colapso de la base de turba de las marismas.
En Cape Cod, las orillas de los arroyos de los pantanos suelen estar tan plagadas de madrigueras de Sesarma que se derrumban, exponiendo la turba fresca a más excavaciones y erosión (Bertness et al. 2008). [46] Las retroalimentaciones entre la herbivoría del cangrejo y la muerte de la grama pueden conducir al retroceso de los bordes de los pantanos. Por ejemplo, Coverdale y sus colegas descubrieron que 20 años de muerte masiva en Cape Cod han resultado en la pérdida de más de 200 años de acreción de pantanos y cientos de acres de pérdida de pantanos. [53] Los efectos perjudiciales que las cascadas tróficas han tenido en los pantanos no solo reducen la biodiversidad , la salud y el atractivo estético de estos ecosistemas, sino que también comprometen la capacidad de los pantanos para proporcionar servicios ecosistémicos clave a las poblaciones humanas.
A pesar de la creciente evidencia de lo contrario, el control de abajo hacia arriba sigue siendo el dogma central que determina los esfuerzos de gestión , conservación y restauración de las marismas . Las marismas saladas se gestionan actualmente como si estuvieran reguladas exclusivamente por factores físicos. Sin embargo, el agotamiento global y cercano a la costa de los depredadores superiores que conduce a la liberación de herbívoros crípticos o no apreciados puede ser la mayor amenaza actual para las marismas saladas. La dependencia de la teoría (favorecimiento subconsciente de identificar y/o examinar fenómenos naturales que tienden a confirmar en lugar de refutar el paradigma actual de un sistema de estudio [Kuhn 1962] [54] ) y la demostración, en lugar de falsificar la ciencia, han sido los principales culpables de este descuido. En consecuencia, las amenazas a las marismas saladas que están gobernadas por el control de arriba hacia abajo se están pasando por alto, con consecuencias potencialmente devastadoras.
Las cascadas tróficas son interacciones poderosas que regulan fuertemente la biodiversidad , la estructura de la comunidad y el funcionamiento del ecosistema. Originalmente se pensaba que las cascadas tróficas eran poco comunes, pero se ha vuelto evidente que ocurren en diversos ecosistemas terrestres, de agua dulce y marinos, tanto a escalas espaciales como temporales pequeñas y grandes. Las cascadas tróficas son aspectos comunes y generalizados de muchas comunidades que durante mucho tiempo se creyó que estaban controladas por fuerzas de abajo hacia arriba y/o eran resistentes al control de los consumidores.
Por lo tanto, la conservación de los ecosistemas afectados por cascadas tróficas no ha incorporado adecuadamente el control de arriba hacia abajo en sus planes y esfuerzos de gestión y restauración, pero las investigaciones recientes han enfatizado que esto es necesario para proteger los servicios que brindan estos ecosistemas y restaurarlos a sus condiciones originales. De no hacerlo, las cascadas tróficas podrían transformar comunidades vegetales altamente diversas y productivas en llanuras estériles.
Además, no reevaluar el paradigma actual y no reconocer que tanto las fuerzas de abajo hacia arriba como las de arriba hacia abajo afectan muchas características de la estructura y función del ecosistema, y que estas fuerzas son complementarias en lugar de contradictorias, podría impedir cualquier incorporación de ambos mecanismos en cualquier plan de gestión y reducir el éxito de los esfuerzos de conservación antes de que siquiera comiencen.