La reacción aldólica ( adición aldólica ) es una reacción de la química orgánica que combina dos compuestos carbonílicos (por ejemplo, aldehídos o cetonas ) para formar un nuevo compuesto β-hidroxicarbonílico. Su forma más simple podría implicar la adición nucleofílica de una cetona enolizada a otra:

Estos productos se conocen como aldoles , del aldehído + alcohol , un motivo estructural que se observa en muchos de los productos. El uso de aldehído en el nombre proviene de su historia: los aldehídos son más reactivos que las cetonas, por lo que la reacción se descubrió primero con ellos. [2] [3] [4]
La reacción aldólica es paradigmática en química orgánica y quizás el medio más común de formación de enlaces carbono-carbono en química orgánica . [5] [6] [7] Presta su nombre a la familia de reacciones aldólicas y técnicas similares analizan toda una familia de reacciones de α-sustitución de carbonilo , así como las condensaciones de dicetonas . Cuando el nucleófilo y el electrófilo son diferentes, la reacción se denomina reacción aldólica cruzada ; por el contrario, cuando el nucleófilo y el electrófilo son los mismos, la reacción se denomina dimerización aldólica .
Las unidades estructurales aldólicas se encuentran en muchas moléculas importantes, ya sean naturales o sintéticas. [8] [9] La reacción se utiliza en varias síntesis industriales, en particular de pentaeritritol , [10] trimetilolpropano , el plastificante 2-etilhexanol y el fármaco Lipitor ( atorvastatina , sal de calcio). [11] Para muchas de las aplicaciones de productos básicos, la estereoquímica de la reacción aldólica no es importante, pero el tema es de gran interés para la síntesis de muchos productos químicos especiales.

La reacción aldólica tiene un mecanismo subyacente, pero aparece en diferentes formas dependiendo del pH: [12]
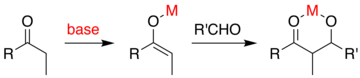
Si el catalizador es una base moderada, como un ion hidróxido o un alcóxido , la reacción aldólica se produce mediante un ataque nucleofílico del enolato estabilizado por resonancia sobre el grupo carbonilo de otra molécula. El producto es la sal alcóxido del producto aldólico. A continuación se forma el propio aldol, que puede sufrir deshidratación para dar el compuesto carbonílico insaturado. El esquema muestra un mecanismo simple para la reacción aldólica catalizada por una base de un aldehído consigo mismo.

Aunque en algunos casos sólo se requiere una cantidad catalítica de base, el procedimiento más habitual es utilizar una cantidad estequiométrica de una base fuerte como LDA o NaHMDS . En este caso, la formación de enolato es irreversible y el producto aldólico no se forma hasta que el alcóxido metálico del producto aldólico se protona en un paso de tratamiento independiente.
Cuando se utiliza un catalizador ácido, el paso inicial en el mecanismo de reacción implica la tautomerización catalizada por ácido del compuesto carbonílico al enol. El ácido también sirve para activar el grupo carbonílico de otra molécula por protonación, volviéndolo altamente electrofílico. El enol es nucleófilo en el carbono α, lo que le permite atacar al compuesto carbonílico protonado, lo que conduce al aldol después de la desprotonación . Algunos también pueden deshidratarse más allá del producto deseado para dar el compuesto carbonílico insaturado a través de la condensación aldólica .

A pesar del atractivo de la variedad aldólica, hay varios problemas que deben abordarse para que el proceso sea efectivo. El primer problema es termodinámico: la mayoría de las reacciones aldólicas son reversibles. Además, el equilibrio también está apenas del lado de los productos en el caso de reacciones aldólicas simples de aldehído-cetona. [13] Si las condiciones son particularmente duras (p. ej.: NaOMe/MeOH/ reflujo ), puede ocurrir condensación, pero esto generalmente se puede evitar con reactivos suaves y temperaturas bajas (p. ej., LDA (una base fuerte), THF, −78 °C). Aunque la adición aldólica generalmente procede hasta casi completarse en condiciones irreversibles, los aductos aldólicos aislados son sensibles a la escisión retroaldólica inducida por bases para devolver los materiales de partida. En contraste, las condensaciones retroaldólicas son raras, pero posibles. [14] Esta es la base de la estrategia catalítica de las aldolasas de clase I en la naturaleza, así como de numerosos catalizadores de amina de moléculas pequeñas. [15]
Cuando se hace reaccionar una mezcla de cetonas asimétricas, se pueden anticipar cuatro productos de adición aldólica cruzada :

Por lo tanto, si se desea obtener sólo uno de los productos cruzados, se debe controlar qué carbonilo se convierte en enol/enolato nucleófilo y cuál permanece en su forma carbonílica electrófila. El control más simple es si sólo uno de los reactivos tiene protones ácidos, y sólo esta molécula forma el enolato. Por ejemplo, la adición de malonato de dietilo al benzaldehído produce sólo un producto:

Si un grupo es considerablemente más ácido que el otro, el protón más ácido es abstraído por la base y se forma un enolato en ese carbonilo mientras que el carbonilo menos ácido permanece electrofílico. Este tipo de control funciona solo si la diferencia de acidez es lo suficientemente grande y la base es el reactivo limitante . Un sustrato típico para esta situación es cuando la posición desprotonable es activada por más de un grupo similar al carbonilo. Los ejemplos comunes incluyen un grupo CH2 flanqueado por dos carbonilos o nitrilos (ver por ejemplo la condensación de Knoevenagel y los primeros pasos de la síntesis del éster malónico y la síntesis del éster acetoacético ).
De lo contrario, los carbonilos más ácidos suelen ser también los electrófilos más activos: primero los aldehídos , luego las cetonas , luego los ésteres y, por último, las amidas . Por lo tanto, las reacciones de aldehído cruzado suelen ser las más desafiantes porque pueden polimerizarse fácilmente o reaccionar de manera no selectiva para dar una mezcla estadística de productos. [16]
Una solución común es formar primero el enolato de un socio y luego agregar el otro socio bajo control cinético . [17] El control cinético significa que la reacción de adición aldólica directa debe ser significativamente más rápida que la reacción retroaldólica inversa. Para que este enfoque tenga éxito, también deben cumplirse otras dos condiciones: debe ser posible formar cuantitativamente el enolato de un socio y la reacción aldólica directa debe ser significativamente más rápida que la transferencia del enolato de un socio a otro. Las condiciones de control cinético comunes implican la formación del enolato de una cetona con LDA a −78 °C, seguida de la adición lenta de un aldehído.
La reacción aldólica une dos moléculas relativamente simples para formar una más compleja. La complejidad aumenta porque cada extremo del nuevo enlace puede convertirse en un estereocentro . La metodología moderna no solo ha desarrollado reacciones aldólicas de alto rendimiento , sino que también controla por completo la configuración relativa y absoluta de estos nuevos estereocentros. [6]
Para describir la estereoquímica relativa en los carbonos α y β, los artículos más antiguos utilizan la nomenclatura eritro/treo de la química de los sacáridos; los artículos más modernos utilizan la siguiente convención syn / anti . Cuando los nucleófilos propionatos (o de orden superior) se añaden a los aldehídos, el lector visualiza el grupo R de la cetona y el grupo R' del aldehído alineados en un patrón de "zigzag" en el papel (o la pantalla). La disposición de los estereocentros formados se considera syn o anti , dependiendo de si están en el mismo lado o en lados opuestos de la cadena principal:
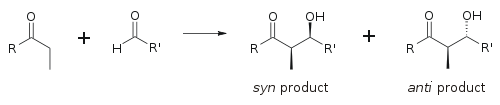
El factor principal que determina la estereoselectividad de una reacción aldólica es el contraión metálico enolizante . Los enlaces metal-oxígeno más cortos "estrechan" el estado de transición y producen una mayor estereoselección. [18] El boro se utiliza a menudo [19] [20] porque sus longitudes de enlace son significativamente más cortas que las de otros metales baratos ( litio , aluminio o magnesio ). La siguiente reacción da una relación sin:anti de 80:20 utilizando un enolato de litio en comparación con 97:3 utilizando un enolato de bibutilboro.

Donde el contraión determina la fuerza de la estereoinducción , el isómero enolato determina su dirección . Los isómeros E dan productos anti y los Z dan productos sin : [21]


Si los dos reactivos tienen carbonilos adyacentes a un estereocentro preexistente, entonces los nuevos estereocentros pueden formarse en una orientación fija con respecto al anterior . Este "estereocontrol basado en el sustrato" ha sido objeto de un amplio estudio y los ejemplos abundan en la literatura. En muchos casos, un estado de transición estilizado , llamado modelo de Zimmerman-Traxler , puede predecir la nueva orientación a partir de la configuración de un anillo de 6 miembros . [22]
Si el enol tiene un estereocentro adyacente, entonces los dos estereocentros que flanquean el carbonilo en el producto son naturalmente sin : [23]

La razón mecanicista subyacente depende del isómero enólico. Para un enolato E , la estereoinducción es necesaria para evitar la tensión 1,3-alílica , mientras que un enolato Z, en cambio, busca evitar las interacciones 1,3-diaxiales: [24]

Sin embargo, Fráter y Seebach demostraron que una fracción básica de Lewis quelante adyacente al enol provocará, en cambio, anti adición.
Los enolatos E muestran una selección diastereofacial de Felkin , mientras que los enolatos Z muestran una selectividad anti-Felkin. El modelo general se presenta a continuación: [25] [26]
Dado que el estado de transición de los enolatos Z debe contener una interacción sin -pentano desestabilizadora o un rotámero anti-Felkin , los enolatos Z son menos diastereoselectivos: [27] [28]
Si tanto el enolato como el aldehído contienen quiralidad preexistente, entonces el resultado de la reacción aldólica de "doble estereodiferenciación" se puede predecir utilizando un modelo estereoquímico combinado que tenga en cuenta todos los efectos analizados anteriormente. [29] A continuación se ofrecen varios ejemplos: [28]
A finales de los años 1970 y 1980, David A. Evans y sus colaboradores desarrollaron una técnica para la estereoselección en las síntesis aldólicas de aldehídos y ácidos carboxílicos . [30] [31] El método funciona añadiendo temporalmente un auxiliar de oxazolidinona quiral para crear un enolato quiral. La quiralidad preexistente del auxiliar se transfiere luego al aducto aldólico a través de métodos de Zimmermann-Traxler y luego se elimina la oxazolidinona.
Las oxazolidinonas comerciales son relativamente caras, pero se obtienen en dos pasos sintéticos a partir de aminoácidos comparativamente económicos. (Las síntesis económicas a gran escala preparan el material auxiliar en casa). Primero, un borohidruro reduce la fracción ácida . Luego, el aminoalcohol resultante se cicla deshidratativamente con un éster de carbonato simple, como el dietilcarbonato.
La acilación de una oxazolidinona se denomina informalmente "carga realizada".
Los aductos anti , que requieren un enolato E , no se pueden obtener de manera confiable con el método de Evans. Sin embargo, los enolatos Z , que dan lugar a aductos syn , se pueden formar de manera confiable utilizando una enolización suave mediada por boro: [32]
A menudo, se puede obtener un único diastereómero mediante una cristalización del aducto aldólico.
Muchos métodos escinden el auxiliar: [33]
Un auxiliar quiral adicional común es un grupo tioéter : [33] [b]
En el enfoque de tiazolidinetiona de Crimmins , [34] [35] una tiazolidinetiona es el auxiliar quiral [36] y puede producir los aductos "sin Evans" o "sin no Evans" simplemente variando la cantidad de (−)-esparteína . Se cree que la reacción se produce a través de estados de transición de seis miembros unidos al titanio , análogos a los estados de transición propuestos para el auxiliar Evans.
Una modificación común de la reacción aldólica utiliza otros grupos funcionales similares como enoles sustitutos . En la reacción aldólica de Mukaiyama , [37] los éteres de sililo enol se añaden a los carbonilos en presencia de un catalizador de ácido de Lewis , como el trifluoruro de boro (como eterato de trifluoruro de boro ) o el tetracloruro de titanio . [38] [39]
En la alquilación de enaminas de Stork , las aminas secundarias forman enaminas cuando se exponen a cetonas. Estas enaminas luego reaccionan (posiblemente de manera enantioselectiva [ 40]) con electrófilos adecuados. Esta estrategia ofrece una enantioselección simple sin metales de transición. En contraste con la preferencia por los aductos sin que se observa típicamente en las adiciones aldólicas basadas en enolato, estas adiciones aldólicas son antiselectivas .
En solución acuosa, la enamina puede luego hidrolizarse a partir del producto, lo que la convierte en un catalizador de moléculas orgánicas pequeñas . En un ejemplo fundamental, la prolina catalizó eficazmente la ciclización de una tricetona:
Esta combinación es la reacción de Hajos-Parrish [41] [42] [43] En las condiciones de Hajos-Parrish solo es necesaria una cantidad catalítica de prolina (3 mol%). No hay peligro de una reacción de fondo aquiral porque los intermediarios de enamina transitorios son mucho más nucleofílicos que sus enoles cetónicos originales.
Una estrategia de tipo Stork también permite las reacciones cruzadas, que de otro modo serían difíciles, entre dos aldehídos. En muchos casos, las condiciones son lo suficientemente suaves como para evitar la polimerización: [44]
Sin embargo, la selectividad requiere la adición lenta y controlada con bomba de jeringa del componente electrofílico deseado, ya que ambos componentes reaccionantes suelen tener protones enolizables. Si un aldehído no tiene protones enolizables ni ramificaciones alfa o beta, se puede lograr un control adicional.
En la adición aldólica habitual, se desprotona un compuesto carbonílico para formar el enolato. El enolato se añade a un aldehído o una cetona, que forma un alcóxido, que luego se protona durante el procesamiento. En principio, un método superior evitaría el requisito de una secuencia de varios pasos a favor de una reacción "directa" que podría realizarse en un solo paso del proceso.
Si un componente del acoplamiento enoliza preferentemente, el problema general es que la adición genera un alcóxido, que es mucho más básico que los materiales de partida. Este producto se une firmemente al agente enolizante, impidiéndole catalizarse con reactivos adicionales:
Un enfoque, demostrado por Evans, es sililar el aducto aldólico. [45] [46] Se agrega un reactivo de silicio como TMSCl en la reacción, que reemplaza el metal en el alcóxido, lo que permite la renovación del catalizador metálico:
Las síntesis tradicionales de hexosas utilizan variaciones de estrategias iterativas de protección-desprotección , que requieren de 8 a 14 pasos; la organocatálisis puede acceder a muchos de los mismos sustratos mediante un protocolo de dos pasos que implica la dimerización de alfa-oxialdehídos catalizada por prolina seguida de una ciclización aldólica de Mukaiyama en tándem.
La dimerización aldólica de alfa-oxialdehídos requiere que el aducto aldólico, en sí mismo un aldehído, sea inerte a posteriores reacciones aldólicas. [47] Estudios anteriores revelaron que los aldehídos que llevan sustituyentes alfa-alquiloxi o alfa -sililoxi eran adecuados para esta reacción, mientras que los aldehídos que llevan grupos atractores de electrones como el acetoxi no eran reactivos. El producto eritrosa protegido podría entonces convertirse en cuatro posibles azúcares mediante la adición aldólica de Mukaiyama seguida de la formación de lactol . Esto requiere un diastereocontrol apropiado en la adición aldólica de Mukaiyama y que el ion sililoxicarbenio producto se cicle preferentemente, en lugar de sufrir una reacción aldólica adicional. Al final, se sintetizaron glucosa , manosa y alosa :
Los ejemplos de reacciones aldólicas en bioquímica incluyen la división de fructosa-1,6-bisfosfato en dihidroxiacetona y gliceraldehído-3-fosfato en la cuarta etapa de la glucólisis , que es un ejemplo de una reacción aldólica inversa ("retro") catalizada por la enzima aldolasa A (también conocida como fructosa-1,6-bisfosfato aldolasa).
En el ciclo del glioxilato de las plantas y algunos procariotas, la isocitrato liasa produce glioxilato y succinato a partir del isocitrato . Después de la desprotonación del grupo OH, la isocitrato liasa escinde el isocitrato en el succinato de cuatro carbonos y el glioxilato de dos carbonos mediante una reacción de escisión aldólica. Esta escisión es similar en términos mecánicos a la reacción de la aldolasa A de la glucólisis.
La reacción aldólica fue descubierta independientemente por el químico ruso (y compositor romántico) Alexander Borodin en 1869 [48] [49] [50] y por el químico francés Charles-Adolphe Wurtz en 1872, que originalmente utilizó aldehídos para realizar la reacción. [2] [3] [4]
Howard Zimmerman y Marjorie D. Traxler propusieron su modelo de estereoinducción en un artículo de 1957. [22]