La investigación sobre la evolución del envejecimiento , o envejecimiento, tiene como objetivo explicar por qué un proceso perjudicial como el envejecimiento evolucionó y por qué hay tanta variabilidad en la duración de vida de los organismos . Las teorías clásicas de la evolución ( acumulación de mutaciones , pleiotropía antagónica y soma desechable ) [1] [2] [3] sugieren que los factores ambientales, como la depredación, los accidentes, las enfermedades y/o el hambre, aseguran que la mayoría de los organismos que viven en entornos naturales no vivirán hasta la vejez, por lo que habrá muy poca presión para conservar los cambios genéticos que aumentan la longevidad. La selección natural , en cambio, favorecerá fuertemente a los genes que aseguren la maduración temprana y la reproducción rápida, y la selección de rasgos genéticos que promuevan el automantenimiento molecular y celular disminuirá con la edad para la mayoría de los organismos. [4]
August Weismann fue el responsable de interpretar y formalizar los mecanismos de la evolución darwiniana en un marco teórico moderno. En 1889, teorizó que el envejecimiento era parte del programa de la vida para hacer espacio para la siguiente generación con el fin de sostener la renovación necesaria para la evolución. [5] La idea de que la característica del envejecimiento fue seleccionada (una adaptación) debido a su efecto nocivo fue ampliamente descartada durante gran parte del siglo XX, pero un modelo teórico sugiere que el envejecimiento altruista podría evolucionar si hay poca migración entre las poblaciones. [6] Weismann abandonó más tarde su teoría y después de algún tiempo continuó con su teoría de la "muerte programada". [ cita requerida ]
La selección natural es un proceso que permite a los organismos adaptarse mejor al medio ambiente, es la supervivencia del más apto que se predice que producirá más descendientes. La selección natural actúa sobre los rasgos del ciclo de vida para optimizar el éxito reproductivo y la aptitud de por vida. La aptitud en este contexto se refiere a la probabilidad de que un organismo sobreviva y se reproduzca. Se basa en el medio ambiente y también es relativa a otros individuos de la población. Ejemplos de rasgos del ciclo de vida incluyen; edad y tamaño en la primera reproducción, número de tamaño y descendientes producidos, y el período de vida reproductiva. Los organismos ponen energía en el crecimiento, la reproducción y el mantenimiento siguiendo un patrón particular que cambia a lo largo de su vida debido a las compensaciones que existen entre las diferentes asignaciones de energía. La inversión en la reproducción actual frente a la futura, por ejemplo, se produce a expensas de la otra. Sin embargo, la selección natural no es tan efectiva en los organismos a medida que envejecen. La acumulación de mutaciones (MA) y la pleiotropía antagónica (PA) son dos factores que contribuyen a la senescencia . [7] Tanto la MA como la PA contribuyen a las disminuciones relacionadas con la edad en la aptitud. [8] La acumulación de alelos mutados aleatorios relacionados con la edad en la línea germinal se conoce como acumulación de mutaciones. Nótese que las mutaciones somáticas no son hereditarias, son solo una fuente de variación del desarrollo. Los estudios realizados en Drosophila melanogaster han demostrado que la acumulación de mutaciones impulsa la combinación de alelos que tienen "efectos aditivos específicos de la edad" que causan una disminución en la respuesta al estrés y, en última instancia, una disminución relacionada con la edad en la aptitud. [7] El número de divisiones de células germinales por generación es variable entre linajes y se relaciona con el tamaño del genoma; en el caso de los humanos, se producen 401 divisiones de células germinales por generación en los machos y 31 en las hembras. [9]
La primera teoría moderna sobre el envejecimiento de los mamíferos fue formulada por Peter Medawar en 1952. Esta teoría se había desarrollado en la década anterior con JBS Haldane y su concepto de sombra selectiva . El desarrollo de la civilización humana ha cambiado la sombra selectiva, ya que las condiciones en las que viven los humanos ahora incluyen una mejor calidad de los alimentos, las condiciones de vida y la atención médica. Esta atención médica mejorada incluye la medicina moderna, como los antibióticos y la nueva tecnología médica. [10] Algunos estudios en Drosophila han demostrado que la edad de expresión de nuevas mutaciones deletéreas define los efectos que contribuyen a la mortalidad. Sin embargo, en general, aunque su frecuencia aumenta, sus efectos y variación disminuyen con la edad.
No existe ninguna teoría que explique cómo estas mutaciones perjudiciales afectan la aptitud a diferentes edades y la evolución de la senescencia. [11] [12] Su idea era que el envejecimiento era una cuestión de negligencia, ya que la naturaleza es un lugar altamente competitivo. Casi todos los animales mueren en la naturaleza por depredadores, enfermedades o accidentes, lo que reduce la edad promedio de muerte. Por lo tanto, no hay muchas razones para que el cuerpo permanezca en forma durante mucho tiempo porque la presión de selección es baja para los rasgos que mantendrían la viabilidad más allá del momento en que la mayoría de los animales habrían muerto de todos modos. Las enfermedades metabólicas aparecen debido a la baja demanda de actividad física en la civilización moderna en comparación con los tiempos en que los humanos tenían que buscar comida en la naturaleza para sobrevivir. [10] Ahora que la sombra selectiva ha cambiado, los humanos deben lidiar con estas nuevas presiones selectivas.
La senescencia se considera un subproducto de la fisiología porque nuestro metabolismo celular crea productos tóxicos, tenemos mutaciones cuando envejecemos y no tenemos suficientes células madre que se regeneren. ¿Por qué la selección no encontró y favoreció mutaciones de manera que nos permitieran, por ejemplo, regenerar nuestras células o no producir un metabolismo tóxico? ¿Por qué evolucionó la menopausia? Porque la selección es más eficiente en los rasgos que aparecen temprano en la vida. Las mutaciones que tienen un efecto temprano en la vida aumentarán la aptitud mucho más que las mutaciones que se manifiestan más tarde. La mayoría de las personas ya se han reproducido antes de que se manifieste alguna enfermedad; esto significa que los padres transmitirán sus alelos a sus descendientes antes de que muestren algún problema de aptitud y, por lo tanto, es "demasiado tarde" para la selección.
Las dos teorías, la no adaptativa y la adaptativa, se utilizan para explicar la evolución de la senescencia, que es el declive de la reproducción con la edad. [8] La teoría no adaptativa supone que el deterioro evolutivo de la edad humana se produce como resultado de la acumulación de mutaciones deletéreas en la línea germinal. [8] Estas mutaciones deletéreas comienzan a expresarse tarde en la vida, cuando estamos débiles/inestables y ya nos hemos reproducido, esto significa que la selección natural no puede actuar sobre ellas porque la reproducción ha terminado. Los estudios realizados en Drosophila melanogaster han demostrado una relación inversa entre la edad media óptima de madurez y las tasas de mutación por gen. [13] La acumulación de mutaciones afecta la asignación de energía y tiempo que se destinan al crecimiento y la reproducción a lo largo de la vida de un organismo, especialmente el período de vida reproductiva debido al hecho de que la acumulación de mutaciones acelera la senescencia, esto significa que los organismos deben alcanzar la edad óptima de madurez a una edad más temprana ya que su vida reproductiva se acorta con la mutación acumulada. [13]
Las mutaciones ocurren y son completamente aleatorias con respecto a una necesidad en el ambiente y la aptitud. Las mutaciones pueden ser beneficiosas en el sentido de que aumentan la aptitud de un organismo, neutrales en el sentido de que no afectan la aptitud de un organismo o perjudiciales en el sentido de que afectan negativamente a la aptitud de un organismo. Experimentos realizados previamente han demostrado que la mayoría de las acumulaciones de mutaciones son perjudiciales y solo unas pocas son beneficiosas. Las mutaciones de genes que interactúan entre sí durante el proceso de desarrollo crean diversidades biológicas y, por lo tanto, fenotípicas. Las mutaciones son información genética que se expresa entre organismos a través de la expresión génica , que es la traducción de la información genética en un carácter fenotípico. [14] La evolución es el cambio en un rasgo hereditario en una población a lo largo de generaciones, ya que las mutaciones generan variaciones en los rasgos hereditarios; se consideran la materia prima para la evolución. Por lo tanto, las acumulaciones de mutaciones beneficiosas durante los procesos de desarrollo podrían generar más variaciones fenotípicas, lo que aumenta su frecuencia genética y afecta la capacidad de evolución fenotípica. [15]
La teoría de la mutación somática como factor de envejecimiento sostiene que la acumulación de mutaciones en las células somáticas es la causa principal del envejecimiento. Una comparación de la tasa de mutación somática en varias especies de mamíferos reveló que el número total de mutaciones acumuladas al final de la vida era aproximadamente igual en un amplio rango de períodos de vida. [16] Los autores afirman que esta fuerte relación entre la tasa de mutación somática y la duración de la vida en diferentes especies de mamíferos sugiere que la evolución puede limitar las tasas de mutación somática, tal vez mediante la selección que actúa sobre diferentes vías de reparación del ADN.
La teoría de Medawar fue criticada y luego desarrollada por George C. Williams en 1957. Williams señaló que la senescencia puede estar causando muchas muertes incluso si los animales no están "muriendo de vejez". [1] Comenzó su hipótesis con la idea de que el envejecimiento puede causar una senescencia más temprana debido a la naturaleza competitiva de la vida. Incluso una pequeña cantidad de envejecimiento puede ser fatal; por lo tanto, la selección natural realmente se preocupa y el envejecimiento no es gratuito. [17]
Williams finalmente propuso su propia hipótesis llamada pleiotropía antagónica . La pleiotropía, por sí sola, significa una mutación que causa múltiples efectos en el fenotipo . [18] La pleiotropía antagónica, por otro lado, se ocupa de un gen que crea dos rasgos, uno de los cuales es beneficioso y el otro perjudicial. En esencia, esto se refiere a genes que ofrecen beneficios temprano en la vida, pero que luego acumulan un costo. [1] En otras palabras, la pleiotropía antagónica es cuando la relación resultante entre dos rasgos es negativa. Es cuando un rasgo fenotípico afecta positivamente la reproducción actual a expensas de una senescencia, crecimiento y mantenimiento acelerados posteriores. La pleiotropía antagónica es permanente a menos que ocurra una mutación que modifique los efectos del locus primario. [13]
Aunque la pleiotropía antagónica es una teoría predominante en la actualidad, se trata en gran medida de una teoría predeterminada y no ha sido bien verificada. Las investigaciones han demostrado que esto no es cierto para todos los genes y puede considerarse una validación parcial de la teoría, pero desvirtúa la premisa central: que las compensaciones genéticas son la causa fundamental del envejecimiento.
En experimentos de crianza, Michael R. Rose seleccionó moscas de la fruta para que tuvieran una vida larga. Basándose en la pleiotropía antagónica, Rose esperaba que esto seguramente reduciría su fertilidad . Su equipo descubrió que podían criar moscas que vivían más del doble de tiempo que las moscas con las que empezaron, pero para su sorpresa, las moscas consanguíneas de vida larga en realidad ponían más huevos que las moscas de vida corta. Este fue otro revés para la teoría de la pleiotropía, aunque Rose sostiene que puede ser un artefacto experimental. [19]
Una tercera teoría dominante, propuesta en 1977 por Thomas Kirkwood , presupone que el cuerpo debe presupuestar los recursos de que dispone. El cuerpo utiliza recursos derivados del medio ambiente para el metabolismo, la reproducción y la reparación y el mantenimiento, y el cuerpo debe hacer concesiones cuando hay un suministro finito de recursos. La teoría afirma que este compromiso hace que el cuerpo reasigne energía a la función de reparación que hace que el cuerpo se deteriore gradualmente con la edad. [2]
Una salvedad a esta teoría sugiere que esta reasignación de energía se basa en el tiempo en lugar de limitar los recursos. Este concepto se centra en la presión evolutiva para reproducirse en un período de tiempo determinado y óptimo que está dictado por la edad y el nicho ecológico. La forma en que esto tiene éxito es mediante la asignación de tiempo y energía en la reparación de daños a nivel celular, lo que resulta en una acumulación de daños y una disminución de la esperanza de vida en relación con los organismos con una gestación más larga . Este concepto se deriva de un análisis comparativo de la estabilidad genómica en células de mamíferos. [20] [21]
Un argumento opuesto se basa en el efecto de la restricción calórica , que alarga la vida. [22] [23] [24] Sin embargo, no se ha demostrado que la restricción dietética aumente el éxito reproductivo (aptitud) a lo largo de la vida, porque cuando la disponibilidad de alimentos es menor, el rendimiento reproductivo también es menor. Además, las calorías no son el único recurso de suministro posiblemente limitado para un organismo que podría tener un efecto en múltiples dimensiones de la aptitud.
Así como la mutación y la expresión del ADN tienen efectos fenotípicos en los organismos, el daño del ADN y la acumulación de mutaciones también tienen consecuencias fenotípicas en los seres humanos mayores. El daño a las macromoléculas como el ADN, el ARN y las proteínas, junto con el deterioro de los tejidos y órganos, son la base del envejecimiento. Las tasas de envejecimiento específicas de cada especie se deben a cambios nocivos que se manifiestan después de la fase reproductiva. " El ADN mitocondrial (ADNmt) regula el metabolismo celular , la apoptosis y el control del estrés oxidativo ". [25] Por lo tanto, el daño al ADNmt es otro factor que contribuye a los fenotipos relacionados con el envejecimiento . La neurodegeneración y el cáncer son dos factores que se manifiestan con daño al ADN; por lo tanto, necesitamos comprender el cambio en la asociación entre el daño al ADN y la reparación del ADN a medida que envejecemos para estar al tanto de las enfermedades relacionadas con la edad y desarrollar estilos de vida que posiblemente podrían promover una vida saludable. [26]
La teoría del envejecimiento por daño del ADN postula que el daño del ADN es omnipresente en el mundo biológico y es la causa principal del envejecimiento. [27] La teoría se basa en la idea de que el envejecimiento se produce con el tiempo debido al daño del ADN. Como ejemplo, los estudios del cerebro y el músculo de los mamíferos han demostrado que la capacidad de reparación del ADN es relativamente alta durante el desarrollo temprano cuando las células se dividen mitóticamente, pero disminuye sustancialmente a medida que las células entran en el estado posmitótico. [28] [29] [30]
El efecto de reducir la expresión de la capacidad de reparación del ADN es una mayor acumulación de daño en el ADN. Esto perjudica la transcripción genética y causa la pérdida progresiva de las funciones celulares y tisulares que definen el envejecimiento. Como respuesta al daño del ADN, una de las respuestas desencadenadas por el estrés oxidativo es la activación de la p53 . [31] La proteína p53 se une al ADN, luego estimula la producción de una p21 , que también se conoce como inhibidor de la quinasa dependiente de ciclina 1. Esto asegura que la célula no pueda ingresar a la siguiente etapa de división celular a menos que se repare el daño del ADN. Sin embargo, las células p21 pueden desencadenar la apoptosis . La apoptosis o muerte celular programada está asociada con la degradación gradual del sistema inmunológico, el músculo esquelético y el mal funcionamiento asociado con el envejecimiento. [32]

Los telómeros son secuencias de nucleótidos recurrentes que protegen los extremos de nuestro cromosoma; son sensibles al estrés oxidativo y se degradan durante la replicación cromosómica. La telomerasa es una proteína ribonucleótido que ayuda a reparar y reemplazar los telómeros degradados . Sin embargo, la telomerasa nos falla a medida que envejecemos; se vuelve menos capaz de reparar los telómeros, y todo nuestro cuerpo comienza a desmoronarse. Esto significa que nuestras células ya no pueden dividirse o se dividen con errores, y algunos creen que esto contribuye al proceso de envejecimiento. Nuevas investigaciones también han demostrado que existe una asociación entre el acortamiento de los telómeros y la disfunción mitocondrial. [33] Sin embargo, la sobreexpresión de la telomerasa aumenta las posibilidades de cáncer. Si los telómeros se mantienen en reparación, hay una mayor probabilidad de longevidad, pero también hay más división celular y una mayor probabilidad de mutación, que podría resultar en cáncer. Por lo tanto, una célula longeva es solo una bomba de relojería. Mejorar la actividad de la telomerasa, por lo tanto, no es una solución; Sólo permite que las células vivan más tiempo. Las ratas topo desnudas tienen una actividad alta de la telomerasa, viven mucho tiempo y algunos pensaban que nunca contraían cáncer; por lo tanto, posiblemente sean una excepción a esta hipótesis. [34] Sin embargo, las ratas topo desnudas contraen cáncer. [35] [36]
Teorías como la teoría de la "muerte programada" de Weismann sugieren que el deterioro y la muerte debidos al envejecimiento son un resultado intencionado del diseño evolutivo de un organismo y se conocen como teorías del envejecimiento programado o envejecimiento adaptativo.
La teoría del mantenimiento programado basada en la capacidad evolutiva [37] sugiere que los mecanismos de reparación están controlados por un mecanismo de control común capaz de detectar condiciones, como la restricción calórica, y puede ser responsable de la longevidad en especies particulares. En esta teoría, las técnicas de supervivencia se basan en mecanismos de control en lugar de en mecanismos de mantenimiento individuales, como se ve en la teoría no programada del envejecimiento de los mamíferos.
Una teoría no programada del envejecimiento de los mamíferos [38] afirma que las distintas especies poseen distintas capacidades de mantenimiento y reparación. Las especies más longevas poseen muchos mecanismos para compensar los daños causados por causas como la oxidación, el acortamiento de los telómeros y otros procesos de deterioro. Las especies más cortas, que alcanzan edades más tempranas de madurez sexual, tienen menos necesidad de longevidad y, por lo tanto, no han desarrollado ni conservado los mecanismos de reparación más eficaces. Por lo tanto, los daños se acumulan más rápidamente, lo que da lugar a manifestaciones más tempranas y a una vida más corta. Dado que existe una amplia variedad de manifestaciones del envejecimiento que parecen tener causas muy diferentes, es probable que existan muchas funciones de mantenimiento y reparación diferentes.
El sombreado selectivo es una de las teorías evolutivas del envejecimiento que se basa en la presunción de que la selección de un individuo generalmente disminuye una vez que este prácticamente ha superado la fase de madurez sexual. Como resultado, esto forma una sombra sin tener en cuenta la aptitud sexual, que ya no se tiene en cuenta a medida que un individuo envejece. Esto respalda la idea de que la fuerza de la selección natural disminuye en función de la edad, que fue introducida por primera vez por Peter B. Medewar y JBS Haldane.
"La idea conceptual clave que permitió a Medawar, Williams y otros desarrollar la teoría evolutiva del envejecimiento se basa en la noción de que la fuerza de la selección natural, una medida de la eficacia con la que la selección actúa sobre la tasa de supervivencia o la fecundidad en función de la edad, disminuye con la edad progresiva". [39]
Medewar desarrolló un modelo que resalta esto, mostrando la disminución en la tasa de supervivencia de una población a medida que un individuo envejece, sin embargo, la tasa de reproducción se mantiene constante. La probabilidad de reproducción generalmente alcanza su punto máximo durante la madurez sexual y disminuye a medida que un individuo envejece, mientras que el resto de la población disminuye con la edad a medida que ingresan a la sombra de selección. El modelo también respalda la teoría de Medewars de que debido a condiciones peligrosas e imprevistas en el entorno, como enfermedades, cambios climáticos y depredadores, muchos individuos mueren poco tiempo después de la maduración sexual. En consecuencia, la probabilidad de que un individuo sobreviva y sufra los efectos relacionados con la edad es relativamente baja.
De la misma manera, muchas mutaciones beneficiosas son rechazadas si tienen un efecto positivo en un individuo más adelante en la vida. Por ejemplo, si una mutación beneficiosa o perjudicial ocurre sólo después de la fase reproductiva de un individuo, entonces no afectará la aptitud, que por lo tanto no puede ser rechazada por la selección. Posteriormente, estas mutaciones y efectos posteriores se consideran como parte de la "región de sombra" de la selección. [40]
La selección grupal se basa en la idea de que todos los miembros de un grupo determinado tendrán éxito o fracasarán juntos según las circunstancias. Con este mecanismo, la deriva genética se produce colectivamente en todos los miembros del grupo y los distingue de otros grupos de su misma especie. Esto es diferente de la selección individual, ya que se centra en el grupo en lugar del individuo. [41]
A menudo, los individuos posreproductivos también realizan transferencias intergeneracionales: los delfines mulares y las ballenas piloto cuidan a sus nietos; existe crianza cooperativa en algunos mamíferos, muchos insectos y alrededor de 200 especies de aves; las diferencias sexuales en la supervivencia de los primates antropoides tienden a correlacionarse con el cuidado de la descendencia; o un bebé Efe a menudo es atendido por más de 10 personas. Lee desarrolló una teoría formal que integra la selección debida a transferencias (a todas las edades) con la selección debida a la fertilidad. [42]
La capacidad evolutiva es el concepto según el cual una especie debería beneficiarse de una adaptación genética más rápida a su entorno actual. En los siguientes ejemplos, esto se utiliza para argumentar que la eliminación de individuos viejos podría beneficiar a la especie en general.
Skulachev (1997) [43] ha sugerido que el envejecimiento programado ayuda al proceso de evolución al proporcionar un desafío u obstáculo gradualmente creciente para la supervivencia y la reproducción y, por lo tanto, mejora la selección de características beneficiosas.
Goldsmith (2008) [44] propuso que si bien aumentar la tasa de generación y la tasa de evolución es beneficioso para una especie, también es importante limitar la esperanza de vida para que los individuos más viejos no dominen el acervo genético .
El modelo de Yang (2013) [6] también se basa en la idea de que el envejecimiento acelera la acumulación de nuevos genes adaptativos en las poblaciones locales. Sin embargo, Yang cambió la terminología de "capacidad de evolución" por "creatividad genética" a lo largo de su artículo para facilitar la comprensión de cómo el envejecimiento puede tener un beneficio a más corto plazo del que implicaría la palabra "capacidad de evolución".
Lenart y Vašku (2016) [45] también han invocado la capacidad evolutiva como el principal mecanismo que impulsa la evolución del envejecimiento. Sin embargo, propusieron que, si bien la tasa real de envejecimiento puede ser una adaptación, el envejecimiento en sí es inevitable. En otras palabras, la evolución puede cambiar la velocidad del envejecimiento, pero siempre ocurrirá algún envejecimiento, por lento que sea.
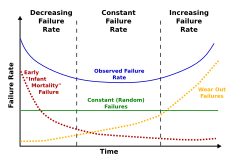
La mortalidad es el número de muertes, en un grupo particular, durante un período de tiempo específico. [46] Hay dos tipos de mortalidad: mortalidad intrínseca y extrínseca . La mortalidad intrínseca se define como la mortalidad debida al envejecimiento, el declive fisiológico debido a procesos innatos, mientras que la mortalidad extrínseca es el resultado de factores ambientales como, por ejemplo, la depredación, el hambre, los accidentes y otros. Los animales voladores, como los murciélagos, por ejemplo, tienen menos depredadores y, por lo tanto, tienen una baja mortalidad extrínseca. Las aves son de sangre caliente y similares en tamaño a muchos mamíferos pequeños, pero a menudo viven entre 5 y 10 veces más. Se enfrentan a menos depredación que los mamíferos que viven en el suelo y, por lo tanto, tienen una mortalidad extrínseca menor.
Al examinar la relación entre el tamaño corporal y la expectativa de vida, también se observa que los mamíferos depredadores tienden a vivir más que los mamíferos presa en un entorno controlado, como un zoológico o una reserva natural. La explicación de la larga expectativa de vida de los primates (como los humanos, los monos y los simios) en relación con el tamaño corporal es que logran una menor mortalidad extrínseca debido a su inteligencia.
Los organismos individuales son ordinariamente mortales; envejecen y mueren, mientras que las líneas germinales que conectan generaciones sucesivas son potencialmente inmortales. La base de esta diferencia es un problema fundamental en biología. El biólogo e historiador ruso Zhores A. Medvedev [47] consideró que la precisión de los sistemas replicativos del genoma y otros sistemas sintéticos por sí solos no pueden explicar la inmortalidad de las líneas germinales . Más bien, Medvedev pensó que las características conocidas de la bioquímica y la genética de la reproducción sexual indican la presencia de procesos únicos de mantenimiento y restauración de la información en las diferentes etapas de la gametogénesis . En particular, Medvedev consideró que las oportunidades más importantes para el mantenimiento de la información de las células germinales se crean por la recombinación durante la meiosis y la reparación del ADN ; vio estos como procesos dentro de las células germinales que eran capaces de restaurar la integridad del ADN y los cromosomas de los tipos de daño que causan envejecimiento irreversible en las células somáticas .
Los síndromes progeroides son enfermedades genéticas que están asociadas al envejecimiento prematuro. Los síndromes progeroides se caracterizan por tener características que se asemejan a las del envejecimiento fisiológico, como la pérdida de cabello y las enfermedades cardiovasculares. [48]
La progeria es una enfermedad genética de un solo gen que causa la aceleración de muchos o la mayoría de los síntomas del envejecimiento durante la infancia. Afecta a aproximadamente 1 de cada 4-8 millones de nacimientos. [49] Quienes padecen esta enfermedad son conocidos por tener retraso en el crecimiento y una serie de síntomas que causan anomalías en las articulaciones, el cabello, la piel, los ojos y la cara. [50] La mayoría de quienes padecen la enfermedad solo viven hasta los 13 años aproximadamente. [51] Aunque el término progeria se aplica estrictamente hablando a todas las enfermedades caracterizadas por síntomas de envejecimiento prematuro, y a menudo se utiliza como tal, a menudo se aplica específicamente en referencia al síndrome de progeria de Hutchinson-Gilford (HGPS). Los niños diagnosticados con HGPS desarrollan rasgos faciales prominentes como una cara pequeña, labios finos, mentón pequeño y orejas prominentes . Aunque la progeria puede causar anomalías físicas en un niño, no afecta sus habilidades motoras ni su avance intelectual. [52] Quienes padecen HGPS son propensos a sufrir trastornos neurológicos y cardiovasculares. [53] El HGPS es causado por una mutación puntual en el gen que codifica la proteína lamina A. La lamina A promueve la estabilidad genética al mantener los niveles de proteínas que tienen papeles clave en la unión de extremos no homólogos y la recombinación homóloga . [54] Las células de ratón deficientes para la maduración de prelamina A muestran un mayor daño del ADN y aberraciones cromosómicas y tienen una mayor sensibilidad a los agentes que dañan el ADN. [55] En el HGPS, la incapacidad de reparar adecuadamente los daños del ADN debido a la lamina de tipo A defectuosa puede causar aspectos del envejecimiento prematuro basado en laminopatía . [55]
El síndrome de Werner, también conocido como "progeria del adulto", es otra enfermedad genética de un solo gen. Es causada por una mutación en el gen wrn . [53] Afecta a aproximadamente 1 de cada 200.000 personas en los Estados Unidos. [56] Este síndrome comienza a afectar a las personas durante la adolescencia, impidiendo que los adolescentes crezcan en la pubertad. Hay cuatro rasgos comunes del síndrome de Werner: cataratas en ambos ojos, cambios en la piel similares a la esclerodermia , baja estatura y encanecimiento temprano y pérdida de cabello. [53] Una vez que el individuo llega a los veinte años, generalmente hay un cambio en el color del cabello, la piel y la voz. La esperanza de vida promedio de alguien con esta enfermedad es de alrededor de 46 años. [57] Esta afección también puede afectar la distribución del peso entre los brazos, las piernas y el torso. [58] Quienes tienen síndrome de Werner tienen un mayor riesgo de cataratas, diabetes tipo 2 , diferentes tipos de cáncer y aterosclerosis . [56] El hallazgo de que la proteína WRN interactúa con DNA-PKcs y el complejo proteico Ku , combinado con evidencia de que las células deficientes en WRN producen deleciones extensas en los sitios de unión de extremos de ADN no homólogos, sugiere un papel para la proteína WRN en el proceso de reparación del ADN de unión de extremos no homólogos . [59] La proteína WRN también parece desempeñar un papel en la resolución de estructuras intermedias de recombinación durante la reparación recombinacional homóloga de roturas de doble cadena de ADN. [59]
El síndrome de Bloom es un trastorno autosómico recesivo poco frecuente que se caracteriza por baja estatura, inestabilidad cromosómica, predisposición al cáncer y piel sensible al sol. [60] Las personas con síndrome de Bloom también pueden tener discapacidades de aprendizaje y un mayor riesgo de desarrollar enfermedad pulmonar obstructiva crónica (EPOC) y otras enfermedades. [61]
El síndrome de Cockayne es una mutación homocigótica o heterocigótica que produce baja estatura, anomalías en el tamaño de la cabeza y crecimiento y desarrollo lentos. [62]
El síndrome de Rothmund-Thomson es un trastorno autosómico recesivo poco frecuente que afecta la piel. Se caracteriza por pelo escaso, cataratas juveniles, anomalías esqueléticas y retraso del crecimiento. [63]
Las teorías sobre el envejecimiento afectan los esfuerzos por comprender y encontrar tratamientos para las enfermedades relacionadas con la edad:
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ){{cite book}}: |work=ignorado ( ayuda )