

Los anticuerpos antinucleares ( ANA , también conocidos como factor antinuclear o ANF ) [2] son autoanticuerpos que se unen al contenido del núcleo celular . En individuos normales, el sistema inmunológico produce anticuerpos contra proteínas extrañas ( antígenos ), pero no contra proteínas humanas ( autoantígenos ). En algunos casos, se producen anticuerpos contra antígenos humanos. [3]
Hay muchos subtipos de ANA, como anticuerpos anti-Ro , anticuerpos anti-La , anticuerpos anti-Sm , anticuerpos anti-nRNP , anticuerpos anti-Scl-70 , anticuerpos anti-ADNbc , anticuerpos anti-histonas , anticuerpos contra complejos de poros nucleares. , anticuerpos anticentrómero y anticuerpos anti-sp100 . Cada uno de estos subtipos de anticuerpos se une a diferentes proteínas o complejos proteicos dentro del núcleo. Se encuentran en muchos trastornos, incluidos la autoinmunidad , el cáncer y las infecciones , con diferentes prevalencias de anticuerpos según la afección. Esto permite el uso de ANA en el diagnóstico de algunos trastornos autoinmunes, incluido el lupus eritematoso sistémico , el síndrome de Sjögren , [4] esclerodermia , [5] enfermedad mixta del tejido conectivo , [6] polimiositis , dermatomiositis , hepatitis autoinmune [7] y fármacos. lupus inducido . [8]
La prueba ANA detecta los autoanticuerpos presentes en el suero sanguíneo de un individuo . Las pruebas comunes utilizadas para detectar y cuantificar ANA son la inmunofluorescencia indirecta y el ensayo inmunoabsorbente ligado a enzimas (ELISA). En inmunofluorescencia, el nivel de autoanticuerpos se informa como título . Ésta es la dilución más alta del suero en la que los autoanticuerpos todavía son detectables. Los títulos de autoanticuerpos positivos a una dilución igual o superior a 1:160 suelen considerarse clínicamente significativos. Títulos positivos inferiores a 1:160 están presentes hasta en el 20% de la población sana, especialmente en los ancianos. Aunque los títulos positivos de 1:160 o superiores están fuertemente asociados con trastornos autoinmunes, también se encuentran en el 5% de las personas sanas. [9] [10] La detección de autoanticuerpos es útil en el diagnóstico de trastornos autoinmunes y el monitoreo de los niveles ayuda a predecir la progresión de la enfermedad. [8] [11] [12] Una prueba de ANA positiva rara vez es útil si no están presentes otros datos clínicos o de laboratorio que respalden un diagnóstico. [13]
El cuerpo humano tiene muchos mecanismos de defensa contra patógenos , uno de los cuales es la inmunidad humoral . Este mecanismo de defensa produce anticuerpos ( glucoproteínas grandes ) en respuesta a un estímulo inmunológico. Para este proceso se requieren muchas células del sistema inmunológico, incluidos los linfocitos ( células T y células B ) y las células presentadoras de antígenos . Estas células coordinan una respuesta inmune ante la detección de proteínas extrañas ( antígenos ), produciendo anticuerpos que se unen a estos antígenos. En la fisiología normal, los linfocitos que reconocen proteínas humanas ( autoantígenos ) sufren una muerte celular programada ( apoptosis ) o dejan de funcionar. Esta autotolerancia significa que los linfocitos no deberían provocar una respuesta inmune contra los antígenos celulares humanos. A veces, sin embargo, este proceso no funciona correctamente y se producen anticuerpos contra antígenos humanos, lo que puede provocar enfermedades autoinmunes. [3]
Los ANA se encuentran en muchos trastornos, así como en algunos individuos sanos. Estos trastornos incluyen: lupus eritematoso sistémico (LES), artritis reumatoide , síndrome de Sjögren , esclerodermia , polimiositis , dermatomiositis , cirrosis biliar primaria , lupus inducido por fármacos , hepatitis autoinmune , esclerosis múltiple , lupus discoide , enfermedad de la tiroides , síndrome antifosfolípido , artritis idiopática juvenil , artritis psoriásica , dermatomiositis juvenil , púrpura trombocitopénica idiopática , infección y cáncer . Estos anticuerpos se pueden subdividir según su especificidad y cada subconjunto tiene diferentes propensiones a sufrir trastornos específicos. [8] [14]
Los antígenos nucleares extraíbles (ENA) son un grupo de autoantígenos que se identificaron originalmente como objetivos de anticuerpos en personas con trastornos autoinmunes. Se denominan ENA porque se pueden extraer del núcleo celular con solución salina. [8] [15] Los ENA consisten en ribonucleoproteínas y proteínas no histonas , nombradas por el nombre del donante que proporcionó el suero prototipo (Sm, Ro, La, Jo) o el nombre del entorno de la enfermedad en el que se produjo el suero. Se encontraron anticuerpos (SS-A, SS-B, Scl-70). [dieciséis]

Los anticuerpos anti-Ro y anti-La , también conocidos como SS-A y SS-B, respectivamente, se encuentran comúnmente en el síndrome de Sjögren primario , un trastorno autoinmune que afecta las glándulas exocrinas . La presencia de ambos anticuerpos se encuentra en el 30-60% del síndrome de Sjögren, los anticuerpos anti-Ro solos se encuentran en el 50-70% del síndrome de Sjögren y el 30% del LES con afectación cutánea, y los anticuerpos anti-La rara vez se encuentran aislados. . [11] [17] Los anticuerpos anti-La también se encuentran en el LES; sin embargo, normalmente también está presente el síndrome de Sjögren. [18] Los anticuerpos anti-Ro también se encuentran con menos frecuencia en otros trastornos, incluidas las enfermedades hepáticas autoinmunes, la enfermedad celíaca , las enfermedades reumáticas autoinmunes, el lupus eritematoso neonatal cardíaco y la polimiositis . [19] [20] Durante el embarazo, los anticuerpos anti-Ro pueden atravesar la placenta y causar bloqueo cardíaco [21] [22] y lupus neonatal en los bebés. [23] En el síndrome de Sjögren, los anticuerpos anti-Ro y anti-La se correlacionan con la aparición temprana, mayor duración de la enfermedad, agrandamiento de la glándula parótida , enfermedad fuera de las glándulas e infiltración de las glándulas por linfocitos. [12] Los anticuerpos anti-Ro son específicos de los componentes del complejo Ro-RNP, que comprende proteínas y ARN de 45 kDa, 52 kDa, 54 kDa y 60 kDa . La proteína de unión a ADN /ARN de 60 kDa y la proteína reguladora de células T de 52 kDa son los antígenos mejor caracterizados de los anticuerpos anti-Ro. Colectivamente, estas proteínas son parte de un complejo de ribonucleoproteína (RNP) que se asocia con los ARN Y humanos , hY1-hY5. El antígeno La es un factor de terminación de la transcripción de 48 kDa de la ARN polimerasa III , que se asocia con el complejo Ro-RNP. [16] [17] [24] [25]
El mecanismo de producción de anticuerpos en el síndrome de Sjögren no se comprende completamente, pero la apoptosis (muerte celular programada) y el mimetismo molecular pueden desempeñar un papel. [12] Los antígenos Ro y La se expresan en la superficie de las células que sufren apoptosis y pueden causar inflamación dentro de la glándula salival mediante la interacción con las células del sistema inmunológico. Los anticuerpos también se pueden producir mediante mimetismo molecular, donde los anticuerpos de reacción cruzada se unen tanto al virus como a las proteínas humanas. Esto puede ocurrir con uno de los antígenos, Ro o La, y posteriormente puede producir anticuerpos contra otras proteínas mediante un proceso conocido como diseminación de epítopos . La proteína gag retroviral muestra similitud con la proteína La y se propone como un posible ejemplo de mimetismo molecular en el síndrome de Sjögren. [12] [20]
Los anticuerpos anti-Smith (Anti-Sm) son un marcador muy específico del LES. Aproximadamente el 99 % de las personas sin LES carecen de anticuerpos anti-Sm, pero sólo el 20 % de las personas con LES tienen los anticuerpos. Se asocian con afectación del sistema nervioso central , enfermedad renal , fibrosis pulmonar y pericarditis en el LES, pero no con la actividad de la enfermedad. Los antígenos de los anticuerpos anti-Sm son las unidades centrales de las pequeñas ribonucleoproteínas nucleares (snRNP), denominadas de A a G, y se unirán a las snRNP U1, U2, U4, U5 y U6. Lo más habitual es que los anticuerpos sean específicos de las unidades B, B' y D. [26] [27] Los estudios moleculares y epidemiológicos sugieren que los anticuerpos anti-Sm pueden ser inducidos por mimetismo molecular porque la proteína muestra cierta similitud con las proteínas del virus de Epstein-Barr . [28] [29]
Los anticuerpos anti-ribonucleoproteína nuclear (anti-nRNP) , también conocidos como anticuerpos anti-U1-RNP, se encuentran en 30 a 40 % de los casos de LES. A menudo se encuentran con anticuerpos anti-Sm, pero pueden tener diferentes asociaciones clínicas. Además del LES, estos anticuerpos están altamente asociados con la enfermedad mixta del tejido conectivo . Los anticuerpos anti-nRNP reconocen las unidades centrales A y C de los snRNP y, debido a esto, se unen principalmente al U1-snRNP. [26] [30] La respuesta inmune a RNP puede ser causada por la presentación de los componentes nucleares en la membrana celular en ampollas apoptóticas. También se ha sugerido el mimetismo molecular como un posible mecanismo para la producción de anticuerpos contra estas proteínas debido a la similitud entre los polipéptidos U1-RNP y los polipéptidos del virus de Epstein-Barr. [31]
Los anticuerpos anti-Scl-70 están relacionados con la esclerodermia . [32] La sensibilidad de los anticuerpos para la esclerodermia es aproximadamente del 34 %, pero es mayor en los casos con afectación cutánea difusa (40 %) y menor en los casos con afectación cutánea limitada (10 %). La especificidad de los anticuerpos es del 98% y del 99,6% en otras enfermedades reumáticas y en individuos normales, respectivamente. [8] [33] Además de la esclerodermia, estos anticuerpos se encuentran en aproximadamente el 5% de las personas con LES. [34] El objetivo antigénico de los anticuerpos anti-Scl-70 es la topoisomerasa I. [35]
Aunque los anticuerpos anti-Jo-1 a menudo se incluyen con los ANA, en realidad son anticuerpos contra la proteína citoplasmática, histidil-ARNt sintetasa , una aminoacil-ARNt sintetasa esencial para la síntesis de ARNt cargado con histidina. [15] Están altamente asociados con polimiositis y dermatomiositis , y rara vez se encuentran en otras enfermedades del tejido conectivo. Alrededor de 20 a 40% de los casos de polimiositis son positivos para anticuerpos Jo-1 y la mayoría tendrá enfermedad pulmonar intersticial, marcadores de antígeno leucocitario humano (HLA) HLA-DR3 y HLA-DRw52; conocido colectivamente como síndrome Jo-1. [26] [36]

Los anticuerpos anti-ADN bicatenario (anti-ADNbc) están altamente asociados con el LES. Son un marcador muy específico de la enfermedad, y algunos estudios citan casi el 100%. [8] Los datos sobre sensibilidad oscilan entre el 25 y el 85%. Los niveles de anticuerpos anti-ADNbc, conocidos como títulos, se correlacionan con la actividad de la enfermedad en el LES; niveles altos indican lupus más activo. La presencia de anticuerpos anti-ADNbc también está relacionada con la nefritis lúpica y hay pruebas de que son la causa. Algunos anticuerpos anti-ADNbc tienen reactividad cruzada con otros antígenos que se encuentran en la membrana basal glomerular (MBG) del riñón, como el sulfato de heparán , el colágeno IV, la fibronectina y la laminina . La unión a estos antígenos dentro del riñón podría provocar inflamación y fijación del complemento , lo que provocaría daño renal. Se ha demostrado que la presencia de una alta unión al ADN y niveles bajos de C3 tienen un valor predictivo extremadamente alto (94%) para el diagnóstico de LES. [37] También es posible que los anticuerpos anti-ADNbc sean internalizados por las células cuando se unen a antígenos de membrana y luego se muestran en la superficie celular. Esto podría promover respuestas inflamatorias de las células T dentro del riñón. Es importante señalar que no todos los anticuerpos anti-ADNbc están asociados con la nefritis lúpica y que otros factores pueden causar este síntoma en su ausencia. El antígeno de los anticuerpos anti-ADNbc es ADN bicatenario . [38] [39]
Los anticuerpos antihistonas se encuentran en el suero de hasta el 75% al 95% de las personas con lupus inducido por fármacos y el 75% de las personas con LES idiopático. A diferencia de los anticuerpos anti-ADNbc en el LES, estos anticuerpos no fijan el complemento. [ cita necesaria ] Aunque se encuentran con mayor frecuencia en el lupus inducido por fármacos, también se encuentran en algunos casos de LES, esclerodermia , artritis reumatoide y enfermedad indiferenciada del tejido conectivo . Se sabe que muchos fármacos causan lupus inducido por fármacos y producen varios objetivos antigénicos dentro del nucleosoma que a menudo tienen reactividad cruzada con varias proteínas histonas y ADN. La procainamida causa una forma de lupus inducido por fármacos que produce anticuerpos contra el complejo de histonas H2A y H2B. [40] [41]
Tanto los anticuerpos antiglicoproteína 210 (anti-gp210) como los antinucleoporina 62 (anti-p62) son anticuerpos contra componentes de la membrana nuclear y se encuentran en la cirrosis biliar primaria (CBP). Cada anticuerpo está presente en aproximadamente 25 a 30% de la CBP. Los antígenos de ambos anticuerpos son constituyentes de la membrana nuclear . gp210 es una proteína de 200 kDa implicada en el anclaje de componentes del poro nuclear a la membrana nuclear. El antígeno p62 es un complejo de poro nuclear de 60 kDa. [42] [43]
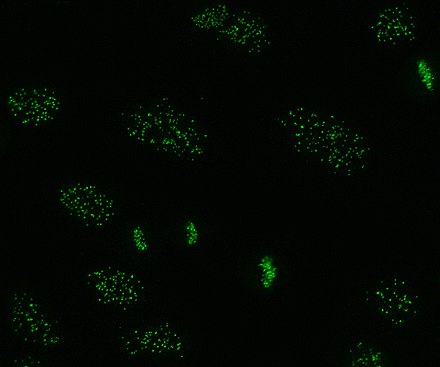
Los anticuerpos anticentrómero se asocian con esclerosis sistémica cutánea limitada, también conocida como síndrome CREST , cirrosis biliar primaria y esclerodermia proximal. [44] Hay seis antígenos conocidos, todos asociados con el centrómero ; CENP-A a CENP-F. CENP-A es una proteína similar a la histona H3 de 17 kDa . CENP-B es una proteína de unión al ADN de 80 kDa implicada en el plegamiento de la heterocromatina . CENP-C es una proteína de 140 kDa implicada en el ensamblaje del cinetocoro . CENP-D es una proteína de 50 kDa de función desconocida, pero puede ser homóloga a otra proteína implicada en la condensación de la cromatina , RCC1 . CENP-E es una proteína de 312 kDa de la familia de proteínas motoras cinesinas . CENP-F es una proteína de 367 kDa de la matriz nuclear que se asocia con el cinetocoro en la fase G2 tardía durante la mitosis. Los anticuerpos CENP-A, B y C se encuentran con mayor frecuencia (16-42% de la esclerosis sistémica) y se asocian con el fenómeno de Raynaud, telangiectasias , afectación pulmonar y aparición temprana en la esclerosis sistémica. [33] [45] [46]
Los anticuerpos anti-sp100 se encuentran en aproximadamente el 20-30% de la cirrosis biliar primaria (CBP). Se encuentran en pocas personas sin CBP y, por tanto, son un marcador muy específico de la enfermedad. El antígeno sp100 se encuentra dentro de los cuerpos nucleares; Grandes complejos de proteínas en el núcleo que pueden tener un papel en el crecimiento y la diferenciación celular. [47]
Los anticuerpos anti-PM-Scl se encuentran en hasta el 50% de los síndromes de superposición de polimiositis/esclerosis sistémica (PM/SSc) . Alrededor del 80% de las personas con anticuerpos presentes en el suero sanguíneo padecerán el trastorno. La presencia de anticuerpos está relacionada con la afectación cutánea limitada del síndrome de superposición PM/SSc. Las dianas antigénicas de los anticuerpos son componentes del complejo exosomal de procesamiento de ARN en el nucléolo . [33] Hay diez proteínas en este complejo y los anticuerpos contra ocho de ellas se encuentran en diferentes frecuencias; PM/Scl-100 (70–80%), PM/Scl-75 (46–80%), hRrp4 (50%), hRrp42 (21%), hRrp46 (18%), hCs14 (14%), hRrp41 ( 10%) y hRrp40 (7%). [48]
Los anticuerpos anti-DFS70 generan un patrón denso y moteado fino en inmunofluorescencia indirecta y se encuentran en personas normales y en diversas condiciones, pero no están asociados con una patología autoinmune sistémica. Por lo tanto, pueden usarse para ayudar a descartar tales condiciones en personas ANA positivas. A un número significativo de pacientes se les diagnostica lupus eritematoso sistémico o enfermedad indiferenciada del tejido conectivo basándose en gran medida en un ANA positivo. En caso de que no se pueda detectar ningún autoanticuerpo definido (por ejemplo, anticuerpos anti-ENA), se recomienda realizar la prueba de anticuerpos anti-DFS70 para verificar el diagnóstico. Las pruebas de anticuerpos anti-DFS70 están disponibles como pruebas con la marca CE. Hasta ahora, no hay disponible ningún ensayo aprobado por la FDA. [49]


La presencia de ANA en sangre se puede confirmar mediante una prueba de detección. Aunque existen muchas pruebas para la detección de ANA, las pruebas más comunes utilizadas para la detección son la inmunofluorescencia indirecta y el ensayo inmunoabsorbente ligado a enzimas (ELISA). [50] Después de la detección de ANA, se determinan varios subtipos. [8]
La inmunofluorescencia indirecta es una de las pruebas más utilizadas para los ANA. Normalmente, las células HEp-2 se utilizan como sustrato para detectar anticuerpos en el suero humano. Los portaobjetos de microscopio se recubren con células HEp-2 y el suero se incuba con las células. Si dichos anticuerpos específicos están presentes, se unirán a los antígenos de las células; en el caso de los ANA, los anticuerpos se unirán al núcleo. Estos se pueden visualizar agregando un anticuerpo antihumano marcado con fluorescencia (generalmente FITC o rodopsina B) que se une a los anticuerpos. La molécula emitirá fluorescencia cuando una longitud de onda de luz específica incida sobre ella, lo que se puede ver bajo el microscopio. Dependiendo del anticuerpo presente en el suero humano y de la localización del antígeno en la célula, se observarán distintos patrones de fluorescencia en las células HEp-2. [51] [52] Los niveles de anticuerpos se analizan realizando diluciones en suero sanguíneo. Una prueba de ANA se considera positiva si se observa fluorescencia a un título de 1:40/1:80. Los títulos más altos son más clínicamente significativos, ya que se encuentran resultados positivos bajos (≤1:160) en hasta el 20% de las personas sanas, especialmente en los ancianos. Sólo alrededor del 5% de la población sana tiene títulos de ANA de 1:160 o superiores. [8] [53]

Hasta aproximadamente 1975, cuando se introdujeron las células HEp-2, se utilizaba tejido animal como sustrato estándar para la inmunofluorescencia. [11] Las células HEp-2 son actualmente uno de los sustratos más comunes para la detección de ANA mediante inmunofluorescencia. [54]
Originalmente comenzó con una cepa de carcinoma de laringe, la línea celular fue contaminada y desplazada por células HeLa , y ahora ha sido identificada como células HeLa. [55]
Son superiores a los tejidos animales utilizados anteriormente debido a su gran tamaño y la alta tasa de mitosis (división celular) en la línea celular . Esto permite la detección de anticuerpos contra antígenos específicos de la mitosis, como los anticuerpos centrómeros. También permiten la identificación de anticuerpos anti-Ro, porque se utiliza acetona para la fijación de las células (otros fijadores pueden eliminar el antígeno). [56]
Se observan muchos patrones de tinción nuclear en las células HEp-2: homogéneo, moteado, nucleolar, membranoso nuclear, centromérico, punteado nuclear y pleomórfico. El patrón homogéneo se ve cuando los cromosomas condensados y la cromatina en interfase se tiñen. Este patrón está asociado con anticuerpos anti-ADNbc , anticuerpos contra componentes nucleosomales y anticuerpos anti-histonas. Hay dos patrones moteados: fino y grueso. El patrón moteado fino tiene una tinción nuclear fina con cromatina en metafase sin teñir , que se asocia con anticuerpos anti-Ro y anti-La. El patrón de tinción grueso tiene una tinción nuclear granular gruesa, causada por anticuerpos anti-U1-RNP y anti-Sm. El patrón de tinción nucleolar está asociado con muchos anticuerpos, incluidos anti-Scl-70, anti-PM-Scl, anti-fibrilarina y anti-Th/To. La tinción de la membrana nuclear aparece como un anillo fluorescente alrededor del núcleo celular y es producida por anticuerpos anti-gp210 y anti-p62. El patrón del centrómero muestra múltiples puntos nucleares en la interfase y en las células mitóticas, correspondientes al número de cromosomas de la célula. Los patrones de puntos nucleares muestran entre 13 y 25 puntos nucleares en las células en interfase y son producidos por anticuerpos anti- sp100 . El patrón pleomórfico es causado por anticuerpos contra el antígeno nuclear de la célula en proliferación . [26] [53] [57] [58] Se ha demostrado que la inmunofluorescencia indirecta es ligeramente superior en comparación con ELISA en la detección de ANA de células HEp-2. [54]

Crithidia luciliae son protistas unicelulares hemoflagelados . Se utilizan como sustrato en inmunofluorescencia para la detección de anticuerpos anti-dsDNA. Poseen un orgánulo conocido como cinetoplasto , que es una mitocondria grandecon una red de moléculas circulares de ADNds entrelazadas. Después de la incubación con suero que contiene anticuerpos anti-ADNbc y anticuerpos antihumanos marcados con fluorescencia, el cinetoplasto emitirá fluorescencia. La falta de otros antígenos nucleares en este orgánulo hace que el uso de C. luciliae como sustrato permita la detección específica de anticuerpos anti-ADNbc. [8] [59] [60]
El ensayo inmunoabsorbente ligado a enzimas (ELISA) utiliza placas de microtitulación recubiertas de antígeno para la detección de ANA. [61] Cada pocillo de una placa de microtitulación está recubierto con un único antígeno o con varios antígenos para detectar anticuerpos específicos o para detectar ANA, respectivamente. Los antígenos proceden de extractos celulares o son recombinantes. El suero sanguíneo se incuba en los pocillos de la placa y se lava. Si hay anticuerpos que se unen al antígeno, permanecerán después del lavado. Se añade un anticuerpo antihumano secundario conjugado con una enzima como la peroxidasa de rábano picante . La reacción enzimática producirá un cambio de color de la solución que es proporcional a la cantidad de anticuerpo unido al antígeno. [11] [52] [62] Existen diferencias significativas en la detección de ANA mediante inmunofluorescencia y diferentes kits de ELISA y solo existe un acuerdo marginal entre estos. Un médico debe estar familiarizado con las diferencias para poder evaluar los resultados de los distintos ensayos. [61]
La siguiente tabla enumera la sensibilidad de diferentes tipos de ANA para diferentes enfermedades.
Algunos ANA aparecen en varios tipos de enfermedades, lo que resulta en una menor especificidad de la prueba. Por ejemplo, se ha demostrado que el factor reumatoide IgM (IgM-RF) tiene una reacción cruzada con ANA, lo que produce una inmunofluorescencia falsamente positiva . [64] Se han notificado ANA positivos y anticuerpos anti-ADN en pacientes con enfermedad tiroidea autoinmune . [65] [66] Los ANA pueden tener un resultado positivo en hasta el 45% de las personas con afecciones tiroideas autoinmunes o artritis reumatoide y hasta el 15% de las personas con VIH o hepatitis C. [66] [67] [68] [69] Según Lupus Foundation of America , "alrededor del 5% de la población general tendrá un ANA positivo. Sin embargo, al menos el 95% de las personas que tienen un ANA positivo no tienen lupus. Una prueba de ANA positiva a veces puede ser hereditaria, incluso si los miembros de la familia no tienen evidencia de lupus". [10] Por otro lado, dicen, aunque el 95% de los pacientes que realmente tienen lupus dan positivo para ANA, "sólo un pequeño porcentaje tiene un ANA negativo, y muchos de ellos tienen otros anticuerpos (como anticuerpos antifosfolípidos , anti-Ro, anti-SSA) o sus ANA convertidos de positivos a negativos debido a esteroides , medicamentos citotóxicos o uremia (insuficiencia renal)". [10]

La célula LE fue descubierta en la médula ósea en 1948 por Hargraves et al. [70] En 1957 Holborow et al. demostró por primera vez ANA mediante inmunofluorescencia indirecta. [71] Este fue el primer indicio de que los procesos que afectan al núcleo celular eran responsables del LES. En 1959 se descubrió que el suero de individuos con LES contenía anticuerpos que precipitaban con extractos salinos de núcleos, conocidos como antígenos nucleares extraíbles (ENA). Esto condujo a la caracterización de los antígenos ENA y sus respectivos anticuerpos. Así, los anticuerpos anti-Sm y anti-RNP se descubrieron en 1966 y 1971, respectivamente. En la década de 1970 se descubrieron los anticuerpos anti-Ro/anti-SS-A y anti-La/anti-SS-B. Se sabía que el anticuerpo Scl-70 era un anticuerpo específico contra la esclerodermia en 1979, sin embargo, el antígeno (topoisomerasa-I) no se caracterizó hasta 1986. El antígeno y el anticuerpo Jo-1 se caracterizaron en 1980. [ 8] [20]